Пример тимомы. Прогноз myastenia gravis
Добавил пользователь Алексей Ф. Обновлено: 01.02.2026
Выявление в крови антител к никотиновому ацетилхолиновому рецептору, которые являются чувствительным и специфическим маркером миастении. Отмечаются у 80% пациентов со миастенией и являются основным серологическим маркером этого заболевания, применяется в дифференциальной диагностике всей нервно-мышечной патологии. Отмечается высокая потребность в таком тестировании среди практикующих неврологов.
Синонимы русские
Антитела при миастении.
Синонимы английские
Anti-acetylcholine receptor antibodies, anti-AChRAbs.
Метод исследования
Иммуноферментный анализ (ИФА).
Единицы измерения
Нмоль/л (наномоль на литр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Миастения - редкое аутоиммунное заболевание, при котором нарушается процесс передачи электрического импульса в нервно-мышечном синапсе. Характерным признаком миастении является слабость поперечно-полосатой (скелетной) мускулатуры (мышцы глазного яблока, конечностей, глотки и гортани, лицевые мышцы, диафрагма). В основе патогенеза миастении лежит образование аутоантител, направленных против различных компонентов нервно-мышечного синапса. В большинстве случаев миастения обусловлена появлением аутоантител к никотиновому ацетилхолиновому рецептору (AxP), относящимся к классу иммуноглобулинов G. При взаимодействии этих аутоантител с АхР происходят следующие нарушения: (1) активация системы комплемента и разрушение рецептора и связанных с ним белков, (2) связывание соседних АхР, их интернализация и разрушение и (3) блокировка сайта связывания ацетилхолина. Таким образом, анти-АхР играют непосредственную патофизиологическую роль в развитии болезни. Кроме того, анти-АхР играют важную диагностическую роль.
Антитела к AxP обнаруживаются у 85 % пациентов с генерализованной миастенией и 50-70 % пациентов с окулярной миастенией. Они очень специфичны для миастении и не выявляются у здоровых людей. Следует, тем не менее, помнить, что описаны редкие случаи выявления анти-АхР при мелкоклеточном раке легкого, ревматоидном артрите на фоне лечения пеницилламином и синдроме Ламберта - Итона. Благодаря высокой чувствительности и специфичности исследование на анти-АхР является основным способом подтверждения диагноза "миастения".
Хотя точный механизм образования аутоантител к АхР остается не до конца ясным, вероятно, ведущая роль принадлежит нарушению иммунной толерантности, связанной с патологией тимуса. Патологию тимуса удается выявить у большинства пациентов с миастенией и анти-АхР (50 % случаев - гиперплазия тимуса, 10-15 % - тимома). Практически все пациенты с миастенией и тимомой имеют антитела к АхР.
Считается, что уровень анти-АхР не отражает активность миастении и повторные анализы для оценки контроля лечения не рекомендуются.
У 15 % пациентов с миастенией обнаружить антитела к AxP не удается (серонегативная миастения). У половины таких больных определяются антитела к специфической мышечной тирозинкиназе (анти-MuSK, от. англ. muscle-specific tyrosine kinase) - ферменту, необходимому для формирования нервно-мышечной пластинки. При отсутствии антител к AxP и анти-MuSK говорят о "дважды-серонегативной" миастении (7-8 % пациентов).
Кроме того, при миастении обнаруживаются аутоантитела к белкам скелетных мышц, не входящим в состав нервно-мышечного синапса (титин, миозин, актин, рианодиновый рецептор). Они обнаруживаются примерно у 90 % пациентов с миастенией и тимомой. Антитела к скелетным мышцам неспецифичны для миастении и могут быть обнаружены при некоторых других аутоиммунных заболеваниях и при наличии тимомы без миастении. При миастении антитела к скелетным мышцам редко обнаруживаются при отсутствии анти-АхР и поэтому не имеют самостоятельного значения в первичной диагностике этого заболевания. Однако они могут отражать наличие патологии тимуса и быть полезны для выявления пациентов с миастенией и тимомой. В качестве маркера тимомы они наиболее информативны у молодых пациентов с миастенией (младше 40 лет) с антителами к АхР.
Показано, что миастения чаще сочетается с другими аутоиммунными заболеваниями, в том числе болезнью Грейвса - Базедова, ревматоидным артритом, системной красной волчанкой и другими. По этой причине при подтверждении диагноза "миастения" рекомендуется провести дополнительные лабораторные тесты для исключения сопутствующей патологии.
Для чего используется исследование?
Когда назначается исследование?
- При наличии признаков слабости скелетной мускулатуры: опущение век, двоение в глазах, нарушение речи, глотания, жевания, бедность мимики, слабость в ногах, руках.
Что означают результаты?
Референсные значения: менее 0,45 нмоль/л.
- миастения;
- в редких случаях: мелкоклеточный рак легкого, миастенический синдром Ламберта - Итона, системная красная волчанка.
Что может влиять на результат?
Клиническая форма миастении: анти-АхР обнаруживаются в 90 % случаев генерализованной миастении и 50-70 % окулярной миастении.
Тимома у взрослых и детей
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Среди достаточно редких новообразований специалистами выделяется тимома, которая представляет собой опухоль эпителиальной ткани тимуса - одного из основных лимфоидно-железистых органов иммунной системы.
Код по МКБ-10
Эпидемиология
Среди всех раковых заболеваний доля опухолей вилочковой железы - менее 1%. Частота образования тимомы оценивается ВОЗ в 0,15 случаев на 100 тыс. человек. А, к примеру, в Китае, общая заболеваемость злокачественной тимомой составляет 6,3 случая на 100 тыс. человек. [1]
Тимома переднего средостения, на которую приходится 90% всех опухолей вилочковой железы, составляет 20% опухолей данной локализации - в верхней части грудной клетки, под грудиной.
В остальных случаях (не более 4%) опухоль могут возникать на других участках, и это тимома средостения.
Причины тимомы
Биология и классификация неоплазий, связанных с тимусом, относятся к сложным вопросам медицины, и ей до сих пор неизвестны точные причины тимомы вилочковой железы. Эта опухоль с одинаковой частотой выявляется у мужчин и у женщин, и чаще обнаруживается тимома у взрослых людей зрелого возраста.
А вот опухоль вилочковой железы у молодых, а также тимома у детей бывает редко. Хотя тимус (вилочковая железа) наиболее активен именно в детстве, поскольку формирующаяся иммунная система требует большого количества Т-лимфоцитов, которые вырабатываются данной железой.
Вилочковая железа, достигая наибольшего размера в пубертатный период, у взрослых постепенно инволюционирует (сокращаясь в размерах), и ее функциональная активность минимальна.
Факторы риска
Предрасполагающие к развитию тимомы наследственные или экологические факторы риска тоже не выявлены. И на сегодняшний день факторами риска, подтвержденными клинической статистикой, считают возраст и этническую принадлежность.
Риск данного типа новообразований растем с возрастом: тимомы чаще наблюдаются и у взрослых 40-50 лет, а также после 70 лет.
По данным американских онкологов, в США эта опухоль наиболее распространена среди представителей азиатской расы, афроамериканцев и выходцев с островов Тихого океана; реже всего тимома обнаруживается у белокожих и латиноамериканцев. [2]
Патогенез
Как и причины, патогенез тимомы пока остается загадкой, но исследователи не теряют надежды ее разгадать и рассматривают различные версии, включая УФ-облучение и радиацию.
Тимусом продуцируются Т-лимфоциты, обеспечивается их миграция в периферические лимфоидные органы, а также индуцируется выработка антител В-лимфоцитами. Кроме того, данный лимфоидно-железистый орган секретирует гормоны, которые регулируют дифференцировку лимфоцитов и сложные взаимодействия Т-клеток в тимусе и тканях других органов.
Тимома относится к эпителиальным опухолям и растет медленно - с пролиферацией нормальных или видоизмененных медуллярных эпителиальных клеток (схожих с нормальными). Специалисты отмечают, что эпителиальные клетки, из которых состоит злокачественная тимома, могут не иметь типичных признаков злокачественности, что определяет цитологические особенности данной опухоли. И ее злокачественное поведение, наблюдаемое в 30-40% случаев, заключается в инвазии в окружающие органы и структуры.
Анализ связи тимомы с другими заболеваниями показал, что практически все они имеют аутоиммунный характер, что может свидетельствовать о нарушениях толерантности иммунокомпетентных клеток и формировании стойкой аутоиммунной реакции (клеточной аутореактивности). Наиболее частое связанное состояние (у трети пациентов) - миастения при тимоме. Myasthenia gravis связана с наличием аутоантител к ацетилхолиновым рецепторам нервно-мышечных синапсов или к ферменту мышечной тирозинкиназе.
Также установлена корреляция опухолей данного типа с такими одновременно протекающими аутоиммунными заболеваниями, как: полимиозит и дерматомиозит, системная красная волчанка, аплазия эритроцитов (у половины пациентов), гипогаммаглобулинемия (у 10% пациентов), буллезные дерматозы (пузырчатка), пернициозная или мегалобластная анемия (болезнь Аддисона), неспецифический язвенный колит, болезнь Кушинга, склеродермия, диффузный токсический зоб, тиреоидит Хашимото, неспецифический аортоартериит (синдром Такаясу), синдром Шегрена, гиперпаратиреоидизм (избыток паратиреоидного гормона), болезнь Симмондса (пангипопитуитаризм), синдром Гуда (комбинированный В- и Т-клеточный имммунодефицит).
Симптомы тимомы
В 30-50% случаев симптомы роста опухоли эпителиальной ткани тимуса отсутствуют, и, как отмечают рентгенологи, случайно обнаруживается тимома на рентгенограмме грудной клетки (или КТ) - при обследовании, проводимому по другому поводу.
Если опухоль проявляет себя, то первые признаки ощущаются в виде дискомфорта и давления в груди и загрудинном пространстве, к которым могут присоединяться одышка, постоянный кашель, боль в груди неопределенного характера и другие признаки синдрома верхней полой вены.
Пациенты, у которых имеется миастения при тимоме, жалуются на усталость и слабость (например, им трудно поднять руку, чтобы причесаться), двоение в глазах (диплопию), затруднения при глотании (дисфагию), опущение верхних век (птоз). [3], [4]
Стадии
Рост тимомы и степень ее инвазивности определяется стадиями:
I - опухоль полностью инкапсулирована и не прорастает в жировые ткани средостения;
IIA - присутствие опухолевых клеток вне капсулы - микроскопическое проникновение через капсулу в окружающую жировую ткань;
IIB - макроскопическая инвазия через капсулу;
III - макроскопическое вторжение в соседние органы;
IVA - имеются плевральные или перикардиальные метастазы;
IVB - наличие лимфо- или гематогенных метастазов во внегрудные области.
Формы
Поведение этих опухолей непредсказуемо, и большинство из них способны развиваться как рак и распространяться за пределы железы. Так что тимомы могут быть доброкачественными или злокачественными; злокачественной (или инвазивной) тимомой называют опухоли, ведущие себя агрессивно. Большинство западных специалистов относят тимому к злокачественной неоплазии. [5]
Объединив и систематизировав ранее существовавшие классификации опухолей тимуса, эксперты ВОЗ все виды тимом разделили в зависимости от их гистологического типа.
Тип А - медуллярная тимома, состоящая из опухолевых эпителиальных клеток тимуса (без ядерной атипии); в большинстве случаев опухоль инкапсулированная, овальной формы.
Тип AB - смешанная тимома, в которой имеется смесь веретенообразных и округлых эпителиальных клеток или лимфоцитарных и эпителиальных компонентов.
Тип B1 - кортикальная тимома, состоящая из клеток, похожих на эпителиальные клетки железа и ее коры, а также зон, имеющих сходство с мозговым веществом тимуса.
Тип В2 - корковая тимома, новообразованная ткань которой имеет набухшие эпителиоретикулярные клетки с пузырчатыми ядрами и массивы Т-клеток и В-клеточных фолликул. Опухолевые клетка могу скапливаться около сосудов тимуса.
Тип B3 - эпителиальная или сквамоидная тимома; состоит из пластинчато растущих полигональных эпителиоцитов с или без атипии, а также неопухолевых лимфоцитов. Считается хорошо дифференцированной карциномой тимуса.
Тип С - карцинома тимуса с гистологической атипией клеток.
Когда тимома ведет себя агрессивно с инвазией, ее иногда называют злокачественной.
Пример тимомы. Прогноз myastenia gravis
Зубцовская центральная районная больница, Тверская область
Эктопическая тимома у больной с поздним дебютом миастении
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2012;112(7): 70‑73
Жданов Г.Н. Эктопическая тимома у больной с поздним дебютом миастении. Журнал неврологии и психиатрии им. С.С. Корсакова. 2012;112(7):70‑73.
Zhdanov GN. Ectopic thymoma in a female patient with late-onset myasthenia. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2012;112(7):70‑73. (In Russ.).
Миастения (myasthenia gravis, МА), или болезнь Эрба—Гольдфлама—Джоли, — тяжелое прогрессирующее аутоиммунное заболевание, характеризующееся нарушением нервно-мышечной передачи и клинически проявляющееся слабостью и патологической утомляемостью поперечнополосатых мышц.
Описанная более 100 лет назад под названием бульбарного паралича МА является относительно редким заболеванием: 0,5—5 случаев на 100 000 населения, дебют чаще всего приходится на 3—4-е десятилетие жизни [1, 7, 12, 14, 15, 21]. Согласно современным исследованиям [2—4, 8, 10, 13, 16, 17, 23], в основе патогенеза МА лежит явление аутоагрессии, направленной на холинорецепторы постсинаптической мембраны и пресинаптические структуры, приводящей к изменению функционального состояния ионных каналов. В свою очередь аутоиммунный процесс при МА обусловлен патологией вилочковой железы, ее гиперплазией с образованием лимфатических фолликулов и/или неоплазией, которая чаще проявляется в виде лимфоэпителиальной тимомы. Благоприятное влияние тимэктомии на состояние больных МА является существенным аргументом в пользу данной концепции [9, 11, 18, 24].
Тимомы относят к наиболее частым новообразованиям средостения, выявляя их у 10—60% больных МА. При этом опухоль вилочковой железы обнаруживают у 37,8% мужчин, заболевших в возрасте от 31 года до 40 лет, и 31,7% женщин этого же возраста, а в 41—50 лет — у 25,0% мужчин и 32,6% женщин [11, 18, 24].
Топографически тимомы могут встречаться в различных отделах средостения: в переднем — у 75,0% пациентов, в переднем верхнем — у 15,0%, в верхнем — у 6,0%, в шее, среднем и заднем средостении — у 5,0%. Согласно предложенной ВОЗ (1999 г.) последней гистологической классификации, основанной на гистологической и иммунофенотипической близости к клеткам кортикального или медуллярного слоев тимуса, все тимомы подразделяются на тип А — медуллярноклеточные, темноклеточные, веретеноклеточные, тип В — кортикальноклеточные, эпителиальные, плоскоклеточные, атипичные, высокодифференцированный рак тимуса и тип АВ — смешанные [9].
В 60% случаев, особенно на начальном этапе своего развития, тимомы клинически не проявляются и часто являются случайной рентгенологической находкой. В более поздний период опухоли тимуса могут проявляться в виде трех групп симптомов: общих, интраторакальных, паратимических. Общие симптомы представлены астеническим синдромом. Интраторакальные — выявляются при сдавлении или прорастании структур средостения опухолью и проявляются чувством стеснения, неприятными ощущениями и болью за грудиной, одышкой, кашлем, охриплостью голоса, перикардитом, плевритом, синдромом верхней полой вены. Респираторные нарушения особенно выражены у детей вследствие сдавливания относительно узкой податливой трахеи. Паратимические симптомы включают в себя ряд иммунологических и других расстройств, встречающихся при МА [11].
Несмотря на яркость и своеобразие клинических проявлений МА, позволяющих в большинстве случаев решать вопросы диагностики на основании результатов изучения анамнеза, осмотра и проведения медикаментозных тестов, правильный диагноз нередко устанавливается только после продолжительного наблюдения. Согласно данным литературы [5, 6, 21], у 32 из 44 больных правильный диагноз был поставлен только через 6—8 мес после появления первых признаков заболевания. Это объясняется малой выраженностью клинической картины МА в начальной стадии, недостаточной осведомленностью практических врачей, к которым впервые обращаются за помощью больные МА.
Примером дебюта генерализованной МА на фоне длительного бессимптомного течения атипично расположенной (внутрилегочной) тимомы может служить собственное наблюдение.
Пациентка К., 69 лет, пенсионерка. С 1997 г. наблюдалась онкологом по поводу периферической опухоли правого легкого, от хирургического лечения отказывалась. При очередном осмотре в областном онкологическом диспансере г. Твери в связи с отрицательной динамикой рентгенологической картины — ростом опухоли, появлением жалоб на одышку, общую слабость пациентка дала согласие на хирургическое лечение. При госпитализации 13.01.10 состояние больной удовлетворительное. Кожные покровы обычной окраски, периферические лимфатические узлы не увеличены, повышенного питания. В легких дыхание везикулярное, хрипы не выслушиваются. Частота дыхательных движений — 17 в покое. Артериальное давление 150/90 мм рт.ст., частота сердечных сокращений 72 в минуту. Лабораторные исследования: в общем анализе крови, мочи, биохимическом анализе крови — без особенностей. При рентгенографии органов грудной клетки в правом легочном поле в средней зоне выявлено округлое образование с четкими контурами, выполняющее всю долю. Из-за длительного существования периферического образования средней доли правого легкого было сделано заключение о его доброкачественном генезе. Однако из-за появления симптомов острой респираторной вирусной инфекции и гипертонического криза (АД 240/120 мм рт.ст.) было решено воздержаться от оперативного вмешательства с последующей явкой в областной онкологический диспансер через 1,5 мес.
В связи с ухудшением состояния, появлением жалоб на слабость в мышцах лица, шеи и конечностях, затрудненное дыхание, трудность при глотании твердой и жидкой пищи 09.06.10 больная была госпитализирована в неврологическое отделение. В неврологическом статусе отмечались птоз век, двусторонний офтальмопарез, слабость круговых мышц глаз, жевательной мускулатуры, бульбарный синдром, слабость мышц шеи, голова свисала вперед и не держалась без помощи рук, выявлялся тетрапарез преимущественно в проксимальных отделах конечностей, сила снижена до 2—3 баллов. Мышечный тонус низкий D=S, сухожильные рефлексы снижены D=S, патологические рефлексы не определялись. Ходьба была возможна только с посторонней помощью. Общие анализы крови и мочи нормальные. Биохимический анализ крови отклонений от нормы не выявил. Электрокардиограмма: синусовый ритм, отклонение электрической оси влево, блокада левой передней ветви пучка Гиса, гипертрофия левого желудочка. Магнитно-резонансная томография (МРТ) головного мозга (06.07.10): в белом веществе лобных и теменных долей определяются множественные очаги гиперинтенсивного МРТ-сигнала на Т2 ВИ и FLAIR, неправильной формы с нечеткими контурами, размером 0,5—0,7 см, без перифокального отека, объемного эффекта. Боковые и III желудочки не расширены. IV желудочек не изменен. Базальные цистерны не деформированы. Хиазмальная область без особенностей, ткань гипофиза имеет обычный сигнал. Определяется нерезкое расширение субарахноидального пространства конвекситальной поверхности и кортикальных борозд, периваскулярных пространств за счет церебральной атрофии. Срединные структуры не смещены. Миндалины мозжечка расположены обычно. На серии ангиограмм, выполненных в режиме TOF в аксиальной проекции с последующей обработкой по MIP-алгоритму и трехмерной реконструкцией, визуализированы внутренние сонные, основная, интракраниальные сегменты позвоночных артерий и их разветвления. Вариант развития виллизиева круга в виде отсутствия кровотока по задним соединительным артериям (виллизиев круг разомкнут). Просветы остальных сосудов равномерные, МРТ-признаков гемодинамически значимого стеноза и наличия аневризмы не найдено. Заключение: очаговые изменения субкортикальных отделов лобных, теменных долей, предположительно сосудистого генеза. Проявления церебральной атрофии. Убедительных данных за острое нарушение мозгового кровообращения и внутричерепной объемный процесс на момент исследования не найдено.
Учитывая развитие генерализованной мышечной слабости, была заподозрена МА и пациентке выполнена компьютерная томография (КТ) грудной полости (09.07.10). В нижних отделах правого легкого визуализируется округлое солидное образование диаметром около 75 мм, с четкими крупноволнистыми контурами, расположенное на неизмененном легочном фоне. В медиальных отделах образования видны кальцификаты. В паренхиме легких очаговых и инфильтративных изменений не обнаружено. В средостении дополнительных образований не обнаружено, лимфоузлы не увеличены. Заключение: признаков тимомы нет. Имеется образование в правом легком, судя по размерам длительно существующее (вероятно, доброкачественное), однако из-за невозможности оценить динамику процесса однозначно высказаться о его характере нельзя.
Существующая клиническая картина и наличие образования в правом легком неизвестного характера индуцировали проведение в этот период дифференциальной диагностики между МА и миастеническим синдромом Ламберта—Итона.
В течение 2 нед после возникновения первых симптомов заболевания у пациентки усугубились имеющиеся расстройства, появилась слабость в дистальных отделах конечностей, мимических и жевательных мышц, усилились нарушения речи, глотания, дыхания. Развился тяжелый миастенический криз с нарушением дыхания, потребовавший перевода больной в реанимационное отделение и проведения интенсивной терапии, включая антихолинэстеразные препараты, глюкокортикостероиды, плазмаферез. Отмечена положительная динамика в состоянии больной, улучшилась речь, наросла сила скелетных мышц, в мышцах лица, увеличился объем движений глазных яблок, уменьшился птоз. Больная была консультирована торакальным хирургом. Анализируя анамнез заболевания, результаты инструментальных исследований, наличие образования в правом легком и генерализованной МА было сделано предположение об атипично расположенной тимоме. После компенсации миастенических проявлений больной рекомендовано оперативное лечение.
07.10.10 пациентка была госпитализирована в Национальный медико-хирургический центр им. Н.И. Пирогова для хирургического лечения. При поступлении предъявляла жалобы на выраженную мышечную слабость в конечностях, больше в нижних, одышку при физической нагрузке, утомляемость. При осмотре общее состояние больной средней тяжести. Кожные покровы обычной окраски, лимфоузлы не увеличены. В легких дыхание везикулярное, с жестким оттенком, проводится во все отделы, хрипов нет. ЧДД — 16 в минуту. Область сердца не изменена, аускультативно тоны приглушены, ритмичные. ЧСС 78 в минуту. АД 130/80 мм рт.ст. Живот мягкий, безболезненный, печень и селезенка не увеличены. Отеков нет. Общий анализ крови, мочи, коагулограмма, биохимический анализ крови — без патологии. В неврологическом статусе слабость краниобульбарной мускулатуры, слабость в мышцах конечностей, больше в нижних, положительный синдром патологической мышечной утомляемости. КТ органов грудной клетки в правом кардиодиафрагмальном углу определяется опухоль неопределенной формы размерами 92x78x85 мм. Структура однородна со средним денситометрическим показателем 37 ед. Н. Опухоль имеет экспансивный тип роста.
После получения информированного согласия больной 07.10.10 проведена правосторонняя торакотомия, атипичная резекция средней доли легкого. При ревизии плевральная полость свободна от спаек. В правом кардиодиафрагмальном углу определяется опухоль в капсуле, исходящая из средней доли правого легкого, с бугристой поверхностью, каменистой плотности размерами 94x80x45 мм. Опухоль подрастает к медиастинальной плевре. Лимфатические узлы средостения и корня легкого не увеличены. Гистологическое исследование: неэпителиальная (стромальная) веретеноклеточная опухоль с мультицентрическим характером роста и неуточненным потенциалом злокачественности. Морфологически с учетом локализации и клинической картины не исключена метапластическая тимома с врастанием в легочную паренхиму. Макроскопическое описание: округлое образование размерами 10x8x7 см с прилежащим плоскостным фрагментом легкого 3 4 см (плоскость резекции 71—74) в четкой капсуле. На разрезах представлено студенистой тканью с множественными сливающимися узлами диаметром от 0,5 до 4x2,5 см, серо-розового цвета «мясистого» вида. Микроскопическое описание: в готовых препаратах и препарате, изготовленном с блока, кусочки опухолевой ткани из вытянутых и полигональных клеток, формирующих гемангиоперицитомоподобные структуры. Фибробластоподобные клетки формируют тяжи. Структура опухолевой ткани более свойственна тимоме А типа. Для уточнения диагноза на срезах с парафинового блока проведено иммуногистохимическое исследование с использованием антител к CD1a, CD3, CD5, CD20, CD57, BCL2, виментину, панцитокератину (AE1/AE3), EMA, K67. Опухолевые клетки экспрессируют виментин, панцитокератин, EMA, BCL2, CD20 (очаговая реакция). С остальными маркерами реакции в опухолевых клетках негативные. Единичные CD3+ Е-лимфоциты располагаются дискретно. Заключение: морфоиммуногистохимическая характеристика опухолевой ткани соответствует тимоме А типа.
Больная выписана в удовлетворительном состоянии. Послеоперационная рана зажила первичным натяжением. При катамнестическом наблюдении состояние больной остается стабильным в течение всего периода после выписки. Сохраняется умеренная слабость в мышцах верхних и нижних конечностей, жевательных мышцах. Постоянно принимает калимин в дозе 480 мг/сут.
В приведенном наблюдении заболевание дебютировало у пациентки в возрасте 69 лет на фоне бессимптомно протекающей внутрилегочной тимомы. Появление первых симптомов МА и предшествующая рентгенологическая, а затем и нейровизуализационная картина неизвестного образования в правом легком дали основание на раннем этапе провести дифференциальный диагноз МА с миастеническим синдромом Ламберта—Итона.
В соответствии с современными представлениями миастенический синдром Ламберта—Итона, как и МА, относится к аутоиммунным заболеваниям, патогенез которых связан с присутствием аутоантител к потенциалзависимым кальциевым каналам пресинаптической мембраны нервно-мышечного соединения [19, 20, 22, 25]. В 70% случаев миастенический синдром Ламберта—Итона развивается на фоне центрального бронхогенного рака легких (мелкоклеточная карцинома), реже — опухолей другой локализации (в том числе тимомы), которые, как полагают, и запускают аутоиммунный процесс. Необходимо отметить, что указанный синдром может задолго предшествовать выявлению опухоли [19].
Клинически миастенический синдром Ламберта—Итона проявляется мышечной слабостью и утомляемостью проксимальных мышц конечностей при относительной сохранности глазодвигательной и бульбарной мускулатуры. Нижние конечности поражаются в большей степени, чем верхние. Мышечная слабость может быть незначительной, а при повторных движениях сила увеличивается в противоположность тому, что наблюдается при МА. Типичные симптомы при миастеническом синдроме Ламберта—Итона: гипо- или арефлексия, а также нарушения со стороны вегетативной нервной системы (сухость во рту, снижение либидо, уменьшение потливости, ортостатическая гипотензия, изменение зрачковых рефлексов); частой жалобой являются парестезии [22].
Дальнейшее прогрессирование заболевания с вовлечением различных групп мышц, развитие миастенического криза, а также эффективность антихолинэстеразных препаратов позволили исключить миастенический синдром Ламберта—Итона и заподозрить у пациентки МА с атипично расположенной тимомой. Проведенное хирургическое вмешательство, гистологическое и патоморфологическое исследование подтвердили диагноз генерализованной МА и наличие внутрилегочной тимомы.
В литературе нами не обнаружено упоминаний о подобном случае. Представленное клиническое наблюдение свидетельствует о важности и необходимости всестороннего диагностического подхода и совместного наблюдения таких пациентов врачами разных специальностей с целью диагностики МА и миастенических синдромов и выбора адекватной терапии.
Миастения
Миастения - аутоиммунное заболевание, проявляющееся эпизодами мышечной слабости и утомляемости, в основе чего деструкция ацетилхолиновых рецепторов факторами гуморального и клеточного иммунитета. Чаще поражает молодых женщин и пожилых мужчин, хотя может возникнуть в любом возрасте. Симптомы миастении усугубляются при нагрузке на мышцы и уменьшаются в состоянии покоя. Диагностируется с помощью внутривенного введения эдрофония, который на короткое время уменьшает слабость. Лечение миастении включает антихолинэстеразные препараты, иммунодепрессанты, глюкокортикоиды, тимэктомию и плазмаферез.
Миастения (Myasthenia gravis) - приобретенное аутоиммунное заболевание, проявляющееся слабостью и патологической утомляемостью скелетных мышц. Заболеваемость миастенией составляет менее 1 случая на 100 000 населения в год, а распространенность - от 10 до 15 случаев на 100 000 населения. Миастения особенно часто встречается у молодых женщин и мужчин старше 50 лет.
Причины миастении
Миастения развивается в результате аутоиммунной атаки на постсинаптические ацетилхолиновые рецепторы, нарушающей нервно-мышечную передачу. Что запускает образование аутоантител, неизвестно, но заболевание связывают с патологией тимуса, тиреотоксикозом и другими аутоиммунными нарушениями. Роль тимуса в развитии заболевания не ясна, но в 65 % случаев миастении тимус гиперплазирован, а в 10 % есть тимома. Среди предрасполагающих факторов - инфекции, хирургическое вмешательство и некоторые лекарственные препараты (например, аминогликозиды, квинин, сульфат магния, прокаинамид, блокаторы кальциевых каналов).
Редкие формы миастении. При глазной форме страдают только наружные мышцы глаза. Врожденная миастения - редкое заболевание с аутосомно-рецессивным типом наследования. Это, скорее, результат структурных нарушений постсинаптического рецептора, нежели следствие аутоиммунного процесса. Часто бывает офтальмоплегия.
12 % детей, матери которых страдают миастенией, рождаются с неонатальной миастенией. Это связано с пассивным проникновением lgG-антител через плаценту. Общая мышечная слабость проходит через несколько дней - недель, параллельно снижению титра антител в крови ребенка.
Симптомы миастении
Наиболее распространенные симптомы миастении: птоз, диплопия и слабость мышц после нагрузки. Слабость проходит после отдыха, но при повторной нагрузке рецидивирует. В 40 % случаев первоначально поражаются мышцы глаз, позже распространенность этого поражения достигает 85 %. За первые 3 года в большинстве случаев происходит генерализация процесса. Часто встречается слабость в проксимальных отделах конечностей. Иногда пациенты обращаются с жалобами на бульварные нарушения (например, изменения голоса, назальная регургитация, асфиксия, дисфагия). При этом чувствительность и глубокие сухожильные рефлексы не изменяются. Выраженность нарушений колеблется с периодом в несколько часов - дней.
Миастенический криз - тяжелый генерализованный тетрапарез или угрожающая жизни слабость дыхательных мышц, развивается примерно в 10 % случаев. Он часто связан с инфекцией, активирующей иммунную систему. После начала дыхательной недостаточности остановка дыхания может наступить очень быстро.
Диагностика миастении
Диагноз ставят на основании жалоб, клинической картины и данных специальных исследований. Для оценки поражения пациента просят напрячь мышцу до усталости (например, держать глаза открытыми, пока не разовьется птоз, или громко считать, пока не нарушится речь); затем внутривенно вводят 2 мг эдрофония - антихолинэстеразного препарата кратковременного действия (
ФГБОУ ВО «Иркутский государственный медицинский университет» Минздрава России, Иркутск, Россия
Качество жизни больных миастенией с различными типами течения
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2017;117(1‑2): 64‑69
Цель исследования. Изучение качества жизни больных миастенией и его сопряженности с особенностями клинических проявлений при различных вариантах течения заболевания. Материал и методы. Обследовали 103 пациента с миастенией. Использовали комплекс тестов и шкал для оценки неврологического дефицита и качества жизни. Результаты и заключение. В результате исследования выделено 2 типа течения миастении: благоприятный и неблагоприятный. Показано, что применение тимэктомии статистически достоверно способствует улучшению качества жизни больных миастенией. Установлено, что единственным благоприятным прогностическим признаком успешно выполненной тимэктомии при миастении является минимальная длительность заболевания до ее выполнения. Благоприятное и мягкое течение миастении наблюдается при преобладании в клинической картине слабости экстраокулярных мышц и мышц конечностей. Самые низкие показатели качества жизни отмечены при вовлечении в патологический процесс дыхательных и бульбарных мышц (p
Миастения — наиболее распространенная форма расстройств нервно-мышечной передачи [1]. Основной целью лечения миастении является индукция ремиссии. На сегодняшний день назрела необходимость изучения прогнозирования развития ремиссии.
Актуальность проблемы определяется тенденцией к увеличению распространенности миастении с середины XX века, которая достигла 32 случая на 100 000 населения [2, 3]. Это связано с улучшением качества диагностики миастении, постарением населения и увеличением продолжительности жизни больных. Диагноз «миастения» до сих пор ассоциируется с повышенной смертностью, особенно в группе с поздним началом заболевания [4]. Сообщается, что смертность больных миастенией выше у мужчин, чем у женщин [5]. Однако существуют исследования, опровергающие этот факт: среди женщин миастения чаще дебютирует в пожилом возрасте с более высокой частотой сопутствующих заболеваний, в этом случае отмечается более высокий показатель смертности [4]. Имеющиеся данные литературы, касающиеся вопросов клинического течения миастении, также противоречивы [6]. До настоящего времени нет единого мнения относительно факторов, влияющих на характер течения заболевания, так как у части пациентов один вариант может переходить в другой. Для подбора адекватного лечения больным миастенией необходимо учитывать особенности протекания заболевания [7]. Выделение варианта клинического течения миастении позволяет сформулировать полный клинический диагноз при его постановке, определить тактику лечения и разработать индивидуальные реабилитационные мероприятия [8].
Миастения не создает трудностей при клинической интерпретации и диагностике, однако для построения более полной картины заболевания необходима всесторонняя оценка качества жизни [9]. Оценка качества жизни позволяет объективно определять тяжесть состояния больных в дополнение к клинической картине миастении, в связи с этим основанием для настоящего исследования послужила проблема соотношения клинического паттерна с показателями качества жизни больных миастенией.
Цель исследования — изучение качества жизни больных миастенией и его сопряженности с особенностями клинических проявлений при различных вариантах течения заболлевания.
Материал и методы
Наблюдали 103 пациентов с миастенией. Их средний возраст составил 36,2±12,4 года. Критериями включения пациентов в исследование были: верифицированный диагноз миастении, выставленный на основании основных диагностических критериев [10], подписанное информированное согласие больного. Критериями исключения были: миастенический синдром, тяжелые сопутствующие соматические и неврологические заболевания, отсутствие подписанного информированного согласия больного.
Для изучения клинического течения миастении использовалась отечественная классификация миастении, предложенная Б.М. Гехтом [11]. В соответствии с этой классификацией все обследованные больные были разделены на четыре группы: с ремиттирующим (n=26), стационарным (n=17), прогрессирующим (n=48) и злокачественным (n=12) течением. Определение показателей качества жизни проводилось с помощью опросника Short form 36 (SF-36) [12]. Тяжесть двигательных расстройств у больных миастенией оценивалась при помощи количественной шкалы QMGS — Quantitative Myasthenia Gravis Score [13]. Статистическая обработка результатов осуществлялась с использованием пакета прикладных программ IBM SPSS Statistics 22.0 и Microsoft Excel. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимался равным 0,05 (p — достигнутый уровень значимости).
Результаты и обсуждение
В связи с тем, что миастения является хронической патологией и требует длительного лечения симптоматическими и патогенетическими средствами, особое внимание было уделено клиническим характеристикам заболевания. Общий балл шкалы QMGS варьировал от 0 до 21. Выявлено, что при ремиттирующем течении балл по шкале составлял 0, при стационарном 10±4,04, при прогрессирующем — 13,58±2,39, а при злокачественном — 16,0±3,4 (рис. 1). В результате проведенного однофакторного дисперсионного анализа определено, что дисперсия между средними значениями шкалы QMGS в группах вариантов течения миастении в 87,364 раза выше, чем внутригрупповая дисперсия (F=87,364; p<0,0001).
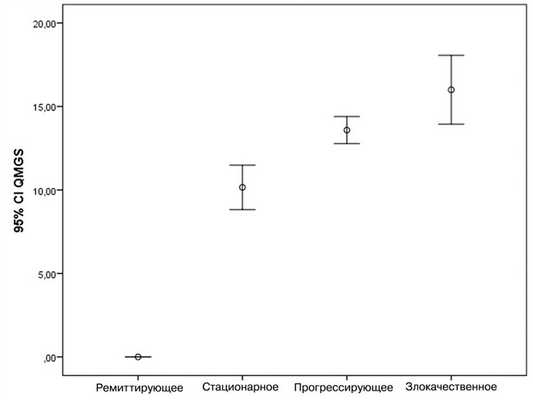
Рис. 1. Средние значения шкалы QMGS при различных вариантах течения миастении.
Применение данной шкалы позволяет оценить выраженность клинических проявлений миастении на фоне различных методов лечения больных с разными формами и типами течения заболевания. Часто встречающимся симптомом при легких формах миастении являлась слабость мышц конечностей (25%). При тяжелых формах достоверно чаще встречались дыхательные (59%) и бульбарные (55%) нарушения (p<0,003). Это имеет прогностическое значение, т. е. отсутствие у пациента дыхательных и бульбарных нарушений свидетельствует о более мягком течении заболевания.
Проводя анализ клинического течения миастении у исследованной когорты пациентов, мы учитывали особенности дебюта заболевания. Чаще всего миастения дебютировала с общей слабости (19,8%) и птоза (37,8%), реже в качестве симптомов дебюта выступали нарушение жевания (13%) и дизартрия (6,8%). Количество симптомов дебюта у больных было различным. Более чем в половине случаев — у 61 (59,2%) пациента отмечалось моносимптомное начало заболевания, у 34 (33%) пациентов заболевание проявлялось двумя симптомами, у 5 (4,8%) пациентов симптомов дебюта было три, у 3 (2,9%) пациентов заболевание началось с появления четырех и более симптомов одновременно.
В наших клинических наблюдениях миастения чаще встречалась у молодых женщин (44,6%), наиболее частым симптомом дебюта был птоз (27,8%), среди сопутствующей патологии часто встречались заболевания сердечно-сосудистой системы (59,1%). Неблагоприятными прогностическими симптомами являлись дыхательные и бульбарные нарушения.
Основные клинические показатели при различных вариантах течения миастении приведены в таблице.
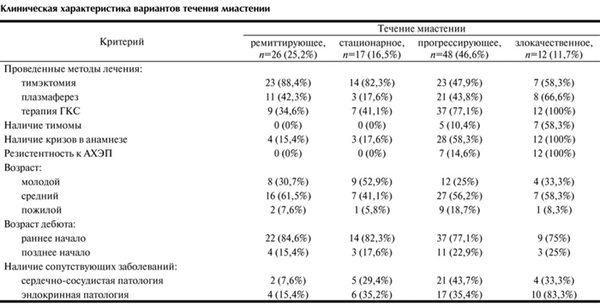
Клиническая характеристика вариантов течения миастении
При ремиттирующем типе течения кратковременные миастенические симптомы (глазодвигательные, бульбарные или генерализованные) сменялись спонтанной или медикаментозно вызванной ремиссией. Под полной ремиссией подразумевается отсутствие мышечной слабости без какой-либо терапии. При медикаментозной ремиссии симптомы миастении отсутствуют на фоне патогенетической терапии глюкокортикоидами (ГКС). В данной группе было 26 (25,2%) пациентов. Периоды ухудшения состояния пациенты этой группы отмечали чаще весной и осенью, а также под влиянием внешних факторов — стрессов и инфекций. В эти периоды возникала необходимость приема ГКС для компенсации миастенических проявлений. Длительность ремиссий варьировала и составляла у разных пациентов от нескольких недель до 15 лет. К данной группе относились пациенты в основном молодого (до 40 лет) и среднего (40—60 лет) возраста (92,3%) с преимущественно ранним дебютом миастении (84,6%) и низким процентом сопутствующих заболеваний: 2 (7,6%) пациента имели сопутствующую сердечно-сосудистую патологию, у 4 пациентов (15,4%) отмечалась эндокринная патология. При этом ранним дебютом считалось начало заболевания в возрасте до 40 лет. К числу сопутствующих сердечно-сосудистых заболеваний относили гипертоническую болезнь, ишемическую болезнь сердца, нарушение сердечного ритма, врожденные или приобретенные пороки сердца, а к сопутствующей эндокринной патологии относились гипотиреоз, тиреотоксикоз и сахарный диабет. Большинство больных из данной подгруппы — 23 (88,4%) человека были прооперированы по поводу миастении. Такие пациенты (34,6%) меньше всего нуждались в гормональной терапии и получали ее в периоды обострений. Это наиболее благоприятный тип течения заболевания. Использование тимэктомии приводит к стабилизации и регрессу неврологической симптоматики, причем, чем раньше от начала заболевания выполнена операция, тем благоприятнее прогноз: в 31,3% случаев наблюдалась стойкая послеоперационная ремиссия у пациентов, которым была выполнена тимэктомия в течение первых 2-х лет от начала заболевания. На рис. 2 показано распределение пациентов в период ремиссии после тимэктомии в зависимости от длительности болезни к моменту операции. Отмечалось, что ремиссия быстрее и чаще наступала при выполнении тимэктомии больным с самой короткой длительностью болезни — до 2-х лет.
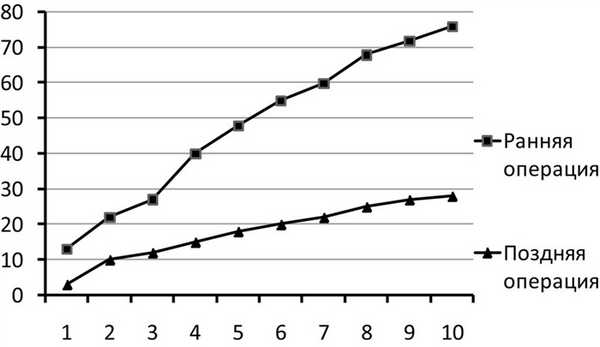
Рис. 2. Распределение пациентов в ремиссии после тимэктомии в зависимости от длительности болезни к моменту операции. По оси абсцисс — годы после операции, по шкале ординат — количество больных в ремиссии. Ранняя операция — операция, выполненная в течение первых 2 лет от момента дебюта заболевания, поздняя — выполненная пациентам с длительностью болезни более 2 лет.
Стационарное течение характеризовалось достаточной стабильностью и монотонностью протекания заболевания на протяжении определенного периода времени, заболевание не менялось ни по тяжести проявления, ни по клинической картине. В нашем исследовании такой тип течения отмечается у 17 (16,5%) больных. Эта форма может возникнуть остро, а в дальнейшем под влиянием лечения приобретает непрогрессирующий характер. В данной группе отсутствовали пациенты с резистентностью к АХЭП, тимома была у 1 (5,8%) больного, а миастенические кризы отмечались у 3 (17,6%) пациентов. Большинство больных этой группы, как и в случае с ремиттирующим течением, относились к молодому и среднему возрасту с ранним дебютом заболевания. Однако число пациентов с сопутствующими заболеваниями в этой группе было больше, чем в группе с ремиттирующим течением; 14 (82,3%) больных перенесли тимэктомию.
Прогрессирующее течение наблюдалось у большинства обследованных больных — 48 (46,6%). Начало заболевания возникало либо молниеносно, остро, либо медленно. С течением времени имелась тенденция к ухудшению состояния, в патологический процесс вовлекались новые группы мышц, увеличивалась выраженность симптоматики. У 1/3 пациентов данной группы миастения сочеталась с тимомой (33,3%), по поводу которой часть из них были прооперированы, и более чем у 58,3% отмечались кризы в анамнезе. Эти пациенты в большей степени нуждались в терапии ГКС (77,1%), число лиц пожилого возраста в этой группе было больше, чем в других группах — 9 (18,7%) пациентов. Данная группа также отличалась большим количеством сопутствующей патологии: 21 (43,7%) больной имел сердечно-сосудистые заболевания, а 17 (35,4%) — сопутствующую эндокринную патологию.
Злокачественное течение наблюдалось у 12 (11,7%) больных и характеризовалось чаще всего острым началом и склонностью к дыхательным нарушениям. Тяжесть их состояния была наиболее высокой. В эту же группу были отнесены больные в стабильно тяжелом состоянии, несмотря на все лечебные процедуры. Причем число пациентов с тимомами было достоверно выше (p<0,005). Частота сопутствующих эндокринных заболеваний была достоверно выше (83,3%, p<0,01). Любая из описанных выше форм, чаще под влиянием инфекции, может принять злокачественный характер. Однако спонтанные ремиссии при миастении могут возникнуть при любом варианте течения заболевания, даже при злокачественном течении.
Резистентность к антихолинэстеразным препаратам (АХЭП) выявлена у всех больных со злокачественной формой заболевания, а также у части больных с прогрессирующим течением (14,6%). Больные с ремиттирующим и стационарным течением имели хороший ответ на введение АХЭП. Наличие кризов в анамнезе отягощает течение заболевания. Все больные с резистентностью к АХЭП имели кризы в анамнезе.
Изучение особенностей влияния различных факторов на клиническое течение миастении позволило нам разделить варианты миастении на 2 основных типа: благоприятный и неблагоприятный. К благоприятному отнесли ремиттирующее и стационарное, к неблагоприятному — прогрессирующее и злокачественное течение. Таким образом, неблагоприятное течение развивается при наличии сопутствующих эндокринологических заболеваний и/или тимомы, перенесенных миастенических или холинергических кризов в анамнезе, а также при позднем дебюте болезни. Заболевание имеет благоприятное течение при хорошем отклике на АХЭП, при отсутствии тимомы и кризов, а также при начале миастении в молодом возрасте. Установление варианта клинического течения миастении и выявление факторов, влияющих на развитие неблагоприятного течения заболевания, позволяют повысить эффективность лечебных и профилактических мероприятий за счет подбора индивидуального подхода к лечению и реабилитации таких больных. Неблагоприятный тип течения миастении является показанием к оперативному лечению.
Клинические особенности миастении оказывают существенное влияние на физическое и психологическое состояние пациента. Уровень неврологического дефицита может приводить к социальным ограничениям, таким как выбор профессии, вождение автомобиля, возможность создания семьи. У таких пациентов нарушается социальная и трудовая адаптация. Даже поражение небольшой группы мышц приводит к птозу и диплопии. При генерализованной форме заболевания социальные проблемы еще больше усугубляются.
Изучена связь параметров качества жизни больных с вариантами течения миастении. Разница показателей по шкале физической роли связана с влиянием физического состояния на выполнение служебных обязанностей на работе, выполнение будничной деятельности. Показатели были ниже у пациентов со злокачественным течением заболевания (p<0,001). Показатель «общее здоровье» отражает оценку больным своего состояния здоровья в настоящий момент и перспектив лечения в дальнейшем. Пациенты в ремиссии имели бо́льшую удовлетворенность лечением, чем пациенты со стационарным течением (p<0,05). Шкала «жизнеспособности» отражает самочувствие и переносимость физических нагрузок. Пациенты со злокачественным тяжелым течением заболевания чаще себя чувствовали уставшими, обессиленными (p<0,001). У больных с прогрессирующим течением максимальные изменения касались шкал, характеризующих ограничения физических функций (p<0,001), возможности осуществления физической деятельности (p<0,001), изменения общего состояния здоровья (p<0,001), энергичности (p<0,005), в меньшей степени ухудшения психологического здоровья и наличия физической боли (p>0,05). Болевой синдром не характерен для миастении, а его присутствие может лишь указывать на наличие у больных сопутствующей патологии, сопровождающейся болевыми синдромами. Больные с прогрессирующим и злокачественным течением заболевания страдают от ограничений в физическом состоянии и социальном функционировании в большей степени, чем пациенты с ремиттирующим и стационарным течением. Показатели качества жизни у пациентов в ремиссии имели самые высокие значения по сравнению с другими подгруппами: это касалось как показателей, отвечающих за физическое здоровье, так и показателей психического здоровья.
По результатам корреляционного анализа по коэффициенту Спирмена установлена связь клинических факторов с качеством жизни. С суммарными оценками опросника SF-36 связаны степень тяжести заболевания (r=-0,41), характер течения (r=-0,21), длительность (r=-0,47), возраст дебюта заболевания (r=-0,29), уровень значимости составил р
Проведена оценка влияния характера течения миастении на показатели шкалы SF-36. Анализ среднегрупповых величин показателей, характеризующих качество жизни, выявил достоверное снижение большинства из них в исследуемых подгруппах. На рис. 3 представлены значения показателей физического и психического компонентов здоровья по шкале SF-36 у пациентов с различными вариантами течения миастении.
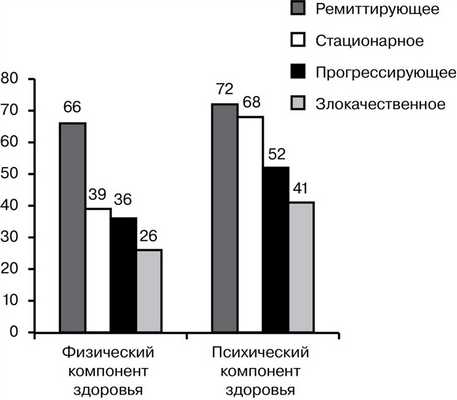
Рис. 3. Значения показателей физического и психического компонентов здоровья в зависимости от варианта течения миастении. По оси ординат — баллы по шкале SF-36.
На течение миастении влияют возраст дебюта, клинический паттерн заболевания и компенсация двигательных расстройств на фоне проводимых методов лечения. Благоприятными прогностическими критериями миастении являются: дебют заболевания в молодом возрасте, преобладание в клинической картине слабости мышц конечностей, высокая компенсация двигательных расстройств на фоне проводимых методов лечения. К критериям неблагоприятного прогноза миастении относятся: бульбарные и дыхательные нарушения, поздний дебют заболевания, резистентность к АХЭП, сопутствующая эндокринная патология (узловой зоб, сахарный диабет), наличие тимомы и перенесенные миастенические или холинергические кризы. При неблагоприятном типе течения миастении показано оперативное вмешательство на вилочковой железе (тимэктомия), в случае отсутствия противопоказаний к ее применению. Благоприятным прогностическим признаком успешно выполненной тимэктомии является более ранняя операция.
Качество жизни является важнейшим показателем состояния больных миастенией. Показатели качества жизни у больных миастенией наряду с клинической картиной заболевания являются критерием эффективности лечения. К факторам, ухудшающим качество жизни больных миастенией, относятся тяжелое и злокачественное течение миастении, средняя и тяжелая степень инвалидизации.
Читайте также:
- Специфичность исследования воротникового пространства. Чувствительность оценки воротникового пространства
- Профилактика преренальной формы острой почечной недостаточности. Принципы профилактики преренальной формы опн.
- Травма. ДВС синдром при травме
- Псевдосиндром Фрелиха (Pseudo Frohlich)
- Расчет вероятности заболевания с неполной пенетрантностью. Пример
