Примеры ангиографии с флюоресцеином и индоцианином зеленым при гемангиоме хориоидеи с четкими контурами
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
предоставляем актуальную медицинскую информацию от ведущих специалистов, помогая врачам в ежедневной работе
Peculiarities of blood supply of localized choroidal
hemangiomas
A.F. Brovkina, A.G. Amiryan, V.G. Leluck
Moscow Scientific Research Institute of Gelmgoltsa MH of RF,
State Scientific Center- Institute of Biophysics of MH RF.
Hemangioma is a rare congenital tumour, which refers to malformations (haemarthromas) and consists of 0.76% from removed intraocular tumours.
Recently the diagnosis of localized choroidal hemangioma has been considered as fatal for the eye because of total retinal detachment. Taking into consideration the opportunity of early local hemangioma destruction, it’s early detection bacame actual.
Purpose: To study peculiarities of haemodynamics of localized choroidal hemangiomas with the help of duplex scanning.
Materials and methods
9 patients (9 eyes) with localized choroidal hemangioma were examined. Age of patients- 18-67 years old. (average - 44.7).
Results and discussion
Being in central zaone, hemangioma affects macular and paramacular zones in 2/3 of cases. There is juxtapapillary location of hemangioma in 1/3 of patients. While examinating in regime of CDK, in all cases, not depending on sizes of localized hemangioma, an even distribution of neovascular vessels at all it’s thickness and square was registered. By sight, blood supply of hemangioma is perfomed by choroidal vessels; retinal vessels don’t participate in it’s supply.
Only in juxtapapillary localization (3 cases) the tumour aquired double supply- from choroidal vessels and central retinal artery.
When the choroidal hemangioma takes place, increase of blood flow in posterior ciliar vessels is observed in 16.6% in average , in central retinal artery in 44.4% in average and in central retinal vein by 18.9%.
Change of blood flow in neovascular vessels is accompanied by increase of maximum systolic speed in intratumourous vessels.
Conclusion
Localized choroidal hemangioma may be differentiated clearly enough, using duplex scanning. Registered haemodynamic changing allows to confirm the double tumorous blood supply (from central retinal artery and posterior ciliar arteries). Exactly by this unsatisfying results of lasercoagulation could be explained. It affects supply from net of retinal vessels, but vessels from reservoir of posterior ciliar vessels, which are obliterated after the brachitherapy, remain intact.
Гемангиома - редкая врожденная опухоль - относится к порокам развития (гамартомам) и составляет 0,76% от удаленных внутриглазных опухолей [6]. Мужчины и женщины заболевают одинаково часто. Их возраст колеблется от 10 до 60 лет, средний составляет 35,2 года [1, 2].
Опухоль развивается очень медленно, длительно протекает бессимптомно [1, 2, 4, 5]. При локализации в заднем полюсе глаза снижение зрения является первой причиной обращения пациентов к офтальмологу.
По своему характеру роста гемангиома хориоидеи может быть представлена одиночным узлом (отграниченная гемангиома), но может иметь и диффузное распространение. Последняя, как правило, сопровождает синдром Стюрж-Вебера [1, 2, 4, 16, 19].
Ранее диагноз отграниченной гемангиомы хориоидеи считался для глаза фатальным в результате появления тотальной отслойки сетчатки. В исходе возникала вторичная глаукома. В 70-80 гг. была попытка использовать лазеркоагуляцию для локализации «роста» гемангиомы и ее разрушения [3]. Однако полной регрессии опухоли достичь не удалось: в большинстве случаев продолжалась прогрессия отслойки сетчатки. В последние годы, как свидетельствуют данные литературы, эффективными оказались брахитерапия и наружное облучение глаза (при диффузной гемангиоме). Облучение приводит к резорбции субретинальной жидкости, уменьшению и локализации экссудата.
В связи с возможностью локального разрушения гемангиомы стало актуальным раннее ее выявление. Офтальмоскопически диагностика гемангиомы сложна, ее часто приходится дифференцировать с увеальной меланомой и метастатическими поражениями хориоидеи, в то же время от точного диагноза зависит выбор тактики лечения больного и оценки прогноза для жизни [1, 2, 3, 10, 16, 18]. Клинико-инструментальные методы исследования не всегда доказательны. Наиболее информативна ангиография - флюоресцентная и с индоцианин зеленым [1, 7, 8, 9, 11, 14, 15, 17, 18].
При ультразвуковом сканировании, которое широко применяется для диагностики внутриглазных опухолей, выделены эхографические признаки гемангиомы хориоидеи. К ним можно отнести проминирующий очаг повышенной эхогенности и отсутствие «экскавации» хориоидеи, столь характерной для увеальной меланомы [1]. Однако они относительны. Характерные для гемангиомы кровеносные сосуды при УЗ-сканировании не выявляются. Определенные надежды возлагали на дуплексное сканирование, сочетающее в себе элементы УЗ-сканирования (В-метод), цветового допплеровского кодирования (ЦДК) и спектрального допплеровского анализа, позволяющее получить информацию о кровотоке в сосудах глаза и в новообразованных сосудах опухоли в режиме реального времени. Тем не менее, данные литературы о диагностических возможностях дуплексного сканирования при отграниченной гемангиоме хориоидеи не многочисленны и противоречивы. В основном они принадлежат зарубежным авторам [11, 13, 16, 20, 21]. В отечественной литературе имеется публикация, в которой представлена только описательная картина ЦДК гемангиомы [4]. Располагая наблюдениями над 9 больными с гемангиомой хориоидеи, мы поставили перед собой задачу изучить особенности гемодинамики отграниченных гемангиом хориоидеи методом дуплексного сканирования.
Материалы и методы
Нами обследовано 9 пациентов (9 глаз) с отграниченной гемангиомой хориоидеи. Возраст больных - от 18 до 67 лет (средний - 44,7), женщин - 5, мужчин- 4. В 5 случаях диагноз отграниченной гемангиомы хориоидеи подтвержден флюоресцентной ангиографией (ФАГ), в 1 случае ФАГ не проведена из-за недостаточной прозрачности оптических сред, а в остальных случаях - из-за индивидуальной чувствительности к флюоресцеину. В этих случаях диагноз ставился на основании клинической картины, УЗ - сканирования и длительно существующего анамнеза.
Дуплексное сканирование с цветовым доплеровским кодированием и спектральным допплеровским анализом проводили на многофункциональном ультразвуковом сканере Acuson-Sequoia-512 линейным датчиком 15L8 с частотой сканирования 14-8 МГц, работающим в режиме реального времени (рис. 1). Сканирование проводили транспальпебрально в положении больного лежа с использованием обычного геля для УЗ-исследований.
На первом этапе проводили сканирование в режиме серой шкалы, оценивая при этом локализацию опухоли, топометрию, характер контура опухоли, эхогенность, наличие или отсутствие сопутствующей отслойки сетчатки.
В режиме ЦДК с помощью цветовых картограмм потоков визуализировали собственные сосуды опухоли, изучали их ангиоархитектонику. С помощью спектрального допплеровского анализа регистрировали показатели кровотока в собственных сосудах образования, центральной артерии и вене сетчатки (ЦАС, ЦВС), задних циллиарных артериях (ЗЦА). Контролем являлись гемодинамические параметры в ЦАС, ЦВС и ЗЦА здоровой стороны.
Результаты и их обсуждение
Располагаясь в центральной зоне, гемангиома почти в 2/3 случаях поражает макулярную и парамакулярную области. Юкстапапиллярное расположение гемангиомы, по нашим данным, встречается у 1/3 больных (рис. 2).
С учетом локализации опухоли ранним признаком ее, заставившей больных обратиться к офтальмологу, практически во всех случаях явилось снижение зрения. К моменту обследования гемангиома имела толщину, равную в среднем 3±0,7 мм (от 1,6 до 3,9 мм), а основание ее достигало в среднем 8,9±3,2 мм (от 3,8 до 13,5). Во всех случаях имелась вторичная отслойка сетчатки (в 6 случаях плоская, в 3-х - высокая).
При УЗ-сканировании у всех больных определялся проминирующий гиперэхогенный очаг без «экскавации» хориоидеи с ровной поверхностью.
При исследовании в режиме ЦДК во всех случаях, независимо от размеров отграниченной гемангиомы, выявлено равномерное распределение новообразованных сосудов по всей ее толщине и площади. Визуально кровоснабжение гемангиомы осуществляется за счет сосудов хориоидеи: сосуды сетчатки не участвуют в ее питании (рис. 3, 4) Только при юкстапапиллярной локализации (3 случая) опухоль получала двойное кровоснабжение - за счет сосудов хориоидеи и ЦАС (рис. 5).
Скоростные показатели кровотока представлены в таблице 1.
С учетом того, что хориоидея наполняется из бассейна задних цилиарных артерий, представляет интерес, как меняется кровоток в них при хориоидальной опухоли и, в частности, при гемангиоме. Оказалось, что скорость кровотока в задних цилиарных артериях здоровой и больной сторон отличаются и составляют 14,3±4,16 см/с и 16,68±5,8 см/с соответственно. Таким образом, в задних цилиарных артериях при гемангиоме хориоидеи отмечается усиление кровотока в среднем на 16,6%, что можно объяснить необходимостью усиленного притока к опухоли.
При гемангиоме хориоидеи отмечается также увеличение кровотока в ЦАС и ЦВС. По сравнению со «здоровой» стороной кровоток в ЦАС увеличен в среднем на 44,4%, что касается кровотока в ЦВС - он увеличен лишь на 18,9%. Хотя исследуемые нами группы не многочисленны, тем не менее удалось выявить зависимость кровотока в ЦАС в зависимости от локализации опухоли. Так, систолическая скорость кровотока в ЦАС при гемангиоме юкстапапиллярной локализации в среднем составила 15,13 см/с, а при макулярной и парамакулярной локализациях - 10,8 см/с. То есть именно при юкстапапиллярной гемангиоме кровоток в ЦАС усилен по сравнению с гемангиомой макулярной и парамакулярной локализации на 40,1%. Вероятно, увеличением общего притока крови к глазу при гемангиоме хориоидеи можно объяснить такие клинические признаки, как выраженная экссудативная реакция, сопровождающая вторичную отслойку сетчатки даже при небольшой ее проминенции, которые особенно выражены при юкстапапиллярной гемангиоме.
Анализ гемодинамики в новообразованных сосудах опухоли свидетельствует, что пиковая систолическая скорость и конечная диастолическая скорость в них достаточно высоки и превышают таковые в ЗЦА в 1,2 и 1,1 раза соответственно. Именно этим и можно объяснить быстрое «вымывание» флюоресцеина при флюоресцентной ангиографии, на что имеются указания в литературе [7, 13].
Зависимости между степенью выраженности кровотока и размерами опухоли в анализируемой группе не выявлен (табл. 2).
Возможно, это связано с торпидным характером роста, свойственным доброкачественным образованиям. В процессе роста таких новообразований происходит медленное постепенное увеличение новообразованных сосудов и сосудистых полостей.
Изменение кровотока в новообразованных сосудах гемангиомы с учетом локализации патологического очага сопровождается увеличением максимальной систолической скорости кровотока во внутриопухолевых сосудах, что более демонстративно при юкстапапиллярной локализации гемангиомы. В среднем она оказалась выше, чем при макулярной и парамакулярной локализациях, и составила 24,6 см/с и 18,7 см/с соответственно. Т.о., при юкстапапиллярной локализации гемангиомы отмечается усиление скорости кровотока в среднем в 1,3 раза. Обнаруженные изменения можно рассматривать, как документальное подтверждение двойного кровоснабжения опухоли.
Резюмируя изложенное, позволим себе сделать следующее заключение.
Отграниченная гемангиома хориоидеи может быть достаточно четко дифференцирована с помощью дуплексного сканирования. Выявляемые при этом гемодинамические сдвиги позволяют утвердиться в мнении о двойном кровоснабжении опухоли (из системы ЦАС и ЗЦА). Именно этим можно объяснить неудовлетворительные результаты лазеркоагуляции. При последней нарушается питание от сети ретинальных сосудов, но остаются сохранными питающие сосуды из бассейна задних цилиарных артерий, которые облитерируются после брахитерапии.
Литература
1. Бровкина А. Ф., Офтальмоонкология. - М., Медицина, 2002. - С. 255-259.
2. Бровкина А.Ф., в Сб.: Современные технологии в диагностике и лечении сосудистой патологии органа зрения. - Краснодар, 2002. - С. 52-53.
3. Бровкина А. Ф., Макарская Н. В. Гемангиомы хориоидеи. // Офтальмол. Журнал. - 1985. - №7. - С. 407 - 411.
4. Катькова Е. А. Диагностический ультразвук в офлальмологии. - М., «Фирма СТРОМ», 2002. - С. 55 - 79.
5. Терентьева Л. С. Внутриглазные опухоли. //Опухоли глаза, его придатков и орбиты. - Киев.: Здоров я, 1978. - С. 109 - 135.
6. Шепкалова В. М., Хорасанян -Тадэ А. А., Дислер О. Н. Внутриглазные опухоли. Атлас. - М.: Медицина, 1965. - С. 6 - 86.
7. Юровская Н. Н. Флюоресцентная ангиография при внутриглазных опухолях. //Офтальмоонкология. - М., Медицина, 2002. - С 16 - 35.
8. Anand R., Augsburger J., Shilds J. Circumscribed choroidal hemangiomas. //Arch ophthal. - 1989. - Vol. 107. - №9. - P. 1338 - 1342.
9. Arevalo J. F., Shields C. L., Shields J.A., et al. Circumscribed choroidal hemangioma: characteristic features with indocyanine green videoangiography. // Ophthalmology . - 2000. - Vol. 107. - P. 344 - 50.
10. Gass GMD. Stereoscopic Atlas of macular diseases. Diagnosis and treatment, 4th ed. St. Louis: Mosby, 1997; 208 - 13.
11. Guthoff R., Berger R., Helmke K. et al. Doppler sonographic findings in intraocular tumors. // Fortschr. Ophthalmol. - 1989. - Vol. 83. - №3. - P. 239.
12. Leys A., Bonnet S. Case repot: associated retinal neovascularization and choroidal hemangioma. // Retina. - 1993. - Vol. 13. - №3. - P. 528 - 532.
13. Lieb W. E., Shields J.A., Cohen S. M., Merton D. A., Mitchell D. G., Shields C. L. et al. Color Doppler imaging in the management of intraocular tumors. // Ophthalmology. - 1990. - Vol. 97. - P. 1660 - 1664.
14. Piccolino F., Borgia L, Zincola E. Indocyanin green angiography of circumscribed choroidal hemangiomas. // Retina. - 1996. - Vol. 16. - №1 - P. 19 - 28.
15. Ruby A., Jampol L., Goldberg M et al. Coroidal neovascularizaions assotiated with choroidal hemangiomas. // Arch. Ophthal. - 1992. - Vol. 110. - №3. - P. 658 - 661.
16. Shields C. L., Honovar S. G., Shields J.A., et al. Circumscribed choroidal hemangioma. // Ophthalmology. - 2001. - Vol. 108. - №12. - P. 2237 - 48.
17. Shields C. L., Shields J.A., De Potter P. Patterns of indocyanine green videoangiography of choroidal tumours. // Br. J. Ophthalmol. - 1995. - Vol. 79. - P. 237 - 45.
18. Shields J.A., Shields C. L. Atlas of intraocular tumors. Philadelphia: Lippincott. Williams & Wilkins, 1999; 170 - 9.
19. Shields J.A., Stephens R. F., Eagle R.C., Shields C.L. Progressive enlargement of a circumscribed choroidal hemangioma. // Arch. Ophthalmol. - 1992. - Vol. 110. - P. 1276 - 78.
20. Yang W., Hu S., Wang L. Color Doppler imaging diagnosis of ocular tumor. // Chin. Med. J. Engl. - 1997. - Vol. 110. - №9. - P. 664 - 6.
21. Yang W., Hu S., Wang L. Color Doppler imaging diagnosis of ocular tumor. //Chang. Hua. Yen. Ko. Tsa. Chin. - 1997. - Vol. 33. - №4. - P. 272 - 6.
Примеры ангиографии с флюоресцеином и индоцианином зеленым при гемангиоме хориоидеи с четкими контурами
Частота определения сосудистой сети по ангиографии с индоцианином зеленым
Как свидетельствуют данные, представленные в табл. 3, при проведении ангиографии с индоцианином зеленым при меланоме хориоидеи собственная сосудистая сеть в ткани опухоли визуализировалась у 21 из 27 (77,8%) больных, при метастазе — у 3 из 4 пациентов и при гемангиоме — у всех больных. Результаты, представленные в табл. 3, наглядно отражают более высокую информативность данного метода в сравнении с методом УЗДГ при меланоме хориоидеи. Следует отметить, что в данной выборке больных с меланомами превалировали пациенты с меланомой малых размеров (до 3 мм высотой) — именно у данной категории больных отмечаются сложности дифференциальной диагностики с невусами, а при беспигментом характере — с метастатическим поражением хориоидеи и гемангиомами.
Невус хориоидеи при ангиографии с индоцианином зеленым характеризовался диффузной гипофлюоресценцией во всех фазах исследования с довольно четкой границей; сосуды хориоидеи, как правило, экранировались зоной невуса и были более размытыми по сравнению с окружающим свечением неизмененной собственно сосудистой оболочки. Площадь невуса, определяемая на ангиограмме, в некоторых случаях была больше, чем при офтальмоскопии. Трудности для диагностики представляют невусы, сопровождающиеся отслойкой нейроэпителия, отложениями на пигментном эпителии. Ангиография с индоцианином зеленым позволяет дифференцировать эти состояния. Для таких невусов характерно отсутствие патологических сосудов в проекции образования и постепенно появляющиеся в поздние фазы очаги гипо- и гиперфлюоресценции, соответствующие друзеноидным отложениям, отслойке нейроэпителия и деструктивным изменениям пигментного эпителия сетчатки. У всех пациентов данной группы кровоток по данным УЗДГ не выявлялся (рис. 1).
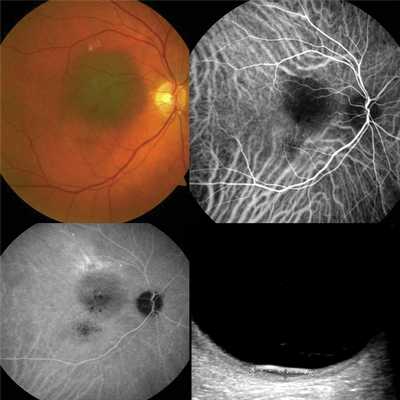
Рис. 1. Невус хориоидеи при УЗДГ и ангиографии с индоцианином зеленым: диффузная гипофлюоресценция во всех фазах исследования.
Размеры образования по данным УЗДС — 0,7×6,4 мм. Патологическая сосудистая сеть не определяется.
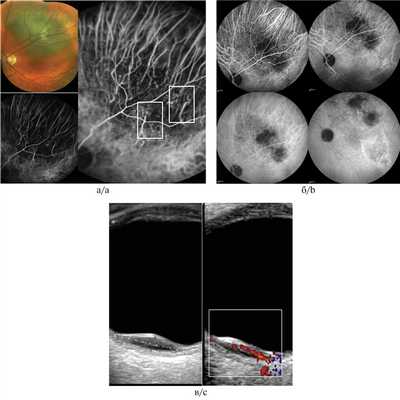
Рис. 2. Меланома хориоидеи при ангиографии с индоцианином зеленым.
а — на фоне гипофлюоресценции в опухоли в раннюю фазу исследования визуализируются собственные сосуды в виде вертикальных прямых паттернов (до 15 с); б — в поздние фазы исследования (до 30 мин от начала исследования) определяется нарастающая гиперфлюоресценция в опухоли вследствие просачивания и накопления красителя; в — УЗДГ-картина: среднескоростной, среднерезистентный кровоток в ткани опухоли (размер образования 2,1×12,0 мм).
При метастатическом поражении хориоидеи ангиографическая картина была разнообразна. Так, при метастазе кожной меланомы имело место выраженное свечение патологической неоваскулярной сети на фоне блокады фоновой флюоресценции, при проведении УЗДГ определялся низкоскоростной, среднерезистентный кровоток (рис. 3, а, б). Метастатическое поражение хориоидеи при первично не выявленном очаге, напротив, демонстрировало блок свечения сосудов хориоидеи соответственно размерам очага во всех фазах исследования при полном отсутствии идентификации признаков патологической неоваскуляризации (рис. 4, а, б).
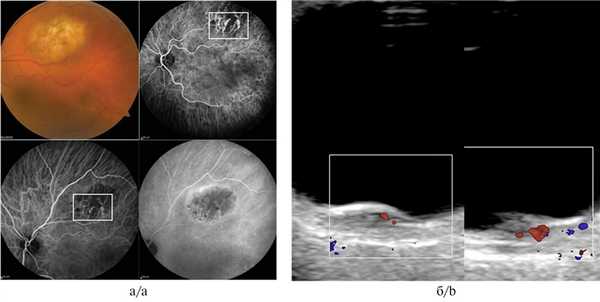
Рис. 3. Метастаз хориоидеи вследствие меланомы кожи при ангиографии с индоцианином зеленым.
а — выраженное свечение патологической неоваскулярной сети на фоне блокады фоновой флюоресценции. Визуализируются собственные сосуды в виде петлевых паттернов; б — УЗДГ-картина: низкоскоростной, среднерезистентный кровоток в ткани опухоли (размер образования 2,0×8,9 мм).
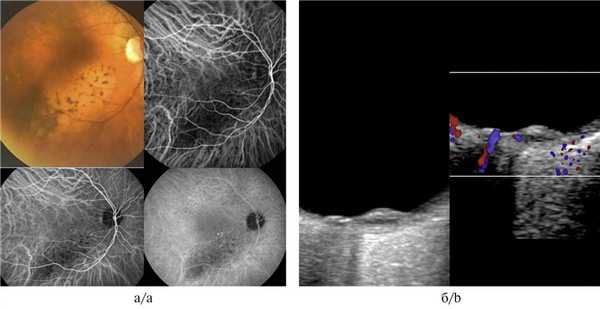
Рис. 4. Метастаз хориоидеи при первично не выявленном очаге.
а — ангиография с индоцианином зеленым: определяется блок свечения сосудов хориоидеи соответственно размерам очага во всех фазах исследования при полном отсутствии идентификации признаков патологической неоваскуляризации; б — УЗДГ-картина: отсутствие кровотока в ткани опухоли (размер образования 1,6×5,7 мм).
Гемангиома хориоидеи характеризовалась выраженными отличительными признаками как при проведении ангиографии с индоцианином зеленым, так и при УЗИ с ЦДК. Данную патологию отличали идентификация патогномоничных сосудистых паттернов в виде рисунка «рыбацкой сети», сети в виде «кружева» и гиперфлюоресценция на всех фазах исследования (рис. 5, а, б). При проведении УЗДГ выявлялся высокоскоростной и среднерезистентный кровоток (рис. 5, в).
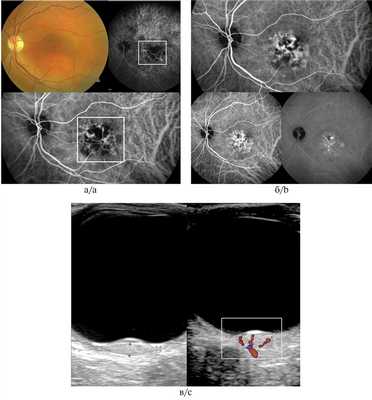
Рис. 5. Гемангиома хориоидеи при ангиографии с индоцианином зеленым.
а, б — сосудистые паттерны в виде рисунка «рыбацкой сети», сети в виде «кружева» и гиперфлюоресценция на всех фазах исследования; в — УЗДГ-картина: высокоскоростной и среднерезистентный кровоток в ткани опухоли (размер образования 1,8×9,2 мм).
Краситель индоцианин зеленый впервые синтезирован в 1950 г. компанией Eastman Kodak для производства инфракрасных фотографических материалов, в медицинской практике он нашел применение с начала 1970 г., когда K. Kogure и E. Chromokos при изучении гемодинамики мозга обезьяны обнаружили возможности визуализации сосудистой сети при его применении. Перспективность его использования в офтальмологии определяется тем, что индоцианин зеленый, являясь трикарбоцианиновым красителем, хорошо связывается с белками плазмы (98%), не диффундирует через фенестрированные капилляры, достигает своего пикового свечения при 835 нм, имеет pH 5,5—6,5, что определяет его хорошее проникновение через большинство глазных тканей, включая пигментный эпителий и ксантофилл макулярной области, а также долгую персистенцию в кровотоке. В 70-х годах прошлого века данная методика бурно развивалась в ряде стран, что обусловлено совершенствованием техники и прогрессом в области разработки современного оборудования, позволяющего проводить спектральную динамическую видеоангиографию [23].
В современных условиях для диагностики различных новообразований хориоидеи применяется мультимодальный подход с использованием таких методов, как спектральная оптическая когерентная томография, УЗИ с ЦДК, флюоресцентная ангиография, контрастная магнитно-резонансная томография, в сложных диагностических случаях — тонкоигольная аспирационная биопсия [24]. Как правило, данного арсенала диагностических средств бывает достаточно для верификации неопластического процесса, и основные сложности возникают в диагностике беспигментных первичных и вторичных опухолей хориоидеи [1, 13]. Как показывает данное исследование, применение ангиографии с индоцианином зеленым вкупе с УЗДГ является исключительно информативным при гемангиоме хориоидеи и может быть полезным в идентификации беспигментной меланомы и метастаза, что согласуется с мнением ряда авторов [5, 13, 25].
Как свидетельствуют полученные результаты, визуализация неоваскулярной сети меланом с помощью ангиографии с индоцианином зеленым возможна у 77,8% пациентов, а при применении метода УЗДГ — у 55,6%. Следует отметить, что в данном исследовании изучаемую выборку составили пациенты с малыми меланомами, что, возможно, ограничивало информативность ангиографии с индоцианином зеленым. Так, по данным A.J. Mueller и соавт. (1999), частота выявления сосудистой сети в меланомах хориоидеи высотой до 8 мм достигает 94% [26]. Следует отметить, что возможности данного метода лимитированы степенью пигментации опухоли: общеизвестно, что с увеличением степени пигментации меланомы хориоидеи снижается степень ее флюоресценции вплоть до полного блока [13].
Перспективность изучения применения ангиографии с индоцианином зеленым в настоящее время определяется возможностью идентификации васкулогенной мимикрии. Так, в исследованиях A.J. Mueller и соавт. [17] в 1998 г. у 16 (89%) из 18 пациентов при помощи ангиографии с индоцианином зеленым были идентифицированы опухолевые сосуды (петлевые структуры), которые в последующем были подтверждены исследованием гистологических срезов опухолей с помощью PAS-реакции. S. Frenkel и соавт. [21] в 2008 г. показали, что петлевые паттерны васкулогенной мимикрии, идентифицированные методом ангиографии с индоцианином зеленым, в гистологических срезах увеальной меланомы соединяются с кровеносными сосудами, выстланными эндотелиальными клетками, представляя альтернативный путь для питания опухоли. Учитывая, что выявленные ангиографические паттерны в виде петлевых структур, анастомозов и сетей определяют риски метастазирования процесса, представляется перспективным дальнейшее изучение данного метода [20, 27].
Выводы
1. Ангиография с индоцианином зеленым позволяет диагностировать сосудистую сеть у 77,8% больных с меланомами хориоидеи малых и средних размеров.
2. Ангиоархитектоника новообразований хориоидеи, визуализируемая при ангиографии с индоцианином зеленым, отличается вариабельностью паттернов, которые следует учитывать в дифференциальной диагностике различных патологических состояний.
ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва
ФГБУ "Научно-исследовательский институт глазных болезней" РАМН, Москва
ФГБУ "НИИ глазных болезней" РАМН, Москва
ГОУ ДПО РМАПО Минздрава России, ул. Баррикадная, 2/1, Москва, Российская Федерация, 125993
Гемангиома хориоидеи и возможности ее уточненной диагностики
Журнал: Вестник офтальмологии. 2016;132(4): 10‑19
Цель - выявить возможности оптической когерентной томографии (ОКТ) в уточненной диагностике гемангиомы хориоидеи (ГХ). Материал и методы. Обследованы 27 больных (22 женщины, 5 мужчин) с монолатеральной ГХ. Возраст на момент постановки диагноза составлял 30-76 лет (в среднем 53,7±5,29 года). Толщина опухолевого узла варьировала в пределах 0,9-5,3 мм (2,17±0,41 мм; медиана 1,9 мм), диаметр основания - 2,64-13,86 мм (медиана 7,7 мм). Результаты. Оценивая ОКТ-симптоматику ГХ, можно сказать, что нарушение архитектоники сетчатки, в том числе ее кистозная дистрофия, возникают при проминенции опухоли более 1,8 мм, а отек сетчатки - чаще при ее бо́льшей толщине. Следует отметить, что появившиеся морфофункциональные изменения в сетчатке при ГХ прогрессируют крайне медленно. При исследовании аутофлюоресценции опухоль была представлена участком обширной гипоаутофлюоресценции различной интенсивности. Локальный фиброз, гиперплазия и атрофия ретинального пигментного эпителия (PПЭ) также представлены зонами гипоаутофлюоресценции. Участки гипераутофлюоресценции соответствовали зонам скопления липофусцина. Вокруг самого узла опухоли в двух случаях наблюдали обширные зоны умеренной гипераутофлюоресценции за счет наличия свежей субретинальной жидкости с повреждением фоторецепторного слоя; точечные участки гипоаутофлюоресценции в этих зонах, по данным ОКТ, соответствовали участкам атрофии РПЭ. Заключение. Офтальмоскопическая картина ГХ представляет определенные трудности в уточненной диагностике. Наряду с получившей широкое распространение флюоресцентной ангиографией, современные методы диагностики, такие как спектральная ОКТ (в том числе в режиме углубленного сканирования с выявлением хориоидальных признаков), а также исследование аутофлюоресценции в режиме MultiColor позволяют уточнить диагноз гемангиомы.
Гемангиома хориоидеи (ГХ) - представитель группы гамартом, чаще представлена в виде отграниченного новообразования, реже - в виде диффузной формы, которая, как правило, сочетается с синдромом Стюрж-Вебера. Опухоль характеризуется торпидным течением, первые симптомы роста отграниченной ГХ возникают на 4-5-м десятилетии жизни. Клиническая картина ее многократно описана в литературе 3. Главная отличительная особенность - оранжево-красный или оранжево-желтый цвет опухоли. В то же время J. Gass в 1974 г. описал ГХ аспидно-серого цвета и объяснил это гиперплазией надлежащего ретинального пигментного эпителия (РПЭ). Такие случаи и делают трудной дифференциальную диагностику ГХ с другими опухолями и в первую очередь с меланомой хориоидеи.
Жалобы на зрительные расстройства при ГХ длительное время отсутствуют. Появление их связано с развивающимися изменениями в надлежащей сетчатке 5.
С целью уточнения диагноза ГХ достаточно широко используют флюоресцентную ангиографию (ФАГ), особенно с индоцианином зеленым [6], а также метод аутофлюоресценции (АФ) [7, 8].
Приводимые в литературе сведения о диагностической возможности визуализирующих методов исследования порой противоречивы, основное внимание уделено состоянию надлежащей сетчатки. Появление современных спектральных томографов, в том числе с функцией получения изображения в глубине тканей (EDI-OCT), позволило проводить более глубокое сканирование с оценкой хориоидального слоя [12]. При использовании EDI-OCT отграниченные гемангиомы выглядят как гипо- или среднерефлективные полосы с гомогенным сигналом и внутренними полостями. Они могут отличаться от нормальной окружающей хориоидеи, но их наружная граница может быть визуализирована только при толщине опухоли до 0,9 мм [6, 9].
Цель исследования - выявить возможности ОКТ в уточненной диагностике ГХ.
Материал и методы
Обследованы 27 больных (22 женщины, 5 мужчин) с монолатеральной Г.Х. Возраст на момент постановки диагноза составлял 30-76 лет (в среднем 53,7±5,29 года). У 10 пациентов исследование проводили в течение первого года после появления жалоб, у 4 человек - через 1,5-3 года, у 4 пациентов - через 3-8 лет, у 8 больных - через 9 лет и более (максимальный срок 16 лет). В одном случае ГХ была выявлена на амблиопичном глазу. В правом глазу ГХ диагностирована у 14 пациентов, в левом - у 13. Локализация во всех наблюдениях была ограничена задним полюсом глаза, в том числе макулярной (6 глаз) и парамакулярной (6 глаз) зоной. Толщина опухолевого узла варьировала в пределах 0,9-5,3 мм (2,17±0,41 мм, медиана 1,9 мм), диаметр основания - 2,64-13,86 мм (медиана 7,7 мм).
Всем пациентам проведены биомикроофтальмоскопия, цифровая фоторегистрация глазного дна, ультразвуковое исследование (УЗИ), ФАГ, ОКТ. Фоторегистрация глазного дна в режиме MultiColor (МС) выполнена у 7 больных, АФ - у 6. Повторно в процессе динамического наблюдения ОКТ проведена у 10 больных, из них у 3 - трехкратно (табл. 1).

Таблица 1. Временные параметры повторных исследований Примечание. * - амблиопия, скорее всего, обусловлена макулярной локализацией ГХ.
С целью выявления влияния толщины ГХ на состояние надлежащей сетчатки все опухоли были подразделены на группы с учетом ее толщины (табл. 2).
Таблица 2. Распределение глаз с учетом проминенции ГХ
ОКТ в стандартном режиме и в режиме получения изображения в глубине тканей (EDI-OCT), исследование АФ в режиме BluePeak и исследование в режиме MultiColor выполняли на приборе OCT Spectralis («Heydelberg Engineering», Германия), ФАГ - на фундус-камере FF 450 plus («Carl Zeiss», Германия). Фоторегистрацию глазного дна проводили во время ангиографии, а также с помощью фундус-камеры TRC-NW300 («Topcon», Япония). Ультразвуковые исследования выполнены на приборе UD 600 («Tomey», Япония).
Статистическую обработку результатов проводили с помощью Microsoft Excel 2007.
Результаты и обсуждение
Анализ томограмм начинали с оценки хориоидеи. Во всех случаях профиль хориоидеи проминировал в сторону надлежащей сетчатки, его величина не всегда совпадала с толщиной ГХ, уточненной по данным ультразвуковой биометрии хориоидальной зоны. Подобное несовпадение мы наблюдали при исследовании 6 глаз. В 4 случаях ГХ выявлена случайно, и, по данным УЗИ, высота ее варьировала от 1 до 2,33 мм, в то время как высота хориоидального профиля в зоне интереса по данным ОКТ оказалась в 2 раза меньше. Как свидетельствуют данные ОКТ, разница показателей обусловлена отслойкой нейроэпителия (ОНЭ) и интраретинальным отеком. Необходимо отметить, что при толщине ГХ более 2 мм (по данным ультразвуковой биометрии хориоидальной зоны) достоверно измерить толщину опухоли по ОКТ не представляется возможным.
При морфобиометрии хориоидального комплекса (зона интереса) следует помнить, что возможны отклонения от истинных границ ГХ, так как оптически плотные образования (рубцы, кровоизлияния, экссудат, сосуды) препятствуют прохождению световых лучей и визуализации глубжележащих структур [13].
В 8 наблюдениях (толщина ГХ 1-3,15 мм) в зоне интереса визуализировали ампулообразное утолщение хориоидеи с «выстоянием» в сторону склеры (рис. 1). Полосу склеры в проекции максимальной толщины ГХ удалось зафиксировать в 3 случаях (толщина опухоли 1; 1,25 и 1,3 мм) (см. рис. 1). При анализе томограмм в режиме оттенков серого в зоне патологического очага у 25 пациентов, независимо от высоты ГХ, практически сразу выявили очертания относительно крупных сосудов под мембраной Бруха, диаметр их просвета варьировал от 65 до 559 мкм, (рис. 2). Следует отметить, что в зоне максимальной проминенции ГХ имели место сосуды меньшего диаметра, а по периферии опухоли - сосуды большего диаметра.
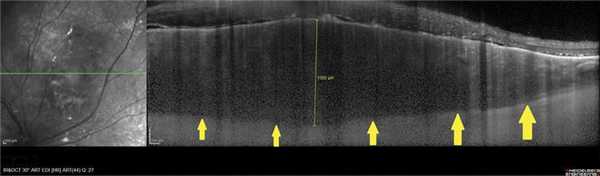
Рис. 1. ОКТ-горизонтальный срез через ГХ в зоне ее максимальной проминенции. Ампулообразное расширение хориоидеи (полоса склеры указана стрелками).
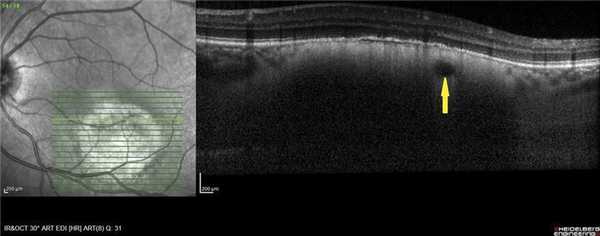
Рис. 2. ОКТ-горизонтальный срез. Крупный сосуд в толще ГХ (указан стрелкой).
Между мембраной Бруха и патологическим очагом в 9 случаях была видна гипорефлективная линия, разделяющая базальную мембрану и Г.Х. Эту полосу «самоотграничения» зафиксировали преимущественно при высоте опухоли до 1,9 мм (6 глаз) (рис. 3). В 3 случаях проминенция составляла 2,3; 3 и 4 мм. Не исключено, что она соответствует пространству между мембраной Бруха и псевдокапсулой гемангиомы, которую практически всегда находят при гемангиомах орбиты.
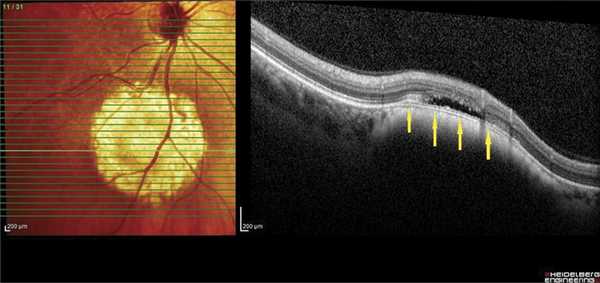
Рис. 3. ОКТ-горизонтальный срез. Зона «самоотграничения» ГХ (указана стрелками).

Рис. 4. ОКТ-горизонтальный срез. Уплощенная неровная поверхность ГХ, гиперрефлективная зона - фиброваскулярный рубец (отмечена звездочкой).
В 23 случаях поверхность РПЭ была неровной за счет его неравномерной гиперплазии, у 2 пациентов РПЭ имел вид «облысевшего» в результате его атрофии (длительность наблюдений 3 и 10 лет). У 7 пациентов при минимальной толщине ГХ 1 мм и максимальной 3,45 мм наряду с гиперрефлективностью РПЭ выявлены друзы, что проявляется на ОКТ неравномерной рефлективностью и отложением депозитов по РПЭ.
В 15 глазах были выявлены гиперрефлективные зоны (см. рис. 4), которые могут быть расценены как организовавшиеся субретинальные кровоизлияния или фиброваскулярные рубцы. Размер этих зон увеличивался по мере удлинения сроков заболевания. Таким образом, изменения РПЭ, расположенного на мембране Бруха, носили вторичный характер. Отслойка РПЭ зафиксирована у 8 пациентов (при толщине ГХ от 1 до 3,15 мм). При исследовании больных в динамике в сроки от 3 до 11 мес существенных изменений в РПЭ не выявлено.
ОНЭ с отеком и дезорганизацией дисков наружных фоторецепторов в макулярной зоне выявлена у 12 больных с ГХ со снижением зрения до 0,02-0,8, проминенцией опухоли 1-4,05 мм и анамнезом заболевания от 1 мес до 15 лет. Наиболее выраженное снижение зрения (до сотых) отмечали в случаях пара- и макулярного расположения ГХ и длительности анамнеза более 10 лет (рис. 5, а), минимальное снижение остроты зрения (до 0,6-0,8) - при длительности анамнеза до 1 года (см. рис. 5, б).
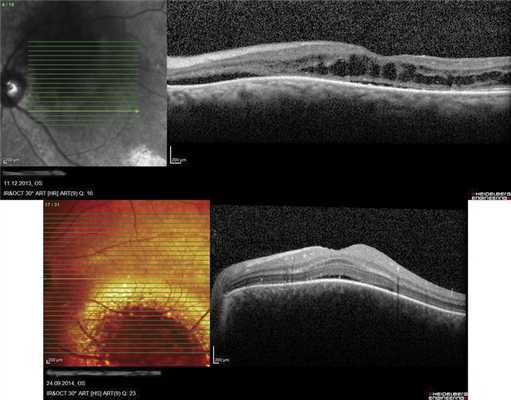
Рис. 5. ОКТ-горизонтальный срез через макулярную зону. а - пациентки Е., Vis OS =0,02, длительность анамнеза 11 лет (ОНЭ, кистозные изменения в макулярной зоне с разрушением фоторецепторов); б - пациентки С., Vis OS =0,7-0,8, длительность анамнеза 6 мес (отечность наружных сегментов фоторецепторов).
В 8 случаях выявили распространенную зону ОНЭ с дезорганизацией фоторецепторного слоя «на протяжении» от очага (рис. 6, а). В 2 случаях при анамнезе более 15 лет были выявлены зоны разрушения слоя фоторецепторов и наружных слоев сетчатки, соответствующие зонам ранее существовавшей ОНЭ (см. рис. 6, б).
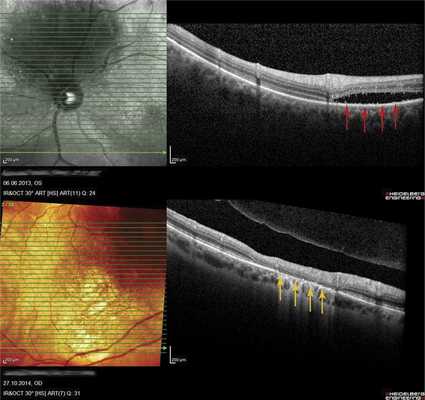
Рис. 6. ОКТ-горизонтальный срез «на протяжении» от ГХ. а - пациентки Х., длительность анамнеза 3,5 года (красными стрелками указана зона ОНЭ); б - пациентки К., длительность анамнеза 15 лет (желтыми стрелками указана зона разрушения слоя фоторецепторов и наружных слоев сетчатки на месте ранее существовавшей ОНЭ, атрофия РПЭ).
Следует отметить, что появившиеся морфофункциональные изменения в сетчатке при ГХ прогрессируют крайне медленно, что мы имели возможность подтвердить у 8 больных при повторных ОКТ с интервалами от 3 до 25 мес. Этот факт важен при планировании лечения больных с достаточно хорошим зрительным прогнозом. Ранние изменения в сенсорной части сетчатки (при анамнезе 3 мес) находили и другие авторы [10].
Оценивая ОКТ-симптоматику ГХ, можно сказать, что нарушение архитектоники сетчатки, в том числе ее кистозная дистрофия, возникают при проминенции опухоли более 1,8 мм, а отек сетчатки - чаще при ее бо́льшей толщине [15]. В то же время имеются сведения, что куполообразная элевация хориоидеи с фокальной гиперплазией надлежащего РПЭ может сочетаться с серозной отслойкой сетчатки над опухолью и сохранной архитектоникой сетчатки, нормальным слоем фоторецепторов и отсутствием интраретинального отека [9, 16], что расценивают как отражение остроты процесса [6].
Как показывают наши наблюдения, ГХ может быть подвержена саморегрессии. Мы имели возможность наблюдать больную 66 лет, у которой в 2005 г. была выявлена ГХ проминенцией 5,5 мм (рис. 7, а). Больная отказалась от лечения и находилась под наблюдением. При контрольном исследовании спустя 9 лет по данным ОКТ и УЗИ отмечено уменьшение толщины ГХ до 1,2 мм (см. рис. 7, б-г). Очаг, по данным ОКТ, «выстоял» в сторону склеры, куполообразная проминенция в сторону сетчатки отсутствовала. Аналогичный случай описан M. Munteanu и соавт. в 2013 г. [17].
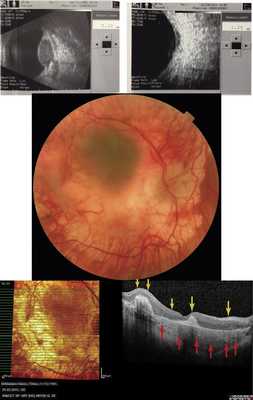
Рис. 7. Офтальмоскопическая картина глазного дна при саморегрессии ГХ (в) и соответствующие данные УЗИ в динамике (а - на момент выявления ГХ; б - при контрольном обследовании через 9 лет) и результат ОКТ (г) (красными стрелками отмечена область изменений в хориоидее, желтыми - в сетчатке).
Аутофлюоресценция исследована у 6 пациентов с ГХ, опухоль была представлена участком обширной гипоаутофлюоресценции различной интенсивности (рис. 8, а), в то время как по ФАГ ей соответствовали зоны гиперфлюоресценции собственных сосудов опухоли и сосудистых лакун (см. рис. 8, б). Локальный фиброз, гиперплазия и атрофия пигментного эпителия также представлены зонами гипоаутофлюоресценции. Участки гипераутофлюоресценции соответствовали зонам скопления липофусцина в виде пятен оранжевого пигмента, описанного J. Gass в 1974 г. Вокруг самого узла опухоли в 2 случаях наблюдали обширные зоны умеренной гипераутофлюоресценции за счет наличия свежей субретинальной жидкости с повреждением фоторецепторного слоя и/или альтерацией РПЭ, выявленными по данным ОКТ, точечные участки гипоаутофлюоресценции в этих зонах, по данным ОКТ, соответствовали участкам атрофии РПЭ (рис. 9).
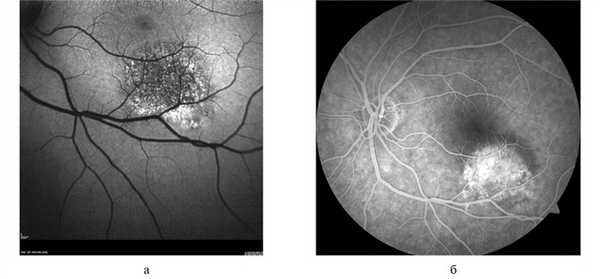
Рис. 8. Картина А.Ф. (а) и ФАГ (б) глазного дна при гемангиоме хориоидеи (объяснения в тексте).
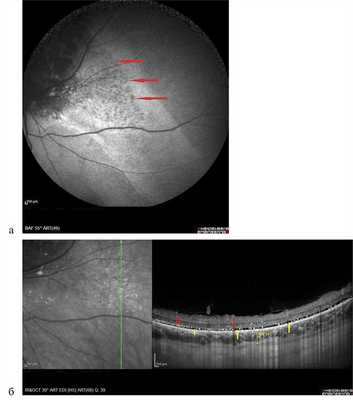
Рис. 9. Картина А.Ф. при гемангиоме хориоидеи и соответствующие данные ОКТ. Вертикальный срез через зону умеренной гипераутофлюоресценции, разрыв слоя фоторецепторов (указан желтыми стрелками, точечный блок АФ в зоне точечной атрофии пигментного эпителия указан красными стрелками).
Исследование глазного дна в режиме MC проведено в 7 случаях. Проанализированы как цветные, так и отдельные изображения, полученные при сканировании каждым из трех лазеров.
В исследованных случаях при получении цветного изображения гемангиомы выглядели в виде проминирующего участка зеленого цвета с четкими границами (рис. 10, б). При этом границы ГХ были представлены четче, чем на цветной фотографии глазного дна (см. рис. 10, а). Следует отметить, что в 5 случаях имели место беспигментные и слабопигментированные гемангиомы. Поля оранжевого пигмента определены во всех случаях. Следует отметить, что на МС липофусцин выглядел именно оранжевым (см. рис. 10, б), в то время как при офтальмоскопии на поверхности беспигментных опухолей он имел коричневую окраску и чаще совсем не выявлялся.
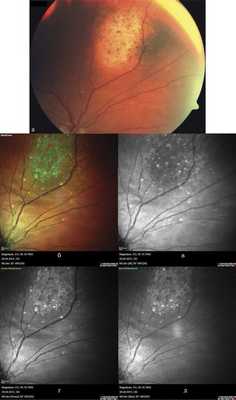
Рис. 10. Офтальмоскопическая картина глазного дна при гемангиоме хориоидеи (а) и соответствующие изображения глазного дна в режиме MultiColor (б), в инфракрасном свете (в), зеленом (г) и синем (д) отраженном свете (объяснения в тексте).
Анализ изображений, полученных отдельно от каждого лазера, показал, что зоны скопления липофусцина выявляются только на инфракрасном изображении, скопления твердого экссудата на поверхности сетчатки - на всех трех изображениях, но наиболее четко - на изображении в зеленом отраженном свете. Также на изображениях в зеленом и синем отраженном свете лучше всего видны участки эпиретинального фиброза (см. рис. 10, в-д).
Заключение
Офтальмоскопическая картина ГХ представляет определенные трудности в уточненной диагностике. Наряду с получившей широкое распространение флюоресцентной ангиографией, современные методы диагностики, такие как спектральная ОКТ (в том числе в режиме углубленного сканирования с выявлением хориоидальных признаков), а также исследование аутофлюоресценции и в режиме MultiColor позволяют уточнить диагноз гемангиомы.
5.4. Ангиография с индоцианином зеленым
С момента своего появления в начале 1990 годов цифровая, а теперь уже и конфокальная ангиография с индоцианином зеленым (ICGА) стала «золотым стандартом» визуализации хориоидальной сосудистой сети. При ЦСХ она определяет лучшее понимание хориоидальных изменений, лежащих в основе возникновения и развития заболевания, обеспечивает необходимыми данными, позволяющими отличить сложные хронические случаи от дифференциальных состояний. В частности она помогает выявить СНМ, осложняющую течение ЦСХ [75, 89].
Визуализация сосудистых структур, наблюдаемых по ICGА, происходит за счет биохимических свойств индоцианина - молекулы с удвоенным молекулярным весом флюоресцеина. Благодаря своей амфифильной природе индоцианин зеленый обладает сродством к гидрофильным (как некоторые протеины), липофильным (как липопротеиды высокой и низкой плотности) структурам, а также и к тем и к другим (как мембранные фосфолипиды), окрашивая внутрисосудистое содержимое, сосудистые стенки и экстравазальные структуры (хориоидальную строму). Более того, его оптический спектр поглощения/излучения сдвинут по направлению к ближним инфракрасным частотам по сравнению со спектром флюоресцеина, что позволяет сигналу лучше передаваться через РПЭ [14].
В результате проведения ICGA были выявлены значительные гидро- и гемодинамические изменения сосудистого русла глаз с ЦСХ, которые послужили основой для развития хориоидальной теории патогенеза заболевания [40]. Такие аномалии хориоидальной циркуляции наблюдаются в различные фазы проводимого исследования.
Ранняя фаза (от момента введения красителя до конца 1-й минуты): первоначальная задержка заполнения артерий и хориокапилляров [66], определяемая появлением гипофлюоресцентных областей (в результате сниженного заполнения хориокапилляров) и сохраняющаяся в среднюю и позднюю фазах ICGA [40] (рис. 5.64).
Средняя фаза (от 1-й до 15-й минуты): расширение крупных хориоидальных вен, а также появление областей гиперфлюоресценции с размытыми контурами, классически интерпретируемых как хориоидальная сосудистая гиперпроницаемость - один из отличительных признаков визуализации ЦСХ [62, 76] (рис. 5.65). Предполагается, что такие области расположены во внутренних слоях сосудистой оболочки [12].
Поздняя фаза (после 15 минут): развитие областей гиперфлюоресценции средней фазы либо в стойкую гиперфлюоресценцию, либо вымывание или центробежное смещение гиперфлюоресценции с формированием гиперфлюоресцентных колец [80] (рис. 5.66).
Важно отметить, что расширение крупных хориоидальных вен с областями гиперфлюоресценции (гиперпроницаемости) в среднюю фазу ICGA коррелируют с атрофией или элевацией (подъемом) РПЭ по SD-ОКТ (рис. 5.67) [26].
Существенная роль хориоидальной гиперпроницаемости в патогенезе ЦСХ проиллюстрирована тем фактом, что области гиперфлюоресценции средней фазы ICGA сохраняются после прекращения просачивания по ФАГ [70], а рецидивирование ЦСХ с новым просачиванием развивается в областях устойчивой гиперфлюоресценции в среднюю фазу ICGA [28]. Более того, они могут локализоваться не только в области точек просачивания жидкости, обнаруженных на ФАГ, но и в областях внешне неизмененного глазного дна [20], а также более чем в половине асимптомных парных глаз (рис. 5.68в-г) [28, 80]. Размеры гиперфлюоресцентных областей варьируют и могут заметно превышать размеры видимых повреждений РПЭ, распространяясь далеко за пределы заднего полюса глазного дна [56].
В процессе проведения ICGA типичные изменения показывают и области ОПЭ. Их гиперфлюоресценция объясняется сродством индоцианина к фибриновым депозитам, как правило, содержащимся в составе жидкости отслоенного РПЭ. Также гиперфлюоресценция характерна в случае, если ОПЭ расположена над областью гиперпроницаемости (рис. 5.69)[24, 54].
Помимо вышеописанных изменений в сосудистом русле, вокруг точек фильтрации жидкости, как правило, по ICGA визуализируются области локальной гипофлюоресценции (рис. 5.70). Предполагают, что это зоны очаговой хориокапиллярной ишемии, вызванные неперфузией или вазоконстрикцией хориокапилляров различной этиологии. Это может индуцировать коллатеральный хориокапиллярный и/или венозный застой вокруг этой области с повышением внутрипросветного давления, приводя к снижению скорости хориокапиллярного кровотока [10, 85].
Таким образом, ангиография с индоцианином зеленым позволяет выявить гидро- и гемодинамические изменения в хориоидальном сосудистом русле глаз с ЦСХ (области сосудистой гиперпроницаемости, хориокапиллярной ишемии/окклюзии, зоны расширенных хориоидальных вен), лежащие в основе патофизиологии заболевания, приводящие к вторичным изменениям функциональной активности РПЭ и фоторецепторного слоя нейросенсорной сетчатки.
Литература
1. Бровкина А. Ф., Офтальмоонкология. - М., Медицина, 2002. - С. 255-259.
2. Бровкина А.Ф., в Сб.: Современные технологии в диагностике и лечении сосудистой патологии органа зрения. - Краснодар, 2002. - С. 52-53.
3. Бровкина А. Ф., Макарская Н. В. Гемангиомы хориоидеи. // Офтальмол. Журнал. - 1985. - №7. - С. 407 - 411.
4. Катькова Е. А. Диагностический ультразвук в офлальмологии. - М., «Фирма СТРОМ», 2002. - С. 55 - 79.
5. Терентьева Л. С. Внутриглазные опухоли. //Опухоли глаза, его придатков и орбиты. - Киев.: Здоров я, 1978. - С. 109 - 135.
6. Шепкалова В. М., Хорасанян -Тадэ А. А., Дислер О. Н. Внутриглазные опухоли. Атлас. - М.: Медицина, 1965. - С. 6 - 86.
7. Юровская Н. Н. Флюоресцентная ангиография при внутриглазных опухолях. //Офтальмоонкология. - М., Медицина, 2002. - С 16 - 35.
8. Anand R., Augsburger J., Shilds J. Circumscribed choroidal hemangiomas. //Arch ophthal. - 1989. - Vol. 107. - №9. - P. 1338 - 1342.
9. Arevalo J. F., Shields C. L., Shields J.A., et al. Circumscribed choroidal hemangioma: characteristic features with indocyanine green videoangiography. // Ophthalmology . - 2000. - Vol. 107. - P. 344 - 50.
10. Gass GMD. Stereoscopic Atlas of macular diseases. Diagnosis and treatment, 4th ed. St. Louis: Mosby, 1997; 208 - 13.
11. Guthoff R., Berger R., Helmke K. et al. Doppler sonographic findings in intraocular tumors. // Fortschr. Ophthalmol. - 1989. - Vol. 83. - №3. - P. 239.
12. Leys A., Bonnet S. Case repot: associated retinal neovascularization and choroidal hemangioma. // Retina. - 1993. - Vol. 13. - №3. - P. 528 - 532.
13. Lieb W. E., Shields J.A., Cohen S. M., Merton D. A., Mitchell D. G., Shields C. L. et al. Color Doppler imaging in the management of intraocular tumors. // Ophthalmology. - 1990. - Vol. 97. - P. 1660 - 1664.
14. Piccolino F., Borgia L, Zincola E. Indocyanin green angiography of circumscribed choroidal hemangiomas. // Retina. - 1996. - Vol. 16. - №1 - P. 19 - 28.
15. Ruby A., Jampol L., Goldberg M et al. Coroidal neovascularizaions assotiated with choroidal hemangiomas. // Arch. Ophthal. - 1992. - Vol. 110. - №3. - P. 658 - 661.
16. Shields C. L., Honovar S. G., Shields J.A., et al. Circumscribed choroidal hemangioma. // Ophthalmology. - 2001. - Vol. 108. - №12. - P. 2237 - 48.
17. Shields C. L., Shields J.A., De Potter P. Patterns of indocyanine green videoangiography of choroidal tumours. // Br. J. Ophthalmol. - 1995. - Vol. 79. - P. 237 - 45.
18. Shields J.A., Shields C. L. Atlas of intraocular tumors. Philadelphia: Lippincott. Williams & Wilkins, 1999; 170 - 9.
19. Shields J.A., Stephens R. F., Eagle R.C., Shields C.L. Progressive enlargement of a circumscribed choroidal hemangioma. // Arch. Ophthalmol. - 1992. - Vol. 110. - P. 1276 - 78.
20. Yang W., Hu S., Wang L. Color Doppler imaging diagnosis of ocular tumor. // Chin. Med. J. Engl. - 1997. - Vol. 110. - №9. - P. 664 - 6.
21. Yang W., Hu S., Wang L. Color Doppler imaging diagnosis of ocular tumor. //Chang. Hua. Yen. Ko. Tsa. Chin. - 1997. - Vol. 33. - №4. - P. 272 - 6.
Читайте также:
- Золото, палладий, ртуть в стоматологии. Влияние палладия и ртути на здоровье
- Синдром Фабри (Fabry)
- Аускультативное измерение артериального давления у новорожденного. Показания, противопоказания
- Расстройства сознания в виде выпадения. Самосознание и аффективность
- Целлюлит на руках. Как решить проблему целлюлита рук?
