Принципы микробиологической диагностики листериоза. Диагностика листерий. Бактериоскопический, бактериологический, серологический методы диагностики листерий. Лечение листериоза. Профилактика листериоза.
Добавил пользователь Alex Обновлено: 01.02.2026
Медицинская микробиология:
Возбудитель листериоза (Listeria monocytgenes): морфология и культурально-биохимические свойства
В последние десятилетия XIX в. внимание исследователей привлекла инфекционная болезнь, поражающая преимущественно грызунов. А в 1924 г. в питомнике Кембриджского университета среди кроликов и морских свинок возникла эпизоотия сепсиса. От заболевших животных были выделены не известные в то время грамположительные полиморфные не образующие капсул и спор бактерии.
В 1940 г. Pirie дал название возбудителю болезни — Listeria monocytogenes в честь английского хирурга Джозефа Листера, основоположника метода асептической хирургии, подчеркнув при этом феномен моноцитоза как одного из ранних и наиболее постоянных симптомов листериозной инфекции у животных*. Предложенное название было принято, утверждено Международной классификационной комиссией и используется до настоящего времени.
В 2000 г. мы, анализируя особенности эпидемиологии листериоза, выделили 3 основных этапа во взаимоотношении возбудителя болезни и человеческой популяции.
Третий этап — с 80-х годов XX в. по настоящее время. Характеризуется многочисленными эпидемическими вспышками и спорадическими случаями листериоза в высокоразвитых странах мира (США, Франция, Великобритания, Швейцария, Канада).
Подавляющее большинство регистрируемых случаев болезни связано с употреблением готовых продуктов, главным образом мягких сортов сыра, салатов, мясных и куриных полуфабрикатов. В связи с этим листериоз начинают рассматривать как одну из важнейших пищевых инфекций с высокой летальностью.
В Российской Федерации регистрация листериоза началась в 1956 г. для животных и только в 1992 г. — для людей.
Согласно 9-му изданию определителя бактерий Берджи (1997) листерии относятся к 19-й группе «Грамположительных аспорогенных палочек правильной формы». Анализ гомологии нуклеотидных последовательностей ДНК листерий и близких к ним микроорганизмов, исследование 16S рРНК показали, что листерии филогенетически наиболее близки к роду Brochotrix, занимая промежуточное положение между бациллами и лактобациллами, и несколько более удалены от Streptococcus, Kurthia, Gemella и Erysopelothrix.
В настоящее время род Listeria насчитывает 6 видов: L. monocytogenes, L. seeligeri, L. welshimeri, L. innocua, L. ivanovii, L. grayi. Из них только 2 вида обладают признаками патогенности: L. monocytogenes патогенны для человека и для животных, L. ivanovii — только для животных.
В течение первой половины XX в. листерии рассматривались как типичные возбудители зоонозов. Возбудители листериоза были выделены более чем от 90 видов домашних и диких животных, птиц, рыб, лягушек, моллюсков и некоторых видов клещей. Начиная с 50-х гг. XX в., спорадические случаи и эпидемические вспышки все чаще стали обнаруживаться в человеческой популяции.
Являясь частым компонентом фекальной микрофлоры млекопитающих, листерии широко распространены в почве, подстилке для животных, силосе, часто выделяются из воды открытых водоемов.
Данные последних лет свидетельствуют об исключительно высоких адаптивных способностях листерий, позволяющих размножаться им в природных условиях: на растениях, в почвенных субстратах, водоемах в температурном диапазоне от +4° до 45'С, при колебании pH от 4,8 до 9,0, в присутствии высокой концентрации натрия хлорида и углекислоты.
Высокая метаболическая активность листерий создает возможность легкого перехода их от саирофитической к паразитической форме и наоборот. Поэтому проблема листериоза тесно связана с охраной окружающей среды, особенно с загрязнением почвы и водоисточников вблизи расположения крупных агропромышленных комплексов, где активное проявление листериозной инфекции является прямым следствием глубоких изменений биоценозов под влиянием широкомасштабной и не всегда рациональной человеческой деятельности.
Морфологические, тинкториальные и культурально-биохимические свойства листерий. Микроорганизмы рода листерий, в том числе L. monocytogenes в суточной культуре, представляют собой короткие палочки 0,4-0,5x0,5-2,0 мкм с закругленными концами. В мазках из чистой, особенно жидкой культуры, в ряде случаев образуют короткие цепочки из 3-4 клеток, приближающихся по форме к коккам. В других случаях листерии приобретают вид палочек с булавовидным утолщением на одном конце, обоих концах или в середине, давая основания для предположения, что культура, выделенная в первом случае, представляет собой стрептококки, а во втором случае — бактерии дифтерии.
Палочковидные формы располагаются хаотично, под углом друг к другу в виде римской цифры V, иногда образуют фигуры, напоминающие иероглифы. В стареющих 3-5-суточных культурах наблюдается отчетливо выраженный полиморфизм. Наряду с небольшим количеством мелких типичных форм, в мазке обнаруживаются крупные грубые палочки и даже нити длиной 300 мкм и более.
Свежевыделенные культуры окрашиваются грамположигельно, стареющие — окраску по Граму воспринимают плохо.
Спор и капсул листерии не образуют, кислотоустойчивостью не обладают, при выращивании культур при комнатной температуре до 22°С проявляют подвижность за счет немногочисленных перитрихиально расположенных жгутиков. Листерии, выращенные в термостате при 36-37°С, утрачивают жгутики и, соответственно, подвижность.
Листерии принадлежат к категории микроаэрофилов, культивируемых лучше всего в атмосфере, содержащей 5-10% С02. Являются хеморганотрофами. Имеют метаболизм бродильного типа, сбраживают глюкозу с образованием лактата. Образуют цитохромы.
Характерной чертой L. monocytogenes является двойственность ее природы, проявляющаяся в способности паразитировать в организме человека и различных видов животных и существовать во внешней среде с ничтожным по сравнению с живыми организмами трофическими возможностями в условиях непрерывно меняющейся температуры, влажности и pH среды.
Изучая биохимические механизмы адаптации L. monocytogenes к факторам внешней среды, Л.С. Будалева с соавт. в 1999 г. определила, что у листерий при температуре +(4-6)°С синтезируются «холодовые» изоферменты, более приспособленные к функционированию в этих условиях.
При культивировании листерий в минеральных средах, не содержащих соединений углерода, они способны ассимилировать С02 для синтеза основных полимеров клетки (ДНК, РНК, белки, липиды, углеводы). Следовательно, в условиях внешней среды листерии, как и многие бактерии-сапрофиты, являются микротрофами, использующими хемолитоавтотрофный путь метаболизма.
Существует мнение, что листерии, вышедшие из внешней среды, попав в организм теплокровного животного, сформировали в процессе эволюции компенсаторные генетико-биохимические механизмы, обеспечивающие их жизнеспособность в меняющихся экологических условиях.
Листерии способны размножаться в салатах, молочных продуктах, мясных полуфабрикатах в условиях бытового холодильника даже при +4°С, хотя температурный оптимум их роста 30-37°С.
Размножение листерий происходит в диапазоне pH от 6,0 до 9,0, оптимальной является слабощелочная реакция pH 7,2-7,4.
К питательным средам листерии непритязательны, могут расти на простых питательных средах, содержащих продукты пептического или триптического перевара, МПБ, МПА, агаре Хоттингера, но наилучший рост отмечается на агаре с добавлением крови или сыворотки.
При выделении колоний на поверхности среды в первые сутки они едва заметны невооруженным глазом. Через 48 ч инкубации в термостате они увеличиваются и в зависимости от густоты роста и свойств питательной среды достигают 1,5-2,5 мм в диаметре. Культура имеет своеобразный запах, напоминающий запах творога или сыворотки, очевидно, обусловленный продуктами углеводного обмена, образующимися во время роста культуры.
Изолированные колонии листерий могут быть гладкими в S-форме и шероховатые — в R-форме. Гладкие формы имеют вид росинок, слегка выпуклые в центральной части, с ровным четко очерченным краем. В проходящем свете — прозрачны, в падающем — мутные, серовато-молочного цвета.
В смешанных культурах хорошо дифференцируются при косом освещении. Для этого зеркало устанавливается плоской поверхностью кверху. Осветитель с голубым фильтром размещается под углом примерно 40° на расстоянии 12,5 см от зеркала. Чашки просматриваются без крышек. Колонии листерий в S-форме — выпуклые с резко очерченным краем, сине-зеленого цвета, водянистой консистенции, колонии в R-форме — шероховатые с зазубренным краем и грубозернистой центральной частью. Между крайними S- и R-формами имеется множество переходных вариантов.
На кровяном агаре S-формы образуют мелкие блестящие колонии, окруженные узкой зоной гемолиза, проявляющейся более отчетливо на вторые сутки роста. Значительно лучше гемолиз выявляется после снятия колонии с поверхности агара или инокуляции культуры в толщу агара.
При культивировании листерий в МП Б, бульоне Хоттингера или других жидких средах на вторые сутки культивирования в термостате появляется помутнение в виде легкой дымки. В дальнейшем на дне пробирки концентрируется осадок, который в последующие 7-10 суток при полном просветлении столбика среды приобретает слизистый характер, а при встряхивании пробирки поднимается в виде косички, трудно разбиваемой в разномерную муть. Культуры в R-форме образуют в бульоне хлопьевидный или крошковидный рост с тонкой пленкой и пристеночным кольцом на поверхности бульона.
В полужидком агаре рост листерий идет в виде штриха вдоль укола петли с более интенсивной зоной помутнения на 2-3 сутки, на глубине 3-5 мм от поверхности. Если посевы культивированы при 37,6-37,7°С, в характере роста особых изменений не происходит. Если их выдерживают при 20-22°С, на 2-3 сутки на поверхности агара и верхней части столбика появляется характерный рост в виде открытого зонтика, что свидетельствует о подвижности выделенного микроорганизма.
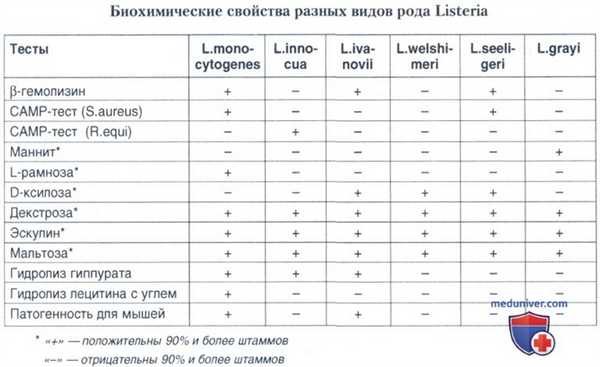
Листерии относят к категории бактерий сравнительно малоактивных в биохимическом отношении. Все виды, относящиеся к этому роду, каталазоположительны. Индол и сероводород не образуют, нитраты не восстанавливают. К углеводам и многоатомным спиртам разные виды листерий относятся неодинаково. Наиболее показательным является определение ферментативных свойств в отношении трех субстратов: рамнозы, ксилозы и маннита. Данный тест позволяет дифференцировать 3 гемолитических вида листерий. L. monocytogenes ферментирует рамнозу и не ферментирует ксилозу и маннит; L. ivanovii и L. seeligeri не ферментирует рамнозу и маннит, но утилизирует ксилозу.
Ферментативные свойства листерий определяют на средах Гисса. Посевы инкубируют 7 дней при 35°С, ежедневно проверяя наступление ферментации, хотя L. monocytogenes ферментирует рамнозу обычно уже на вторые сутки. Более полный ряд ферментации листериями включает: декстрозу, эскулин, мальтозу, рамнозу, маннит и ксилозу. Все виды листерий дают положительную реакцию на декстрозу, эскулин и мальтозу и все виды листерий, за исключением L. grayi, инертны в отношении маннита.
Тест ферментации углеводов для идентификации листерий имеет большое значение, но необходимо помнить, что практически все тесты па углеводы не дают 100% достоверности идентификации вида.
Относительно высокая частота ферментации рамнозы L. innocua и L. welshimeri и отсутствие ферментации ксилозы L. monocytogenes и L. innocua подчеркивают значение β-гемолитического САМР-теста (метод Christie, Atkins, Munch— Peterson) для идентификации L. monocytogenes. Принцип САМР-теста основан на синергизме листериолизина-О L. monocytogenes и L. seeligeri с гемолизином Staphylococcus aureus и листериолизина-О L. ivanovii — с гемолизином Rhodococcus equi.
При совместном культивировании листерий, S. aureus и R. equi на кровяном агаре в точках соединения гемолизинов S. aureus, L. monocytogenes или L. seeligeri или гемолизинов R. equi и L. ivanovii образуются более обширные и четкие зоны гемолиза по сравнению с теми, которые формируются вокруг колоний отдельно высеянного гемолитического микроорганизма.
Другим биохимическим тестом, имеющим большое значение в идентификации L. monocytogenes, является выявление лецитина (фосфатидилхолинспецифическая фосфолипаза). Однако при культивировании L. monocytogenes на обычных или стандартных средах с лецитином лецитиназа не всегда выявляется. В присутствии активированного угля в среде, содержащей лецитин, L. monocytogenes проявляет четко выраженную лецитиназную активность, проявляющуюся в виде плотной зоны помутнения вокруг колоний шириной 2-4 мм в первые сутки и 6-10 мм — на вторые сутки инкубации посевов в термостате. В отличие от L. monocytogenes другие виды листерий, продуцирующие лецитиназу (L. innocua, L. seeligeri), специфической индукции в присутствии активированного угля не проявляют.
Листериоз
Листериоз относится к зоонозным инфекционным заболеваниям, имеет полиморфное клиническое течение с преобладанием поражения мононуклеаров и нервных клеток, или протекающее в ангинозно-септической форме. Листериоз имеет в основном фекально-оральный способ распространения, также листерии могут проникать в организм аэрозольным и трансплацентарным путем. По преимущественным клиническим симптомам листериоз разделяется на ангинозно-септическую, септико-гранулематозную, глазо-железистую и смешанную формы. В основе диагностики листериоза лежит определение моноцитоза в КАК и выделение возбудителя в ходе бактериологического исследования.
МКБ-10
Общие сведения
Листериоз относится к зоонозным инфекционным заболеваниям, имеет полиморфное клиническое течение с преобладанием поражения мононуклеаров и нервных клеток, или протекающее в ангинозно-септической форме. Листериоз классифицируется в зависимости от клинической картины, подразделяясь на ангинозно-септическую, глазо-железистую, септико-гранулематозную (развивается преимущественно у плода или новорожденного ребенка) и смешанную формы.
Характеристика возбудителя
Листериоз вызывает бактерия Listeria monocytogenes, представляющая собой подвижную, факультативно-анаэробную, грамположительную, короткую палочку. Листерии не образуют спор, могут внедряться в клетки и формировать капсулу, способствуя латентному течению инфекции. Во внешней среде устойчивы, легко переносят замораживание, размножатся в почве и воде, на растениях и в трупах животных при температуре от 4-6 °С. Инактивация при воздействии солнечного света происходит спустя 2-15 суток, в растворе формалина - через 20 минут. В засоленных продуктах может сохранять жизнеспособность при концентрации соли 6-20% достаточно длительное время. Спустя 5-10 минут погибают при температуре 100°С. Большинство штаммов, за редким исключением, чувствительно к антибиотикам широкого спектра действия.
Резервуаром и источником листериоза являются животные и объекты окружающей среды (вода, почва и др.). Заболевают листериозом многие домашние животные и птицы, отмечаются случаи инфекции у диких млекопитающих (грызуны, лисы, норки, еноты, копытные) и птиц (голуби). Возможно засевание бактериями рыб и морепродуктов. Выделение возбудителя происходит с испражнениями, слюной, молоком, спермой. Человек может стать источником инфекции при реализации вертикального пути заражения (от матери к ребенку перинатально и при лактации). Родильницы и новорожденные выделяют возбудителя 10-12 дней после родоразрешения.
Листериоз передается с помощью разнообразных механизмов (феально-оральный, трансплацентарный, аэрозольный) преимущественно алиментарным путем. Животные заражаются при потреблении обсемененной бактериями воды и пищи. Эпидемиологическое значение в поддержании очаговости инфекции играют кровососущие насекомые (в особенности клещи), получающие возбудителя от грызунов и других животных и распространяющие его среди здоровых особей.
Человек обычно заражается при употреблении в пищу инфицированных продуктов животного происхождения, либо при употреблении зараженной воды, свежих овощей. Возможна передача инфекции при отработке животного сырья (шерсть, пух, шкуры и др.), при этом реализуется контактный путь передачи через повреждения кожных покровов. В редких случаях отмечено заражение половым путем от человека к человеку, а также вертикальная передача от матери к ребенку. Люди обладают довольно невысокой естественной восприимчивостью к листериозу. Заболевание развивается преимущественно у лиц с ослабленным иммунитетом, пожилого или раннего детского возраста.
Патогенез листериоза
Бактерии проникают в организм через слизистые оболочки пищеварительного тракта, иногда через повреждения кожных покровов. При распространении возбудителя с кровью и лимфой проявляется лихорадочная реакция. Листерии оседают в лимфатических узлах и миндалинах, других органах. Там происходит размножение бактерий (при этом возникает соответственная местная воспалительная реакция). При активном прогрессировании в лимфоузлах и тканях внутренних органов (а у беременных женщин - в плаценте) формируются листериомы (некротические узелки). Тяжелое течение листериоза может привести к развитию сепсиса.
Симптомы листериоза
Инкубационный период листериоза может составлять от нескольких дней до полутора месяцев. Течение листериоза бывает острым, подострым, абортивным, а также хроническим - рецидивирующим. Зафиксированы случаи продолжительного бактерионосительства без выраженной клинической картины. Чаще всего листериоз протекает в ангинозно-септической форме. При этом основными проявлениями являются симптомы ангины, обычно катаральной или фолликулярной, имеющей сходное со стрептококковой ангиной течение. Такая форма листериоза имеет благоприятный прогноз, излечивается через 5-7 дней.
При развитии язвенно-пленочной ангины, сопровождающейся лихорадкой, заболевание при благоприятном течении длится 12-14 дней, могут отмечаться кашель и насморк, миндалины увеличены, резко гиперемированы и покрыты пленками. Ангина обычно сопровождается регионарным лимфаденитом. В некоторых случаях листериозная ангина (как язвенно-пленчатая, так и фолликулярная) может прогрессировать в сепсис (чаще всего у взрослых). При этом отмечается выраженная ремитирующая лихорадка, интоксикация, увеличение печени и селезенки. На коже могут отмечаться разнообразные высыпания, на миндалинах - белый налет.
Нервная форма листериоза протекает в виде менингита, менингоэнцефалита либо абсцесса мозга. Клиническое течение этих состояний при поражении листериями не отличается от такового в случае неспецифического бактериального поражения центральной нервной системы (менингеальная симптоматика - ригидность затылочных мышц: симптомы Брудзинского и Кернига, признаки энцефалита, расстройства периферической иннервации - парезы и параличи, полирадикулоневриты и т. д.).
Довольно редко встречающаяся глазо-железистая форма листериоза обычно развивается в случае контакта с больным животным. Проявляется в виде конъюнктивита на фоне общей симптоматики (лихорадка и интоксикация) и увеличения лимфатических узлов (преимущественно шейных и околоушных). При осмотре больных отмечается отечность век, глазная щель сужена, имеют место жалобы на ухудшение зрения. Лимфатические узлы увеличены, умеренно болезненны при пальпации. Листериоз в такой форме обычно длиться от месяца, до трех.
У новорожденных (и плодов при антенатальном заражении) листериоз протекает в септико-гранулематозной форме. Листериоз у беременной женщины может протекать бессимптомно либо в стертой форме, оставаясь нераспознанным. В результате происходит внутриутробное заражение плода. На ранних сроках оно, как правило, приводит к прерыванию беременности либо грубым аномалиям развития. Листериоз у новорожденных протекает крайне тяжело, отмечается лихорадка, достигающая критических цифр, выраженная интоксикация, рвота, диарея. Кожные покровы цианотичны, отмечаются розеолезно-папулезные высыпания. Имеют место тяжелые нарушения со стороны дыхания, сердечного ритма. Распространение гнойного процесса на мозговую оболочку обычно заканчивается смертью.
Листериоз в грудном возрасте первоначально протекает по типу ОРВИ, с гипертермией и катаральной симптоматикой, в дальнейшем развиваясь в бронхопневмонию или плеврит. В 15-20% случаев после выздоровления у детей сохраняются расстройства функционирования ЦНС и периферической иннервации. В некоторых случаях происходит хронизация инфекции. Течение при хронической форме характеризуется незначительной выраженностью симптоматики, больные могут отмечать кратковременное повышение температуры тела, катаральные признаки, диспепсию. В некоторых случаях выявляются симптомы хронического пиелонефрита.
Ангинозно-септический листериоз может осложняться эндокардитом. Хронический листериоз у лиц с выраженными расстройствами иммунитета может привести к генерализации я тяжелого сепсиса.
Диагностика листериоза
Листериоз нередко (в особенности в случае ангинозно-септической формы) сопровождается выраженным моноцитозом. Количество моноцитов может достигать 60-70% всех клеток белой крови. Специфическая диагностика заключается в проведении бактериологического исследования. Возбудитель выделяется из крови, ликвора, слизи из носоглотки, мазка с конъюнктивы. При необходимости для анализа берут биопсию лимфатических узлов, околоплодные воды (амниоцентез) или пунктат плаценты (биопсия хориона).
Посев производят в первые 7-10 дней заболевания. Серологическая диагностика производится с помощью РА, а также РНГА, РСК в парных сыворотках. Серологические исследования могут давать ложные позитивные результаты, ввиду близкого антигенного состава со стафилококками. В диагностике нервной формы листериоза может потребоваться консультация невролога, проведение ЭЭГ головного мозга и реоэнцефалографии, люмбальная пункция, при подозрении на развитие абсцесса - МРТ или КТ головного мозга.
Лечение листериоза
Выбор тактики лечения осуществляется в соответствии с клинической нормой заболевания. В качестве этиотропных средств хороший эффект имеют тетрациклин, доксициклин, эритромицин. Нервная форма листериоза обычно является показанием к назначению внутривенного введения бензилпенициллина натриевой соли. К препаратам резерва относятся кларитромицин и ципрофлоксацин. Глазо-железистая форма обычно лечиться с применением местных средств: каплей с сульфацетамидом и гидрокортизоновой эмульсии. При необходимости назначают дезинтоксикационную терапию, жаропонижающие и антигистаминные средства. В комплексной терапии присутствуют витамины и адаптогены.
Прогноз и профилактика листериоза
В большинстве случаев прогноз благоприятный. Ухудшение прогноза отмечается при развитии нервной формы (могут быть последствия в виде расстройства функции ЦНС и периферической иннервации, угроза летального исхода), беременности (вероятность прерывания беременности и врожденного листериоза плода). Неблагоприятный прогноз имеет заболевание у детей первого года жизни, лиц старческого возраста и больных с иммунодефицитом.
Общая профилактика листериоза включает меры санитарно-гигиенического и ветеринарного контроля над животноводческими хозяйствами, предприятиями пищевой промышленности и общественного питания, водными источниками. В качестве профилактической меры распространения инфекции грызунами производится дератизация. Беременным с целью индивидуальной профилактики рекомендовано отказаться от продуктов животного происхождения, не прошедших должную кулинарную обработку (длительное приготовление при высоких температурных режимах), или не имеющих гигиенического сертификата.
Врожденный листериоз
Врожденный листериоз - инфекционное заболевание, возникающее при внутриутробном инфицировании ребенка листериями. Клинически патология характеризуется гипертермией, увеличением лимфатических узлов, папулезной или розеолезной сыпью на коже, специфическими гранулемами на слизистых оболочках, картиной менингита, пневмонии. Диагностика заключается в идентификации листерий в биологических жидкостях ребенка при помощи бактериоскопического исследования, посева материалов на специальные питательные среды, проведения РСК, РПГА, ИФА, ПЦР. Основное лечение проводится при помощи комбинации антибактериальных средств. Препараты выбора - ампициллин и гентамицин.
Врожденный листериоз - тяжелое инфекционное заболевание новорожденных, вызванное коринебактериями L.monocytogenes, при котором в органах и тканях ребенка формируются специфические гранулемы. Впервые возбудитель был идентифицирован в 1911 году, однако детальное описание представлено Мюрреем только в 1926 году. В 1940 г. было принято название «листериоз» в честь английского хирурга Дж. Листера. Это редкая патология в педиатрии и неонатологии, которая возникает примерно у 0,1% новорожденных. Источником заражения матери могут выступать практически любые млекопитающие, чаще всего - сельскохозяйственный скот. Летальность детей с врожденным листериозом зависит триместра беременности, в котором произошло инфицирование, однако суммарный показатель составляет порядка 30%. Опасной особенностью листериоза является то, что довольно часто у матери он протекает бессимптомно, а без целенаправленной диагностики данную патологию выявить сложно.
Причины врожденного листериоза
Возбудитель листериоза - коринебактерия Listeria monocytogenes. Данный микроорганизм представляет собой грамположительную, короткую палочку правильной формы. Является факультативным анаэробом, споры не образует. Листерии способны расти и размножаться в температурном интервале от +1 до +45°С, устойчивы к изменениям во внешней среде. Чаще всего они находятся в продуктах питания животного происхождения (сырое мясо, фарш, колбасы, молоко, творог, сыр), редко - в овощах и фруктах. Часто фактором передачи является «фаст-фуд». Возможны также контактный и аэрогенный механизмы заражения при работе со шкурами и т. п.
Инфицирование врожденным листериозом может проходить трансплацентарно или интранатально. При любой из форм одним из ключевых факторов является латентное бациллоносительство листерий матерью. Полное отсутствие симптомов или наличие нечетких клинических проявлений снижает вероятность своевременной диагностики и лечения беременной, соответственно повышая риск врожденного листериоза у ребенка. Вероятность внутриутробного инфицирования путем преодоления возбудителями плацентарного барьера или проникновения через амниотическую оболочку существует во всех триместрах беременности. При попадании в организм плода листерии распространяются по всем органам и системам, в первую очередь, инфицируя ЦНС. В пораженных тканях возникает специфический вид гранулем - листеромы. Их формирование провоцирует гиперпродукцию цитокинов и насыщение патологических новообразований макрофагами. Постоянная стимуляция работы макрофагов и повышенное содержание цитокинов приводят к нарушению кровоснабжения и дистрофии пораженных органов и тканей.
Листерии могут проникать в организм ребенка и во время родов, при контакте с зараженными слизистыми оболочками родовых путей или при аспирации околоплодных вод, содержащих бактерии. В редких случаях источником заражения могут быть инфицированные руки медицинского персонала.
Классификация врожденного листериоза
Согласно периоду, в котором произошло инфицирование, выделяют следующие формы врожденного листериоза:
- Ранний. Клинические симптомы возникают в первые 24-36 часов жизни ребенка. Заражение проходит внутриутробно. Как правило, такая форма протекает в виде генерализованной инфекции. Летальность - свыше 50%.
- Поздний. Первые признаки листериоза возникают на 10-14 сутки. Инфицирование - интра- или постанатальное. Заболевание протекает в виде локального поражения. Клиническая картина часто имитирует менингит или пневмонию. Летальный исход наблюдается примерно у 25% детей.
Симптомы врожденного листериоза
Инфицирование листериями в первую половину гестации часто вызывает самопроизвольное прерывание беременности. Заражение в промежуток от 20-22 недель и позже провоцирует клиническую картину раннего врожденного листериоза. Манифестация происходит сразу после родов или в первые несколько часов, иногда - 1,5 суток. Первичные симптомы включают в себя тяжелое общее состояние ребенка, гипертермию свыше 38,5-39°С, кожные высыпания в виде папул с геморрагическим содержанием, иногда - розеол. Формируются характерные листериозные гранулемы на слизистых оболочках рта, глотки, редко - конъюнктивы. Могут пальпироваться увеличенные шейные лимфоузлы. Спустя несколько часов после появления ранних симптомов состояние ребенка начинает прогрессивно ухудшаться, возникают резкая одышка и генерализованный цианоз, клиника дыхательной недостаточности. Возможно развитие ринита, конъюнктивита, желтухи. Параллельно наблюдаются судороги и другие проявления менингоэнцефалита.
Первые клинические проявления поздней формы врожденного листероза возникают в возрасте ребенка 10-12 дней. Первичные симптомы чаще всего указывают на поражение ЦНС. Это мышечный тремор, гиперестезии, судорожный синдром. Часто наблюдается увеличение печени и селезенки, желтуха, повышение температуры тела до 38,5°С. Реже клиническая картина напоминает пневмонию, гастро- или энтероколит.
Диагностика врожденного листериоза
Диагноз «врожденный листериоз» в основном базируется на лабораторных методах исследования, направленных на выявление листерий в организме ребенка. Анамнестические данные могут указать педиатру или неонатологу на вероятное заражение матери. Клинические симптомы малоспецифичны, могут напоминать другие заболевания: менингит, пневмонию и т. д. «Золотым стандартом» является бактериологическое исследование биологических жидкостей ребенка: крови, ликвора, околоплодных вод, аспирационных масс из трахеи и бронхиального дерева и выявление в них листерий. Экспресс-диагностика - бактериоскопия биоматериала с окрашиванием по Грамму и идентификация окрашенных палочек. Окончательный диагноз выставляется при проведении посевов материала больного на специальных питательных мясопептонных средах с глюкозой или кровью. Серологические методы исследования (РСК, РПГА) в динамике определяют нарастание титра специфических антител к листериям в 4 и больше раз. Иногда проводится ИФА с целью определения IgM и IgG. При необходимости срочной диагностики назначают ПЦР, которая позволяет выявить молекулы ДНК листерий с высокой точностью в течение 2-3 часов.
Дифференциальная диагностика врожденного листериоза проводится с такими заболеваниями, как врожденный токсоплазмоз, сифилис, гемолитическая болезнь, родовая травма новорожденных, цитомегаловирусная инфекция, стафилококковый сепсис.
Лечение врожденного листериоза
Лечение врожденного листериоза осуществляется в условиях отделения реанимации и интенсивной терапии новорожденных. Методом выбора при подтвержденном диагнозе является комбинация антибактериальных средств из групп аминогликозидов и пенициллинов - гентамицин и ампициллин. Оба антибиотика применяются одновременно, но с разной длительностью, а дозировка определяется возрастом, массой тела ребенка и формой заболевания. Длительность приема ампициллина зависит от поражения мозговых оболочек - при возникновении менингита лечение проводится 21 день, без него - 14 суток. Гентамицин назначают на срок не более 1 недели. После получения антибиотикограммы препараты подбираются в соответствии с чувствительностью возбудителя. При необходимости проводится симптоматическая терапия, направленная на купирование судорог, гипертермии и т. п.
Прогноз и профилактика врожденного листериоза
Прогноз врожденного листериоза сомнительный. Даже на фоне адекватной антибиотикотерапии летальность составляет порядка 25-50%. Часто возникают осложнения в виде гидроцефалии, энцефалопатии, пневмонии. На ранних сроках беременности листериоз приводит к выкидышу.
Специфической профилактики врожденного листериоза не разработано. Основные превентивные меры должны быть направлены на предотвращение инфицирования матери во время беременности. Для этого полностью исключается употребление термически необработанных продуктов, в первую очередь, мяса и молока. При наличии в анамнезе факторов риска заражения листериями проводится целенаправленная диагностика. При подтверждении диагноза показана немедленная антибактериальная терапия.
Принципы микробиологической диагностики листериоза. Диагностика листерий. Бактериоскопический, бактериологический, серологический методы диагностики листерий. Лечение листериоза. Профилактика листериоза.
Микробиологическая диагностика возбудителя листериоза
В связи с многообразием форм и проявлений листериоза постановка диагноза болезни не может основываться только на данных клинической симптоматологии. При обследовании больного с подозрением на листериоз большое значение имеют результаты эпидемиологического анамнеза (производственная деятельность, бытовые условия). Однако даже клинический симптомокомплекс с данными эпидемиологического анамнеза позволяют поставить лишь предварительный диагноз. Окончательный диагноз может быть верифицирован только после проведения бактериологического анализа и выделения L. monocytogenes из клинического материала.
Бактериологическое исследование клинического материала при выделении листерий выполняется в двух вариантах:
1) выделение листерий из стерильных биологических жидкостей: ликвора, крови, синовиальной, плевральной, перикардиальной и амниотической жидкостей;
2) выделение листерий из нестерильного клинического материала: носоглоточной слизи, отделяемого нагноившихся фликтен кожных покровов, гнойного отделяемого конъюнктивы при поражении глаз, фекалий, мекония и отделяемого половых органов у рожениц.
а) Схема выделения листерий из стерильного клинического материала. Первым этапом исследования материала на листериоз является прямая бактериоскопия окрашенных препаратов-мазков. При положительном результате окраски по Граму в ликворе, синовиальной и плевральной жидкости обнаруживаются мелкие единичные грамположительные палочки с закругленными концами, расположенные хаотично, иногда под углом друг к другу в виде римской цифры V. В некоторых случаях палочки настолько мелкие, что напоминают кокки, что дает повод для ошибочного заключения о выделении пневмококка или энтерококка, в других случаях палочки имеют на концах или в середине утолщения, и тогда возникает вопрос о возможности обнаружения в исследуемом материале коринебактерий.
1. В мазках крови, окрашенных методом Романовского-Гимзы, встречаются единичные листерии, расположенные между форменными элементами в виде коротких палочек, коккобактерий или бактерий, сходных с коринебактериями, красно-фиолетового цвета. Положительный результат бактериоскопии материала позволяет дать ориентировочный ответ.
Для бактериологического исследования на листериоз крови, ликвора, плевральной и синовиальной жидкостей используются жидкие и плотные элективные среды. Из жидких сред рекомендуются: тиогликолевая среда и дрожжевой триптон-соевый бульон с глюкозой как среды обогащения. Из плотных питательных сред: мясопептонный агар с добавлением 5% бараньей крови, за исключением посевов ликвора.
2. Кровь. Первый день. Учитывая бактерицидные свойства крови, ее засевают в жидкую питательную среду в соотношении 1:9. Для посева желательно использовать 5-10 мл крови, поэтому для выделения гемокультур пользуются не пробирками, а флаконами. Посевы инкубируют 24-48 ч при температуре 37°С. При отрицательном результате посев крови оставляют на 10-14 сут., периодически делая из него высевы на плотные среды.
3. Жидкости, полученные из стерильных полостей, в большом количестве высевают в жидкую питательную среду в соотношении 1:9, так же как кровь для выделения гемокультуры. Посевы инкубируют до появления заметного помутнения или опалесценции среды в течение нескольких суток при 37°С, делая первый высев на плотную среду через 24-48 ч.
4. Ликвор. Первый день. Доставленный в лабораторию ликвор в упаковке, поддерживающей температуру 37°С, немедленно подвергают бактериологическому анализу. Чашки с посевами материал;» инкубируют при 37°С в течении 48 ч. При отсутствии роста через 48 ч, посевы выдерживают в термостате до 5-7 сут.
Второй день. Учитываются результаты посевов на жидкие питательные среды. Если признаков роста не обнаруживается, посевы оставляют еще на одни сутки. При наличии признаков микробного роста (легкое помутнение или опалесценция среды) производят высев на МПА с 5% овечьей, кроличьей, лошадиной или человеческой (без консервантов) крови. Высев с жидкой питательной среды желательно делать на 2 чашки кровяного агара: для посева шпателем и бактериологической петлей, двумя истощающими штрихами, нанесенными перпендикулярно друг другу, с целью получения изолированных колоний. Чашки с засеянным кровяным агаром помещают в термостат при температуре 37"С на 48 ч.
Третий день. Учитывают рост бактерий на поверхности кровяного агара, засеянного в первый день из сред обогащения. Для работы используют чашку с ростом изолированных колоний. Из типичных для L.monocytogenes колоний делают мазки для окрашивания их по Граму и микроскопии. При соответствии микроскопической картины описанной выше морфологии листерий выделенную культуру используют для дальнейшей работы. Делают высев в 2-3 пробирки со скошенным 20% сывороточным или кровяным либо дрожжевым триптон-соевым агаром для накопления чистой культуры листерий, необходимой для идентификации выделенного микроорганизма. «Косяки» с посевами культуры инкубируют в термостате при 37°С в течение 48 ч.
На четвертый день приступают к идентификации культуры L.monocytogenes. Определяют каталазную активность выделенной культуры. Каталазообразование характерно не только для всех видов Listeria, но и для коринебактерий. Однако все коринебактерии, в отличие от листерий, неподвижны.
После ориентировочного определения принадлежности выделенных культур к роду Listeria, приступают к определению их видовой принадлежности. Выделенную культуру проверяют на ферментацию трех углеводов: маннита, ксилозы и рамнозы. Для определения ферментации углеводов используют среды Гиса или среды с бромкремзоловым пурпурным. Пробирки с посевами для ферментации углеводов помещают в термостат при 36°С и ведут за ними наблюдение в течение 7 сут., ежедневно проверяя кислото- и газообразование, хотя ферментация рамнозы выявляется обычно уже на вторые сутки роста.
Определение лецитиназы (фосфатидилхолинспецифичной фосфолипазы) производят на агаризированной среде ГРМ № 1 в двух чашках Петри с 0,5% активированным углем и без него. Исследуемые штаммы высевают короткими штрихами на обе чашки и инкубируют 48 ч при температуре 37°С.
Испытуемые штаммы проверяют повторно на гемолитическую активность. С этой целью используют агар с 5% овечьей или, реже, лошадиной крови и 1% глюкозы. Исследуемый штамм засевают уколом в кровяной агар.
Из типичных для L. monocytogenes колоний, снятых с чашки кровяного агара, ставят пробу на подвижность выделенного микроорганизма. Для этого засевают уколом бактериологической петли две пробирки с полужидкими средами для определения подвижности. Одну из засеянных пробирок оставляют на 24 ч при комнатной температуре 20-22"С, вторую инкубируют в термостате при 37°С.
Культуры, выросшие при низкой температуре (не выше 22°С), отличаются большой подвижностью, что выражается спецификой роста в форме зонтика на поверхности столбика среды.
При температуре выше 30°С листерии утрачивают свои немногочисленные жгутики и вместе с ними способность к подвижности. Неподвижные культуры растут в виде тонкого штриха по ходу укола бактериологической петли и только вверху, на 2-3 мм ниже поверхности среды, отмечается более обширная зона интенсивного роста, свидетельствующая о принадлежности листерий к категории факультативно анаэробных бактерий.
Пятый день. Просматривают посевы на средах для учета ферментации углеводов, фиксируя признаки ферментации маннита, ксилозы и рамнозы. Ферментация рамнозы L.monocytogenes определяется обычно уже на вторые сутки. Учитывают появление лецитиназы на чашках ГРМ №1 с активированным углем и без него. Лецитиназная активность штаммов, проявляющаяся образованием плотной зоны помутнения шириной в 2 мм через сутки и 6-8 мм — через 2 сут. роста, обнаруживается у L.monocytogenes только на среде ГРМ № 1 с активированным углем.
Учитывают β-гемолитическую активность листерий, засеянных уколом вглубь кровяного агара. Культуры L.monocytogenes образуют вокруг места укола узкие зоны гемолиза.
Учитывают результаты пробы на подвижность.
5. Исследование ликвора при подозрении на менингит имеет ряд особенностей. По клиническими признакам листериозный менингит не отличается от гнойных менингитов, вызываемых (чаще, чем листериями) менингококками, пневмококками, гемофилами и рядом условно патогенных микроорганизмов. Поэтому при получении ликвора для исследования, учитывая тяжесть заболевания, врач должен быть готов к выделению всех потенциальных возбудителей гнойного менингита.
Первый день. Предварительную микроскопию ликвора с целью экономии образца и защиты его от возможной контаминации производят не всегда. Для микроскопии препараты-мазки готовят только из осадка, если он имеется (или образовался в результате центрифугирования образца), причем делают это только после проведения посевов.
Опалесцирующий или прозрачный ликвор желательно центрифугировать и для посевов использовать осадок.
Вначале засевают (по 1-3 капле пипеткой) 3 чашки Петри с агаром: «шоколаднокровяным», чтобы уловить Н. influenzae, 20% сывороточным — для менингококка, пневмококка и листерий и обычным МПА. Чашки культивируют при повышенном содержании CO2. Оставшиеся 2-3 мл ликвора (кроме осадка) засевают в пробирку с 5,0 мл полужидкого питательного агара или тиогликолевую среду для обогащения; посевы помещают в термостат.
Из осадка готовят 2 мазка на стекле, их окрашивают 1% водным раствором метиленового синего и по Граму. На основании бактериоскопии, в случае обнаружения микроорганизмов, выдается предварительный ориентировочный ответ.
Второй день. Через 24-48 ч просматривают посевы на агаровых средах. Отмечают характерный рост, внешний вид колоний; из колоний готовят препараты-мазки, окрашенные по Граму. Листерии вырастают на всех трех средах, однако на агаре с кровью и сывороткой колонии более развитые (1,0-1,5 мм в диаметре, выпуклые, бело-сероватые), чем на простом МПА.
При подозрении на листерии делают отсев нескольких колоний в пробирки с кровяным или сывороточным скошенным агаром.
В этот же день можно сделать (при появлении признаков роста) высев из сред обогащения на 3 чашки с агаровыми средами, используемыми для первичного прямого посева ликвора.
Третий день. Изучают культуры, выросшие в пробирках при отсеве в предыдущий день по той же схеме, что и культуры, выделенные из крови и синовиальной жидкости.
б) Схема выделения листерий из нестерильного клинического материала. Наряду со стерильными биологическими жидкостями в лабораторию для микробиологической диагностики листериоза поступает отделяемое миндалин и ротоглотки, гной вскрывшихся абсцессов, отделяемое половых путей женщин, испражнения. Каждый из перечисленных образцов клинического материала, помимо предполагаемого возбудителя, содержит специфическую для него грамположительную и грамотрицательную бактериальную микрофлору а в ряде случаев и грибы.
Количество листерий в этих образцах на общем микробном фоне невелико, скорость их роста уступает резистентным условно-патогенным бактериям, поэтому для успешного проведения анализа прибегают к использованию селективных питательных сред.
В качестве селективных агентов для выделения листерий используется широкий спектр химических соединений, в том числе солей и антибиотиков. Основными селективными реагентами являются теллурит калия, налидиксовая кислота, акрифлавин, лития хлорид, антибиотики (цефтазидим, полимиксин В, колистин, цефотетан, цик-логексимид, фосфомидин).
Схема выделения листерий из клинического материала, контаминированного сопутствующей микрофлорой, включает следующие этапы.
Первый день. Поступивший на исследование клинический материал высевают параллельно на селективные плотные и жидкие питательные среды.
Для прямого посева материала используют плотные среды, являющиеся одновременно селективными, и дифференциально-диагностическими. Наиболее рекомендуемыми считаются сухие агаровые среды с селективными добавками — среды ПАЛ, PALCAM и Оксфордская среда. В среде PALCAM, наряду с источниками углерода и азота (пептон, глюкоза и др.), содержатся лития хлорид, полимиксин В, цефтазидим и акрифлавина гидрохлорид в качестве селективных агентов, подавляющих сопутствующую флору, а также две индикаторные системы. Одна из них — маннит и феноловый красный (L.monocytogenes не ферментирует маннит, в отличие многих видов кокков сопутствующей флоры), вторая — эскулин и цитрат аммонийного железа.
Листерии разлагают эскулин с образованием эскулетина, который образует с железом комплекс коричневого цвета. Незасеянная среда прозрачна, окрашена в красный цвет.
Другие плотные среды, рекомендуемые для выделения и одновременной дифференциации листерий, — среда ПАЛ и Оксфордский агар. В качестве селективных агентов используют антибиотики, лития хлорид, циклогексимид, фосфомидин для подавления грамотрицательной флоры. В качестве индикаторной системы используется эскулин и железа аммонийного цитрат.
Отделяемое миндалин и ротоглотки, так же как и отделяемое женских половых путей и глаз, взятое на тампоны, высевают на три чашки со средой. На поверхность среды первой чашки разными сторонами тампона с полученным материалом делают последовательно несколько отпечатков. Нанесенный таким образом материал распределяют равномерно по поверхности среды стеклянным или металлическим шпателем. Оставшийся на шпателе материал переносят с первой чашки на вторую и со второй на третью для получения изолированных колоний.
Параллельно с высевом на селективный агар исследуемый материал высевают в жидкие среды обогащения. В настоящее время широкое распространение в качестве бульона обогащения для выделения листерий получила среда UVM. Эта среда, наряду с источниками питания, содержит эскулин и ингибиторы посторонней флоры — налидиксовую кислоту и акрифлавина гидрохлорид. Для первичного посева, с целью обогащения, возможно использование бульона с тиамином, где селективными факторами являются калия роданид и налидиксовая кислота.
При использовании этих сред рекомендуется 25,0 г или 25 мл исследуемого материала высевать в 225,0 мл питательной среды. При небольшом количестве или объеме материала, поступившего в лабораторию, посев производят из расчета 1:10. Материал, засеянный в жидкую среду обогащения, инкубируют при 30°С в течение 24-48 ч.
Второй день. Со среды обогащения производят высев 0,1 мл культуры на селективный агар: ПАЛ, Оксфордскую среду или агар PALCAM. Шпателем, распределяют его по всей площади чашки, как описано выше, для получения изолированных колоний. Посевы инкубируют в термостате при 37°С в течение 24-48 ч.
Просматривают чашки с посевами с селективного агара.
Оксфордская среда прозрачная, имеет янтарную окраску с голубым отблеском. Колонии листерий через 24 ч роста — мелкие, диаметром 1,0 мм сероватого цвета, окруженные черным ореолом. Через 48 ч колонии темнеют, вырастают до 1,5-2,0 мм в диаметре, появляется черный ореол.
Агар PALCAM — прозрачный красного цвета. В течение 24 ч инкубации в термостате при 37°С листерии вырастают в виде мелких колоний диаметром 1,0 мм серовато-зеленого или оливково-зеленого цвета с черным центром и характерным черным ореолом на красном фоне среды. Колонии кокков имеют желтый и красный цвет. Через 48 ч размер колоний листерий увеличивается до 1,5-2,0 мм в диаметре. Сохраняется зеленоватая окраска и черный ореол вокруг колонии.
Типичные для L. monocytogenes колонии пересевают на кровяной агар или триптон-соевый агар с дрожжевым экстрактом для накопления культуры и проведения последующего анализа с целью ее идентификации.
Третий день. Выделенную культуру изучают по следующим признакам: морфология клеток, окрашивание по Граму, наличие каталазы, на основании которых можно ориентировочно отнести культуру к роду Listeria. Для подтверждения принадлежности культуры к виду L. monocytogenes ее засевают на среды «цветного ряда» с маннитом, рамнозой и ксилозой, на желточные среды ГРМ №1 с углем и без него для выявления лецитиназы и в 2 пробирки с полужидким агаром для выявления подвижности при 20-22°С. Одну пробирку оставляют при этой температуре, а вторую (контрольную) помещают в термостат на 24 ч. Можно повторно поставить пробу на гемолитическую активность путем посева культуры «уколом» в кровяной агар.
В этот же день просматривают чашки с высевами из сред обогащения, отбирают колонии, подозрительные на листерии, отсевают их на пробирки со скошенным агаром (кровяным, сывороточным и т.д.) для дальнейшего изучения и идентификации выделенной культуры.
Четвертый день. Производят учет изменений на дифференциально-диагностических средах; определяют подвижность при 20-22°С. Выделенную культуру проверяют на чувствительность к антибиотикам общепринятым дискодиффузионным способом.
В этот же день возможна выдача окончательного ответа. В случае изучения культуры, выделенной при помощи среды обогащения, выдача окончательного ответа предполагается на 5-й день.
в) Серологическая диагностика листериоза. В нашей стране в 60-е годы прошлого столетия серологичесие методы широко использовались для диагностики листериоза, несмотря на то, что еще в 1967 г. один из основоположников школы исследования листериоза И.А. Бакулов обращал внимание на их недостаточную специфичность и несостоятельность как диагностического метода. По его словам, «серологические исследования должны проводиться с целью выявления скрытых больных и бактерионосителей в неблагополучных по листериозу хозяйствах, где наличие заболеваний установлено с помощью клинико-эпизоотических и бактериологических исследований». Первичный диагноз при помощи одних только серологических реакций «не надежен».
В настоящее время серологические методы исследования применяют только как вспомогательные, при этом они полностью сохраняют свое значение для выяснения эпидемической ситуации. Используют реакции связывания комплемента и непрямой гемагглютинации с коммерческими диагностическими препаратами.
Читайте также:
- Синдром Лера-Леона Киндберга (Lohr-Leon Kindberg)
- Строение и функции щелевых контактов
- Допплерометрия кровотока в маточных артериях и АФП. Допплерометрия кровотока с определением уровня ХГ
- Семенной канатик. Элементы семенного канатика. Круглая связка матки. Оболочки круглой связки матки.
- Дрожжи. Дрожжеподобные грибы. Бластоконидии. Плесневые грибы. Рост плесневых грибов. Диморфизм грибов.
