Проблемы диагностики кардиальных источников эмболии
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Эхокардиографию (ЭхоКГ) нам приходится проводить для поиска причин эмболии в сосуды. Острая ишемия органа или конечности из-за артериальной непроходимости обычно возникает из-за одного из двух патогенных процессов: острой тромботической окклюзии на субстрате значительного местного артериального заболевания (чаще всего атеросклероз) или эмболии из полостей сердца или проксимальных пораженных крупных сосудов (чаще всего грудной аорты). Доля острых ишемических событий, имеющих эмболическую этиологию, зависит от ряда факторов, включая возраст пациента, вероятность внутреннего сосудистого заболевания и пораженное сосудистое русло. Исследование после такого события сосредоточено на определении основного процесса, ответственного за событие, с основной целью предотвратить дальнейшие потенциально более разрушительные события. Эхокардиография — это основной диагностический инструмент для выявления потенциального источника эмболии. В оставшейся части этого обсуждения источники эмболов внутри сердца и грудной аорты будут вместе обозначаться как «сердечно-сосудистые эмболы», подчеркивая, что не все потенциальные источники эмболов находятся в сердце. Это часть блога изначально фокусируется на определении роли эхокардиографии в оценке потенциальных сердечно-сосудистых источников эмболии, включая показания для ЭхоКГ, которая является оптимальным методом (чреспищеводный или трансторакальный), и как выполнить комплексное эхокардиографическое исследование. В оставшейся части обсуждаются отдельные потенциальные источники (как вероятные, так и возможные), рассматриваются доказательства связи между каждым потенциальным источником и эмболическими событиями, характерные эхокардиографические особенности, как всесторонне оценивать их с помощью эхокардиографии и текущие стратегии лечения.
Эпидемиология сердечно-сосудистой эмболии
Инсульт - одно из наиболее частых и разрушительных клинических последствий сердечно-сосудистой эмболии. В 2009 году стандартизованный по возрасту коэффициент смертности от всех ССЗ составлял 237,1 на 100 000 человек, а уровень смертности от инсульта, заболеваний сердца и других сердечно-сосудистых причин составил 38,9, 116,1 и 81,0 на 100 000, соответственно. Кроме того, данные NHANES за 2009-2010 гг. Показывают, что в целом 7,2% пациентов сами сообщили о наличии какого-либо типа ССЗ, включая 3,2% с ишемической болезнью сердца (ИБС), 2,7% с инсультом и 2,0% с застойной (хронической) сердечной недостаточностью (ХСН). В настоящее время предполагается, что около 20% острых неврологических событий связаны с сердечно-сосудистыми эмболами. Еще 40% классифицируются как «криптогенные», хотя появляется все больше данных, предполагающих связь с возможными сердечно-сосудистыми источниками эмболов в них. У молодых людей с острым ишемическим инсультом (до 45 лет) доля сердечно-сосудистой эмболии значительно выше (> 50%), поскольку потенциальный источник эмболии, скорее всего, будет единственной идентифицируемой причиной. Это контрастирует с пациентами старшего возраста, которые с большей вероятностью имеют идентифицируемое сопутствующее врожденное цереброваскулярное заболевание. Также возможно, что у некоторых пациентов весь источник эмбола мог мигрировать в сосудистое русло, создавая ложноотрицательное эхокардиографическое исследование, недооценивая истинную долю пациентов, у которых есть сердечно-сосудистый источник эмболии.
Возможные сердечно-сосудистые источники эмболии
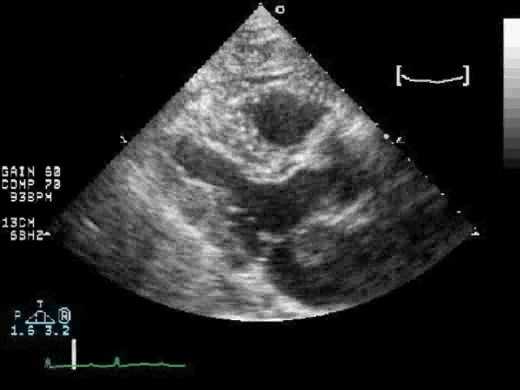
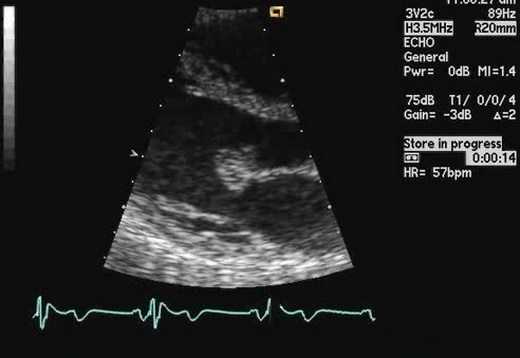
Литература, документирующая взаимосвязь между потенциальными источниками сердечно-сосудистой эмболии, ограничена тем фактом, что большая часть текущих данных основана на нерандомизированных сериях случай-контроль, а не на проспективных исследованиях. Потенциальные источники эмболов в сердечно-сосудистой системе лучше всего разделить на две группы в зависимости от уровня имеющихся в настоящее время доказательств: вероятные или возможные источники (таблица 1). Большинство из них происходит из-за эмболии внутрисердечного тромба, который в более чем половине всех случаев локализуется в пределах левого предсердия (ЛП), прежде всего в пределах ушка левого предсердия (УЛП). Фибрилляция предсердий и ревматическая болезнь митрального клапана (в первую очередь митральный стеноз) являются наиболее частыми предрасполагающими факторами. Тромб левого желудочка (ЛЖ), обычно возникающий в условиях серьезной аномалии движения апикальной стенки (акинезия или аневризма), является вторым наиболее частым потенциальным источником эмболии (25%). Большие вегетации и левосторонние опухоли (миксома или папиллярная фиброэластома) встречаются гораздо реже. Все чаще на эхокардиографии выявляется атерома грудного отдела аорты, которая связывается с эмболическими событиями. Эта связь наиболее высока для «сложных» бляшек (например, толщиной> 4 мм или поражений на ножке и подвижных тромботических наложений). Острое ишемическое событие у пациента с протезом механического клапана является кардиоэмболическим, пока не будет доказано обратное.
Другие результаты эхокардиографии перечислены как возможные источники, поскольку уровень доказательности менее надежен. Открытое овальное окно (ООO) связано с повышенным риском ишемического инсульта, особенно у молодых людей, хотя это настолько частое явление в общей популяции (20-25%), что определение точной причины и следствия затруднено. Комбинация аневризмы межпредсердной перегородки (AМПП) и ООО связана с многократным увеличением риска инсульта по сравнению с одним открытым овальным окном. Другие находки, предполагающие возможные ассоциации с эмболическими событиями, включают спонтанный эхоконтрастирование (СЭК) в левом предсердии, клапанный фиброз, кальцификацию митрального кольца, пролапс митрального клапана и более мелкие вегетации.
Рекомендации по эхокардиографии у пациентов с неврологическими нарушениями или другими сосудистыми эмбологенными событиями (обновление рекомендаций AHA / ACC / ASE 2003 по клиническому применению эхокардиографии)
I класс.
- Пациенты любого возраста с резкой окклюзией основной периферической или висцеральной артерии
- Более молодые пациенты (обычно
- Пожилые пациенты (обычно> 45 лет) с неврологическими нарушениями без признаков цереброваскулярного заболевания или другой очевидной причины
- Пациенты, для которых клиническое терапевтическое решение (например, антикоагулянтная терапия) будет зависеть от результатов эхокардиографии.
Класс IIa
- Пациенты с подозрением на эмболию и цереброваскулярные заболевания сомнительной значимости
Класс IIb
- Пациенты с неврологическими нарушениями и внутренними цереброваскулярными заболеваниями, природа которых достаточна, чтобы вызвать клиническое событие.
III класс
- Пациенты, для которых результаты эхокардиографии не повлияют на решение о назначении антикоагулянтной терапии или иным образом не повлияют на подход к диагностике или лечению.
Трансторакальная и чреспищеводная эхокардиография для выявления причины эмболии
Чувствительность трансторакальной эхокардиографии (TTЭхоКГ) для обнаружения потенциальных источников эмбола низкая, так как наиболее частые потенциальные причины плохо визуализируются с помощью этой методики. При отсутствии клинических сердечных заболеваний диагностическая ценность составляет всего 1%, а с клиническими сердечными аномалиями увеличивается до 15%. Его основное применение - оценка глобальной и региональной систолической функции ЛЖ и апикального тромба в левом желудочке.
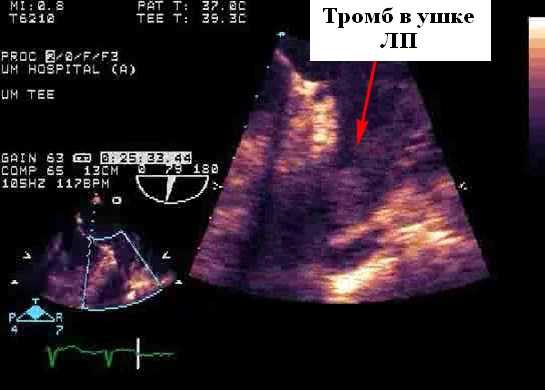
Оценка межпредсердной перегородки и грудной аорты. В целом чреспищеводная эхокардиография (ЧПЭХоКГ) выявляет значительно больше потенциальных источников эмболии, чем TТЭхоКГ (39-57% против 15-19%). Оценка потенциального источника эмбола в настоящее время является основным клиническим показанием для ЧПЭХоКГ в большинстве лечебных учреждений (26%). Использование контраста могло бы повысить эффективность ЧПЭхоКГ для обнаружения тромбов в ушке левого предсердия, и польза была максимальной, когда исследования были ограничены наличием спонтанного эхо-контрастирования или когда была низкая скорость опорожнения ушка левого предсердия. Кроме того, контраст часто помогает отличить плотный спонтанный эхоконтрастный осадок и необходим для оптимальной визуализации ЛП и тромба, в частности, расположенной сзади ушка левого предсердия (наиболее частое место расположения тромба). Однако, вероятно, лучше рассматривать эти два метода как взаимодополняющие, а не исключающие друг друга.
Патогенетические подтипы ишемического инсульта
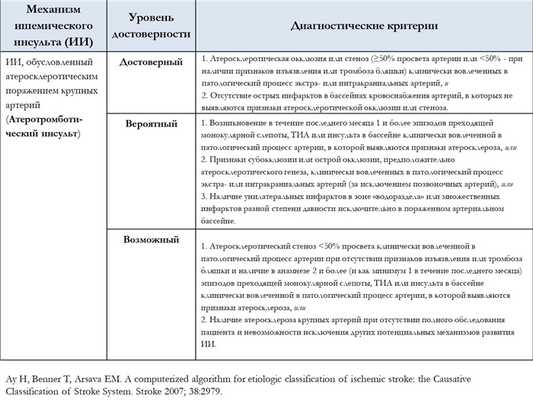
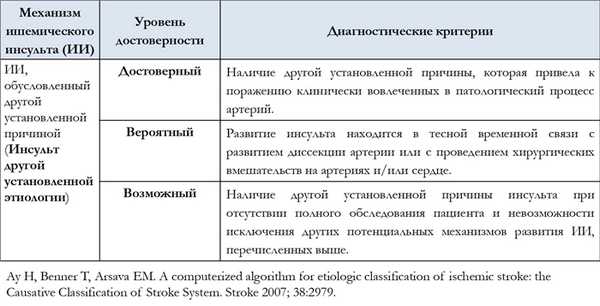
В настоящее время общепризнанной классификацией патогенетических подтипов ишемического инсульта является классификация TOAST (Adams H. P.et al. 1993). Выделяют пять патогенетических подтипов ишемического инсульта: атеротромботический (вследствие атеросклероза крупных артерий), кардиоэмболический, лакунарный (вследствие окклюзии перфорантной артерии), инсульт другой установленной этиологии и инсульт неустановленной этиологии. Критерии определения патогенетического подтипа ишемического инсульта согласно классификации TOAST представлены в таблице 1.
Таблица 1. Критерии определения патогенетического подтипа ишемического инсульта
| Признаки | Патогенетический подтип | |||
|---|---|---|---|---|
| Атеротромботический | Кардио-эмболический | Лакунарный | Другой установленной этиологии | |
| Клиника Поражение коры или мозжечка | + | + | - | +/- |
| Клиника Лакунарный синдром | - | - | + | +/- |
| Нейровизуализация (КТ/МРТ) Кортикальный, мозжечковый или подкорковый инфаркт более 1,5 см в диаметре | + | + | - | +/- |
| Нейровизуализация (КТ/МРТ) Подкорковый инфаркт или инфаркт ствола мозга менее 1,5 см в диаметре | - | - | +/- | +/- |
| Обследование Стеноз крупной церебральной артерии | + | - | - | - |
| Обследование Кардиальный источник эмболии | - | + | - | - |
| Обследование Другие причины | - | - | - | + |
Атеротромботический (вследствие атеросклероза крупных артерий) патогенетический подтип ишемического инсульта диагностируют у пациентов с ипсилатеральным пораженному полушарию стенозом более 50% или окклюзией одной из магистральных артерий головы.
Критерии:
- Клиническая картина соответствует поражению коры головного мозга (афазия, двигательные нарушения и др. ) или мозжечка;
- В анамнезе - ТИА в аффектированном артериальном бассейне, шум при аускультации на сонных артериях, снижение их пульсации;
- Наличие в анамнезе перемежающейся хромоты;
- По данным КТ или МРТ - повреждение коры головного мозга, мозжечка или субкортикальный полушарный инфаркт более 1,5 см в диаметре;
- По данным дуплексного сканирования и/или дигитальной субтракционной ангиографии — стеноз более 50% или окклюзия интра — или экстракраниальной артерии ипсилатеральной пораженному полушарию;
- Исключены потенциальные источники кардиогенной эмболии;
- Диагноз атеротромботического патогенетического подтипа ИИ не может быть установлен, если изменения церебральных артерий при дуплексном сканировании или дигитальной субтракционной ангиографии минимальны или отсутствуют.
Кардиоэмболический патогенетический подтип ишемического инсульта диагностируют у пациентов с окклюзией церебральных артерий вследствие кардиогенной эмболии.
- Наличие кардиального источника эмболии высокого или среднего риска (таблица 2);
- По данным КТ или МРТ - повреждение коры головного мозга, мозжечка или субкортикальный полушарный инфаркт более 1,5 см в диаметре;
- Предшествующие ТИА или ИИ в более чем одном артериальном бассейне;
- Исключена потенциальная артерио-артериальная эмболия;
- Ишемический инсульт у пациентов со средним риском кардиальной эмболии при отсутствии других причин расценивают как кардиоэмболический патогенетический подтип.
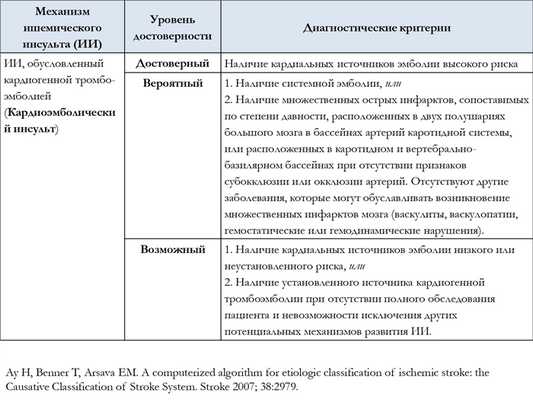
Таблица 2. Кардиальные источники эмболии высокого и среднего риска
- Механические протезы клапанов сердца
- Фибрилляция предсердий
- Митральный стеноз с фибрилляцией предсердий
- Тромбоз ушка левого предсердия
- Синдром слабости синусового узла
- «Свежий» инфаркт миокарда (менее 4 недель)
- Дилатационная кардиомиопатия
- Глобальная патология движений стенки миокарда
- Миксома
- Инфекционный эндокардит
- Пролапс митрального клапана
- Кальцификация митрального кольца
- Митральный стеноз и недостаточность без фибрилляции предсердий
- Небактериальный эндокардит
- Аневризма межпредсердной перегородки
- Открытое овальное окно
- Трепетание предсердий
- Инфаркт миокарда (более 4 недель, но менее 6 месцев)
- Биологические протезы клапанов сердца
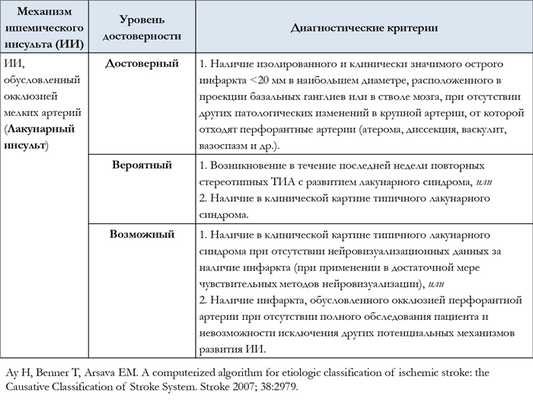
Лакунарный (вследствие окклюзии мелкой перфорантной артерии) патогенетический подтип ишемического инсульта верифицируют на основании следующих критериев:
- Наличие в клинической картине одного из традиционных лакунарных синдромов (чисто двигательный инсульт; чисто чувствительный инсульт; сенсомоторный инсульт; синдром дизартрии с неловкостью руки; синдром атактического гемипареза и т. д. ) и отсутствие нарушений корковых функций;
- Наличие в анамнезе гипертонической болезни или сахарного диабета;
- Субкортикальные/стволовые повреждения диаметром менее 1,5 см по данным КТ/МРТ или нейровизуализационные изменения отсутствуют;
- Отсутствие потенциальных источников кардиогенной эмболии или стеноза ипсилатеральной мозговой артерии более 50%.
Одной из наиболее частых причин лакунарного инсульта является липогиалиноз перфорантных артерий.
Таблица 3. Диагностические критерии лакунарного инсульта
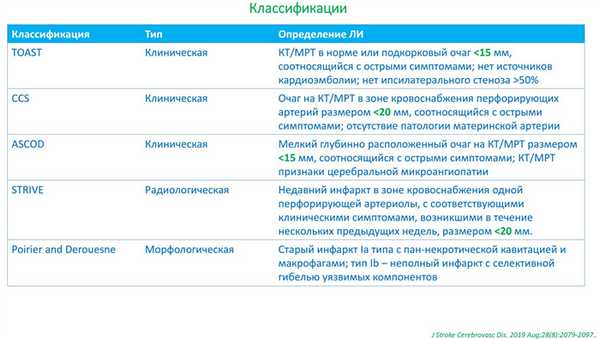
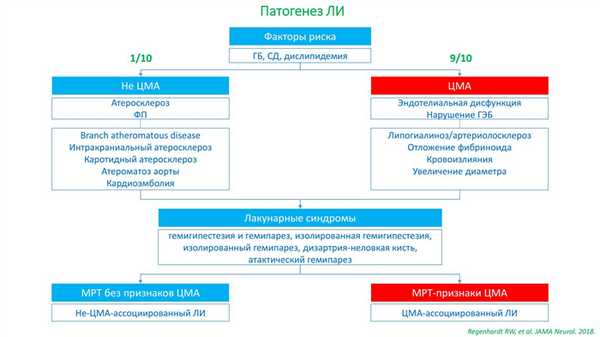
Критериями постановки диагноза инсульта другой установленной этиологии являются:
- Пациенты с редкими причинами ишемического инсульта (гипергомоцистениемия, тромбофилии, диссекция церебральных артерий, CADASIL, болезнь Фабри и др. ). Редкие причины ишемического инсульта подробно изложены в главе XII «Вторичная профилактика».
- По данным КТ/МРТ головного мозга выявляется инфаркт мозга любого размера и любой локализации;
- При диагностических исследованиях - должна быть выявлена одна из редких причин инфаркта мозга;
- Исключены кардиальные источники эмболии и атеросклеротическое поражение церебральных артерий.
Инсульт неустановленной этиологии констатируют у пациентов с неустановленной причиной ишемического инсульта, а также у пациентов с двумя и более потенциальными причинами инсульта (например, пациент с фибрилляцией предсердий и ипсилатеральным стенозом сонной артерии >50%).
Церебральная эмболия
Лекция посвящена одной из наиболее актуальных проблем современной ангионеврологии — церебральной эмболии. Подробно освещены исторические аспекты проблемы, основные результаты, полученные к настоящему времени, а также определены основные перспективы дальнейшего развития. Материал сгруппирован в соответствии с тремя основными звеньями патогенеза церебральной эмболии: донорский источник, эмболический материал, реципиентная артерия. Наиболее подробно изложена информация, касающаяся потенциальных источников церебральной эмболии. Показаны особенности тромбообразования при различных типах источников, что позволило обоснованно изложить базовые подходы к профилактической антитромботической терапии. Продемонстрированы возможности хирургического устранения потенциальных источников эмболии. Подробно описан метод допплеровской детекции церебральной эмболии, являющийся единственным методом регистрации пассажа эмболического материала по сосудам головного мозга. Показана судьба эмболического материала в реципиентной артерии. Продемонстрированы особенности клинической картины и данных нейровизуализации в зависимости от размера и состава эмбола, а также динамики процесса реканализации. Особый акцент сделан на геморрагической трансформации эмболического инфаркта. Представлены подходы к тромболитической терапии. В ходе изложения использованы материалы собственных исследований. Настоящая лекция является первым систематизированным представлением данной проблемы в отечественной литературе.
Первооткрывателем эмболии по праву можно считать великого немецкого ученого Rudolf Virchow В 1847 году, в возрасте всего 26 лет, он опубликовал работу под названием «Ueber die akut Entzuendung der Arterien», в которой на основе патологоанатомических и экспериментальных исследований сформулировал основополагающий вывод: тромбы не обязательно формируются в том месте, где они обнаружены при вскрытии, а могут быть принесены из периферических или церебральных вен в легочные артерии, а также из ушка левого предсердия и клапанов сердца в периферические артерии. В 1854 году он ввел в научную медицинскую литературу термины «эмбол», «эмболия», «тромб», «тромбоз». Открытие Virchow стало возможно благодаря накоплению суммы описанных в литературе отдельных клинических случаев, где причиной нарушений могла быть эмболия (в том числе, церебральная), но до Virchow отсутствовал фундаментальный подход к пониманию процесса эмболии. В течение длительного времени существенным препятствием являлось представление, что внутрисосудистые тромбы являются исключительно постмортальными. Затем в течение длительного времени постулировалась связь прижизненного образования тромбов с воспалением (флебит или артериит). Virchow показал, что воспаление не является необходимым условием тромбообразования. Необходимо отметить, что в последние годы вновь активно изучается связь инфекционного и асептического воспаления с тромбообразованием и эмболией. Незадолго до открытия Virchow была опубликована работа Carswell (1838), в которой было впервые показано, что размягчение мозга является формой некроза, вызванного облитерацией церебральных артерий (ранее размягчение мозга считали следствием воспаления). Virchow также представил несколько случаев церебрального эмболического размягчения. В дальнейшем случаи эмболического размягчения мозга были опубликованы целым рядом авторов (Ruhle, 1853; Cohn, 1860; Gowers, 1875). Вплоть до начала годов XX века представления о церебральной эмболии базировались исключительно на результатах патологоанатомических и экспериментальных исследований. В качестве источника рассматривался лишь узкий круг заболеваний сердца — ревматическое поражение сердца с митральным стенозом и мерцательной аритмией, а также свежий инфаркт миокарда. В качестве диагностических критериев учитывались также внезапное развитие максимального в дебюте фокального неврологического дефицита и признаки системной эмболии. Сообщаемая частота церебральной эмболии среди причин инсульта не превышала 10%. На данном этапе отечественные ученые также внесли вклад в развитие данной проблемы. Особенно продуктивными были исследования газовой (воздушной) эмболии при операциях на открытом сердце в условиях искусственного кровообращения (Акимов, 1971; Бураковский и соавт., 1972; Бадалян, 1975). В дальнейшем развитие представлений о церебральной эмболии было достаточно бурным и имело тесную связь с прогрессом диагностических медицинских технологий. Внедрение в клиническую практику радиологических методов (церебральная ангиография и компьютерная томография головного мозга) привело к смещению акцента в диагностике от донорского источника к реципиентной артерии. Частота церебральной эмболии среди причин инсульта в регистрах конца начала годов XX века (Harvard Stroke Registry, Michael Reese Stroke Registry) увеличилась до В качестве потенциального источника стали рассматриваться атеросклеротические бляшки в церебральных артериях (артерио-артериальная эмболия). Прогресс ультразвуковых методов исследования и широкое внедрение трансторакальной эхокардиографии и дуплексного сканирования брахиоцефальных артерий вновь сместило акцент в сторону потенциального источника эмболии. Однако это привело к снижению сообщаемой частоты эмболического инсульта в крупных регистрах конца годов XX века (Stroke Data Bank, Lausanne Stroke Registry) в среднем до 20%. Появление трансэзофагеальной эхокардиографии позволило повысить эффективность обнаружения потенциальных кардиальных источников эмболии. Среди больных ишемическим инсультом такие источники стали выявлять у и более пациентов. Даже если учесть, что потенциальный источник эмболии не всегда может являться истинной причной инсульта, эмболия в настоящее время рассматривается в качестве ведущего патогенетического механизма инсульта. По образному выражению Futrell (1998) «маятник качнулся в сторону эмболии как главной причины ишемического инсульта». В соотвествии с классификацией TOAST Stroke Subtype Classification, которая является общепризнанной в настоящее время, выделяют следующие патогенетические подтипы ишемического инсульта:
- атеротромбоэмболический (церебральная макроангиопатия);
- кардиоэмболический;
- лакунарный (церебральная микроангиопатия);
- инсульт другой определенной этиологии;
- инсульт неопределенной этиологии.
- кардиогенная эмболия — 40%;
- артерио-артериальная эмболия — 8%;
- инсульт вследствие гемодинамически значимого стено-окклюзирующего поражения магистральной артерии головного мозга — 14%;
- лакунарный инсульт — 14%;
- инсульт неясного генеза — 24%.
- Наличие потенциального артериального или кардиального источника эмболии.
- Особенности клинической картины:
- острое начало;
- максимальный в дебюте неврологический дефицит;
- быстрое сокращение неврологического дефицита;
- симптомы поражения бассейна задних ветвей левой средней мозговой артерии и признаки системной эмболии (при кардиогенной эмболии).
- Определенные типы церебральных инфарктов при нейровизуализации:
- территориальный инфаркт;
- геморрагический инфаркт;
- множественные инфаркты (при кардиогенной эмболии).
- Характерные данные при ангиографии:
- окклюзия крупных интракраниальных артерий или их ветвей;
- доказательства миграции эмбола или реканализации аффектированной артерии;
- отсутствие атеросклеротического поражения соответствующей интракраниальной артерии.
- Микроэмболические сигналы при транскраниальной допплерографии.
- более тщательное определение вида источника эмболии (патология камер сердца, патология клапанов сердца, другие, их сочетание);
- использование комбинации непрямых антикоагулянтов и антитромбоцитарных препаратов (например, варфарин + дипиридамол);
- использование хирургических методов лечения по «неврологическим» показаниям (в том числе, малоинвазивных вмешательств).
- более тщательный учет механизма развития артерио-артериальной эмболии;
- использование различных новых комбинаций антитромбоцитарных средств;
- расширение показаний к использованию хирургических и эндоваскулярных методов лечения.
- установить эмболическую природу церебральных ишемических нарушений;
- определить локализацию источника эмболии;
- оценить риск развития церебральных ишемических нарушений при потенциальных кардиальных и каротидных источниках эмболии;
- определить эмболическую нагрузку на головной мозг при операциях на сердце и сосудах мозга;
- оценить эффективность антитромботической терапии (Кузнецов, 2001).
- более широкое использование систем автоматической допплеровской детекции церебральной микроэмболии;
- создание систем, позволяющих дифференцировать состав и размеры микроэмболов;
- использование метода для контроля эффективности антитромбоцитарной терапии.
- широкое использование тромболизиса;
- расширение терапевтического окна для использования тромболизиса (дополнительные диагностические тесты, новые препараты, сочетание с нейропротекцией);
- использование новых методов реканализации (сонотромболизис, эндоваскулярные процедуры).
Источники:
- Акимов Г.А. Нервная система при острых нарушениях кровообращения.- Л.: Медицина, 1971.- 263 с.
- Бадалян Л.О. Неврологические синдромы при болезнях сердца.- М.: Медицина, 1975.- 336 с.
- Кузнецов А.Н. Кардиогенная и артерио-артериальная церебральная эмболия: Этиология, патогенез, клиника, диагностика, лечение и профилактика: Автореф. дис. : д-ра мед. наук.- СПб., 2001.- 32 с.
- Кучеренко С.С. Клинико-инструментальные паттерны патогенетических вариантов ишемического инсульта: Автореф. дис. : канд. мед. наук.- СПб., 2004.- 20 с.
- Осложнения при операциях на открытом сердце: Основы реаниматологии в кардиохирургии / В.И.Бураковский, Я.Л.Рапопорт, Г.Г.Гельштейн и др.- М.: Медицина, 1972.- 304 с.
- Шевченко Ю.Л. Хирургическое лечение инфекционного эндокардита.- СПб.: Наука, 1995.- 229 с.
- Шевченко Ю.Л., Михайленко А.А., Кузнецов А.Н., Ерофеев А.А. Кардиохирургическая агрессия и головной мозг: Церебральная гемодинамика и неврологические исходы операций на сердце.- СПб.: Наука, 1997.- 152 с.
- Шевченко Ю.Л., Одинак М.М., Михайленко А.А., Кузнецов А.Н. Кардиоэмболический инсульт.- СПб., 1997.- 66 с.
- Adams H.P.Jr., Bendixen B.H., Kappelle L.J., et al. Classification of subtype of acute ischemic stroke: Definitions for use in a multicenter clinical trial: TOAST: Trial of Org 10172 in Acute Stroke Treatment // Stroke.- 1993.- Vol. 24.- P.
- Antiplatelet Trialists` Collaboration. Collaborative overview of randomised trials of antiplatelet therapy // Brit. Med. J.- 1994.- Vol. 308.- P. P. P.
- Brain ischemia: Basic concepts and clinical relevance / Ed. by Caplan L.R.- London, etc.: Springer-Verlag, 1995.- 380 p.
- Caplan L.R. Brain embolism revisited // Neurology.- 1993.- Vol. 43.- P.
- Caplan L.R. Clinical diagnosis of brain embolism // Cerebrovasc. Dis.- 1995.- Vol. 5.- P.
- CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE) // Lancet.- 1996.- Vol. 348.- P.
- Cardiogenic brain embolism // Arch. Neurol.- 1986.- Vol. 43.- P.
- Cohen A. Atheroma of the aortic arch and embolic risk // Ann. Cardiol. Angeiol.- 1998.- Vol. 47.- P.
- Consensus Committee of the Ninth International Cerebral Hemodynamic Symposium. Basic identification criteria of Doppler microembolic signals // Stroke.- 1995.- Vol. 26.- P. 1123.
- Cujec B., Polasek P., Voll C., Shuaib A. Transesophageal echocardiography in the detection of potential cardiac source of embolism in stroke patients // Stroke.- 1991.- Vol. 22.- P.
- Delcker A., Diener H.C. Neurologische Diagnostik und therapeutische Massnahmen bei zerebralen Embolien // Herz.- 1991.- Jg. 16.- S.
- Diener H.C., Cunha L., Forbes C., et al. European Stroke Prevention Study: 2: Dipyridamole and acetylsalicylic acid in the secondary prevention of stroke // J. Neurol. Sci.- 1996.- Vol. 143.- P.
- Futrell N. Pathophysiology of acute ischemic stroke: New concepts in cerebral embolism // Cerebrovasc. Dis.- 1998.- Vol. 8, suppl. 1.- P.
- Georgiadis D., Baumgartner R.W., Karatschai R., et al. Further evidence of gaseous embolic material in patients with artificial heart valves // J. Thorac. Cardiovasc. Surg.- 1998.- Vol. 115- P.
- Guidelines for the early management of patients with ischemic stroke: A scientific statement from the Stroke Council of the American Stroke Association // Stroke.- 2003.- Vol. 34.- P.
- Hagen P.T., Scholz D.G., Edwards W.D. Incidence and size of patent foramen ovale during the first 10 decades of life: An autopsy study of 965 normal hearts // Mayo Clin. Proc.- 1984.- Vol. 59.- P.
- Hanna J.P., Furlan A.J. Cardiac disease and embolic sources // Caplan L.R., ed. Brain ischemia: Basic concepts and clinical relevance.- London, etc.: Springer-Verlag, 1995.- P.
- Hart R.G., Kagen-Hallet K., Joerns S.E. Mechanisms of intracranial hemorrhage in infectious endocarditis // Stroke.- 1987.- Vol. 18.- P.
- Heiro M., Nikoskelainen J., Engblom E., et al. Neurologic manifestations of infective endocarditis: A experience in a teaching hospital in Finland // Arch. Intern. Med.- 2000.- Vol. 160.- P.
- Herrschaft H. Herzkrankheiten als Ursache zerebraler Symptome und Syndrome // Fortschr. Neurol. Psychiatr.- 1990.- Jg. 58.- S.
- Hornig C.R. Risk evaluation of anticoagulant therapy in cardioembolic stroke // Dorndorf W., Marx P., eds. Stroke prevention.- Basel, etc.: Karger, 1994.- P.
- Kaps M. Detection of embolic events by ultrasound // Dorndorf W., Marx P., eds. Stroke prevention.- Basel, etc.: Karger, 1994.- P.
- Kessler C.M. Intracerebral platelet accumulation as evidence for embolization of carotid origin // Clin. Nucl. Med.- 1992.- Vol. 17.- P.
- Kessler C., von Maravic M., Bruckmann H., Kompf D. Ultrasound for the assessment of the embolic risk of carotid plaques // Acta Neurol. Scand.- 1995.- Vol. 92.- P.
- Mast H., Thompson J.L., Voller H., et al. Cardiac sources of embolism in patients with pial artery infarcts and lacunar lesions // Stroke.- 1994.- Vol. 25.- P.
- Minematsu K., Yamaguchi T., Omae T. «Spectacular shrinking deficit»: Rapid recovery from a major hemispheric syndrome by migration of an embolus // Neurology.- 1992.- Vol. 42.- P.
- Moehring M.A., Spencer M.P. Power Doppler (PMD) for observing cerebral blood flow and tracking emboli // Ultrasound Med. Biol.- 2002.- Vol. 28.- P.
- Mohr J.P. Classification of strokes: Experience from Stroke Data Banks // Dorndorf W., Marx P., eds. Stroke prevention.- Basel, etc.: Karger, 1994.- P.
- Ogata J., Yutani C., Imakita M. et al. Hemorrhagic infarct of the brain without a reopening of the occluded arteries in cardioembolic stroke // Stroke.- 1989.- Vol. 20.- P.
- Rapp J.H., Pan X.M., Sharp F.R., et al. Atheroemboli to the brain: Size threshold for causing acute neuronal cell death // J. Vasc. Surg.- 2000.- Vol. 32.- P.
- Ringleb P.A., Schellinger P.D., Schranz C., Hacke W. Thrombolytic therapy within 3 to 6 hours after onset of ischemic stroke: Useful or harmful? // Stroke.- 2002.- Vol. 33.- P.
- Schwartz A., Gass A., Hennerici M.G. Is there a need to reclassify acute stroke patients? // Cerebrovasc. Dis.- 1998.- Vol. 8, suppl. 1.- P.
- Spencer M.P. Transcranial Doppler monitoring and causes of stroke from carotid endarterectomy // Stroke.- 1997.- Vol. 28.- P.
- Takano K., Yamaguchi T., Minematsu K., et al. Differences in clinical features and computed tomographic findings between embolic and non-embolic acute ischemic stroke: A quantitative differential diagnosis // Int. Med.- 1998.- Vol. 37.- P.
- The European Stroke Initiative Executive Committee and the EUSI Writing Committee. European Stroke Initiative recommendations for stroke management: Update 2003 // Cerebrovasc. Dis.- 2003.- Vol. 16.- P.
- The heart and stroke / Ed. by Furlan A.J.- London, etc.: Springer-Verlag, 1987.- 380 p.
- Virchow R. Ueber die akut Entzuendung der Arterien // Virchows Arch Path Anat.- 1847.- Vol. 1.- S.
© 2022 ФГБУ «НМХЦ им. Н.И. Пирогова» Минздрава России. Использование материалов сайта полностью или частично без письменного разрешения строго запрещено.
Эмболический инсульт из неустановленного источника
В статье представлена концепция ESUS - эмболического инсульта из неустановленного источника. Приведены критерии диагностики и возможные алгоритмы верификации источника инсульта.
Выяснение причины, вызвавшей развитие ишемического инсульта, является первым и важнейшим шагом во вторичной профилактике повторного ОНМК. Классификация ишемического инсульта по патогенетическим подтипам TOAST выделяет атеротромботический, эмболический, лакунарный, гемодинамический и криптогенный подтипы инсульта, и остается актуальной по сей день. В настоящее время все чаще используется понятие ESUS - эмболический инсульт из неустановленного источника (embolic stroke of undetermined source). Впервые данная концепция была предложена международной рабочей группой по изучению криптогенного инсульта в 2014 году [1].
Согласно определению, ESUS - это нелакунарный инфаркт головного мозга без установленного кардиогенного источника эмболии или стеноза брахиоцефальных или интракраниальных артерий на стороне поражения. Частота эмболического инсульта из неустановленного источника колеблется, по разным данным, от 9 до 25%, усредненно составляет 17% [2].
Для того, чтобы установить диагноз ESUS, необходимо провести пациенту базовый набор исследований, направленных на выявление причины инсульта. Критериями диагностики ESUS в настоящее время являются [3]:
инсульт, по данным КТ или МРТ, не являющийся лакунарным (лакунарный инсульт определяется как подкорковый инфаркт в области васкуляризации мелких пенетрирующих артерий головного мозга с максимальным линейным размером ≤1,5 см на КТ или ≤2,0 см на диффузионно-взвешенных изображениях МРТ);
не выявлено атеросклеротического стеноза более 50% просвета экстра- и интракраниальных артерий на стороне поражения;
отсутствие источников кардиогенной эмболии высокого риска (таких как перманентная или пароксизмальная ФП, трепетание предсердий, внутрисердечные тромбы, протезированные клапаны сердца, миксома предсердия или другие опухоли сердца, митральный стеноз, недавний инфаркт миокарда, снижение фракции выброса левого желудочка
не выявлено иных редких специфических причин инсульта (например, артериита, диссекции, мигрени, вазоспазма, употребления наркотических препаратов).
Исходя из вышеуказанных критериев, обязательными инструментальными исследованиями, необходимыми для выявления причины инсульта, являются:
МРТ головного мозга - для оценки размеров, характера и локализации очага;
УЗДГ брахиоцефальных артерий - для выявления стенозирующего поражения на экстракраниальном уровне на стороне инсульта;
в случае отсутствия изменений на УЗДГ БЦА - КТ-ангиография интракраниальных артерий для выявления внутричерепных стенозов или тромбозов артерий ипсилатерально очагу;
Трансторакальная ЭхоКГ - исключение кардиальных источников эмболии высокого риска;
ЭКГ-ХМ суточное или трехсуточное - выявление эмбологенных нарушений сердечного ритма.
Данные исследования входят в стандарт [4] оказания помощи больным с ОНМК и выполняются всем пациентам с ишемическим инсультом. Результаты этих исследований в совокупности позволяют верифицировать причину инсульта примерно в 60-75% случаев.
В случае развития инсульта у молодого пациента, а также при наличии анамнестических указаний на возможные аутоиммунные заболевания, сочетание инсульта с другой патологией, пациенту должно быть проведено дополнительное обследование для исключения редких причин инсульта, таких как васкулиты, тромбофилии, генетические заболевания (болезнь Фабри, CADASIL, MELAS) и другие. Диагностика данных заболеваний часто является труднодоступной и дорогостоящей, поэтому спектр обследования определяется в этом случае индивидуально, с учетом особенностей анамнеза и наличия сопутствующей патологии у пациента.
Частота инсульта вследствие редких причин, согласно данным популяционных исследований, невелика и составляет около 3% [5]. В этой связи важное значение приобретет поиск неочевидного источника возможной эмболии. В настоящее время выделяют три основных причины развития ESUS:
— скрытая кардиогенная эмболия (на фоне не выявленных при рутинном обследовании форм фибрилляции предсердий (ФП) или других кардиоэмболических источников);
— субстенотический атеросклероз в каротидном бассейне или в области дуги аорты;
— парадоксальная эмболия на фоне тромбоза вен в условиях наличия открытого овального окна или иного дефекта предсердной или желудочковой перегородки, а также внесердечные артериовенозные аномалии легочных сосудов.
В диагностике субстенотического поражения аорты и каротидных артерий большое значение имеет селективная ангиография и МРТ сосудистой стенки, возможная на томографах высокого разрешения. Также ценным диагностическим тестом является длительная (30-ти минутная) транскраниальная допплерография, которая позволяет визуализировать микроэмболы в каротидном русле.
С целью выявления парадоксальной эмболии через открытое овальное окно пациенту может быть проведена контрастная транскраниальная допплерография (ТКД) в режиме эмболодетекции для диагностики шунта справа налево с проведением “микропузырьковой” пробы. Наличие функционирующего ООО не всегда может быть выявлено при выполнении рутинной трансторакальной ЭхоКГ. Чреспищеводная ЭхоКГ является более достоверным методом в диагностике этой патологии, однако данное исследование тяжело переносится пациентами. ТКД с “микропузырьковой” пробой является доступным и высокоинфоомативным методом, позволяющим выявить у конкретного пациента возможность попадания микропузырьков воздуха в сосуды головного мозга из большого круга кровообращения (парадоксальной эмболии).
Остановимся подробнее на алгоритме поиска источников кардиогенной эмболии среднего и низкого риска, а также на возможностях выявления скрытых форм ФП.
К источникам кардиоэмболии низкого и среднего риска относятся [6]:
миксоматозная дегенерация на фоне пролапса митрального клапана,
кальцификация митрального кольца,
стеноз аортального клапана,
кальцификация аортального кольца,
предсердная асистолия и синдром слабости синусового узла,
неустойчивые пробежки предсердной тахикардии (пробежки),
стаз крови в ушке левого предсердия,
аневризма межпредсердной перегородки,
умеренная систолическая или диастолическая дисфункция левого желудочка (ЛЖ),
эндомиокардиальный фиброз левого желудочка.
Для выявления большей части вышеуказанных состояний достаточно проведения рутинной ЭхоКГ и ЭКГ ХМ. В случае возникновения подозрения на наличие одного из вышеуказанных источников эмболии пациенту показано более детальное обследование (ЧП ЭхоКГ, МРТ сердца).
В настоящее время выделяют предикторы высокой вероятности развития ФП у пациентов, перенесших ишемический инсульт. К ним относятся:
Клинические: возраст старше 75 лет и наличие сердечно-сосудистых факторов риска;
Признаки предсердной кардиопатии: диаметр левого предсердия (ЛП) > 46 мм, эпизоды наджелудочковой тахикардии длительностью более 20 сердечных циклов, повышение уровня NT-proBNP> 400 пг/мл.
Пациенты, перенесшие эмболический инсульт из неустановленного источника, и имеющие предикторы высокого риска ФП из обеих групп, должны быть более внимательно обследованы для выявления нарушений сердечного ритма. Речь идет о длительном (от 7 дней и более) мониторировании ЭКГ с помощью наружных или имплантируемых электродов. Подобные исследования целесообразно проводить на амбулаторном этапе. Целью такого продолжительного мониторинга является выявление скрытых форм ФП и подбор адекватной вторичной профилактики ишемического инсульта (ИИ) В настоящее время пациентам, перенесшим ESUS, не рекомендовано рутинное назначение антикоагулянтов в качестве вторичной профилактики ИИ. Если на амбулаторном этапе у такого пациента с помощью пролонгированного ЭКГ-мониторинга будет выявлена ФП, врач будет иметь основания для назначения антикоагулянтов, что положительно повлияет на прогноз пациента в отношении повторного ИИ.
Концепция эмболического инсульта из неустановленного источника (ESUS) позволяет рассматривать пациента с так называемым криптогенным инсультом как пациента с нерешенным вопросом вторичной профилактики. В настоящее время ведутся активные исследования в этой области. Пациент с подобным диагнозом должен оставаться в поле зрения специалистов амбулаторного звена вплоть до выявления причины инсульта и подбора адекватной терапии, направленной на предотвращение рецидива.
Приказ Министерства здравоохранения Российской Федерации от 29 декабря 2012 г. № 1740н "Об утверждении стандарта специализированной медицинской помощи при инфаркте мозга".
Национальная ассоциация по борьбе с инсультом, Всероссийское общество неврологов, Ассоциация нейрохирургов России, МОО Объединение нейроанестезиологов и нейрореаниматологов, Союз реабилитологов России. Клинические рекомендации по ведению больных с ишемическими нсультом и транзиторными ишемическими атаками. Москва, 2020.
А.А. Кулеш, Л.И. Сыромятникова, В.Е. Дробаха, С.А. Мехряков, В.В. Шестаков. Криптогенный инсульт. “ГЭОТАР-Медиа”, Москва, 2020, 128 с.
ТЭЛА - современная классификация, диагностика, прогноз, лечение и профилактика рецидивов

Название тромбоэмболия состоит из двух слов. Эмболия - это закупорка сосуда пузырьком воздуха, клеточными элементами и т. д. Таким образом, тромбоэмболия означает закупорку сосуда именно тромбом.
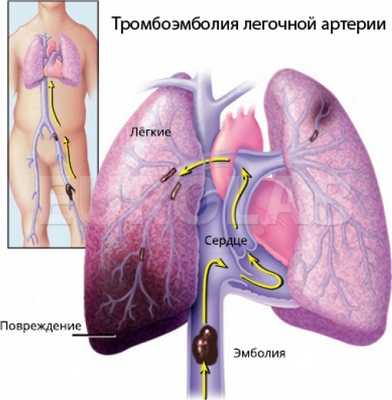
Тромбоэмболия легочной артерии (ТЭЛА) - окклюзия ствола или основных ветвей легочной артерии частичками тромба, сформировавшимися в венах большого круга кровообращения или правых камерах сердца и занесенными в легочную артерию с током крови.
Сегодня тромбоэмболия легочной артерии считается осложнением некоторых соматических заболеваний, послеоперационных и послеродовых состояний. Смертность от данного тяжелейшего осложнения очень высока, и занимает третье место среди самых частых причин летального исхода среди населения, уступая первые две позиции сердечно-сосудистым и онкологическим патологиям.
Основным источником ТЭЛА является тромбоз глубоких вен (ТГВ) нижних конечностей или малого таза, поэтому ТГВ и ТЭЛА в настоящее время объединяют в понятие «венозный тромбоэмболизм» (ВТЭ). ТЭЛА - одна из наиболее частых причин внезапной смерти. В отсутствие лечения уровень смертности при ТЭЛА составляет 20-30%, тогда как благодаря своевременному проведению терапии этот показатель снижается до 5%
Характеристика симптомов ТЭЛА
Одним из главных симтомов ТЭЛА является одышка, возникающая без каких-либо предварительных признаков, при этом явные причины появления тревожного симптома отсутствуют. Одышка возникает на вдохе, причем может присутствовать постоянно. Помимо одышки ТЭЛА характеризует увеличение частоты сердечных сокращений от 100 ударов в минуту и выше. Артериальное давление сильно падает, причем степень уменьшения обратнопропорциональна степени тяжести заболевания. То есть, чем ниже артериальное давление, тем массивнее патологические изменения, вызванные тромбоэмболией легочной артерии.
Болевые ощущения характеризуются значительной полиморфностью, и зависят от степени тяжести тромбоэмболии, объема пораженных сосудов и степени общепатологических нарушений в организме. Например, закупорка ствола легочной артерии при ТЭЛА повлечет за собой развитие болей за грудиной, которые имеют острый, разрывающий характер. Такое проявление болевого синдрома определяется сдавлением нервов в стенке закупоренного сосуда. Другой вариант болей при тромбоэмболии легочной артерии - подобные стенокардическим, когда развивается сдавливающие, разлитые боли в области сердца, которые могут иррадиировать в руку, лопатку и т. д.
При развитии осложнения ТЭЛА в виде инфаркта легкого, боль локализуется во всей грудной клетке, причем усиливается при совершении движений (чихание, кашель, глубокое дыхание).
Реже боль при тромбоэмболии локализована справа под ребрами, в области печени. Недостаточность кровообращения, развивающаяся при тромбоэмболии, может спровоцировать развитие мучительной икоты, пареза кишечника, напряжение передней стенки живота, а также выбухание крупных поверхностных вен большого круга кровообращения (шеи, ног и т. д. ). Кожа приобретает бледный цвет, причем может развиваться серый или пепельный отлив, посинение губ присоединяется реже (в основном при массивной тромбоэмболии легочной артерии). В некоторых случаях можно выслушать сердечный шум в систолу, а также выявить галопирующую аритмию. При развитии инфаркта легкого, как осложнения ТЭЛА, может наблюдаться кровохарканье примерно у 1/3 - 1/2 больных, в сочетании с резкой болезненностью в груди и высокой температурой. Температура держится от нескольких суток до полутора недель. Тяжелая степень тромбоэмболии легочной артерии (массивная) сопровождается нарушения мозгового кровообращения с симптомами центрального генеза - обмороками, головокружениями, судорогами, икотой или коматозным состоянием. В некоторых случаях к нарушениям, вызванным тромбоэмболией легочной артерии, присоединяются симптомы острой почечной недостаточности.
Описанные выше симптомы не являются специфичными именно для ТЭЛА, поэтому для постановки правильного диагноза важно собрать всю историю болезни, обратив особое внимание на наличие патологий, ведущих к тромбозам сосудов.
И все же главные симтомы - развитие одышки, увеличение частоты сердечных сокращений (тахикардия), учащением дыхания, болями в области груди. Все остальные симптомы необходимо рассматривать в совокупности, учитывая наличие тромбоза глубоких вен или перенесенного инфаркта, которые должны поставить врача и близких родственников больного в позицию настороженности относительно высокого риска развития тромбоэмболии легочной артерии.
В настоящее время в кардиологии приняты две классификации ТЭЛА. По классификации Европейского общества кардиологов (ESC, 2008) выделяют ТЭЛА высокого и невысокого (промежутоного и низкого) риска.
Классификация Американской ассоциации сердца (AHA, 2011) предполагает следующие виды ТЭЛА: массивная, субмассивная и низкого риска.
Эти классификации по многим критериям пересекаются: например, массивная ТЭЛА соответствует ТЭЛА высокого риска, субмассивная - ТЭЛА промежуточного риска. Безусловно, наиболее высокий уровень летальности - более 15% - характерен для пациентов с массивной ТЭЛА.
Главным клиническим критерием, на основании которого дифференцируют больных массивной ТЭЛА, является системная гипотония (уровень систолического АД ≤90 мм рт. ст. либо снижение его на ≥40 мм рт. ст. по сравнению с обычным), к диагностическим критериям относятся также кардиогенный шок, внезапная остановка кровообращения, признаки дисфункции правых отделов сердца, повышение сывороточных уровней сердечных тропонинов. Однако пациенты с массивной ТЭЛА встречаются в клинической практике нечасто - в 5-10% случаев.
Основным дифференциально диагностическим критерием субмассивной ТЭЛА считается наличие острой перегрузки правых отделов сердца, которая проявляется в виде дисфункции правого желудочка и определяется при использовании таких визуализирующих методик, как эхокардиография (ЭхоКГ) или компьютерная томография (КТ). Повышение уровня маркеров некроза миокарда, прежде всего тропонинов, также является одним из важных маркеров субмассивной ТЭЛА. При отсутствии вышеперечисленных маркеров говорят о ТЭЛА низкого риска, которая чаще всего и встречается в клинической практике.
Алгоритм диагностики массивной ТЭЛА достаточно лаконичен, поскольку тяжесть состояния пациентов диктует необходимость установления диагноза в кратчайшие сроки. Центральным диагностическим методом в этом алгоритме является мультиспиральная КТ.
В качестве альтернативного и в то же время скринингового метода следует рассматривать ЭхоКГ. Эхокардиографическими признаками ТЭЛА являются следующие:
- признак Мак-Коннелла (акинезия свободной стенки правого желудочка при нормальном движении верхушки сердца),
- признак «60/60» (время ускорения - AccTime - в легочной артерии 30 мм рт. ст. ),
- парадоксальное движение межжелудочковой перегородки, отсутствие инспираторного спадения нижней полой вены, дилатация легочной артерии,
- признаки легочной гипертензии,
- тромб в области правого предсердия, желудочка.
При подозрении на ТЭЛА у пациентов со стабильной гемодинамикой (без развития шока и гипотензии) начинать диагностику следует с оценки клинических симптомов и степени риска ТЭЛА (например, по Женевской шкале клинической вероятности ТЭЛА), определения уровня D -димера и компрессионной ультрасонографии вен нижних конечностей. D -димер - высокочувствительный маркер, обладающий высокой отрицательной прогностической значимостью при подозрении на ТЭЛА; нормальные значения D-димера (
Однако решающее значение в диагностике также отводится мультиспиральной КТ или, в некоторых случаях, ангиопульмонографии.
Прогноз пациентов с ТЭЛА и выбор тактики лечения в первую очередь зависят от степени тяжести процесса и его обширности. Современная схема лечения пациентов с массивной ТЭЛА (высокого риска) включает тромболитические препараты и нефракционированный гепарин (НФГ), а также симптоматическую терапию (кислород, вазопрессорные агенты - норадреналин, вазопрессин). При неудачной тромболитической терапии (ТЛТ) или наличии противопоказаний к ней рекомендуется проведение хирургических методов лечения (эмболэктомия).
У пациентов с субмассивной ТЭЛА и промежуточным риском (с признаками дисфункции правого желудочка и/или высоким уровнем маркеров повреждения миокарда) препаратами выбора являются НМГ или фондапаринукс. При наличии дополнительных факторов риска может быть проведенаТЛТ, при наличии противопоказаний или неудачной ТЛТ - эмболэктомия.
В связи с получением данных о том, что проведение ТЛТ при субмассивной ТЭЛА наряду с уменьшением риска смерти и гемодинамического коллапса обусловливает повышение частоты больших кровотечений, включая интракраниальные геморрагии (исследование PEITO, 2013), у таких больных перед назначением данной процедуры следует тщательно оценить соотношение «польза/риск».
В схеме лечения пациентов с ТЭЛА низкого риска, которые также подлежат обязательной госпитализации, основным остается применение антикоагулянтов (НМГ или фондапаринукса). ТЛТ и эмболэктомия в этих ситуациях не показаны.
Основной вопрос, который возникает после острого периода ТЭЛА, - какова оптимальная длительность проведения антикоагулянтной терапии? В остром периоде стандартным является назначение парентеральных антикоагулянтов на 5-7 дней с параллельным контролированным назначением антагонистов витамина К (варфарина). При ликвидации источника тромбоэмболии или при первом эпизоде идиопатической ТЭЛА (когда источник тромбоза обнаружить не удалось) назначают пероральные антикоагулянты курсом от 3 мес (класс и уровень доказательств IА в рекомендациях ESC, 2008), предпочтение следует отдавать длительному применению антикоагулянтов - в течение 6-12 мес (В, IIb). Длительный (бессрочный) прием пероральных антикоагулянтов показан в случае высокой вероятности рецидива (повторный эпизод идиопатической ТЭЛА или сохраняющиеся факторы риска).
Трудности, сопряженные с амбулаторным приемом варфарина (необходимость подбора дозы, лабораторного мониторинга; узкое терапевтическое окно, частое отсутствие возможности качественного контроля коагуляции, ограничения в образе жизни пациента и т. д. ), обусловливают крайне низкую приверженность к длительной антикоагулянтной терапии, что хорошо известно врачам. Между тем профилактика повторных эпизодов ВТЭ является важным аспектом ведения больных с ТЭЛА.
Когда речь идет о длительном самостоятельном приеме антикоагулянтов пациентом после выписки из стационара, в первую очередь необходимо обеспечить высокую приверженность пациента к лечению, что во многом зависит от удобства применения назначенного препарата и его безопасности.
Из НОАК только ривароксабан одобрен Управлением по контролю за качеством продуктов питания и лекарственных средств США (Food and DrugAdministration - FDA) и Европейским агентством по лекарственным средствам (ЕМА) для лечения ТГВ и ТЭЛА и профилактики рецидивов.
Ривароксабан рекомендован для лечения пациентов с ТГВ или ТЭЛА в дозе 15 мг 2 р/сут в течение 3 нед с переходом на дозу 20 мг 1 р/сут в течение последующего периода терапии (профилактика рецидивов), который должен продолжаться от 3 до 12 мес.
Основой для разработки данных рекомендаций стали результаты, полученные в глобальной программе EINSTEIN, которая включила несколько исследований ІІІ фазы, подтвердивших эффективность и безопасность ривароксабана в лечении пациентов с острым ТГВ, ТЭЛА, а также в долгосрочной профилактике рецидивов ТГВ и ТЭЛА у этих пациентов.
В исследовании EINSTEIN-PE сравнивали эффективность и безопасность монотерапии ривароксабаном (в дозе 15 мг 2 р/сут в течение 3 нед, затем в дозе 20 мг/сут) и стандартное лечение (эноксапарином подкожно с переходом на антагонист витамина К) у пациентов с острой симптомной ТЭЛА, а также оценивали данные показатели для изучаемых подходов в случае использования с целью профилактики рецидивов ВТЭ. Длительность наблюдения составляла 3-6-12 мес (на усмотрение лечащего врача). В рамках данного исследования эффективность ривароксабана в снижении первичной конечной точки - частоты рецидивов симптомной ВТЭ (совокупного показателя симптомного ТГВ, фатальной и нефатальной ТЭЛА) - была сопоставима с таковой стандартной терапии (2, 1 и 1, 8% соответственно; p=0, 003). Важно, что по основному показателю безопасности, включающему большое кровотечение и клинически значимое небольшое кровотечение, ривароксабан также не уступал стандартной терапии (10, 3 и 11, 4% соответственно; p=0, 23). Более того, частота больших кровотечений была на 51% ниже у пациентов, получавших лечение ривароксабаном (1, 1 против 2, 2% на фоне стандартного лечения; p=0, 003) . Таким образом, результаты исследования EINSTEIN-PE показали, что ривароксабан - это эффективная и более безопасная альтернатива НМГ /антагониста витамина К для лечения пациентов с ТГВ и ТЭЛА. Это подтверждают и результаты метаанализа 9 рандомизированных контролированных исследований (более 16 тыс. пациентов), в которых сравнивали эффективность и безопасность новых пероральных антикоагулянтов - ингибиторов фактораХа ривароксабана, апиксабана, прямых ингибиторов тромбина дабигатрана и ксимелагатрана - с варфарином в лечении пациентов с высоким риском ВТЭ. Согласно результатам этого анализа, только применение ривароксабана продемонстрировало значительное снижение частоты кровотечений по сравнению с приемом варфарина в процессе терапии. Остальные антикоагулянты показали сопоставимые с варфарином эффективность и безопасность (B. D. Fox, 2012).
Поскольку ТЭЛА имеет тенденцию к рецидивирующему течению, очень важно проводить специальные профилактические мероприятия, которые помогут предотвратить повторное развитие грозной и тяжелой патологии. Профилактика ТЭЛА проводится у людей, имеющих высокий риск развития патологии. Целесообразно проводить профилактику ТЭЛА у следующих категорий людей:
- старше 40 лет;
- перенесенный инфаркт или инсульт;
- избыточная масса тела;
- операции на органах живота,
- малого таза, ногах и грудной клетки;
- эпизод тромбоза глубоких вен ног или ТЭЛА в прошлом.
Профилактические мероприятия включают в себя следующие необходимые действия:
- УЗДС вен ног;
- тугое бинтование ног;
- сдавление вен голени специальными манжетами;
- терапия антикоагулянтами ( в т. ч. НОАК) ;
- перевязывание крупных вен ног;
- имплантация специальных кава-фильтров разнообразных модификаций (например, Мобин-Уддина, Гринфильда, "тюльпан Гюнтера", "песочные часы" и т. д. ).
Кава-фильтр достаточно сложно установить, но правильное введение надежно профилактирует развитие ТЭЛА. Кава-фильтр, введенный некорректно, повлечет за собой увеличение риска формирования тромбов и последующего развития ТЭЛА. Поэтому проводить операцию по установке кава-фильтра следует только у квалифицированного специалиста в хорошо оборудованном медицинском учреждении.
Таким образом, ТЭЛА представляет собой очень серьезное патологическое состояние, которое может оканчиваться летальным исходом или инвалидизацией. В силу серьезности заболевания, необходимо при наличии малейшего подозрения на ТЭЛА проконсультироваться с врачом или вызвать скорую помощь при тяжелом состоянии. Если был перенесен эпизод ТЭЛА, или имеются факторы риска, настороженность в отношении данной патологии должна быть максимальной.
В нашей клинике накоплен богатый опыт профилактики ТЭЛА, а также лечения пациентов, как с ТГВ, так и с самой ТЭЛА на всех этапах медицинского обеспечения - начиная с амбулаторного и заканчивая стационарным.
Читайте также:
