Путь элонгации и терминации трансляции мРНК при синтезе белка
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Трансляция - это процесс, в результате которого рибосомы считывают генетическую информацию матричных РНК и создают белковый продукт в соответствии с этой информацией.
Специфические молекулы транспортрых РНК (тРНК) служат посредниками между кодом мРНК и конечной белковой последовательностью. В их состав входит последовательность, узнающая код мРНК и соответствующая этому коду аминокислота.
События трансляции разделяют на последующие события: инициацию, элонгацию и терминацию. На стадии инициации рибосома связывает мРНК и первая аминокислота присоединяется к рибосоме. Во время элонгации происходит рост полипептидной цепи. На стадии терминации рибосома отделяется от мРНК и процес трансляции заканчивается. У прокариот и эукариот процессы трансляции схожи, но имеются и существенные различия.
Трансляция происходит в цитоплазме, где находятся рибосомы. В зависимости от дальнейшего преднозначения синтезируемых белков, они могут образовываться либо в цитозоле, либо на поверхности шероховатого эндоплазматического ретикулума.
Полипептидные цепи синтезируются однонаправленно: с амино-конца к карбокси-концу.
При инициации первая и вторая молекулы аминоацил-тРНК спариваются с первыми двумя кодонами мРНК. Далее трансляция продолжается в направлении 5'->3' кодон за кодоном до тех пор, пока не достигнет стоп-сигнала, расположенного сразу же за кодоном, детерминирующим С-концевую аминокислоту.
К сожалению, список литературы отсутствует.
Генетический код
Трансляция у эукариот
Вместо комплементарного РНК-РНК узнавания, в которое вовлечена прединициирующая последовательность Шайна-Дальгарно прокариотических мРНК, эукариотические мРНК узнаются эукариотическими рибосомами по кэпированному 5'-концу с обязательным участием белка, например, eIF-4F инициаторного фактора ( Rhoads, 1988 ). Предполагается, что этот белок участвует в расплавлении вторичных структур 5'- областей мРНК, облегчая их связывание с малыми субчастицами рибосом. В отличие от прокариот, эукариотическая мРНК образует комплексы с белками ( мРНП , или мессенджер-рибонуклеопротеиды, или информосомы ), что обусловливает ее метаболическую стабильность. Вследствие этого у эукариот отсутствует постоянная интенсивная деградация и интенсивный ресинтез мРНК, которые, как правило, моноцистронны и имеют специфически модифицированный (кэпированный) 5'-конец. Все это обусловливает целый ряд особенностей инициации трансляции и ее регуляции у эукариотических организмов. Естественно, что метаболическая стабильность эукариотической мРНК делает регуляцию на уровне трансляции особенно важной в общей картине регуляции биосинтеза белка ( Спирин, 1986 ).
Трансляция у прокариот
Трансляция бактерии E.coli наиболее изучена
Синтез белка происходит на рибонуклеопротеиновом комплексе - рибосоме, в процессе трансляции mRNA. Рибосома состоит из большой и малой субъединиц, которые соединены в области инициации трансляции (translation initiation region -TIR) mRNA во время стадии инициации трансляции. Во время элонгации рибосома скользит вдоль mRNA и синтезирует полипептидную цепь. Элонгация продолжается до тех пор, пока рибосома не достигает стоп-кодона на mRNA - терминация трансляции. После терминации рибосома отделяется от синтезированного полипептида и способна снова повторить цикл трансляции mRNA.
Каждая стадия трансляции имеет свои регуляторные факторы, но у эукариот этих факторов гораздо больше, чем у прокариот.
Инициация
Инициация
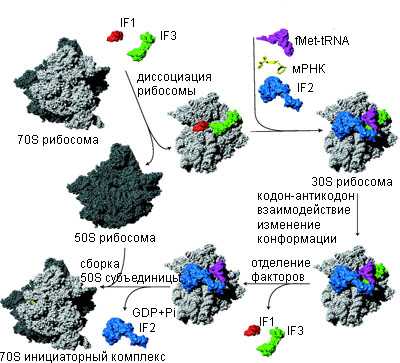
Последовательность инициации трансляции у бактерии. 30S и 50S рибосомные субъединицы показаны светлым и темным серым цветом. [Laursen, et al. 2005]
Рибосомы прокариот инициируют трансляцию на мРНК уже во время транскрипции. Время необходимое для посадки рибосом порядка секунд, хотя это зависит от каждой мРНК. Рибосомы транслируют мРНК со скоростью приблизительно 12 аминокислот в секунду.
В инициации трансляции участвуют: рибосома, аминоацилированная и формилированная тРНК (fMet-tRNAf Met ), мРНК и три белковых инициирующих фактора IF1, IF2 и IF3.
Бактериальная 70S рибосома состоит из большой 50S и малой 30S субъединицы. Имеется три tRNA связывающих сайта аминоацил - aminoacyl (A), пептидил - peptidyl (P), и сайт выхода - exit (E). Присоединение фактора IF3 к 30S рибосомной субъединице обеспечивает распад рибосомы на субъединицы. Фактор инициации IF1 связывается с A-сайтом 30S рибосомной субъединицы и служит инициатором присоединения tRNA к рибосомному P-сайту блокируя A-сайт. IF1 стимулирует активность IF3 и также распад рибосомных субъединиц.
После распада субъединиц, IF2, mRNA и fMet-tRNAfMet соединяются с 30S рибосомной субъединицей. Последовательность Шайно-Дальгарно (Shine-Dalgamo -SD) mRNA взаимодействует с anti-SD последовательностью 16S rRNA и инициирующий кодон присоединяется в Р-сайте рибосомы. Инициирующие факторы, особенно IF3, способствуют этому присоединению.
Инициаторная tRNA устанавливается в P-сайте 30S рибосомной субъединицы в три шага не зависимо от кодона, зависимо от кодона и fMet-tRNAfMet присоединение.
Все три шага обеспечиваются фактором IF2, который взаимодействует с fMet-tRNAf Met на рибосоме. IF3 стабилизирует присоединение fMet-tRNAfMet к рибосомному P-сайту и стабилизирует кодон-антикодон взаимодействие.
30S преинициаторный комплекс состояций из 30S рибосомной субъединицы, трех инициаторных факторов, mRNA в стартовой позиции, где fMet-tRNAf Met связана кодон независимо. Такой относительно нестабильный комплекс подвергается конформационному изменению, что обеспечивает кодон-антикодон взаимодействие и формирует более стабильный 30S инициаторный комплекс. Инициаторные факторы IF1 и IF3 отсоединяются, тогда как IF2 фактор стимулирует взаимодействие с 50S рибосомной субъединицей. После сборки рибосомы IF2 покидает комплекс. Во время этого процесса GTP связанный с IF2 гидролизуется до GDP и Pi. Вновь образованный 70S инициаторный комплекс, содержащий fMet-tRNAf Met как субстрат для пептидилтрансферазного центра 50S рибосомной субъединицы готов к вступлению в фазу элонгации трансляции.
Факторы инициации: IF-1, IF-2, IF-3 - белки временно связывающиеся с рибосомой, необходимые для инициации.
Этапы инициации трансляции
1. Факторы инициации IF-1 и IF-3 связываются с 30S-субчастицей, что обеспечивает ее взаимодействие с IF-2, инициаторной формилметиониновой-тРНК (Fmet-тРНКF Met ) и GTP.
2. При связывании инициаторных белков IF-1 и IF-2 с 30S-субчастицей происходит диссоциация 70S-рибосомы на две субъединицы.
3. Комплекс 30S-субъединицы со всеми факторами инициации и Fmet-тРНКF Met связывается с 5'-концом мРНК вблизи кодона AUG и узнает. AUG-кодон мРНК.
Связывание 30S-субчастицы с мРНК находится под строгим контролем нуклеотидной последовательности, расположенной примерно
за 10 нуклеотидов до 5'-конца инициаторного кодона. Взаимодействию способствует комплементарное спаривание этой богатой пуринами по следовательности из 5-8н, называемой последовательностью Шайна-Дальгарно, с полипиримидиновым участком, находящимся вблизи 3'-конца 16S-pPHK.
4. Формирование полноценного функционального комплекса инициации завершается ассоциацией 50S-субчастицы с преинициаторным комплексом. При ассоциации 70S-рибосомы образуются два активных центра: Р- и А-участки. Fmet-TPHKF Met занимает Р-участок.
5. С образованием функциональной 70S-субчастицы отделяются все три белка инициации.
Элонгация
Факторы элонгации: EF-Tu и EF-Ts - белки связывающиеся с рибосомой, необходимые для элонгации трансляции.
В процессе инициации образуется 70S-рибосома связанная с мРНК, в Р-центре которой находится Fmet-тPHKF Met
Для образования первой пептидной связи необходимо, чтобы
аминоацил-тРНК, соответствующая следующему кодону, заняла А-центр.
Этапы элонгации трансляции:
1. EF-Tu-GTP связывает все аминоацил-тРНК, кроме Fmet-тPHKF Met , и доставляет их к А-центру комплекса 70S-рибосома-мРНКАминоацил-тРНК связывает EF-Tu и GTP. Образовавшийся комплекс (аминоацил-тРНК-[ЕF-Тu-GТР]) доставляет аминоацил-тРНК к А-участку. GTP гидролизуется, и комплекс (EF-Tu-GDP) отделяется от рибосомы. EF-Ts восстанавливает EF-Tu-GDP.
2. Когда оба участка, А и Р, заняты, пептидилтрансферазная активность 50S-субчастицы катализирует перенос группы Fmet с ее тРНК на аминогруппу аминоацил-тРНК, находящейся в А-участке. В результате в А-участке оказывается дипептидил-тРНК, а в Р - свободная тРНК.
3. тРНК освобождает Р-участок, образовавшаяся дипептидил-тРНК переместиться на него, а новый кодон должен быть готов к тому, чтобы занять освободившийся А-участок. Все эти процессы
осуществляются с помощью EF-G при GTP-зависимой транслокации рибосомы.
4. Теперь новый кодон, занявший А-сайт, готов к спариванию с родственной аминоацил-тРНК. Сразу после связывания аминоацил-тРНК с А-
участком высвобождается комплекс EF-Tu-GDP и происходит регенерация функционально активного EF-Tu-GTP. При этом EF-Tu-GDP взаи- модействует с белком EF-Ts, что приводит к отделению GDP и образованию комплекса EF-Tu•EF-Ts. Далее EF-Tu•EF-Ts взаимодействует с GTP, происходит регенерация EF-Tu-GTP и отделение EF-Ts, и оба соединения оказываются готовыми к следую- щему циклу.
Для прочтения следующего кодона и удлинения полипептидной цепи еще на одну аминокислоту вся серия реакций должна повториться.
При образовании каждой пептидной связи расходуется энергия, равная четырем энергетическим эквивалентам (если за один эквивалент принять энергию образования фосфатной связи): два эквивалента АТР потребляются при аминоацилировании тРНК и два эквивалента GTP-
в каждом цикле элонгации.
2. При инициации трансляции IF-2 узнает Fmet-тРНКFMet среди всех других аминоацил-тРНК, a EF-Tu отличает met-тРНКF Met от
Fmet-тРНКM Met при внедрении в А-участок.
3. Факторы элонгации EF-Tu и EF-G то присоединяются, то отделяются от рибосомы в зависимости от того, связаны ли они с GTP или с GDP соответственно.
4. Растущая полипептидная цепь всегда соединена своим карбоксильным концом с тРНК, которая соответствует С-концевой аминокислоте в растущей полипептидной цепи.
5. Пептидилтрансфераза катализирует формирование пептидных связей между карбоксильным концом растущей цепи и аминогруппой аминоацил-тРНК.
Терминация
Факторы терминации:
RF-1 вызывает отделение полипептидной цепи при считывании кодонов UAA и UAG;
RF-2 действует аналогичным образом при считывании UAA и UGA,
EF-3 может облегчить работу двух других факторов.
Этапы терминации трансляции:
1. В А-участке оказывается один из трех терминирующих кодонов - UAG, UAA или UGA. Из-за отсутствия тРНК, отвечающих этим кодонам,полипептидил-тРНК остается связанной с Р-участком.
2. RF-1 и RF-2 катализируют отсоединение полипептидной цепи от тРНК, отделение их обоих от рибосомы, а 70S-рибосомы - от мРНК.
RF-1 узнает в А-участке кодон UAA или UAG; RF-2 включается в том случае, когда в А-участке оказы-вается UAA или UGA;
RF-3 облегчает работу двух других факторов. Если терминирующим кодономявляется UAA, то эффективность процесса терминации оказывается наибольшей, поскольку этот кодон узнают оба фактора - RF-1 и RF-2. Однако, каким бы из стоп-кодонов ни обеспечивалась терминация,ее эффективность зависит от фланкирующих эти кодоны последовательностей в мРНК.
Когда расстояние от рибосомы до сайта инициации достигнет величины 100-200 нуклеотидов, в этом сайте может произойти новая инициация трансляции. Таким образом на одной мРНК
может находится несколько транслирующих рибосом - полирибосомы (рис)
Биосинтез белка. Эпицикл трансляции: инициация, элонгация, терминация
Фаза инициации, или начало синтеза пептида, заключается в объединении двух находящихся до этого порознь в цитоплазме субчастиц рибосомы на определенном участке мРНК и присоединении к ней первой аминоацил-тРНК. Этим задается также рамка считывания информации, заключенной в мРНК.
В молекуле любой мРНК вблизи ее 5'-конца имеется участок, комплементарный рРНК малой субчастицы рибосомы и специфически узнаваемый ею. Рядом с ним располагается инициирующий стартовый кодон АУТ, шифрующий аминокислоту метионин. Малая субчастица рибосомы соединяется с мРНК таким образом, что стартовый кодон АУТ располагается в области, соответствующей П-участку. При этом только инициирующая тРНК, несущая метионин, способна занять место в недостроенном П-участке малой субчастицы и комплементарно соединиться со стартовым кодоном. После описанного события происходит объединение большой и малой субчастиц рибосомы с образованием ее пептидильного и аминоацильного участков.
К концу фазы инициации П-участок занят аминоацил-тРНК, связанной с метионином, тогда как в А-участке рибосомы располагается следующий за стартовым кодон.
Описанные процессы инициации трансляции катализируются особыми белками — факторами инициации, которые подвижно связаны с малой субчастицей рибосомы. По завершении фазы инициации и образования комплекса рибосома — мРНК — инициирующая аминоацил-тРНК эти факторы отделяются от рибосомы.
Фаза элонгации, или удлинения пептида, включает в себя все реакции от момента образования первой пептидной связи до присоединения последней аминокислоты. Она представляет собой циклически повторяющиеся события, при которых происходит специфическое узнавание аминоацил-тРНК очередного кодона, находящегося в А-участке, комплементарное взаимодействие между антикодоном и кодоном.
Благодаря особенностям трехмерной организации тРНК. (см. разд. 3.4.3.1) при соединении ее антикодона с кодоном мРНК. транспортируемая ею аминокислота располагается в А-участке, поблизости от ранее включенной аминокислоты, находящейся в П-участке. Между двумя аминокислотами образуется пептидная связь, катализуемая особыми белками, входящими в состав рибосомы. В результате предыдущая аминокислота теряет связь со своей тРНК и присоединяется к аминоацил-тРНК, расположенной в А-участке. Находящаяся в этот момент в П-участке тРНК высвобождается и уходит в цитоплазму (рис. 3.33).
Перемещение тРНК, нагруженной пептидной цепочкой, из А-участка в П-участок сопровождается продвижением рибосомы по мРНК на шаг, соответствующий одному кодону. Теперь следующий кодон приходит в контакт с А-участком, где он будет специфически «опознан» соответствующей аминоацил-тРНК, которая разместит здесь свою аминокислоту. Такая последовательность событий повторяется до тех пор, пока в А-участок рибосомы не поступит кодон-терминатор, для которого не существует соответствующей тРНК.
Сборка пептидной цепи осуществляется с достаточно большой скоростью, зависящей от температуры. У бактерий при 37 °С она выражается в добавлении к подипептиду от 12 до 17 аминокислот в 1 с. В эукариотических клетках эта скорость ниже и выражается в добавлении двух аминокислот в 1 с.
Фаза терминации, или завершения синтеза полипептида, связана с узнаванием специфическим рибосомным белком одного из терминирующих кодонов (УАА, УАГ или У ГА), когда тот входит в зону А-участка рибосомы. При этом к последней аминокислоте в пептидной цепи присоединяется вода, и ее карбоксильный конец отделяется от тРНК. В результате завершенная пептидная цепь теряет связь с рибосомой, которая распадается на две субчастицы
Синтез белков обеспечивают рибосомы
Трансляция (англ. translation - перевод) - это биосинтез белка на матрице мРНК.
После переноса информации с ДНК на матричную РНК начинается синтез белков. Каждая зрелая мРНК несет информацию только об одной полипептидной цепи. Если клетке необходимы другие белки, то необходимо транскрибировать мРНК с иных участков ДНК.
Биосинтез белков или трансляция происходит на рибосомах, внутриклеточных белоксинтезирующих органеллах, и включает 5 ключевых элементов:
- матрица - матричная РНК,
- растущая цепь - полипептид,
- субстрат для синтеза - 20 протеиногенных аминокислот,
- источник энергии - ГТФ,
- рибосомальные белки, рРНК и белковые факторы.
Выделяют три основных стадии трансляции: инициация, элонгация, терминация.
Для инициации необходимы мРНК, ГТФ, малая и большая субъединицы рибосомы, три белковых фактора инициации (ИФ-1, ИФ-2, ИФ-3), метионин и тРНК для метионина.
В начале этой стадии формируются два тройных комплекса:
- первый комплекс - мРНК + малая субъединица + ИФ-3,
- второй комплекс - метионил-тРНК + ИФ-2 + ГТФ.
После формирования тройные комплексы объединяются с большой субъединицей рибосомы. В этом процессе активно участвуют белковые факторы инициации, источником энергии служит ГТФ. После сборки комплекса инициирующая метионил-тРНК связывается с первым кодоном АУГ матричной РНК и располагается в П-центре (пептидильный центр) большой субъединицы. А-центр (аминоацильный центр) остается свободным, он будет задействован на стадии элонгации для связывания аминоацил-тРНК.
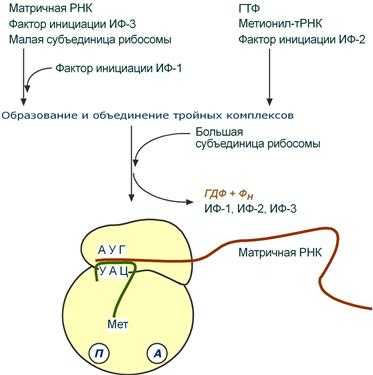
События стадии инициации
После присоединения большой субъединицы начинается стадия элонгации.
Для этой стадии необходимы все 20 аминокислот, тРНК для всех аминокислот, белковые факторы элонгации, ГТФ. Удлинение цепи происходит со скоростью примерно 20 аминокислот в секунду.
Элонгация представляет собой циклический процесс. Первый цикл (и следующие циклы) элонгации включает три шага:
- Присоединение аминоацил-тРНК (еще второй) к кодону мРНК (еще второму), аминокислота при этом встраивается в А-центр рибосомы. Источником энергии служит ГТФ.
- Фермент пептидилтрансфераза осуществляет перенос метионина с метионил-тРНК (в П-центре) на вторую аминоацил-тРНК (в А-центре) с образованием пептидной связи между метионином и второй аминокислотой. При этом уже активированная СООН-группа метионина связывается со свободной NH2-группой второй аминокислоты. Здесь источником энергии служит макроэргическая связь между аминокислотой и тРНК.
- Фермент транслоказа перемещает мРНК относительно рибосомы таким образом, что первый кодон АУГ оказывается вне рибосомы, второй кодон (на рисунке ) становится напротив П-центра, напротив А-центра оказывается третий кодон (на рисунке ). Для этих процессов необходима затрата энергии ГТФ. Так как вместе с мРНК перемещаются закрепленные на ней тРНК, то инициирующая первая тРНК выходит из рибосомы, вторая тРНК с дипептидом помещается в П-центр.
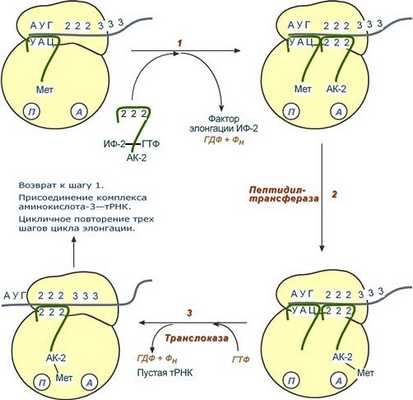
Последовательность событий стадии элонгации
Второе повторение цикла - начинается с присоединения третьей аминоацил-тРНК к третьему кодону мРНК, аминокислота-3 становится в А-центр. Далее трансферазная реакции повторяется и образуется трипептид, занимающий А-центр, после чего он смещается в П-центр в транслоказной реакции..
В пустой А-центр входит четвертая аминоацил-тРНК и начинается третий цикл элонгации:
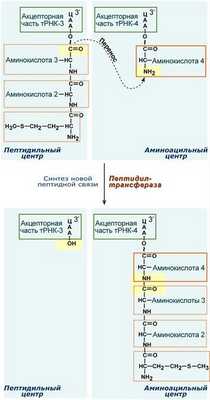
Образование пептидной связи при встраивании четвертой аминокислоты в пептид.
Субъединицы рибосомы, большая часть транспортных РНК и матричная РНК не показаны.
Цикл элонгации (реакции 1,2,3) повторяется столько раз, сколько аминокислот необходимо включить в полипептидную цепь.
Синтез белка продолжается до тех пор, пока рибосома не достигнет на мРНК особых терминирующих кодонов - стоп-кодонов УАА, УАГ, УГА. Данные триплеты не кодируют ни одной из аминокислот, их также называют нонсенс-кодоны . При вхождении этих кодонов внутрь рибосомы происходит активация белковых факторов терминации, которые последовательно катализируют:
- Гидролитическое отщепление полипептида от конечной тРНК.
- Отделение от П-центра последней, уже пустой, тРНК.
- Диссоциацию рибосомы.
Источником энергии для завершения трансляции является ГТФ.
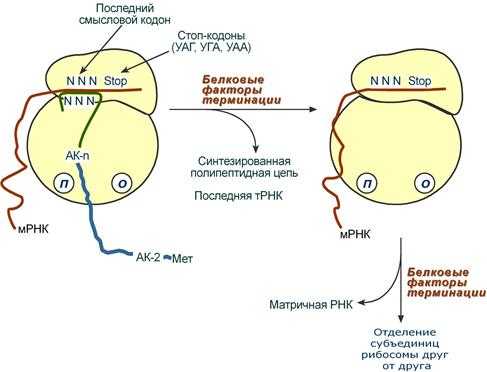
Реакции стадии терминации
Полирибосомы
По причине того, что продолжительность жизни матричной РНК невелика, перед клеткой стоит задача использовать ее максимально эффективно, т.е. получить максимальное количество "белковых копий". Для достижения этой цели на каждой мРНК может располагаться не одна, а несколько рибосом, встающих последовательно друг за другом и синтезирующих пептидные цепи. Такие образования называются полирибосомы.
Этапы трансляции
Трансляция - процесс перевода генетической информации с последовательности нуклеотидов мРНК в последовательность аминокислот в молекуле полипептида. Трансляция осуществляется согласно правилам генетического кода, который имеет следующие особенности:
1. Код - триплетный, т. е. одну аминокислоту определяет три нуклеотида.
2. Код - однозначный (специфичный): каждый кодон обозначает только одну аминокислоту.
3. Код - непрерывный, т. е. отсутствуют сигналы, показывающие конец одного кодона и начало следующего.
4. Код - вырожденный, т. е. одной аминокислоте может соответствовать более одного кодона. Только две аминокислоты - метионин и триптофан - имеют по одному кодону. Лейцину и серину соответствует 6 кодонов, глицину и аланину - по 4 и т. д. Если аминокислота кодируется несколькими кодонами, то в большинстве случаев они различаются по третьей букве, т. е. по нуклеотиду на 3′-конце. Таким образом, специфичность каждого кодона определяется главным образом его первыми двумя нуклеотидами.
5. Код не перекрывается, т. е. один нуклеотид не может одновременно входить в два соседних триплета.
6. Генетический код содержит триплеты, обозначающие начало и окончание синтеза белка. АУГ - инициирующий кодон (кодирует метионин). УАА, УАГ, УГА - терминирующие кодоны, которые не кодируют ни одну из известных аминокислот и сигнализируют об окончании синтеза белка.
7. Генетический код универсален, т. е. одинаков у животных, растений, многих бактерий.
Подготовительные стадии трансляции включают:
- присоединение аминокислот к тРНК.
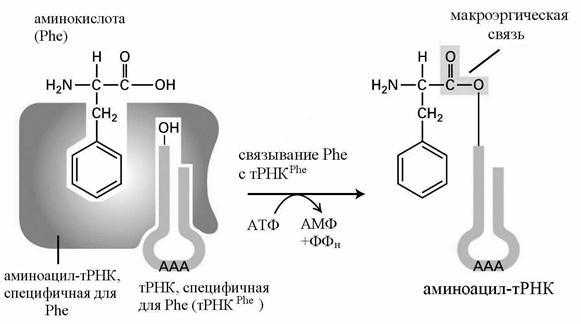
Обе стадии осуществляются с помощью фермента - аминоацил-тРНК-синтетазы (АРС-азы, кодазы). Существует 20 видов таких ферментов - по числу аминокислот. В каждом случае фермент имеет два центра узнавания - для аминокислоты и тРНК (рис. 35).
Рис. 35. Связывание аминокислоты (фенилаланина - Phe) с тРНК
В активном центре фермента аминокислота связывается с АТФ, лишь затем переносится на тРНК. Образование макроэргической связи между аминокислотой и тРНК называется аминоацилированием, а образовавшийся комплекс - аминоацил-тРНК (аа-тРНК). Каждая тРНК может переносить к месту синтеза белка только одну из аминокислот. Для большей части аминокислот имеется несколько тРНК, которые называются изоакцепторными и обозначаются соответственно тРНК1 Phe , тРНК2 Phe и т. д.
Собственно процесс трансляции включает три фазы:
Инициация трансляции - начало синтеза полипептидной цепи, заключается в сборке белоксинтезирующей системы (активной рибосомы).
Функциональные центры рибосом.
Каждая рибосома состоит из двух субчастиц: большой и малой. Форма субчастиц, их контактирующих поверхностей, достаточно сложная (рис. 36). На контактирующих поверхностях большой и малой субчастиц в небольших углублениях находятся центры связывания всех компонентов белоксинтезирующей системы (мРНК, пептидил-тРНК, очередная аминоацил-тРНК), а также центры, катализирующие образование пептидной связи и постепенное перемещение рибосомы относительно мРНК.
Рис. 36. Модель рибосомы Escherichia coli (Васильев В.Д., Институт белка РАН):
слева - перекрывающаяся проекция: малая (30S) субчастица обращена к зрителю
и закрывает собой часть большой (50S) субчастицы; справа - боковая проекция:
к зрителю обращен боковой палочкообразный выступ большой (50S) субчастицы,
а малая (30S) субчастица расположена вверху
Функциональные центры рибосом (рис. 37):
1. Центр связывания мРНК (М-центр). Образован участком 18S-рРНК, который комплементарен на протяжении 5-9 нуклеотидов 5′-нетранслируемому фрагменту мРНК. Расположен на малой субчастице рибосомы.
2. Пептидильный центр (П-центр). В начале процесса трансляции с пептидильным центром связывается инициирующая аа-тРНК. На последующих стадиях трансляции в пептидильном центре находится пептидил-тРНК, содержащая уже синтезированную часть пептидной цепи.
3. Аминоацильный центр (А-центр) - место связывания очередной аа-тРНК. Аминоацильный и пептидильный центры расположены как на большой, так и на малой субчастицах рибосомы.
4. Каталитический (пептидилтрансферазный) центр (К-центр). Катализирует перенос пептидила из состава пептидил-тРНК на поступившую в амино-ацильный центр очередную аа-тРНК. Расположен на большой субчастице рибосомы.
Инициация трансляции у прокариот начинается со связывания мРНК в области 5 - нетранслируемого участка с малой субъединицей рибосомы. Инициирующий кодон (АУГ) оказывается на уровне пептидильного центра будущей рибосомы. Далее за счет комплементарного взаимодействия с этим кодоном происходит связывание инициирующей аа-тРНК. У прокариот инициирующей аа-тРНК является формилметиониновая аа-тРНК - fМet-тРНКi fMet
(рис. 38). Блокирование аминогруппы метионина формильным остатком препятствует включению такой аминокислоты во внутренние участки цепи, но в то же время позволяет fМet-тРНКi fMet связываться с инициирующим кодоном мРНК (АУГ). Инициирующая аа-тРНК, взаимодействуя с пептидильным центром большой субъединицы, вызывает связывание последней.
У прокариот инициация осуществляется при участии трех специфических белков - факторов инициации (IF - Initiation Factors). IF-3, присоединяясь к малой субчастице рибосомы, препятствует преждевременному связыванию большой субчастицы и, с другой стороны, способствует связыванию мРНК. IF-2 участвует в связывании инициирующей аа-тРНК. Вероятно, этот фактор образует комплекс с аа-тРНК еще вне рибосомы, причем в состав комплекса входит ГТФ. В результате образуется так называемый инициаторный комплекс, состоящий из малой субчастицы рибосомы, мРНК, инициаторной аминоацил-тРНК и факторов инициации (рис. 39). Большая субчастица при ассоциации с малой субчастицей вызывает гидролиз ГТФ (до ГДФ и Фн) и одновременно вытесняет все факторы инициации, включая IF-3. В итоге инициации трансляции образуется полная 70S (у прокариот) рибосома с пептидильнымучастком, занятым инициаторной формилметионил-тРНК, и со свободным аминоацильнымучастком.
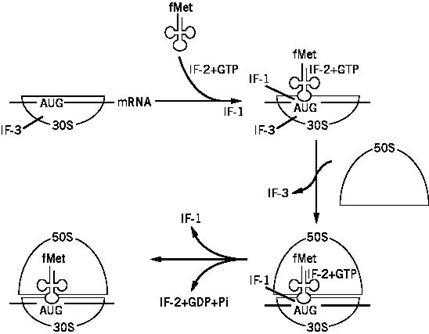
Рис. 39. Инициация трансляции у прокариот
Элонгация трансляции - основной и самый продолжительный этап белкового синтеза, в ходе которого происходит удлинение полипептидной цепи за счет последовательного присоединения аминокислот. Начинается с момента образования первой пептидной связи и заканчивается после включения в полипептидную цепь последней аминокислоты.
Элонгация у бактерий осуществляется при участии трех белковых факторов (EF-Tu, EF-Ts, EF-G) и имеет циклический характер.
Цикл элонгации включает 3 стадии:
1. Связывание аа-тРНК с аминоацильным центром рибосомы. На этой стадии со свободным А-центром рибосомы связывается очередная аа-тРНК - та, чей антикодон комплементарен кодону мРНК, находящемуся в А-центре. Поступив в А-центр, аа-тРНК закрепляется в нем в комплексе с белковым фактором EF-Tu (EF - Elongation Factor) и ГТФ. При участии фактора EF-Тu осуществляется гидролиз ГТФ до ГДФ и Фн, а выделяющаяся энергия расходуется на сближение двух аминокислотных остатков. Комплекс EF-Tu·ГДФ при этом покидает рибосому и регенерируется с участием фактора EF-Ts, так что фактор EF-Tu вновь оказывается связанным с молекулой ГТФ (рис. 40).
Рис. 40. Этап элонгации в синтезе белка у прокариот
2. Образование пептидной связи. В рибосоме после первой стадии цикла находятся пептидил-тРНК (в П-центре) и аа-тРНК (в А-центре). При этом их акцепторные петли и связанные с ними аминокислотные остатки располагаются в каталитическом (К-) центре. Последний и осуществляет пептидилтрансферазную реакцию: переносит пептидил (или инициирующую аминокислоту - формилметионин у прокариот) на аминокислоту поступившей аа-тРНК. Прежняя тРНК пептидила становится свободной (рис. 40).
В ходе пептидилтрасферазной реакции карбоксильная группа пептидила образует пептидную связь с аминогруппой очередной аминокислоты (рис. 41). Таким образом, рост пептидной цепи при трансляции происходит в направлении от N- к С-концу.
Рис. 41. Пептидилтрансферазная реакция
3. Транслокация - перемещение пептидил-тРНК из А-центра в П-центр в результате передвижения рибосомы по мРНК на один кодон. Свободная тРНК вытесняется из рибосомы, и одновременно освобождается А-центр, необходимый для связывания следующей аа-тРНК. Транслокация идет с участием белкового фактора EF-G (у бактерий) и сопровождается гидролизом одной молекулы ГТФ.
Таким образом, удлинение пептидной цепи на один аминокислотный остаток требует расхода двух молекул ГТФ (одна идет на связывание аа-тРНК, вторая - на траслокацию). Многократное повторение циклов элонгации приводит к включению в строящуюся пептидную цепь аминокислотных остатков в соответствии с последовательностью кодонов в мРНК.
Терминация трансляции . Сигналом об окончании трансляции служит появление в рибосоме одного из терминирующих кодонов мРНК: УАА, УАГ или УГА. С терминирующим кодоном, находящимся в А-центре, взаимодействуют особые белки - факторы терминации, или рилизинг-факторы (от англ. relеase - освобождать). У бактерий в терминации трансляции участвуют три белковых фактора: RF-1, RF-2 и RF-3. Фактор RF-1 узнает кодоны УАА и УАГ, а фактор RF-2 - кодоны УАА и УГА. Фактор RF-3 выполняет вспомогательную роль, стимулируя работу RF-1 и RF-2. При поступлении в рибосому одного из терминирующих кодонов с ним немедленно связывается соответствующий RF-фактор и тем самым блокирует присоединение аа-тРНК. Присоединение факторов терминации стимулирует гидролизную активность пептидилтрасферазного (каталитического) центра, в результате чего связь полипептида с тРНК гидролизуется. Синтезированный белок отделяется от рибосомы, одновременно отделяются тРНК и мРНК, а рибосома диссоцирует на субчастицы (рис. 42).
В терминации трансляции принимает участие молекула ГТФ, которая, вероятно, служит аллостерическим регулятором активности белковых факторов терминации.
Новосинтезированные РНК еще неактивны
Сразу после синтеза первичные транскрипты РНК по разным причинам еще не имеют активности, являются "незрелыми" и в дальнейшем претерпевают ряд изменений, которые называются процессинг . У эукариот процессингу подвергаются все виды пре-РНК, у прокариот - только предшественники рРНК и тРНК.
Процессинг предшественника матричной РНК
При транскрипции участков ДНК, несущих информацию о белках, образуются гетерогенные ядерные РНК, по размеру намного превосходящие мРНК. Дело в том, что из-за мозаичной структуры генов эти гетерогенные РНК включают в себя информативные ( экзоны ) и неинформативные ( интроны ) участки.
1. Сплайсинг (англ. splice - склеивать встык) - особый процесс, в котором при участии малых ядерных РНК происходит удаление интронов и сохранение экзонов.
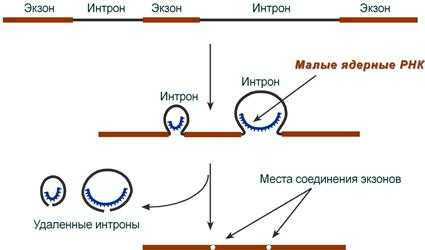
Последовательность событий сплайсинга
2. Кэпирование (англ. cap - шапка) - происходит еще во время транскрипции. Процесс состоит в присоединении к 5'-трифосфату концевого нуклеотида пре-мРНК 5'-углерода N 7 -метил-гуанозина.
"Кэп" необходим для защиты молекулы РНК от экзонуклеаз, работающих с 5'-конца, а также для связывания мРНК с рибосомой и для начала трансляции.
3. Полиаденилирование - при помощи полиаденилат-полимеразы с использованием молекул АТФ происходит присоединение к 3'-концу РНК от 100 до 200 адениловых нуклеотидов, формирующих полиадениловый фрагмент - поли(А)-хвост. Поли(А)-хвост необходим для защиты молекулы РНК от экзонуклеаз, работающих с 3'-конца.
Схематичное представление матричной РНК после процессинга
Процессинг предшественника рибосомальной РНК
Предшественники рРНК являются более крупными молекулами по сравнению со зрелыми рРНК. Их созревание сводится к разрезанию прерибосомной РНК на более мелкие формы, которые уже непосредственно участвуют в формировании рибосомы. У эукариот существуют четыре типа рРНК - 5S-, 5,8S-, 18S- и 28S-рРНК . При этом 5S-рРНК синтезируется отдельно, а большая прерибосомная 45S-РНК расщепляется специфичными нуклеазами с образованием 5,8S-рРНК, 18S-рРНК и 28S-рРНК.
У прокариот молекулы рибосомальной РНК совсем иные по своим свойствам (5S-, 16S-, 23S-рРНК), что является основой изобретения и использования ряда антибиотиков в медицине.
Процессинг предшественника транспортной РНК
1. Модификация нуклеотидов в молекуле путем дезаминирования, метилирования, восстановления.
Например, образование псевдоуридина и дигидроуридина.
Строение модифицированных уридиловых нуклеотидов
2. Формирование антикодоновой петли происходит путем сплайсинга (вернуться вверх) и удаления интрона в средней части пре-тРНК.
3. Формирование на 3'-конце последовательности ЦЦА. Для этого у одних пре-тРНК с 3'-конца удаляются лишние нуклеотиды до "обнажения" триплета ЦЦА, у других идет присоединение этой последовательности.
Читайте также:
