Регуляторная функция ГТФ-связывающих белков
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
Синтез и секреция гормонов регулируются нервной системой либо непосредственно, либо через выделение других гормонов или гуморальных факторов. Роль «эндокринного мозга», регулирующего деятельность периферических желез внутренней секреции, в настоящее время отводят особой «гипофизиотропной» области гипоталамуса. Именно здесь многочисленные и разнообразные нервные сигналы чаще всего трансформируются в гуморальные. В гипоталамусе концентрируются нейроны, выделяющие в ответ на приходящие извне импульсы или нейромедиаторы особые рилизинг-гормоны в кровь портальной системы гипофиза. Эти рилизинг-гормоны действуют на специфические клеточные популяции передней доли гипофиза, стимулируя или тормозя выделение гипофизарных гормонов.
Важнейшую роль в регуляции гормональной секреции играет механизм обратной связи, заключающийся в том, что при избыточном содержании данного гормона в крови тормозится секреция его физиологических стимуляторов, а при его недостатке она усиливается. Частным проявлением механизма обратной связи является регуляция выделения гормона изменением самого систематизируемого параметра. Например, повышение уровня сахара в крови усиливает секрецию инсулина, который снижает содержание сахара. Выделение многих гормонов подчиняется определенным ритмам (суточным, сезонным, возрастным) или связано с некоторыми физиологическими состояниями (беременность, лактация, адаптация к новым условиям среды).
Механизм действия гормонов зависит от того, могут ли они проникнуть через плазматическую мембрану. Так, гормоны белковой, пептидной природы, а также катехоламины (т. е. гидрофильные гормоны) не могут проходить через мембрану; они вступают во взаимодействие с рецепторами, расположенными на ее поверхности, и тем самым генерируют сигнал, который регулирует различные клеточные функции (обычно путем изменения активности ферментов (мембранный механизм циторецепции)). Воздействие гормонов на внутриклеточные процессы обмена при этом опосредуется вторичными посредниками (мессенджерами).
Липофильные гормоны (стероидные и тиреоидные гормоны) диффундируют через плазматическую мембрану и в цитоплазме связываются со специфическими белками-рецепторами. Основной эффект этих гормонов проявляется на уровне транскрипции генов и синтеза соответствующих мРНК. В результате происходит изменение содержания определенных белков, что сказывается на активности тех или иных процессов метаболизма (цитозольный механизм циторе-цепции).
Однако разграничение гормонов на группы с мембранным (гидрофильные гормоны) и цитозолъным механизмами циторецепции (ли-пофильные гормоны) не является абсолютным. В 80-х гг. XX в. было установлено, что многие белковые гормоны после их взаимодействия с рецепторами на плазматической мембране подвергаются эндоцитозу и оказываются внутри клетки, а далее могут транспортироваться в ядро. Это позволяет им осуществлять не только срочную гормональную регуляцию (иметь «раннюю волну» эффектов), но и хроническую регуляцию (иметь «позднюю волну» эффектов) на уровне транскрипции генов.
Доказан внутриядерный перенос инсулина, люлиберина, хориони-ческого гонадотропина и других белковых гормонов. В «позднюю волну» эффектов белковых гормонов входят, в частности, такие эффекты, как индукция синтеза ключевых белков, морфогенетическое действие гормонов, регуляция пролиферации клеток. У стероидов и тиреоидных гормонов также имеется не только внутриклеточный набор отдаленных эффектов, но и ранние эффекты, связанные с их действием на мембранные рецепторы и мобилизацией внутриклеточных посредников того же типа, что и у белковых гормонов. Так, например, тиреоидиые гормоны через поверхностные рецепторы оказывают активирующее влияние на захват клетками аминокислот и глюкозы.
Существует классификация по месту синтеза гормонов: это гормоны гипоталамуса, гипофиза, щитовидной железы, паращитовид-ных желез, поджелудочной железы, надпочечников, половых желез, эпифиза, тимуса.
20)Основные принципы действия системных гормонов на метаболизм: особенности образования и секреции, транспорта в крови и межклеточной жидкости, дистантность действия, клетки- мишени, характер в/д с рецепторами, уровни регулирующего влияния на тканевые ферменты.
Гормоны- биологически активные соединения, выделяемые железами внутренней секреции в кровь или лимфу и оказывающие влияние на метаболизм клетки. Гормоны осуществляют своё биологическое действие, образуя комплекс со специфическими молекулами - рецепторами . Клетки, содержащие рецепторы к определённому гормону, называются клетками-мишенями для этого гормона. Большинство гормонов взаимодействуют с рецепторами, расположенными на плазматической мембране клеток-мишеней; другие гормоны взаимодействуют с рецепторами, локализованными в цитоплазме и ядре клеток-мишеней. В организме существует несколько уровней регуляции гомеостаза, которые тесно взаимосвязаны и функционируют как единая система.
1. Сигналы из внешней и внутренней среды поступают в центральную нервную систему ( высший уровень регуляции, осуществляет контроль в пределах целого организма). Эти сигналы трансформируются в нервные импульсы, попадающие на нейросекреторные клетки гипоталамуса. В гипоталамусе образуются:
1. либерины (или рилизинг-факторы), стимулирующие секрецию гормонов гипофиза;
2. статины - вещества, угнетающие секрецию этих гормонов.
Либерины и статины по системе портальных капилляров достигают гипофиза, где вырабатываются тропные гормоны . Тропные гормоны действуют на периферические ткани-мишени и стимулируют(знак “+”) образование и секрецию гормонов периферических эндокринных желёз. Гормоны периферических желёз угнетают (знак “-”) образование тропных гормонов, действуя на клетки гипофиза или нейросекреторные клетки гипоталамуса. Кроме того, гормоны, действуя на обмен веществ в тканях, вызывают изменения содержания метаболитов в крови , а те, в свою очередь, влияют (по механизму обратной связи) на секрецию гормонов в периферических железах (или непосредственно, или через гипофиз и гипоталамус).
2. Гипоталамус, гипофиз и периферические железы образуют средний уровень регуляции гомеостаза, обеспечивающий контроль нескольких метаболических путей в пределах одного органа, или ткани, или разных органов.
Гормоны эндокринных желёз могут влиять на обмен веществ:
путём изменения количества ферментного белка;
путём химической модификации ферментного белка с изменением его активности, а также
путём изменения скорости транспорта веществ через биологические мембраны.
3. Внутриклеточные механизмы регуляции представляют собой низший уровень регуляции. Сигналами для изменения состояния клетки служат вещества, образующиеся в самих клетках или поступающие в неё.
Молекулярные механизмы действия гормонов в клетках мишенях. Характеристика рецепторов и действия липофильных гормонов. Рецепторы гидрофильных белково-пептидных гормонов G-белки. Вторичные месенджеры: цАМФ и ГМФ, инозитолтрифосфат и диацилглицерол, ионы Са.
Любой белок-рецептор состоит, минимум из двух доменов (участков), которые обеспечивают выполнение двух функций:
· преобразование и передачу полученного сигнала в клетку.
Рецепторы липофильных гормонов во многом сходны, т. к. принадлежат к одному семейству белков. Молекула рецепторного белка состоит из нескольких доменов, имеющих различные размеры и выполняющие разные функции. На С-концевом участке полипептидной цепи рецептора находится домен узнавания и связывания гормона. На N-концевом участке находится регуляторный доменотвечающий за связывание с другими белками. Центральная часть рецептора включает домен связывания ДНК. В этом домене содержаться повторяющиеся фрагменты, богатые остатками цистеина. Цистеин может координационно связывать ионы цинка и образовывать цинковые кластеры, называемые еще «цинковыми пальцами».
Связывание гормона влечет за собой конформационную перестройку молекулы рецепторного белка, сопряженного с другими белками, диссоциацию с освобождением от белков-ингибиторов, в частности от белка теплового шока (hsp90), и образование димеров, обладающих повышенным сродством к ДНК (DNA).
Ключевой стадией процесса гормональной регуляции является связывание димеров гормон-рецепторного комплекса с двунитевой ДНК. Комплекс связывается с регуляторными участками генов, которые носят название гормон-респонсивные элементы. Это короткие симметричные фрагменты ДНК, которые выполняют функции усилителей транскрипции. Связывание димеров рецептора с ГРЭ ведет к стимуляции, реже — к ингибированию, транскрипции соседних генов. Так, действие гормона в течении нескольких часов приводит к изменению уровня специфических мРНК ключевых белков клетки. Однако скорость белкового синтеза в клетках это относительно медленный процесс, т.к. требует большого количества энергии и пластического материала. Поэтому такие гормоны не могут осуществлять быстрый контроль процессов метаболизма. Основная их функция сводится к регуляции процессов роста, развития и дифференцировки клеток организма.
Гидрофильные гормоны построены из аминокислот, или являются производными аминокислот. Гидрофильные гормоны не способны проходить через липофильную клеточную мембрану, поэтому действуют на клетки-мишени за счет связывания с рецептором на плазматической мембране.
Различают три типа рецепторов:
1) Рецепторы первого типа - это белки, которые имеют одну трансмембранную цепь. Активный центр этого аллостерического фермента (многие являются тирозиновыми протеинкиназами) расположен на внутренней стороне мембраны. При связывании гормона с рецептором происходит димеризация последнего с одновременной активизацией и фосфорилированием тирозина в рецепторе. С фосфотирозином связывается белок-переносчик сигнала, который передает сигнал внутриклеточным протеинкиназам.
2) Ионные каналы.Это мембранные белки, которые при связывании с лигандами оказываются открытыми для ионов Na+, K+или Cl+. Так действуют нейромедиаторы.
3) Рецепторы третьего типа, сопряжены с ГТФ-связывающими белками. Пептидная цепь этих рецепторов включает семь трансмембранных тяжей. Такие рецепторы передают сигнал с помощью ГТФ-связывающих белков (G-белок) на белки-эффекторы. Функция этих белков заключается в изменении концентрации вторичных мессенджеров
Основные компоненты: мембранный белок-рецептор, G-белок, фермент аденилатциклаза, гуанозинтрифосфат, протеинкиназы.
Кроме того, для нормального функционирования аденилатциклазной системы, требуется АТФ.
Схема аденилатциклазной системы представлена на рисунке:
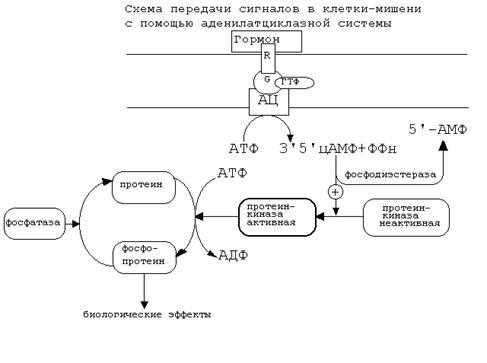
Как видно из рисунка, белок-рецептор, G-белок, рядом с которым располагаются ГТФ и фермент (аденилатциклаза) встроены в мембрану клетки.
До момента действия гормона эти компоненты находятся в диссоциированнном состоянии, а после образования комплекса сигнальной молекулы с белком-рецептором происходят изменения конформации G-белка. В результате одна из субъединиц G-белка приобретает способность связываться с ГТФ.
Комплекс “G-белок-ГТФ” активирует аденилатциклазу. Аденилатциклаза начинает активно превращать молекулы АТФ в ц-АМФ.
ц-АМФ обладает способностью активировать особые ферменты - протеинкиназы, которые катализируют реакции фосфорилирования различных белков с участием АТФ. При этом в состав белковых молекул включаются остатки фосфорной кислоты. Главным результатом этого процесса фосфорилирования является изменение активности фосфорилированного белка. В результате реакции фосфорилирования белки могут становятся функционально активными или неактивными.
Такие процессы будут приводить к изменениям скорости биохимических процессов в клетке-мишени.
Активация аденилатциклазной систтемы длится очень короткое время, потому что G-белок после связывания с аденилатциклазой начинает проявлять ГТФ-азную активность. После гидролиза ГТФ G-белок восстанавливает свою конформацию и перестает активировать аденилатциклазу. В результате прекращается реакция образования цАМФ.
Кроме участников аденилатциклазной системы в некоторых клетках-мишенях имеются белки-рецепторы, связанные с G-белками, которые приводят к торможению аденилатциклазы. При этом комплекс “GTP-G-белок” ингибирует аденилатциклазу.
Когда останавливается образование цАМФ, реакции фосфорилирования в клетке прекращаются не сразу: пока продолжают существовать молекулы цАМФ - будет продолжаться и процесс активации протеинкиназ. Для того, чтобы прекратить действие цАМФ, в клетках существует специальный фермент - фосфодиэстераза, который катализирует реакцию гидролиза 3',5'-цикло-АМФ до АМФ.
Некоторые вещества, обладающие ингибирующим действием на фосфодиэстеразу, (например, алкалоиды кофеин, теофиллин), способствуют сохранению и увеличению концентрации цикло-АМФ в клетке. Под действием этих веществ в организме продолжительность активации аденилатциклазной системы становится больше, то есть усиливается действие гормона.
Кроме аденилат-циклазной или гуанилатциклазной систем существует также механизм передачи информации внутри клетки-мишени с участием ионов кальция и инозитолтрифосфата.
Инозитолтрифосфат -это вещество, которое является производным сложного липида - инозитфосфатида. Оно образуется в результате действия специального фермента - фосфолипазы “С”, который активируется в результате конформационных изменений внутриклеточного домена мембранного белка-рецептора.
Этот фермент гидролизует фосфоэфирную связь в молекуле фосфатидил-инозитол-4,5-бисфосфата и в результате образуются диацилглицерин и инозитолтрифосфат.
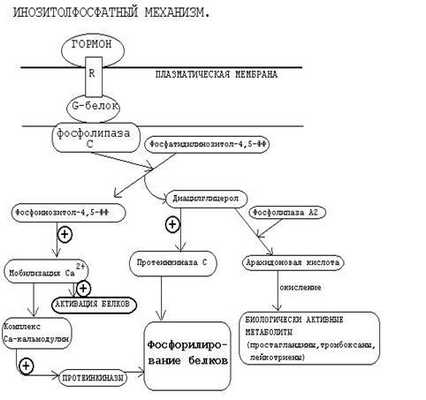
Известно, что образование диацилглицерина и инозитолтрифосфата приводит к увеличению концентрации ионизированного кальция внутри клетки. Это приводит к активации многих кальций-зависимых белков внутри клетки, в том числе активируются различные протеинкиназы. И здесь, как и при активации аденилатциклазной системы, одной из стадий передачи сигнала внутри клетки является фосфорилирование белков, которое в приводит к физиологическому ответу клетки на действие гормона.
В работе фосфоинозитидного механизма передачи сигналов в клетке-мишени принимает участие специальный кальций-связывающий белок - кальмодулин. Это низкомолекулярный белок (17 кДа), на 30% состоящий из отрицательно заряженных аминокислот (Глу, Асп) и поэтому способный активно связывать Са+2. Одна молекула кальмодулина имеет 4 кальций-связывающих участка. После взаимодействия с Са+2 происходят конформационные изменения молекулы кальмодулина и комплекс “Са+2-кальмодулин” становится способным регулировать активность (аллостерически угнетать или активировать) многие ферменты - аденилатциклазу, фосфодиэстеразу, Са+2,Мg+2-АТФазу и различные протеинкиназы.
В разных клетках при воздействии комплекса “Са+2-кальмодулин” на изоферменты одного и того же фермента (например, на аденилатциклазу разного типа) в одних случаях наблюдается активация, а в других - ингибирование реакции образования цАМФ. Такие различные эффекты происходят потому, что аллостерические центры изоферментов могут включать в себя различные радикалы аминокислот и их реакция на действие комплекса Са+2-кальмодулин будет отличаться.
22) Нервно рефлекторный и эндокринный пути регуляции обмена веществ. Гипоталамус- нервный и гуморальный центр регуляции метаболизма. Структура и биологическая роль либеринов и статинов.
Гуморальная регуляция. Некоторые гормоны непосредственно регулируют синтез или распад ферментов и проницаемость клеточных оболочек, изменяя в клетке содержание субстратов, кофакторов и ионный состав.
Нервная регуляция осуществляется различными путями: изменением интенсивности функционирования эндокринных желез; непосредственно активацией ферментов. ЦНС, действуя на клеточные и гуморальные механизмы регуляции, адекватно изменяет трофику клеток.
Роль центра в регуляции обмена веществ и энергии играет гипоталамус. Это обусловлено тем, что в гипоталамусе локализованы нервные ядра и центры, имеющие непосредственное отношение к регуляции голода и насыщения, теплообмена, осморегуляции. В гипоталамусе идентифицированы полисенсорные нейроны, реагирующие сдвигами функциональной активности на изменения концентрации глюкозы, водородных ионов, температуры тела, осмотического давления, т.е. важнейших гомеостатических констант внутренней среды организма. В ядрах гипоталамуса осуществляется анализ состояния внутренней среды организма и формируются управляющие сигналы, которые посредством эфферентных систем приспосабливают ход метаболизма к потребностям организма.
Либерины и статины - рилизинг-гормоны, от концентрации которых зависит деятельность гипоталамуса. Попадая в кровеносное русло человека, либерины и статины начинают распределяться между тканями. Там они продуцируют развитие метаболических процессов на клеточно-мембранном уровне, из-за чего происходят множественные гормональные перестройки. Без либеринов и статинов в организме была бы невозможной регуляторная функция. Либерины и статины - вещества, которые объединены в общую группу рилизинг-факторов. Они являются антагонистами, которые вырабатываются самим организмам. Либерины - стимулируют, а статины - подавляют и выводят гормоны гипофиза из организма.
Известны следующие либерины и статины:
· соматолиберин (стимулирует продукцию гормона роста)
· соматостатин (тормозит продукцию гормона роста)
· гонадолиберин (люлиберин; стимулирует продукцию гонадотропных гормонов - фолликулостимулирующего и лютеинизирующего)
Регуляция каталитической активности ферментов белок-белковыми взаимодействиями.
- вследствие ассоциации или диссоциации протомеров фермента.
Активация ферментов в результате присоединения регуляторных белков.
на примере активации фермента аденилатциклазы, локализованной в плазматической мембране клетки.
· Активный центр аденилатциклазы локализован на внутренней стороне плазматической мембраны. Активированная аденилатциклаза катализирует реакцию образования из АТФ циклического 3',5'-АМФ (цАМФ) - вторичного, внутриклеточного посредника действия гормонов.
· В мембране аденилатциклаза функционирует в комплексе с другими белками:
o рецептором гормона, выступающего во внеклеточную среду и взаимодействующего с гормонами;
o с G-белком, занимающим промежуточное положение между рецептором и ферментом аденилатциклазой. G-белок - олиго-мерный белок, состоящий из 3 субъединиц - α, β, γ. α-субъединица имеет центр связывания и расщепления ГТФ. Поэтому этот белок называется ГТФ-связывающим белком, или G-белком;
o в результате связывания гормона с рецептором происходит изменение конформации G-белка, уменьшение его сродства к молекуле ГДФ, с которой он связан в отсутствие гормонального сигнала, и увеличение сродства к ГТФ. Присоединение ГТФ вызывает конформационные изменения в G-белке и диссоциацию его на субъединицы: субъединицу α, связанную с ГТФ (α-ГТФ), димер βγ;
o α-ГТФ имеет высокое сродство к аденилатциклазе, его присоединение приводит к активации последней, поэтому α-ГТФ - регуляторный белок, а данный механизм активации аденилатциклазы называют активацией ферментов в результате присоединения регуляторных белков.
Молекулярная регуляция метаболизма и клеточного цикла

(материал из PDB_ G PROTEIN HETEROTRIMER GI_ALPHA_1 BETA_1 GAMMA_2 WITH GDP BOUND_Wall, M.A., Coleman, D.E., Lee, E., Iniguez-Lluhi, J.A., Posner, B.A., Gilman, A.G., Sprang, S.R. (1995) Cell 83 : 1047-1058 )
В клетках существует 2 типа ГТФаз (GTPaз), и оба типа участвуют в контролировании процессов молекулярной сигнализации.
Первый тип - тримерные белки, имеют три субъединицы (а, β и γ).
Второй тип - мономерные белки, сотоящие из одного полипептида
G-белки
Тримерные ГТФазы — это крупное семейство белков, называемых обычно G-белками. Они участвуют в переносе сигналов с наружной стороны клетки внутрь. Каждая тримерная субъединица участвует в переносе различных сигналов к целевым молекулам в клетке.
Мономерные ГТФазы
На сегодняшний день выявлено пять подсемейств, они перечислены в таблице 1.
Каждое подсемейство мономерных ГТФaз включает множество белков, наиболее значимые из них — Ran и ARF; эти молекулы найдены на различных субклеточных уровнях.
Мономерные ГТФазы также функционируют как молекулярные переключатели; их конформация изменяется в зависимости от того, находятся ли они в ГТФ- или ГДФ-связанном состоянии. Как часть переключателя функционируют также два вспомогательных белка: ГТФ-активирующий белок и ГТФ-высвобождающий белок.
Регуляторная функция белков
К белкам с регуляторной функцией можно отнести также белки-рецепторы. Мембранные белки — рецепторы передают сигнал с поверхности клетки внутрь, преобразовывая его. Они регулируют функции клеток за счет связывания с лигандом, который «сел» на этот рецептор снаружи клетки; в результате активируется другой белок внутри клетки.
Большинство гормонов действуют на клетку, только если на ее мембране есть определенный рецептор — другой белок или гликопротеид. Например, β2- адренорецептор находится на мембране клеток печени. При стрессе молекула адреналина связывается с β2- адренорецептором и активирует его. Далее активированный рецептор активирует G-белок , который присоединяет Внутриклеточные регуляторные белки
Белки регулируют процессы, происходщие внутри клеток, при помощи нескольких механизмов:
- взаимодействия с молекулами ДНК (транскрипционные факторы)
- при помощи фосфорилирования (протеинкиназы) или дефосфорилирования (протеинфосфатазы) других белков
- при помощи взаимодействия с рибосомой или молекулами РНК (факторы регуляции трансляции)
- воздействия на процесс удаления интронов (факторы регуляции сплайсинга)
Белки-регуляторы транскрипции
Факторы регуляции трансляции
Трансляция - синтез полипептидных цепей белков по матрице мРНК, выполняемый рибосомами. Регуляция трансляции может осуществляться несколькими способами,в том числе и с помощью белков-репрессоров, которые, связываются с мРНК. Известно много случаев, когда репрессором является белок, который кодируется этой мРНК.в этом случае происходит регуляция по типу обратной связи.(примером этого может служить репрессия синтеза фермента треонил-тРНК-синтетазы). В других случаях репрессором является специальный белок, и его способность связываться с определенными мРНК зависит от присутствия того или иного вещества.
Факторы регуляции сплайсинга
Внутри генов эукариот есть участки, не кодирующие аминокислот. Эти участки называются сплайсингом( сшивание, сращивание).Существвует альтернативный сплайсинг. Он осуществляется с помощью небольших РНК, связанных с белками, которые называются факторами регуляции сплайсинга. В сплайсинге принимают участие белки, обладающие ферментативной активностью. Они придают пре-мРНК нужную конформацию. Для сборки комплекса(сплайслслмы) необходимо потребление энергии в виде расщепляемых молекул АТФ, поэтому в составе этого комлекса есть белки, обладающие АТФ-азной активностью.
Протеинкиназы
Основная статья:Цикл активации G-белка под действием См. также
Ссылки
Литература
| Альфа-спираль | Это незавершённая статья по биохимии. Вы можете помочь проекту, исправив и дополнив её. |
Эта страница использует содержимое раздела Википедии на русском языке. Оригинальная статья находится по адресу: Регуляторная функция белков. Список первоначальных авторов статьи можно посмотреть в истории правок. Эта статья так же, как и статья, размещённая в Википедии, доступна на условиях CC-BY-SA .
G-белки
G-белки - это сигнальные белки, которые являются универсальными посредниками при передаче гормональных сигналов от рецепторов клеточной мембраны к эффекторным белкам , вызывающим конечный клеточный ответ.
Когда семи-доменная рецепторная молекула, локализованная в мембране сенсорной клетки, активируется какими-то изменениями во внешней среде, она претерпевает конформационные изменения. Последние детектируются G-белками, связанными с мембраной, которые, в свою очередь, активируют эффекторные молекулы в мембране. Часто это приводит к выделению вторичных мессенджеров в цитозоль.
G-белки, участвующие в передаче сигнала, являются членами большого надсемейства гуанин-связывающих белков. G- белки - это прецизионные регуляторы, включающие или выключающие активность других молекул.
Примерно 80% первичных мессенджеров (гормоны, нейротрансмиттеры, нейромодуляторы) взаимодействуют со специфическими рецепторами, которые связаны с эффекторами через G-белки.
Два семейства белков - гетеротримерные гуанозиннуклеотид связывающие белки (G-белки и отдаленно родственные им гуанозинтрифосфатазы (GTPase) при связывании GTP могут включаться и активировать последующие компоненты передачи сигнала от поверхности клетки. Малые GTPaзы участвуют в контроле фундаментальных свойств клетки - полярности формы и процессов деления и дифференцировки. G-белки обычно регулируют более специализированные сигналы - продукцию вторичных мессенджеров. И те и другие способны гидролизовать GTP и таким образом выключать сигнал.
G-белки, стимулирующие аденилатциклазу (Gs) или участвующие в фототрансдукции (Gt, трансдуцин) служат субстратами для АДФ- рибозилирования, катализируемого холерным токсином по одному из остатков аргинина, что приводит к блокированию деактивации этих белков. Gs, G-белок, ингибирующий аденилатциклазу (Gi) и G-белок с пока еще неизвестной функцией (Gо) АДФ-рибозилируются коклюшным токсином по остатку цистеина, расположенному у C-конца. Эта модификация препятствует взаимодействию между G-белком и рецепторами. Определена последовательность G-белка крысы (Gx), который оказался нечувствительным к коклюшному токсину.
G-белки это - регуляторные белки, связывающие при активации ГТФ . Лучше всего изучены G-белки, стимулирующие и ингибирующие аденилатциклазу (Gs-белки и Gi-белки соответственно). Бета1-адренорецепторы , бета2-адренорецепторы и D1-рецепторы сопряжены с белком Gs, и поэтому стимуляция этих рецепторов сопровождается активацией аденилатциклазы и повышением внутриклеточной концентрации цАМФ - классического второго (внутриклеточного) посредника. Конечный ответ в разных клетках различен и зависит от того, что представляет собой эффекторные фермент (фермент, ионный канал и пр.). Альфа2-адренорецепторы , М2-холинорецепторы и D2-peцепторы сопряжены с белком Gi, и стимуляция этих рецепторов приводит к снижению активности аденилатциклазы и внутриклеточной концентрации цАМФ. Изменения активности ферментов и других внутриклеточных белков и, соответственно, клеточных функций при этом противоположны тем, что наблюдаются при активации белка Gs. Альфа1-адренорецепторы (как и М1-холинорецепторы), видимо, сопряжены с другим, пока еще мало изученным типом G-белка. Этот белок иногда обозначают Gq. Он активирует фосфолипазу С , катализирующую распад мембранных фосфолипидов, в частности - фосфатидилинозитол-4,5-дифосфата до ИФ3 и ДАГ . Оба эти вещества являются вторыми посредниками ( рис. 70.5 ).
Связывание агониста (гормона, нейромедиатора и др.) с соответствующим рецептором приводит к белок-белковому взаимодействию между рецептором и G-белком и ускоряет диссоциацию ГДФ. В результате образуется короткоживущий комплекс агонист - рецептор - G-белок, не связанный ни с каким нуклеотидом. Связывание с этим комплексом молекулы ГТФ снижает сродство рецептора к G-белку, что приводит к диссоциации комплекса и высвобождению рецептора. Потенциально рецептор может активировать большое количество молекул G-белка, обеспечивая, таким образом, высокий коэффициент усиления внеклеточного сигнала на данном этапе. Активированная альфа-субъединица G-белка (альфа* ГТФ Мg). [ Bourne, ea 1997 ] диссоциирует от бета-гамма-субъединиц и вступает во взаимодействие с соответствующим эффектором, оказывая на него активирующее или ингибирующее воздействие.
Взаимодействие с эффектором, однако, длится до тех пор, пока альфа- субъединица, являющаяся ГТФ-азой, удерживает ГТФ. Так что, очень вскоре присоединенный ГТФ гидролизуется до ГДФ. Когда это происходит, альфа- субъединица снова меняет свою коонформацию и теряет способность активировать эффектор. После этого альфа-ГДФ взаимодействует с бета- гамма-комплексом и снова образует тримерный комплекс, завершая, таким образом, цикл ( рис. 1.9 ).
Предполагают, что комплекс из бета-гамма-субъединиц тоже может (прямо или опосредованно) влиять на эффекторные ферменты. Такими феpментами являются аденилатциклаза(4.6.1.1) [ Gilman A.G.,1987 ], 3',5'-циклонуклеотид-фосфодиэстераза сетчатой оболочки глаза, фосфолипаза C .
G-белки также pегулиpуют pаботу K+ и Ca2+ -ионных каналов [ Stryer L.,1986 ; Casey P.J.,1988 ; Plaffinger P.J.,1985 ]. К G-белкам относятся полипептид Gs, стимулирующий аденилатциклазу и pегулиpующий Ca2+ -ионные каналы [ Yatani A.,1987 ], полипептид Gi, ингибирующий аденилатциклазу [ Gilman A.G.,1987 ], и pегулиpующий K+ -каналы в клетках тканей мозга [ Gilman A.G.,1989 ], Gt, трансдуцин, участвующий в передаче светого сигнала [ Stryer L.,1986 ], Golf, специфичный белок обонятельных ресничек [ Jones D.T.,1989 ] и др. Все G-белки являются гетеротримерами, состоящими из субъединиц альфа, бета и гамма в порядке уменьшения молекулярной массы [ Gilman A.G.,1987 ].
Впоследствии ГТФ, связанный с альфа-субъединицей G-белка, подвергается гидролизу, причем ферментом, катализирующим этот процесс, является сама альфа-субъединица. Это приводит к диссоциации альфа-субъединицы от эффектора и реассоциации комплекса альфаГДФ с бета-гамма-субъединицами. Спонтанная активация G-белка, связанного с ГДФ - весьма маловероятный процесс.
Лимитирующей стадией процесса восстановления исходного состояния G-белка является скорость диссоциации GDP от альфа-субъединицы G-белка. Скорость диссоциации увеличивается при взаимодействии G-белок-GDP с агонист-связанным рецептором [ Branot D.R.,1986 ]. Связывание GTP G-белком приводит, очевидно, к образованию комплекса агонист-рецептор-G-белок. Аналог GTP-CTP-гамма-S и Mg2+ усиливает диссоциацию альфа-субъединицы из тримера G-белка [ Northup J.V.,1983 ]. Однако следует заметить, что каталитическая субъединица аденилатциклазы из мембран мозга быка хроматографически соочищается с альфа- и бета-субъединицами GS-белка [ Marbach J.,1990 ] и вопрос диссоциации альфа-субъединиц из тримера G-белка для активации эффектора требует уточнения.
Содержание
Структура G-белков
G-белки биологических мембран состоят из трех субъединиц: из большой альфа-субъединицы (около 45 килодальтон - кДа), а также меньших бета- и гамма-субъединиц.
Поскольку бета- и гамма- субъединицы G-белков чрезвычайно консервативны, G-белки принято различать по их альфа-субъединицам.
G-белки проявляют значительный полиморфизм. Каждая из форм субъединиц G-белка высокогомологична по структуре, близка по функциям, но отличается молекулярной массой и электрофоретической подвижностью [ Перцева М.Н.,1990 ]. Особенно широк полиморфизм и наиболее изучен для альфаs и альфаi G-белков. Так из мозга человека выделено 11 форм сДНК, ответственных за синтез альфаs субъединиц, четыре вида которых клонированы и, предполагается, что они определяют синтез четырех изоформ альфаs в мозге человека [ Bray P.,1986 ]. Для альфаi найдены, в основном, три изоформы альфаi1, альфаi2, альфаi3. Молекулярные массы изоформы альфаs находятся в пределах 42-55 кДа, а альфаi -39-41 кДа [ Перцева М.Н.,1990 ]. Распределение молекулярных вариантов альфаi носит тканеспецифический характер: альфаi1 представлена, в основном, в мозге, альфаi2 обнаружена в нервной ткани и в клетках крови, альфаi3 представлена в переферических тканях и отсутствует в мозге [ Goldsmith P.,1988 ]. Распределение генов, кодирующих синтез синтез трех изоформ альфаi по тканям примерно совпадает в ряду: человека, бык, крыса, мышь [ Lochrie M.A.,1988 ]. Определение аминокислотной последовательности альфаs и альфаi [ Spiegel A.M.,1987 ; Itoh I.,1988 ] показало, что изоформы альфаs или альфаi различаются в области C- и N- концевой последовательности, связывающихся с рецептором или эффектором. Предполагается, что полиморфизм альфа субъединиц определяется многообразием рецепторов и их подтипов и разнообразием эффекторных систем [ Перцева М.Н.,1990 ; Gilman A.G.,1987 ].
Альфа субъединица
Альфа-субъединица обладает ГТФ-азной активностью, в неактивной (выключенной) форме она связывает молекулу ГДФ на активном сайте. Альфа-субъединица также как и гамма связана с мембраной жирной кислотой с длиной цепи в 14 атомов углерода ( миристоевая кислота ). Такие связи обеспечивают то, что комплекс G-белка удерживается в плоскости мембраны, но в то же время способен легко двигаться в этой плоскости.
Альфа субъединицы Gi кодируются тремя различными структурными генами [ NukadaT.,1986 ; Jones D.T.,1987 ; Itoh I.,1988 ]. Что касается изоформ альфа-субъединиц Gs-белков, то пока неясно, кодируются ли изоформы разными структурными генами или это продукт одного гена с последующим внутренним альтернативным сплайсингом исходного РНК-транскрипта [ Robishaw J.D.,1986 ], или множественность их результат посттрансляционной модификации [ Casey P.J.,1988 ]. В настоящее время известно 9 структурных генов, кодирующих C-белки и 12 продуктов этих генов [ Gilman A.G.,1989 ].
Альфа-субъдиница с присоединенным с ней ГТФ способна взаимодействовать с эффектором в мембране - ферментами, такими, как аденилатциклаза , или, возможно, ионными каналами . Фермент может активироваться или ингибироваться, а ионный канал - открываться или закрываться.
Кроме ГТФ-связывающего мотива, каждая последовательность Gальфа содержит как минимум один центр связывания дивалентных катионов, а также сайты ковалентной модификации бактериальными токсинами, катализирующими NAD-зависимые АДФ-рибозилтрансферазные реакции.
Бета субъединица
Субъединицы бета и гамма связаны между собой, и в физиологических условиях не могут быть диссоциированы. В неактивном состоянии бета-гамма-комплекс непрочно связан с альфа-субъединицей.
Гамма субъединица
Гамма-субъединица связана с цитоплазматическим листком биологической мембраны геранил-гераниловой цепью (20 атомов углерода в цепи) , близкой по структуре к холестерину.
Читайте также:
- Механизм развития японского энцефалита. Клиника японского энцефалита
- Диагностика синовиальной саркомы средостения на рентгене, КТ, МРТ
- Перитонеальный диализ. Показания, противопоказания и техника перитонеального диализа.
- Рак влагалища у беременной
- Исследование физиологических пассивных движений плечевого сустава
