Санитарно-микробиологическое исследование воды. Микрофлора водоемов.
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Исследованию подлежит вода централизованного водоснабжения, колодцев, открытых водоемов, бассейнов, сточные воды.
Отбор проб водопроводной воды. Кран стерилизуют обжиганием с последующим стоком воды в течение 10 мин при полностью открытом кране. Пробу воды забирают в стерильную стеклянную посуду с плотно закрывающимися пробками. Доставка воды производится в контейнерах-холодильниках при температуре 4-10 0 С.
Для оценки санитарно-бактериологического состояния воды используют следующие показатели:
1. определение общего микробного числа (ОМЧ);
2. определение бактерий семейства Enterobacteriaceae и термотолерантных колиформных бактерий;
3. определение спор сульфитредуцирующих клостридий;
4. определение колифагов;
5. определение патогенных бактерий кишечной группы.
Исследование питьевой воды на наличие колифагов, патогенных бактерий кишечной группы проводится по эпидемиологическим показателям. Определение спор сульфитредуцирующих клостридий проводится при оценке эффективности технологий обработки воды.
Определение общего микробного числа (ОМЧ)
Для определения ОМЧ вносят два объема воды по 1 мл в стерильные чашки Петри, в которые выливают по 6-8 мл расплавленного и остуженного до 45 0 С МПА. Содержимое чашки смешивают, оставляют до застывания агара и помещают в термостат на 24 ч. Подсчитывают количество колоний на чашках, вычисляют среднее арифметическое. Результат выражают числом КОЕ (колониеобразующих единиц) в 1 мл воды.
Определение бактерий семейства Enterobacteriaceae
и термотолерантных колиформных бактерий
Термотолерантные колиформные бактерии обладают всеми признаками бактерий семейства Enterobacteriaceae, но они способны ферментировать лактозу до кислоты и газа при температуре 44 0 С в течение 24 ч.
Для выявления бактерий семейства Enterobacteriaceae и термотолерантных колиформных бактерий используют два метода: 1) метод мембранных фильтров, 2) титрационный метод.
Метод мембранных фильтров. Необходимый объем воды - 300 мл -фильтруют через мембранные фильтры по 100 мл. Фильтры переносят на среду Эндо в чашке Петри и инкубируют при 37 0 С 24 ч. Подсчитывают число красных и красных с металлическим блеском колоний.
Идентификацию бактерий проводят по оксидазному тесту и тесту образования кислоты и газа при ферментации лактозы (маннита) для чего исследуют не менее 10 колоний.
Так как, микроорганизмы семейства Enterobacteriaceae и термотолерантные колиформные бактерии не обладают оксидазной активностью, то оксидазоположительные культуры дальше не исследуются.
Все лактозоположительные колонии засевают в две пробирки с одной из лактозных сред и 1 пробирку инкубируют при 37 0 (для культивирования микроорганизмов семейства Enterobacteriaceae), а другую при 44 0 (для культивирования термотолерантных колиформных бактерий).
Учитывают бактерии семейства Enterobacteriaceae - показатели давнего фекального загрязнения воды и термотолерантные колиформные бактерии - показатели свежего фекального загрязнения.
Результаты анализа выражают числом колониеобразующих единиц (КОЕ) бактерий семейства Enterobacteriaceae и термотолерантных колиформных бактерий в 100 мл воды.
Титрационный метод. Принцип метода заключается в посеве установленного объема воды (300 мл - 3 объема по 100 мл - качественный анализ и 333 мл - 3 объема по 100 мл, 3 объема по 10 мл, 3 объема по 1 мл - количественный анализ) в лактозно-пептонную (или глюкозо-пептонную) среду, с последующим пересевом в среду Эндо и идентификацией культуры по морфологическим, культуральным и биохимическим свойствам для определения бактерий семейства Enterobacteriaceae.
Для выявления термотолерантных колиформных бактерий делают посев 2-3 изолированных колоний в пробирки с лактозной средой, нагретой на водяной бане или в термостате до 44 0 С.
При обнаружении бактерий семейства Enterobacteriaceae и термотолерантных колиформных бактерий хотя бы в одном из трех объемов делают заключение - об обнаружении колиформных бактерий в 100 мл воды.
Определение спор сульфитредуцирующих бактерий
Сульфитредуцирующие клостридии, преимущественно C. perfringens - спорообразующие анаэробные палочки, редуцирующие сульфит натрия на железосульфитном агаре при 44 0 в течение 24 ч.
Определение сульфитредуцирующих клостридий проводят двумя методами: 1) метод мембранных фильтров, 2) прямым посевом.
Метод мембранных фильтров. Метод основан на фильтровании воды через мембранные фильтры, выращивании посевов в железо-сульфитном агаре в анаэробных условиях и подсчете черных колоний.
Результаты анализа выражают числом колониеобразующих единиц (КОЕ) спор сульфитредуцирующих клостридий в 20 мл воды.
Метод прямого посева. Производят посев 20 мл воды в пробирки с железо-сульфитным агаром (2 объема по 10 мл в 2 пробирки или 4 объема по 5 мл в 4 пробирки) инкубируют при 44 0 С 24 ч и посчитывают черные колонии. Результаты выражают числом КОЕ в 20 мл воды.
Колифаги - вирусы, лизирующие кишечную палочку и образующие зоны лизиса (бляшки) на бактериальном газоне.
Определение колифагов проводят прямым и титрационным методами.
Прямой метод. Исследуемую воду вносят в 5 стерильных чашек по 20 мл. В 6-ю - контрольную воду не берут. Затем во все чашки заливают расплавленный и остуженный до 45 0 агар с добавлением суточной культуры E.сoli, штамм К2 (1,5 мл смыва E.сoli в концентрации 10 9 на 150 мл агара). Перемешивают, оставляют для застывания и инкубируют при 37 0 С 24 ч.
Учитывают результат подсчетом бляшек в чашках Петри в БОЕ (бляшкообразующих единицах) в 100 мл воды. В контрольной чашке бляшки должны отсутствовать.
Титрационный метод. В основе метода - предварительное подращивание колифагов в среде обогащения в присутствии E.сoli и последующее выявления бляшек колифага на газоне E.сoli.
Определение бактерий родов сальмонелла и шигелла
Для выявления патогенных энтеробактерий исследуемый объем воды (не менее 2-3 мл) засевают в среды обогащения (Мюллера-Кауфмана, магниевая среда) с последующим высевом на плотные селективные и дифференциально-диагностические среды - Плоскирева, Эндо, Левина, висмут-сульфитный агар. Выделенные культуры идентифицируют по морфологическим, тинкториальным, биохимическим и серологическим свойствам.
Оценка воды по микробиологическим показателям
Критерии оценки воды разработаны дифференциально в зависимости от ее категории и назначения. Вода плавательных бассейнов по своим качествам должна соответствовать ГОСТу питьевой воды (табл. 3).
IX Международная студенческая научная конференция Студенческий научный форум - 2017

САНИТАРНО-МИКРОБИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ВОДЫ ОТКРЫТОГО ВОДОЕМА
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Вода - уникальный и незаменимый ресурс существования человека. Однако, с точки зрения многих разделов медицинской науки (физиологии, гигиены, санитарной микробиологии) вода, предназначенная для потребления человеком, представляет собой не единый объект окружающей среды, а совокупность объектов, к каждому из которых предъявляются свои требования в зависимости от сферы ее использования, тем неменее все водные объекты должны быть безопасны в эпидемическом отношении. Актуальность проблемы безопасности воды, предназначенной для потребления человеком, нашла отражение в документах ВОЗ [1,2].
Основные задачи и принципы санитарно-микробиологического исследования воды
Прямое обнаружение возбудителей инфекционных заболеваний в исследуемом водном объекте является важной, но далеко не единственной составляющей санитарно-микробиологического исследования. Обнаружение патогенных микроорганизмов однозначно свидетельствует о санитарном неблагополучии исследуемого объекта, однако не обнаружение не является достаточным и достоверным подтверждением эпидемической безопасности.
Причина заключается в том, что, несмотря на успехи развития современной микробиологии, внедрение в практику иммунологических и молекулярно-биологических методов, непосредственное обнаружение и идентификация патогенных микроорганизмов до сих пор сопряжены с рядом трудностей. Вот только основные из них:
- Количество и разнообразие видов патогенных микроорганизмов, которые потенциально могут присутствовать в том или ином водном объекте огромно, поэтому определять все потенциальные патогены нерационально и попросту невозможно;
- Патогенные микроорганизмы находятся в водном объекте непостоянно, и их количество значительно уступает количеству непатогенных или условно-патогенных микроорганизмов. Поэтому, выделение патогенных микроорганизмов часто бывает невозможным из-за того, что они не выдерживают конкуренции с сапрофитной микрофлорой, даже при использовании современных селективных сред. Кроме того, многие из них находятся в некультивируемом состоянии. Уровни содержания патогенных микроорганизмов, достаточные для их обнаружения, появляются только в период эпидемии.
- Распределение патогенных микроорганизмов в водном объекте неравномерное, и высока вероятность того, что патогенные микроорганизмы могут просто не попасть в отбираемый для контроля образец.
- Все большую роль в структуре заболеваемости населения приобретают заболевания, вызванные условно-патогенными микроорганизмами.10
Вот почему отрицательные результаты определения патогенных микроорганизмов не свидетельствуют с достаточной достоверностью об эпидемической безопасности исследуемого водного объекта. Как правило, исследования на наличие патогенных микроорганизмов за небольшим исключением, проводятся только по эпидемиологическим показаниям. Согласно нормативным документам, из патогенных и условно-патогенных микроорганизмов в водных объектах в зависимости от их типа определяют сальмонеллы, шигеллы, псевдомонады, золотистый стафилококк, энтеровирусы, а также некоторых простейших [3,4].
Повседневный текущий надзор за санитарным состоянием водных объектов и надзор на этапах водоподготовки, в основном, проводится косвенно, путем определения степени загрязнения исследуемого объекта выделениями человека и животных. Логика косвенного контроля очень проста.
1. Основными источниками попадания возбудителей инфекционных заболеваний в воду является больные люди или животные, или носители;
2. Основную массу микроорганизмов, в том числе и патогенных, человек и теплокровные животные выделяют в окружающую среду двумя путями: с испражнениями и со слизью из верхних дыхательных путей;
3. Соответственно, чем выше степень загрязнения водного объекта выделениями человека и животных, тем выше вероятность нахождения в нем патогенных микроорганизмов, и тем опаснее этот объект в эпидемическом отношении.
Инструментом, позволяющим оценить степень биогенного загрязнения, являются санитарные показатели, в основе которых лежит понятие «санитарно-показательный микроорганизм».
Санитарный показатель (СП) - это параметр, отражающий наличие и количество тех или иных СПМ в нормируемом объеме пробы воды, взятой из исследуемого водного объекта.
Целью работы было определение общей микробной загрязненности открытого водоема.
Для определения микробного числа воды делали посевы в чашки Петри с МПА. При исследовании воды открытого водоема (прямом высев) 1 мл исследуемой пробывносили стерильной пипеткой в пустую стерильную чашку Петри, затем наливали расплавленный теплый МПА. Воду и МПА тщательно перемешивали и после застывания среды посев выращивали в термостате при 37°С в течение 24 ч.
Также исследования проводили и методом серийных разведений. Для этого проводили серийные разведения исследуемой пробы воды в 10, 100, 1000 и более раз. В пробирку с 9 мл стерильной воды вносили 1 мл исследуемой воды (разведение 1:10), затем после перемешивания другой пипеткой переносили в аналогичную пробирку 1 мл разведенной воды (разведение 1 : 100) и т. д. По 1 мл полученных разведении воды, начиная с большего, переносили в маркированные стерильные чашки Петри и заливали 10 мл расплавленного и охлажденного до 45°С мясопептонного агара. Осторожно кругообразными движениями перемещали по поверхности стола чашку Петри, перемешивая содержимое. Затем чашки Петри с застывшим загаром переворачивали вверх дном и помещали на сутки в термостат 15.
Через 48 часов на МПА в чашках Петри подсчитали количество выросшие колоний.Общее число микробных колоний, выросших на всей чашке Петри, умножали на степень разведения. Далее определяли среднее арифметическое число колоний - микробное число исследуемой пробы. Результаты представлены в таблице 1,2.
САНИТАРНО-МИКРОБИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ВОДЫ, ВОЗДУХА И ПОЧВЫ
Цель занятия. Ознакомить студентов с основными методами и показателями, необходимыми для санитарно-микробиологической оценки объектов внешней среды.
Оборудование и материалы. Прибор для подсчета колоний, колбы с пробами воды, бактериологические пробирки с 9 мл воды, пробирки с 10 мл расплавленного агара, мерные стерильные пипетки на 2 мл, стерильные чашки Петри, чашки Петри с МПА, чашки Петри с кровяным МПА, навески почвы, стерильная водопроводная вода в колбе — 270 мл, пробирки со средой Кесслера, Вильсона—Блера.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Для оценки санитарно-гигиенического состояния объектов окружающей среды проводят санитарно-бактериологические исследования, цель которых состоит в определении эпизоотологической и эпидемиологической безопасности. Показателем неблагополучия служит выявление патогенных микроорганизмов. Однако прямое их обнаружение связано с большими трудностями, и прежде всего с низкой концентрацией данных микробов, которые в основном не могут размножаться в воде, воздухе и почве. Поэтому в санитарно-микробиологической практике используют косвенные методы, направленные на определение микробной обсемененности объекта и обнаружение в нем так называемых санитарно-показательных бактерий. О бактериальной обсемененности судят по микробному числу — общему количеству микроорганизмов, содержащихся в единице объема или массы (1 мл воды, 1 г почвы, 1 м 3 воздуха).
Содержание санитарно-показательных бактерий определяют по двум показателям: титру и индексу. Титром называют минимальный объем или массу, в которых выявляют данные бактерии, индексом — количество санитарно-показательных бактерий, содержащихся в соответствующем количестве среды.
К санитарно-показательным бактериям относят представителей облигатной микрофлоры организма человека и теплокровных животных, для которых среда обитания — кишечник или воздушно-дыхательные пути. Они характеризуются следующими свойствами: 1) постоянно выделяются с калом или капельками слизи из воздушно-дыхательных путей; 2) не имеют других мест обитания; 3) способны сохраняться в окружающей среде то же время, что и патогенные бактерии, паразитирующие в кишечнике или воздушно-дыхательных путях; 4) не способны интенсивно размножаться вне организма хозяина и изменять свои свойства.
Перечисленные признаки присущи бактериям, признанным санитарно-показательными для различных объектов окружающей среды.
Санитарно-показательные бактерии группы кишечных палочек принадлежат к различным родам семейства энтеробактерий.
Обнаружение кишечной палочки в разных объектах окружающей среды считают наиболее достоверным признаком свежего фекального загрязнения. Наличие в этих же объектах бактерий родов Citrobacter и Enterobacter указывает на относительно давнее фекальное загрязнение.
Присутствие С. perfringens, С. sporogenes и других клостридий в почве свидетельствует о ее фекальном загрязнении, причем как свежем, так и давнем, поскольку эти бактерии образуют споры, что позволяет им длительно переживать в окружающей среде (в частности, в почве).
Обнаружение в объектах окружающей среды Streptococcus faecalis также свидетельствует об их фекальном загрязнении. Резкое увеличение количества этих бактерий в саморазогревающемся навозе и компостах может свидетельствовать о загрязнении почвы разлагающимися отбросами.
Гемолитические стрептококки, будучи облигатными обитателями носоглотки и зева, выделяются с капельками слизи орально-капельным путем. Сроки выживания гемолитических стрептококков в окружающей среде практически не отличаются от сроков, характерных для большинства других возбудителей воздушно-капельных инфекций. Обнаружение гемолитических стрептококков в воздухе помещений указывает на возможное его загрязнение микроорганизмами, содержащимися в зеве, носоглотке, верхних дыхательных путях и вызывающими инфекции, передаваемые воздушно-капельным путем.
Staphylococcus aureus — также факультативный обитатель носоглотки и зева. Его присутствие в воздухе помещений служит показателем орально-капельного загрязнения.
Одновременное обнаружение золотистого стафилококка и гемолитических стрептококков свидетельствует о высокой степени загрязнения воздуха.
Санитарно-микробиологическое исследование воды. Вода — естественная среда обитания микробов, которые в большом количестве поступают из почвы, воздуха, с отбросами, стоками. Особенно много микроорганизмов в открытых водоемах и реках. Кроме сапрофитов в воде могут находиться возбудители инфекций животных и человека.
При контроле санитарного состояния воды исследованию подлежат: вода централизованного водоснабжения, колодцев, открытых водоемов (реки, озера), плавательных бассейнов, сточные жидкости.
Отбор проб воды. Из открытых водоемов пробы воды отбирают с глубины 10. 15 см от поверхности и на расстоянии 10. 15 см от дна. Водопроводную воду набирают в стерильные флаконы объемом 0,5 л с притертой пробкой. Предварительно кран обжигают и спускают воду в течение 10. 15 мин. Хлорированную воду перед исследованием нейтрализуют тиосульфатом натрия из расчета 10 мл на 1л воды. Бактериологическое исследование проб воды следует проводить в течение двух часов после отбора или шести часов при температуре хранения 1. 5°С.
Определение микробного числа воды. Водопроводную воду засевают в количестве 1мл, воду открытых водоемов — по 1,0; 0,1; 0,01 мл. Все пробы вносят в стерильные чашки Петри, после чего их заливают 10. 12 мл расплавленного и охлажденного до 40. 45 °С питательного агара, который тщательно перемешивают с водой. Посевы инкубируют при 37 °С в течение 1. 2сут. Воду из открытых водоемов засевают параллельно на две серии чашек, одну из которых инкубируют при 37 ºС в течение суток, другую — 2 сут при 20 °С. Затем подсчитывают количество выросших на поверхности и в глубине колоний и вычисляют микробное число воды — количество микроорганизмов в 1 мл.
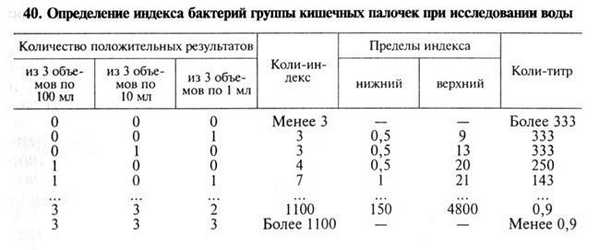
Определение коли-титра и коли-индекса воды. Минимальное количество воды в мл, в котором обнаруживают бактерии группы кишечных палочек (БГКП), называют коли-титром воды, количество БГКП, содержащихся в 1л исследуемой воды, называют кол и-и ндексом воды. Коли-титр и коли-индекс воды определяют титрационным (бродильным) методом или методом мембранных фильтров.
Титрационный метод. В глюкозо-пептонную среду (1%-я пептонная вода, 0,5%-й раствор хлорида натрия, 0,5%-й раствор глюкозы, индикатор Андреде и поплавок) проводят посевы различных объемов воды.
Воду открытых водоемов исследуют в объемах 100; 10; 1 и 0,1 мл. Для анализа водопроводной воды делают посевы трех объемов по 100 мл, трех объемов по 10 мл и трех объемов по 1 мл. Посевы инкубируют при 37 °С в течение суток. О брожении судят по образованию пузырьков газа в поплавке. Из забродивших или помутневших проб делают посевы на среду Эндо. Из выросших колоний готовят мазки, окрашивают по Граму и ставят оксидазный тест, с помощью которого дифференцируют бактерии родов Escherichia, Citrobacter и Enterobacter от грамотрицательных бактерий семейства Pseudomonadaceae и других оксидазоположительных бактерий, обитающих в воде. С этой целью 2. 3 изолированные колонии наносят «штрихом» на фильтровальную бумагу, смоченную диметил-n-фенилендиамином. При отрицательном оксидазном тесте цвет бумаги не изменяется, при положительном она окрашивается в синий цвет в течение 1 мин. Грамотрицательные палочки, не образующие оксидазу, вновь исследуют в бродильном тесте — вносят в полужидкий питательный агар с 0,5 % глюкозы и инкубируют при 37 °С в течение суток. При положительном результате определяют коли-титр и коли-индекс по статистической таблице.
Метод мембранных фильтров. Определенный объем воды пропускают под давлением через мембранный фильтр № 3, предварительно стерилизованный кипячением в дистиллированной воде. Водопроводную воду и воду артезианских скважин фильтруют в объеме 333 мл. Чистую воду открытых водоемов фильтруют в объеме 100, 10, 1 и 0,1 мл, более загрязненную воду перед фильтрованием разводят стерильной водой. Фильтры накладывают на агар Эндо в чашки Петри и после инкубации при 37 °С в течение суток подсчитывают количество выросших красных колоний. Из двух-трех колоний делают мазки, окрашивают их по Граму и ставят оксидазный тест. Грамотрицательные палочки, не образующие оксидазу, принадлежат к БГКП. По существующим нормативам (ГОСТ 2874—82) питьевую воду считают качественной, если ее коли-индекс не более 3, а микробное число — не более 100.
Общепринятым дополнительным показателем фекального загрязнения воды служит количество S.faecalis. Для определения его титра цельную воду и ее 10-кратные разведения засевают в жидкую элективную среду (щелочная полимиксиновая среда). После инкубирования при 37 ºС в течение двух суток, а затем еще через сутки и двое суток делают высевы на плотные элективные среды. Фекальные стрептококки идентифицируют по морфологическим, культуральным и тинкториальным свойствам.
Есть данные о корреляции между содержанием в воде фекальных кишечных палочек и фагами бактерий группы кишечных палочек. Поэтому определение данных фагов служит косвенным показателем возможного присутствия кишечных палочек в исследуемой пробе воды.
Санитарно-микробиологическое исследование воздуха. Микрофлора воздуха зависит от микрофлоры почвы и воды. Воздух — неблагоприятная среда для обитания микроорганизмов из-за отсутствия питательных веществ, действия солнечных лучей, высушивания. Наряду с сапрофитами в воздухе могут находиться патогенные бактерии, споры грибов родов Aspergillus, Mucor и др.
Санитарную оценку воздуха осуществляют по двум показателям: 1) определение микробного числа воздуха; 2) определение количества санитарно-показательных бактерий — гемолитических стрептококков и стафилококков.
Количественные микробиологические методы исследования воздуха основаны на принципах осаждения (седиментации), аспирации или фильтрации.
Седиментационный метод осаждения Коха. Чашки Петри с МПА оставляют открытыми на 5. 10 мин. Для определения санитарно-показательных бактерий берут чашки Петри с кровяным МПА и время экспозиции увеличивают до 40 мин. Чашки выдерживают при 37 °С и комнатной температуре 24 ч и подсчитывают выросшие колонии.
Микробное число воздуха (общее количество бактерий в 1 м3) определяют по формуле Омелянского
Х= а * 100 * 1000 * 5 / (b * 10 * T),
где X— количество микробов в 1 м 3 (1000 л) воздуха; а — количество выросших колоний в чашках; b — площадь чашки; Т— время, в течение которого чашка была открыта; 5 — время по правилу Омелянского; 10 — объем воздуха в литрах. (Правило Омелянского предусматривает, что на поверхности агара в чашке Петри площадью 100 см 3 за 5 мин из воздуха оседает такое количество микробов, которое находится в его 10 л.)
Прямое обнаружение патогенных микробов воздуха проводят только при специальных показаниях.

Аспирационный метод. Более точный количественный способ определения микробного числа воздуха, так как посев микроорганизмов из воздуха производят с помощью приборов. При использовании аппарата Кротова воздух с заданной скоростью засасывается через щель плексигласовой пластины и ударяется о поверхность питательной среды открытой чашки Петри, находящейся на вращающейся подставке, благодаря чему происходит равномерный посев бактерий из воздуха на поверхность МПА (при определении микробного числа) или кровяного МПА (при выделении гемолитических стафилококков и стрептококков). После инкубации в термостате в течение двух суток подсчитывают количество выросших колоний и определяют микробное число воздуха. При исследовании воздуха могут быть использованы и другие приборы (Дьякова, Киктенко, ПАБ-1 — прибор аэрозольный бактериологический и ПОВ-1 — прибор для отбора воздуха). В практику входят ускоренные методы индикации микрофлоры воздуха с помощью мембранных фильтров, каскадных им-пакторов, фильтров Петрякова и др.
Санитарно-микробиологическое исследование почвы. Анализ почвы включает в себя определение микробного числа, коли-тит-ра, перфрингенс-титра и титра термофильных бактерий. По эпидемиологическим признакам проводят определение в почве патогенных микроорганизмов: сальмонелл, шигелл, возбудителей столбняка, ботулизма, злокачественного отека, сибирской язвы. Бактериологический анализ почвы нужен при выборе территории под пастбище, ферму, хозяйственные постройки, детские сады, больницы и др.
В лаборатории почву измельчают, освобождают от камней, осколков стекол, корней растений, просеивают через сито, тщательно перемешивают и отвешивают 30 г. В колбу на 500 мл наливают 270 мл стерильной водопроводной воды и вносят в нее отвешенную пробу почвы, все интенсивно встряхивают 10 мин, не давая отстояться частицам суспензии, готовят серию десятикратных последовательных разведений. Для относительно чистых почв достаточно 4 степени разведения, для загрязненных — 6. 9 разведений. В штатив ставят нумерованные пробирки с 9 мл стерильной воды в каждой. В первую вносят 1 мл суспензии пробы почвы, смешивают, затем 1 мл из первой пробирки вносят во вторую, смешивают, из нее — 1 мл в третью и т. д. В результате в пробирке № 1 получается разведение 1 : 100, № 2 — 1 : 1000 и т.д. Подготовленные таким образом пробы почвы исследуют.
Определение общего микробного числа. Из последних 3. 4 пробирок с разведенной суспензией отдельными стерильными пипетками вносят по 1 мл в стерильные чашки Петри (каждое разведение в отдельности). В каждую чашку добавляют еще по 10. 15 мл расплавленного и охлажденного до 45 ºС МПА. Равномерными осторожными круговыми движениями содержимое чашек перемешивают, оставляют на столе для уплотнения (затвердения) агара. С застывшей средой чашки перевертывают вверх дном, надписывают и помещают в термостат для культивирования на 24. 48 ч при 37 °С. Выросшие колонии подсчитывают в каждой чашке, умножают на степень разведения, полученные числа суммируют и вычисляют среднеарифметическое число, что составит количество микробов, содержащихся в 1 г почвы.
Определение коли-титра, перфрингенс-титра и титра термофильных бактерий почвы. Для определения коли-титра почвы различные разведения почвенной взвеси засевают по 1 мл в пробирки со средой Кесслера (на 1л дистиллированной воды — 10г пептона, 50 мл бычьей желчи — 2,5 г лактозы, 4 мл 1%-го водного раствора генцианвиолета) и инкубируют при 43 ºС в течение 48 ч. В дальнейшем исследования проводят по схеме, применяемой при определении коли-титра воды. Наибольшее разведение почвенной суспензии, в котором отмечена ферментация лактозы (газообразование), соответствует коли-титру почвы. Для определения перфрингенс-титра почвы различные разведения почвенной суспензии по 1 мл засевают в пробирки со стерильным обезжиренным молоком или железосульфитной средой Вильсона— Блера, приготовленной ex tempore. Посевы инкубируют при 43 °С в течение 24. 48 ч, после чего учитывают результаты по свертыванию молока или по образованию черных колоний С. perfringens в агаровом столбике среды Вильсона—Блера. Из колоний делают мазки, окрашивают по Граму, микроскопируют и вычисляют перфрингенс-титр, который соответствует наибольшему разведению почвы, вызвавшему почернение и разрыв среды Вильсона— Блера в первые 12 ч роста.
Для определения титра термофильных бактерий разведения почвенной суспензии по 1 мл вносят в чашки Петри, заливают расплавленным и охлажденным агаром. Посевы инкубируют в течение суток при 60 ºС, а затем подсчитывают количество выросших колоний и пересчитывают на 1 г почвы.
Санитарно-микробиологическую оценку почвы проводят по комплексу показателей, из которых наиболее важный ление степени фекального загрязнения.

ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Определить микробное загрязнение воздуха.
2. Провести исследование воды с целью установления микробного числа и коли-титра.
3. Определить микробное число и перфрингенс-титр почвы.
1. Что такое санитарно-показательные микроорганизмы?
2. Как определяют коли-титр воды?
3. Как определяют микробное число почвы?
4. Как определяют перфрингенс-титр почвы?
5. Какие методы применяют для определения микробного числа воздуха?
6. Что такое санитарно-показательные микробы воздуха и как их определяют?
VII Международная студенческая научная конференция Студенческий научный форум - 2015
"МИКРОБИОЛОГИЧЕСКИЙ МОНИТОРИНГ КАЧЕСТВА ВОДЫ РОДНИКОВ ВЛАДИВОСТОКА"
1 Дальневосточный федеральный университет, Школа естественных наук,Кафедра биохимии,микробиологии и биотехнологий
Введение
Родником, или ключом обозначается небольшой водный поток, бьющий непосредственно из земных недр. Родники, как выходы грунтовых и подземных вод на поверхность, являются уникальными естественными водоёмами. Они имеют большое значение в питании и других поверхностных водоёмов, поддержании водного баланса и сохранении стабильности окружающих их биоценозов.
Объектами исследования стали родники города Владивосток и прилегающих к нему районов. Актуальность данной работы заключается в том, что родниковая вода пользуется огромным спросом среди населения. В настоящее время в результате хозяйственной деятельности человека многие источники подземной воды подвергаются загрязнению. Нередко это загрязнение настолько велико, что вода из них становится непригодной для питья. Изучение родников, их обследование, паспортизация, практические работы по охране - необходимое условие регулирования накопившихся экологических проблем нашего общества.
Цель и задачи исследования:
Цель - провести микробиологический анализ родниковой воды в городе Владивосток и прилегающих к нему районов
Задачи:
Определить численность общего микробного числа, санитарно-показательных микроорганизмов в исследуемых родниках и сравнить полученные результаты со стандартами качества питьевой воды.
Определить существует ли проблема загрязнения данных родников
1.1 Родник
Родником, или ключом обозначается небольшой водный поток, бьющий непосредственно из земных недр.Родники, как выходы грунтовых и подземных вод на поверхность, являются уникальными естественными водоёмами. Они имеют большое значение в питании и других поверхностных водоёмов, поддержании водного баланса и сохранении стабильности окружающих их биоценозов. Некоторые реки и водоёмы порождаются именно такими подземными источниками. Их питание осуществляется за счёт более глубоких водоносных слоёв (свыше 10-20 м), куда загрязняющие вещества с поверхности практически не проникают. Родниковая вода берется в том самом месте, откуда она по ступает из-под земли.
По связи с безнапорными и напорными водами родники подразделяют на нисходящие, связанные с безнапорными водоносными горизонтами, и восходящие, питающиеся напорными водами. По приуроченности к отдельным типам подземных вод родники можно разделить на несколько групп:
Родники, питающиеся верховодкой. Верховодкой называются вре-
менные скопления подземных вод в зоне аэрации над поверхностью отдель-
ных слоев или линз, обладающих слабой проницаемостью [1]. Верховодка
расположена выше уровня грунтовых вод, и родники, питающиеся верховод-
кой, характеризуются резкими колебаниями дебита, температуры и состава,
зависящими от изменения метеорологических условий. Схема родников, пи-
тающихся верховодкой, изображена на рис. 1
Рис. 1 Схема родников, питающихся верховодкой
Родники грунтовых поровых вод. Грунтовые воды - подземные воды первого от поверхности земли постоянно существующего водоносного пласта, расположенного на первом от поверхности водоупоре.
Эта группа родников разделяется на 4 типа в зависимости от характера
выхода грунтовых вод на поверхность земли: эрозионные, контактовые,
экранированные и субаквальные.
Эрозионные (депрессионные) родники (рис. 2) образуются в том
случае, когда эрозионные врезы вскрывают депрессионную поверхность
грунтовых вод, не прорезая весь водоносный горизонт до подстилающего во-
доупора. Формирование подобных выходов весьма характерно для пониже-
ний речных и озерных террас, заболоченных низменностей, а также для мел-
ких эрозионных врезов (оврагов, промоин, балок и др.).
Рис. 2 Схема формирования эрозионных (депрессионных) родников
Контактовые родники (рис. 3) образуются в том случае, когда
эрозионные врезы вскрывают контакт хорошо проницаемых со слабопрони-
цаемыми или водоупорными породами.
Рис. 3 Схема формирования контактовых родников
Экранированные (переливающиеся) родники (рис. 1.4.) форми-
руются в условиях, когда поток грунтовых вод достигает границы распро-
странения слабопроницаемых пород (экрана). Подобные условия разгрузки
характерны для оползневых склонов (делювия), а также участков фациально-
го или тектонического экранирования водоносных пород. Наличие такого эк-
рана приводит к местному подъему уровня грунтовых вод и к формированию
«восходящей» (подпертой) разгрузки грунтовых вод.
Рис. 4 Схема формирования экранированных родников
Субаквальные родники - это сосредоточенные выходы подзем-
ных вод в руслах рек или на дне водоемов ниже уровня поверхностных вод.
Родники карстовых вод. Карстовыми, или трещинно-карстовыми, на-
зываются свободные (гравитационные) подземные воды, связанные с горны-
ми породами, имеющими пустоты, образующиеся в результате растворения
минерального скелета горной породы. Форма и размеры подземных карсто-
вых пустот могут быть резко различными - от мелких пустот (каверн) диа-
метром 2-3 мм до пещер и крупных подземных гротов. Растворимыми (кар-
стующимися) горными породами являются: к а р б о н а т н ы е породы (из-
вестняки, доломиты, мергели и др.); с у л ь ф а т н ы е (гипс, ангидрит) и
х л о р и д н ы е (галит, сильвин). Родники, питающиеся карстовыми водами,
имеют крупные сосредоточенные выходы и наибольшие расходы воды.
Родники межпластовых (артезианских) вод. Межпластовые воды -
это подземные воды, залегающие между водоупорными породами [1]. К меж-
пластовым водам относят артезианские воды (рис. 1.5). Артезианскими назы-
вают напорные подземные воды, самоизливающиеся при вскрытии [1]. Ре-
жим родников, питающихся межпластовыми водами, отличается большой
стабильностью, т.е. весьма небольшими сезонными и годовыми колебаниями
расходов, температур и химического состава воды.
Рис. 5 Схема формирования артезианского потока
По особенностям режима все родники подразделяются на постоянно (родники характеризуются непрерывной деятельностью в течение многих лет), сезонно (родники связаны с водами зоны аэрации, имеют резкие колебания дебита вплоть до полного иссякания, химического состава и температуры воды) и ритмично действующие (гейзеры). Наибольшим постоянством отличаются восходящие источники, питающиеся артезианскими водами. Резкие колебания дебита характерны для источников, питающихся верховодкой. Запасы воды в верховодке малы, а ее качество очень низкое. Родники, питающиеся из верховодки, весьма распространены, их можно повсюду наблюдать весной на склонах местности, по берегам рек, при разработке траншей, котлованов и т.д., они быстро иссякают. Для хозяйственно-питьевого водопользования такие родники, как правило, не пригодны, так как их вода требует дополнительной очистки.( Попов, 2010).
В зависимости от глубины долины и количества, чередующихся водоносных и водоупорных пластов, родники могут выходить на разной высоте по склону местности. Восходящие родники, которые образуются при выходе артезианских вод, истекающих на поверхность по трещинам в твердых породах, наиболее надежны в санитарном отношении. Они питаются из глубинных, хорошо защищенных водоносных пластов. Родниковая вода проходит целую систему естественных фильтров - песок, уголь, глина, по пути она обогащается минеральными солями и приобретает ровную постоянную температуру независимо от времени года и погоды на поверхности (Мухин, 2003).
В отличие от родниковой воды, все другие типы воды требуют очистки с помощью различных технологий (адсорбция, обратный осмос, ионообменные смолы) изменяющих физико-химический состав и природную структуру воды. Это связано с тем, что присутствующие в исходной воде в повышенной концентрации различные вещества требуют значительных преобразований для достижения водой соответствия нормам СанПин для питьевой воды.
Природа у родниковой воды такая же, как у колодезной или артезианской, так как она поступа ет с подземного водоносного горизонта или бассейна. Чтобы соответствовать термину “родниковой”, вода должна поступать на поверхность под влиянием естественных сил.
Санитарно-микробиологический контроль состояния питьевой воды
Микробиологический мониторинг - важный параметр эпидемиологического надзора при решении вопросов гигиены воды и санитарной охраны водоемов. Своевременное обнаружение бактериального загрязнения воды является необходимым условием для правильной организации противоэпидемиологических мероприятий. Целью санитарно-микробиологических исследований воды является ее гигиеническая оценка с точки зрения инфекционной опасности для человека. Бактериологические методы исследования являются прямыми показателями загрязнения воды хозяйственно-фекальными сточными водами и поэтому нашли самое широкое применение в практике санитарной оценки водоемов. Основным критерием эпидемиологической безопасности является отсутствие патогенных микроорганизмов - возбудителей инфекционных заболеваний. Согласно действующим санитарным правилам по охране поверхностных вод от загрязнения, индикаторными микробиологическими показателями являются санитарно-показательные микроорганизмы.
1.2.1 Санитарно-показательные микроорганизмы
Вода представляет собой естественную среду обитания микроорганизмов. Это обусловлено тем, что в ней находятся органические и минеральные вещества - остатки растений, останки позвоночных и беспозвоночных животных. Численность микроорганизмов зависит от ряда факторов: климато-географических, температурных, аэрации, освещенности, скорости течения, глубины, солености, показателей рН водоема и др.
Индикаторными группами микроорганизмов при коммунально-бытовом загрязнении являются санитарно-показательные микроорганизмы (СПМ). СПМ - такие микроорганизмы, которые постоянно обитают в организме человека (животных) и постоянно выделяются во внешнюю среду. К ним относятся бактерии группы кишечных палочек (БГКП), энтерококки, протеи, сульфитредуцирующие клостридии. Чем выше концентрация СПМ, тем больше вероятность присутствия патогенных микроорганизмов.Патогенные микроорганизмы попадают в окружающую среду с выделениями больных людей и животных, носителей соответствующих инфекций, а также с трупами погибших от инфекционных заболеваний. Патогенные микроорганизмы могут передаваться от одного хозяина другому, этот процесс называется инфекцией, а при возникновении патологического процесса - инфекционным заболеванием. Их количество выражают в титрах и индексах. Титр - минимальное количество субстрата (в кубических сантиметрах или граммах), в котором обнаруживают СПМ. Индекс - количество СПМ, которое содержится в 1 литре воды или в 1 грамме другого субстрата. Наиболее вероятное число (НВЧ) - количество СПМ в 1 литре воды или в 1 грамме другого субстрата. Это более точный показатель, так как он имеет доверительные границы, в пределах которых может колебаться с вероятностью 95%.
Бактерии группы кишечной палочки - БГКП
Энтерококки
Протей
Клостридии
К роду Clostridium относятся также сульфитредуцирующие бактерии, которые примерно на 90 % представлены видом Clostridium perfringens. Основным местом естественного пребывания Clostridium perfringens является кишечник человека и травоядных животных, что свидетельствует о санитарной значимости этих микроорганизмов
1.2.2 Гигиенические требования и нормативы качества питьевой воды
Гигиенические требования и нормативы качества питьевой воды определяются требованиями СанПиН 2.1.4.1175-02 « Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников».
Санитарно-микробиологическое исследование воды
Цель занятия. Ознакомить студентовс микрофлорой воды, источниками ее загрязнения патогенной микрофлорой. Студенты должны овладеть различными методами бактериологического исследования воды: определения количества МАФАнМ, коли-титра и коли-индекса воды.
Материальное оснащение. Пробы речной воды и стерильные пробирки для взятия водопроводной воды; чашки Петри, расплавленный МПА в пробирках столбиком, стерильные пипетки на 1 мл, стерильный физраствор по 9 мл, спирт для факела, пинцет, вата.
Для демонстрации - прибор Зейтца, водоструйный вакуумный насос, кипяченые мембранные фильтры №3 в стакане с дистиллированной водой, среда Эндо в чашках Петри; глюкозо-пептонная среда (ГПС) с индикатором и поплавками, разлитая по колбам и пробиркам.
Для демонстрации - 3 колбы и 6 пробирок с ГПС с готовыми посевами воды для определения коли-титра воды методом бродильных проб. Только в первой колбе с посевом 100 мл исследуемой воды должно быть помутнение, изменение цвета индикатора (красный цвет индикатора меняется на желтый) и наличие пузырьков газа в поплавках. Агар Эндо в чашках Петри с 4 мембранными фильтрами после фильтрации воды и наличием красных колоний на поверхности белого фильтра.
Вода является естественной средой обитания многих микроорганизмов. Особую опасность для здоровья человека и животных представляют патогенные бактерии, которые могут быть в воде.
Источниками загрязнения воды патогенными микроорганизмами являются выделения больных животных и людей, трупы животных, сточные воды, особенно предприятий, перерабатывающих сырье животного происхождения и др. Длительность выживания патогенных микробов в воде зависит от их вида, условий окружающей среды и может составлять от нескольких часов до нескольких лет. Так, возбудитель сибирской язвы может сохраняться в воде до 3 лет, возбудитель туберкулеза до 1 года, а бруцеллы - до 100 дней. Имеется группа болезней, для которых характерен водный путь распространения (паратифы, лептоспирозы).
Таким образом, вода может стать источником распространения инфекционных болезней и возникновения эпидемий и эпизоотий.
Для санитарно-микробиологической оценки воды проводят следующие исследования:
1.Определение количества МАФАнМ в 1 мл воды;
2. Определение коли-титра (КТ) и коли-индекса (КИ);
3. Обнаружение в воде патогенных микроорганизмов по эпидпоказаниям.
При санитарно-микробиологических исследованиях пробы воды забирают в объеме не менее 0,5 л. Из открытых водоемов пробу воды отбирают батометром. Батометр - стерильная емкость с пробкой, в металлическом каркасе и свинцовым грузилом. На нужной глубине пробку открывают, подтягивая ее за веревочку. Воду из рек, озер отбирают с глубины 10-15 см от поверхности, а при небольшой глубине на расстоянии 10-15 см от дна.
Для отбора проб водопроводной воды из крана используют стерильные колбы на 0,5 л с ватной пробкой. Кран предварительно стерилизуют обжиганием, горящим спиртовым тампоном, затем в течение 10 мин спускают воду. Пробы воды исследуют тотчас же или не позднее 2 ч с момента взятия. Если это невозможно, то хранят не более 6 ч при 1-5 0 С.
Определение количества МАФАнМ в водопроводной воде. В чашку Петри с соблюдением правил асептики вносят 1 мл водопроводной воды без разведения, заливают 15 мл расплавленного и охлажденного до 45 0 С МПА. Посевы инкубируют в термостате при 30 0 С 72 ч. Количество бактерий в 1мл воды определяют по количеству выросших колоний.
Для определения количества МАФАнМ в воде открытых водоемов исследуемую воду в зависимости от предполагаемого загрязнения предварительно разводят стерильной водой от 1:10 -1 до 1:10 -4 , из двух последних разведений по 1 мл вносят в стерильные чашки (не менее 2 чашек на каждое разведение) и заливают 15 мл расплавленного и охлажденного до 46 0 С МПА. Посевы помещают в термостат при 30 0 С на 72 ч, подсчитывают количество колоний, умножают на степень разведения и определяют количество бактерий в 1 мл воды открытых водоемов.
Определение коли-титра (КТ) и коли-индекса (КИ) воды.
Коли-титром называют наименьший объем воды, в котором обнаружена одна кишечная палочка.
Коли-индекс показывает число кишечных палочек в 1000 мл воды.
Кишечная палочка является постоянным обитателем кишечника человека и животных, следовательно, ее присутствие в питьевой воде является индикатором фекального загрязнения. Чем выше концентрация бактерий группы кишечной палочки, тем вероятнее присутствие таких бактерий, как сальмонеллы, возбудители дизентерии и холеры. Показатели КТ и КИ указывают на санитарное состояние воды, ее пригодность в качестве питьевой. КТ и КИ определяют двумя методами:
1.Метод бродильных проб.
2.Метод мембранных фильтров.
Метод бродильных проб
Этот метод основан на ферментативной активности бактерий группы кишечной палочки (БГКП), которая выражается в способности расщеплять при помощи ферментов лактозу или глюкозу до кислоты и газа. Исследуемая вода засевается в различных объемах в среду накопления - глюкозо-пептонную среду (ГПС) с индикатором и поплавками. При наличии кишечной палочки появляется помутнение, меняется цвет индикатора, и появляются пузырьки газа в поплавках. Из забродивших посевов делают пересев на дифференциально-диагностические среды.
Методика: засевают водопроводную воду в объеме 333 мл, разделенной на 9 порций (три объема по 100 мл, три - по 10 мл и три - по 1 мл). При этом вода в объемах по 100 мл засевается в три колбы с 10 мл концентрированной ГПС, 10 мл - в три пробирки с 1 мл концентрированной среды, а 1 мл воды вносят - в пробирки с 10 мл среды с нормальной концентрацией. Посевы инкубируют в термостате 24 часа при 37 0 С. При отсутствии БГКП в исследуемой воде, изменение цвета индикатора и образование газа не происходит
Рост кишечной палочки сопровождается помутнением среды, изменением цвета индикатора (красный цвет переходит в желтый) и появлением газа в поплавках. Из колбы и пробирок с признаками роста проводят пересев на агар Эндо штрихом по секторам. Посевы инкубируют при 37 0 С 24 часа. При отсутствии роста на агаре Эндо или при наличии колоний, не характерных для БГКП, дается отрицательный ответ.
Из колоний, характерных для бактерий БГКП (ярко-красных с металлическим оттенком, розовых), готовят мазки, их окрашивают по Граму, микроскопируют. Дополнительно изучают культуру по оксидазному тесту. Для этого на фильтровальную бумагу пропитанную раствором альфа-нафтола-диэтил-n-фенилендиамина наносят штрихом 2-3 колонии снятые с агара Эндо.
Для кишечной палочки характерно: наличие грамотрицательных палочек в мазке и отсутствие изменений в окраске фильтровальной бумаги на оксидазный тест. Следовательно, наличие грамотрицательных палочек и отрицательный оксидазный тест подтверждает наличие кишечной палочки в исследуемой воде.
Для подтверждения свежего фекального загрязнения исследуемой воды посевы выращивают при 43 0 С для дифференциации от кишечных палочек хладнокровных, не растущих при такой высокой температуре. Требования к санитарному состоянию воды приведены в таблице 3.
Микробиологические нормативы санитарного состояния воды
| Объект контроля | МАФАнМ, КОЕ, не более | Коли- титр, не менее | Коли- индекс, не более | Периодичность контроля |
| Вода водопров-я | 100 в 1 мл | 1 раз в месяц | ||
| Вода открытых водоемов | 1000 в мл | - |
Из таблицы видно, что для питьевой воды установлены следующие нормативы бактериологических показателей:
- общее микробное число - не более 100 в 1 мл;
- коли-титр - не менее 333;
- коли-индекс не должен превышать 3 кишечных палочек в 1000 мл.
Вода открытых водоемов считается доброкачественной, если общее микробное число - не более 1000 в 1 мл, коли-титр - не менее 111, коли-индекс - не более 9.
Метод мембранных фильтров
Через поры мембранного фильтра происходит диффузия питательных компонентов среды Эндо, вследствие этого оставшиеся на поверхности БГКП размножаются на поверхности фильтра и образуют типичные колонии - красные с металлическим оттенком. По числу выросших колоний определяют количество кишечных палочек в 1000 мл воды и тем самым устанавливают коли-индекс.
Водопроводную воду исследуют в объеме 333 мл, которую дробно и последовательно пропускают через четыре фильтра в объемах - 200, 100, 30 и 3 мл воды.
Наличие в воде патогенных бактерий устанавливают путем посева на дифференциально-диагностические и селективные питательные среды с последующей их идентификацией методами, принятыми в микробиологии.
Читайте также:
