Стратификация риска в отделении неотложной помощи. Предоперационная стратификация риска перед некардиальными операциями
Добавил пользователь Cypher Обновлено: 21.01.2026
2. Студенты медицинских вузов, ординаторы, аспиранты.
Базы для разработки методических рекомендаций
Порядок оказания медицинской помощи взрослому населению по профилю «анестезиология и реаниматология», утвержденному приказом Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. №919н.
При разработке методических рекомендаций использовались материалы
Cochrane Reviews, рекомендации World Federation of Societies of Anaesthesiologists, Федерации анестезиологов и реаниматологов России, Association of Anaesthetists of Great Britain and Ireland, European Society of Anaesthesiology.
Методы, использованные для сбора доказательств:
Поиск в электронных базах данных. Клинические рекомендации основаны на публикациях (PubMed/MEDLINE, SCOPUS, EMBASE), в том числе метаанализах, рандомизированных контролируемых исследованиях (РКИ), международных и национальных рекомендациях с учетом следующих принципов:
1. Использовать в качестве доказательной базы рекомендаций адекватно выполненные достоверные исследования;
2. Наиболее приоритетными считать данные РКИ и метаанализов таких исследований, но также использовать результаты эмпирических исследований надлежащего научного качества и мнения экспертов;
3. Указывать класс рекомендаций и уровень доказательности по основным вопросам диагностики и лечения (табл. 1 и 2), что позволяет на стандартизованной основе оценивать состояние научного знания в той или иной области медицины.
Таблица П1. Шкала оценки УДД для диагностических вмешательств
Иерархия дизайнов клинических исследований по убыванию уровня достоверности доказательств от 1 до 5
Систематические обзоры исследований с контролем референсным методом
Отдельные исследования с контролем референсным методом
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода
Несравнительные исследования, описание клинического случая
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица П2. Шкала определения УУР для диагностических вмешательств УУР
Однозначная (сильная) рекомендация (все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
Неоднозначная (условная) рекомендация (не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
Низкая (слабая) рекомендация — отсутствие доказательств надлежащего качества (все исследования имеют низкое методологическое качество, и их выводы по интересующим исходам не являются согласованными)
Таблица П3. Шкала определения УДД для лечебных, реабилитационных, профилактических вмешательств
Систематический обзор РКИ с применением метаанализа
Отдельные РКИ и систематические обзоры исследований любого дизайна (помимо РКИ) с применением метаанализа
Нерандомизированные сравнительные исследования, в том чисде когортные исследования
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай—контроль»
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица П4. Шкала определения УУР для лечебных, реабилитационных, профилактических, вмешательств
4. Представлять конкретные алгоритмы действия для простого и быстрого использования в практической деятельности.
Рекомендации являются результатом согласованного мнения экспертов, выработанного на основании анализа опубликованных исследований в этой области [4, 7, 8]. Данные рекомендации не могут описать всего многообразия клинических форм основного и сопутствующих заболеваний и клинических ситуаций и призваны помочь выбрать врачу наиболее оптимальную стратегию и тактику периоперационного ведения больных с патологией клапанного аппарата сердца. Критическая оценка диагностических и лечебных процедур в последнее время включает определение соотношения риск—польза.
Индикаторы доброкачественной практики (Good Practice Points — GPPs)
Рекомендуемая доброкачественная практика базируется на клиническом опыте членов рабочей группы по разработке рекомендаций.
Экономический анализ
Анализ стоимости не проводился, и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций
— Внешняя экспертная оценка;
— Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, прежде всего, то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания. Получены комментарии со стороны врачей анестезиологов-реаниматологов в отношении доходчивости изложения и оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка
Проект рекомендаций был рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Порядок обновления методических рекомендаций
Клинические рекомендации обновляются каждые 3 года.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, а риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Приложение А2. Связанные документы
1. Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
2. Порядок оказания медицинской помощи взрослому населению по профилю «анестезиология и реаниматология», утвержденному приказом Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. №919н.
3. Приказ Министерства здравоохранения и социального развития Российской Федерации от 17 декабря 2015 г. №1024н «О классификации и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы».
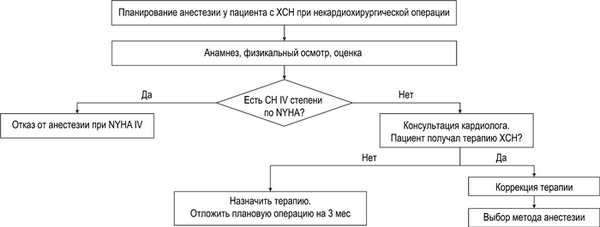
Приложение Б. Алгоритмы ведения пациентов
1. Алгоритм ведения пациента с сопутствующей ХСН перед плановой операцией.
Приложение В. Информация для пациента
У Вас диагностирована хроническая сердечная недостаточность, которая может проявляться одышкой при физической нагрузке и в покое, отеками ног, увеличением живота, затруднением дыхания в горизонтальном положении и необходимостью спать в положении полусидя.
Необходимо рассказать анестезиологу о перенесенных инфарктах миокарда, условиях возникновения болей в груди (при какой нагрузке возникают, как долго продолжаются, отчего проходят), одышки, отеков, повышенном артериальном давлении, наличии нарушений ритма сердца (ощущения «перебоев в работе сердца», возникновении приступов мерцательной аритмии или других аритмий), обмороках, предоставить все выписки и электрокардиограммы.
Вы также должны сообщить анестезиологу обо всех принимаемых Вами препаратах и их дозах, так как кардиальная терапия может повлиять на течение анестезии и исход операции. Особенно важно обратить внимание на прием таких препаратов, как аспирин, клопидогрель, тикагрелор, варфарин, ривароксабан, дабигатран, апиксабан. Несвоевременная отмена или неоправданное прекращение приема препаратов может привести к кровотечениям и тромбозам во время и после оперативного вмешательства.
Обязательно сообщите о перенесенных вмешательствах на сердце и сосудах (ангиопластика и стентирование коронарных артерий, аортокоронарное или маммарокоронарное шунтирование, протезирование клапанов, установка кардиостимулятора, кардиовертебро-дефибриллятора).
Сопутствующие заболевания, такие как сахарный диабет, болезни почек, анемия, гипертоническая болезнь, язвенная болезнь желудка и двенадцатиперстной кишки могут также оказать влияние на тактику анестезиолога и результат оперативного лечения, поэтому необходимо сообщить врачу обо всех имеющихся у Вас диагнозах.
Важное значение имеет также наличие у Вас факторов риска сердечно-сосудистых заболеваний: курения, ожирения, повышенного уровня холестерина и липопротеидов низкой плотности, злоупотребления алкоголем, а также сердечно-сосудистых заболеваний у ближайших родственников.
Стратификация риска в отделении неотложной помощи. Предоперационная стратификация риска перед некардиальными операциями
Оценка статуса коморбидных пациентов перед оперативным вмешательством врачами терапевтического профиля представляет собой актуальную проблему, в частности проблему коллегиального взаимодействия в многопрофильном стационаре. Задача терапевта и кардиолога - определить риск планируемого вмешательства и возможные способы и методы снижения этого риска. Наличие списка обязательного планового предоперационного обследования не всегда помогает решить проблему, а иногда несет явный вред. Назначение необоснованных исследований служит субстратом конфликтных ситуаций со страховыми компаниями ввиду обнаруживаемых неоправданных затрат. Длительное обследование вызывает негативный эмоциональный фон и тревожность у пациентов, занимает значительный период рабочего времени врача. В нашей клинике разработан методический план периоперационного обследования и ведения пациентов врачом-кардиологом на основе рекомендаций Европейского общества кардиологов (ESC) и Американского кардиологического общества (ACC). Назначение тех или иных лабораторных и инструментальных методов оправдано в том случае, если иные методы диагностики не позволяют достоверно оценить состояние, значимое на предстоящий периоперационный период. В статье представлен алгоритм предоперационного обследования и коррекции терапии кардиологических пациентов, затрагиваются вопросы целесообразности «терапии моста» у пациентов перед инвазивными процедурами и хирургическими вмешательствами.
Ключевые слова: кардиальный риск, сердечно-сосудистый риск, предоперационное обследование, коморбидность, коррекция терапии, «терапия моста».
Cardiac risks in extracardiac surgical procedures
Dzhioeva O.N. 1,2 , Orlov D.O. 1 , Egorov P.V. 1,2 , Zakharova I.I. 1 , Varentsov S.I. 1
1 City Outpatient Department No. 24, Moscow
2 Pirogov Russian National Research Medical University, Moscow
Preoperative status assessment in comorbid patients performed by general practitioners is an important issue. The key issue is collective interaction between experts in multitype hospital. The aims of the physician and cardiologist are to determine the risk of future surgery and to find methods to reduce this risk. The list of obligatory routine preoperative examination does not always settle the issue and sometimes even harms. Unnecessary examinations provoke insurance company examinations due to the unjustified costs. Long examinations result in negative emotions and anxiety in patients and take a lot of doctor’s time. We developed a methodical plan of perioperative examination performed by a cardiologist based on the recommendations of the European Society of Cardiology (ECS) and American College of Cardiology (ACC). Laboratory and instrumental tests are reasonable when other diagnostic techniques do not provide reliable assessment of the status in terms of perioperative period. The paper addresses the algorithm of preoperative examination and therapy correction in cardiologic patients and the value of bridging treatment before invasive procedures and surgeries.
Key words: cardiac risk, cardiovascular risk, preoperative examination, comorbidity, therapy correction, bridging treatment.
For citation: Dzhioeva O.N., Orlov D.O., Egorov P.V. et al. Cardiac risks in extracardiac surgical procedures // RMJ. 2016. № 19. P. 1316-1320.
Для цитирования: Кардиальные риски при внесердечных хирургических вмешательствах. РМЖ. 2016;19:1316-1320.
В статье обсуждается проблема кардиальных рисков при внесердечных хирургических вмешательствах
Работа в многопрофильном стационаре подразумевает работу междисциплинарной команды. Коморбидность, особенно у пациентов старшей возрастной группы, встречается очень часто и вызывает определенные трудности в планировании лечения. К сожалению, самоконтроль пациента, имеющего несколько хронических заболеваний, - трудно выполнимая задача. Оценка статуса коморбидных пациентов перед оперативным вмешательством врачами терапевтического профиля представляет собой актуальную проблему, в частности проблему коллегиального взаимодействия в многопрофильном стационаре. Эмпирически сложилось, что каждому пациенту перед хирургической манипуляцией необходимо получить заключение о соматическом статусе. Основываясь на нашем клиническом опыте, хотелось бы подчеркнуть, что так называемое «разрешение на операцию» врач-терапевт или кардиолог, по сути, дать не может, равно как и запрет. К оперативному вмешательству есть определенные показания и противопоказания, и определяет их хирург.
Задача терапевта и кардиолога - определить риск планируемого вмешательства и возможные способы и методы снижения этого риска. Наличие списка обязательного планового предоперационного обследования не всегда помогает решить проблему, а иногда несет явный вред. Назначение необоснованных исследований служит субстратом конфликтных ситуаций со страховыми компаниями ввиду обнаруживаемых неоправданных затрат. Длительное обследование вызывает негативный эмоциональный фон и тревожность пациентов, занимает значительный период рабочего времени врача. Выявленные структурные и функциональные отклонения не всегда клинически значимы, но могут быть по-разному интерпретированы специалистами и повлечь негативные последствия. Мы считаем, что при консультации пациентов перед оперативным вмешательством врачу необходимо следовать определенному алгоритму действий, четко регламентирующему обследование и назначение терапии.
В нашей клинике разработан методический план периоперационного обследования и ведения пациентов врачом-кардиологом. В работе мы основывались на рекомендациях Европейского общества кардиологов (ESC) и Американского кардиологического общества (ACC). Использование этих рекомендаций в ежедневной практике позволяет определять необходимость, целесообразность и объем исследований кардиологических пациентов, что клинически и экономически важно.
Алгоритм формирования заключения состоит из методических шагов, определяющих дальнейшую тактику. Итак, вам предстоит дать заключение относительно оперативного вмешательства у пациента. Первое, о чем необходимо знать, - экстренная или плановая операция предстоит пациенту. Если операция экстренная, то задача врача - корректировать терапию, которую получает пациент.
Если пациент получал терапию статинами, бета-блокаторами, то эти препараты следует оставить на весь периоперационный период [1, 2]. Пациенту с умеренно сниженной и значительно сниженной систолической функцией левого желудочка также на весь периоперационный период назначаются ингибиторы ангиотензинпревращающего фермента.
Если пациент получал новые оральные антикоагулянты, то их отмена производится без «терапии моста» («терапия моста», или «мост-терапия» - временная отмена пероральных антикоагулянтов при инвазивных процедурах и определенных хирургических вмешательствах с переходом на парентеральные гепарины в целях снижения риска кровотечения, без увеличения риска развития тромбоэмболических осложнений). Пациентам с механическими клапанными протезами или имеющим тяжелый стеноз левого атриовентрикулярного отверстия при отмене варфарина показан переход на гепаринотерапию. В иных случаях применения варфарина «мост-терапия» не требуется [3, 4]. У пациентов, получающих по показаниям низкие дозы аспирина, отмена препарата на периоперационный период нецелесообразна [5].
Таким образом, если пациенту показана экстренная операция, задача врача - корректировать медикаментозную терапию на периоперационный период в зависимости от статуса и анамнеза.
Рассмотрим ситуации плановых операций. Если врач-кардиолог консультирует пациента перед плановым хирургическим вмешательством, в первую очередь необходимо ориентироваться на параметры гемодинамики. В случае появления симптомов неотложной кардиологической ситуации (острый коронарный синдром, острый аортальный синдром, острая сердечная недостаточность, значимые нарушения ритма), в срочном порядке требуется дообследование: ЭКГ, Эхо-КГ, при необходимости КТ, чреспищеводная Эхо-КГ, ангиография. У пациентов с нестабильной гемодинамикой решение о назначении сроков плановой операции принимается коллегиально, с учетом соотношения риска и пользы в каждом конкретном клиническом случае.
Как следует поступить, когда перед плановым оперативным вмешательством необходимо определить объем предоперационного обследования пациента со стабильными гемодинамическими параметрами? Здесь важно принять во внимание планируемый объем операции.
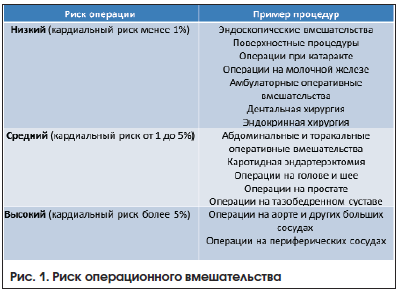
Все хирургические вмешательства делятся на три группы: низкого, среднего и высокого кардиологического риска (рис. 1) [6, 7]. Объему оперативного вмешательства должен соответствовать необходимый объем обследования. Так, в случае предстоящего вмешательства низкого риска никаких дополнительных исследований проводить не нужно. Такие манипуляции, как удаление катаракты, эндокринная тиреоидная хирургия, поверхностные манипуляции и пр., не требуют даже проведения ЭКГ. Мы понимаем, что такое мнение может быть неоднозначно воспринято коллегами. Хотелось бы подчеркнуть, что наша рекомендация касается пациента, который посетил врача сугубо для предоперационного заключения и не имеет жалоб и симптомов кардиальной патологии, значимых изменений при объективном обследовании (пальпации, перкуссии, аускультации легких и сердца), снижения сатурации, исследование которой обязательно для оценки соматического статуса.
В случае предстоящей операции среднего или высокого хирургического риска врач оценивает кардиальные факторы риска, с обязательным их перечислением в своем заключении. К этим факторам относятся:
• симптомная ИБС;
• инсульт в анамнезе;
• диагностированная ранее хроническая сердечная недостаточность;
• сахарный диабет;
• нарушение функции почек.
Наличие кардиальных факторов риска у пациента требует оценки его функционального статуса, а при необходимости - коррекции терапии и определения степени кардиального риска внесердечной операции.
Для оценки функционального статуса на первом этапе используется индекс Duke - опросник, позволяющий определить переносимость физических нагрузок, измеряемых в метаболических единицах (МЕТ) (рис. 2) [6, 7]. Если уровень физической активности пациента по шкале Duke соответствует 10 MET, функциональный статус пациента оценивается как удовлетворительный, коррекции терапии не требуется. Если индекс Duke соответствует уровню 4 МЕТ и ниже, пациенту необходимы ЭКГ-контроль для оценки значимых нарушений сердечного ритма и проводимости, а также включение в терапию бета-блокаторов, статинов, ингибиторов АПФ и блокаторов минералкортикоидных рецепторов при сниженной фракции выброса левого желудочка, т. к. именно препараты этих групп доказанно снижают риски интраоперационных кардиальных осложнений. В случае промежуточного значения индекса Duke пациенту целесообразно провести нагрузочное тестирование, например:
• велоэргометрию;
• тредмил-тест;
• эргоспирометрию;
• тест с 6-минутной ходьбой;
• стресс-Эхо-КГ с эргометрией;
• стресс-Эхо-КГ с добутамином.

Универсального нагрузочного тестирования не существует. Выбрать оптимальный для конкретного пациента способ оценки функционального резерва должен врач, опираясь на данные анамнеза, объективного статуса, клинических, инструментальных и лабораторных исследований. Если задачей тестирования является индукция ишемических изменений, оптимальным будет стресс-эхокардиография с эргометрией. Тест с добутамином - метод выбора диагностики жизнеспособности миокарда.
У пациентов с хронической сердечной недостаточностью используются различные варианты эргометрий, а также эргоспирометрия. Необходимо понимать, что у пациентов с несколькими факторами кардиального риска, когда предстоят операции среднего и, особенно, высокого хирургического риска, гораздо важнее оценка функциональных резервов внутрисердечной гемодинамики. Поэтому в случае планового хирургического вмешательства у таких пациентов проведение нагрузочных проб является обязательной частью предоперационного обследования [8].
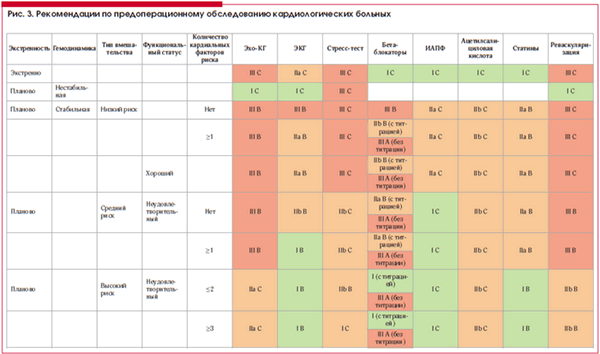
Рекомендации по предоперационному обследованию кардиологических пациентов и назначение кардиологической терапии обобщены в рис. 3 [7].
Таким образом, при формировании предоперационного заключения врач должен оценить:
• кардиальные жалобы;
• кардиальный анамнез;
• наличие сахарного диабета и поражения почек;
• симптоматику;
• функциональный статус пациента.
Представляем клинические примеры применения вышеизложенного алгоритма для определения объема клинико-инструментального обследования и коррекции терапии у кардиологических пациентов перед оперативным вмешательством.
Клинический пример № 1
Пациентка Ш., 81 год. Обратилась к кардиологу в ГКБ № 24 в связи с предстоящим оперативным вмешательством по удалению катаракты OS. Кардиальные жалобы в анамнезе и на момент осмотра отрицает. Из анамнеза известно, что в 1995 г. в поликлинике на основании ЭКГ ретроспективно установлен диагноз «постинфарктный кардиосклероз», около 5 лет назад отметила повышение АД с максимальными цифрами до 160/90 мм рт. ст. Регулярно в течение последних 3-х лет принимает лозартан 12,5 мг/сут. АД контролирует. На фоне принимаемой терапии повышение АД выше 140/90 мм рт. ст. не отмечает. При объективном обследовании: кожные покровы и видимые слизистые нормальной окраски, температуры и влажности. Периферические отеки не выявлены. Дыхание везикулярное над всей поверхностью легких, хрипы не выслушиваются. ЧДД=13 в минуту, SP O2=98%. Тоны сердца не изменены, ритмичны, приглушены, шумы не выслушиваются. ЧСС=77 в минуту, АД=130/88 мм рт. ст. Живот в объеме не увеличен, при пальпации мягкий, безболезненный. Печень не выступает из-под края реберной дуги, селезенка не пальпируется. Размеры печени и селезенки в пределах референсных значений. Почки не пальпируются. Симптом поколачивания отрицательный с двух сторон. Мочеиспускание свободное, безболезненное.
В данном клиническом примере - при отсутствии жалоб и объективных признаков кардиальной патологии, стабильном положительном эффекте от принимаемой антигипертензивной терапии, низком сердечно-сосудистом риске - нет необходимости в дополнительных инструментальных методах обследования (ЭКГ, Эхо-КГ и т. д.) перед хирургическим вмешательством. Рекомендовано продолжить антигипертензивную терапию лозартаном 12,5 мг на протяжении всего периоперационного периода.
Клинический пример № 2
Пациент Б., 60 лет. Доставлен в стационар с клинической картиной острого аппендицита. Показана срочная операция. Из анамнеза известно, что 2 мес назад перенес острый инфаркт миокарда, по поводу которого было выполнено стентирование правой коронарной артерии голометаллическим стентом. Постоянно принимает двойную дезагрегантную терапию (клопидогрел 75 мг и ацетилсалициловую кислоту 100 мг), бисопролол 2,5 мг, периндоприл 2,5 мг, аторвастатин 40 мг. На момент осмотра и в течение последних 2-х месяцев кардиальные жалобы отрицает. При объективном обследовании: ИМТ=33 кг/м2, кожные покровы и видимые слизистые нормальной окраски, температуры и влажности. Периферические отеки не выявлены. Дыхание везикулярное над всей поверхностью легких, хрипы не выслушиваются. ЧДД=16 в минуту, SP O2=99%. Тоны сердца не изменены, ритмичны, приглушены, шумы не выслушиваются. ЧСС=94 в минуту, АД=150/100 мм рт. ст. Живот в объеме не увеличен, при пальпации мягкий, безболезненный. Печень не выступает из-под края реберной дуги, селезенка не пальпируется. Размеры печени и селезенки в пределах референсных значений. Почки не пальпируются. Симптом поколачивания отрицательный с двух сторон. Мочеиспускание свободное, безболезненное.
В данном случае пациенту с кардиальным анамнезом необходимо экстренное оперативное вмешательство. Однако, учитывая отсутствие кардиальных жалоб, стабильную гемодинамику и адекватную терапию ишемической болезни сердца назначение дополнительных инструментальных методов обследования считаем непоказанным, за исключением ЭКГ.
Назначение тех или иных лабораторных и инструментальных методов оправдано в том случае, если иные методы диагностики не позволяют достоверно оценить состояние, значимое для предстоящего периоперационного периода. Полипрагмазия перед хирургическими манипуляциями, к сожалению, явление довольно частое, но совершенно не оправданное. Предложенный алгоритм способствует объективному и рациональному с клинической, экономической и этической точки зрения ведению больного.
Индивидуальная стратификация риска развития послеоперационных венозных тромбоэмболических осложнений

В основе эффективной профилактики послеоперационных венозных тромбоэмболических осложнений лежит адекватная оценка вероятности их развития. На сегодняшний день, для этого существуют два основных подхода.
1. В соответствии с характером основного заболевания, объемом оперативного вмешательства и наличием дополнительных индивидуальных факторов риска пациент соотносится с одной из традиционных клинических групп, у которых известна частота развития послеоперационных тромбозов и изучена иэффективность профилактических мероприятий. Данный подход является простым и эффективным, поэтому он представлен в большинстве отечественных и зарубежных рекомендаций по профилактике ВТЭО. В то же время, главным недостатком "группирования" пациентов является отсутствие учета кумуляции индивидуальных факторов риска, которая может значительно повышать интегральную вероятность развития тромбоза.
2. Учет всех выявленных индивидуальных состояний, предрасполагающих к развитию тромбоза у конкретного пациента, связанных как с его соматическим статусом, так и с характером выполненного оперативного вмешательства. При это каждому фактору риска присваивается определенное количество баллов, характеризующих его влияние на общий риск тромбообразования. На сегодняшний день наиболее валидированной для индивидуальной оценки риска послеоперационных ВТЭО является модель Caprini, которая была специально модифицирована под нужды нашего стационара. Модель содержит 29 факторов риска, значимость которых эквивалентно выражена в баллах: от 1 до 5.
При этом больные с наличием 0 баллов относятся к группе крайне низкого риска развития ВТЭО и не требуют иной профилактики, кроме ранней активизации, 1-2 балла - низкого риска, что подразумевает применение эластичной компрессии нижних конечностей, 3-4 балла - умеренного риска, что требует применения фармакопрофилактики помимо эластичной компрессии, 5-10 баллов - высокого риска, что обуславливает необходимость более длительной и аггресивной фармакопрофилактики и 11+ баллов - крайне высокий риск. Пациенты из группы крайне высокого риска являются наиболее тромбоопасным контингентом больных и проведение стандартной фармакологической профилактики в сочетании с эластичной компрессией не всегда позволяет предотвратить развитие послеоперационных тромбозов. Для данной категории рекомендуется наиболее агрессивная профилактика в виде сочетания фармакологических средств и механических методов, ускоряющих венозный отток: интермиттирующая пневматическая компрессия, электрическая стимуляция мышц голени.

Адаптировано с "Российских клинических рекомендаций по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО)", опубликованных.
Стратификация факторов риска внезапной сердечной смерти в условиях многопрофильного стационара

Имплантация кардиовертера -дефибриллятора спасает жизнь человека при угрозе внезапной смерти. В статье представлен опыт врачей КБ №1 УД Президента РФ по имплантации таких устройств. Рассматриваются причины внезапной смерти и данные отдаленных наблюдений.
Ежегодно около 250. 000 человек в РФ умирает внезапно от сердечных причин (4). Число данных пациентов имеет тенденцию к нарастанию, что делает данную проблему крайне актуальной в современной медицине.
Под внезапной сердечной смертью (ВСС) понимают ненасильственную смерть, развившуюся моментально или наступившую в течение часа с момента возникновения острых изменений (подразумеваются сердечные причины) в клиническом статусе больного (3).
Среди механизмов ВСС, согласно данным, полученным при проведении холетровского мониторинга ЭКГ у пациентов, умерших внезапно, в подавляющем большинстве случаев (85%) превалируют желудочковые тахиаритмии -желудочковая тахикардия (ЖТ) и фибрилляция желудочков (ФЖ) с последующим развитием асистолии; оставшиеся 15% приходятся на долю брадиаритмий и асистолии (3, 8, 10-11).
Показателями стратификации риска злокачественного течения любой аритмии и определения ее жизнеугрожающего характера в клинической интерпретации следует считать: возникновение обморока, предобморока, головокружения, артериальной гипотензии, прогрессирование проявлений сердечной недостаточности, стенокардию (1-3). Наличие или отсутствие имеющейся структурной патологии сердца может иметь определяющее значение для адаптационных изменений параметров сердечного выброса, а значит и для характера клинического течения (1, 3). У лиц с наличием структурной патологии сердца вероятность ВСС в течение года в 7, 5 выше, чем у пациентов без структурной патологии сердца (2, 3). Среди заболеваний сердца основной причиной ВСС является ИБС, на долю которой приходится до 80% всех случаев (3). Кроме ИБС, ВСС встречается у пациентов с дилатационной (ДКМП) и гипертрофической кардиомиопатиями (ГКМП) (5), аритмогенной дисплазией правого желудочка (АДПЖ), при синдромах Бругада и удлиненного интервала QT, аномалиях развития коронарных артерий и других патологических состояниях (3, 6-8).
Все нозологические единицы полностью описаны в рекомендациях по профилактике внезапной смерти (3).
В течение 2014 года в клинической больнице №1 (Волынская) имплантировано 10 двухкамерных ИКД (Medtrtonic Protecta), 1 однокамерный ИКД (Medtrtonic Maximo), а так же 9 ИКД Medtrtonic Protecta c функцией ресинхронизирующей терапии (CRT-D). (См. Табл 1) Среди пациентов было 17 мужчин в возрасте 55, 7+4, 5 года и 2 женщины 58 и 71 года.
Основанием для имплантации ИКД в подавляющем большинстве случаев (у 14 пациентов) являлась гемодинамически значимая пароксизмальная желудочковая тахикардия, 2 пациента в анамнезе перенесли клиническую смерть вследствие фибрилляции желудочков. Таким образом показания для имплантации ИКД у данных пациентов соответствовали 1 А классу и являлась методом первичной профилактики ВСС. Субстратом болезни у 12 пациентов явилась ИБС, причем 10 из них ранее перенесли инфаркт миокарда, 6-рым проведены операции реваскуляризации миокарда. Один пациент, 26 лет, структурной патологии не имел.
Установка ИКД по поводу вторичной профилактики выполнялась 5 пациентам, все пациенты с ДКМП с сердечным арестом в анамнезе и низкой фракцией выброса.
Среди пациентов с ресинхронизирующей терапией подавляющее большинство составили пациенты с ДКМП -8 человек, 1 пациент был с ИБС; все пациенты имели ХСН на уровне III функционального класса по NYHA, у всех на ЭКГ регистрировалась полная блокада левой ножки п. Гиса.
Все пациенты получали поддерживающую медикаментозную терапию, согласно Национальным Рекомендациям.
Период наблюдения составил от 2-х до 12 месяцев. При этом у 12 пациентов не наблюдалось эпизодов включения терапии ИКД. У одного больного с ИБС в течение 2-х месяцев было зафиксировано 48 разрядов дефибриллятора по поводу ЖТ, что потребовало подбора ААТ (кордарон + бета-блокаторы) в условиях стационара, коррекции сопутствующей патологии - сахарного диабета. У 4-х больных ( из них трех с ИБС, один с ДКМП) были трехкратные разряды в течение от 4-х до 8 месяцев, пациенты наблюдались кардиологами городских стационаров, проводилась коррекция терапии, увеличена доза бета-блокаторов, антагонистов альдостерона. У трех пациентов (два с ДКМП, 1 с ИБС) отмечались эпизоды антитахикардитической стимуляции, также проводилась коррекция терапии бета-блокаторами. Четверо пациентов ( все с ДКМП) с ресинхронизирующей терапией были повторно, в течение года, госпитализированы по поводу декомпенсации ХСН, при мониторировании ЭКГ отмечалась желудочковая экстрасистолия высоких градаций.
Несмотря на небольшую выборку пациентов и относительно непродолжительный срок наблюдения за данными пациентами нами проведен анализ причин повторных госпитализаций. Установлено, что благодаря современным технологиям коррекция основных факторов риска ВСС проводится достаточно эффективно, однако вторичным факторам риска уделяется недостаточное внимание. Так, более взвешенного и тщательного подхода требует подбор доз медикаментозной терапии как антиаритмических, так и гипотензивных препаратов, мало используется препараты ПНЖК ( которые, как известно повышают антифибрилляторный потенциал клетки) ; не уделяется должного внимание таким факторами риска как курение, ожирение, коррекции углеводного обмена; зачастую имеет место повышенный депрессивный фон у данных пациентов, который остается без внимания.
Несомненно, модификация всех факторов риска ВСС требует привлечения более широкого круга специалистов, помимо традиционных кардиолога, аритмолога, интервенционного хирурга, целесообразны (по показаниям) консультации диетолога, эндокринолога, психолога, что позволит, по нашему мнению, повысить эффективность терапии и снизить риск ВСС.
Приводим клинический случай приобретённого синдрома удлинённого интервала QT.
Пациентка Б. , 54 л. , в течение длительного времени страдает ИБС, Артериальной Гипертензией, пароксизмальной формой фибрилляцией предсердий. Постоянно принимала антиаритмическую и гипотензивную терапию ( в т. ч. соталекс). 10. 03 развился пароксизм фибрилляции предсердий, купированный самостоятельно, 11. 03. появилась одышка, затем присоединились боли в области сердца, госпитализирована в ОРИТ КБ №1 с диагнозом: Нестабильная стенокардия.
В связи с пароксизмальной формой мерцательной аритмии пациентке был назначен кордарон, что вызвало усугубление удлинения интервала QT:
Через короткий промежуток после поступления отмечался эпизод двунаправленной желудочковой тахикардии (ЖТ) по типу «пируэта» («torsade de pointes»), перешедший в эпизод ФЖ с нарушением гемодинамики, проводилась ЭИТ с положительным эффектом; рецидив 12. 03. , также купирован ЭИТ. ( См. Рис 2)
В ходе проведенного обследования, в т. ч. коронароангиография (от 12. 03. 2013) : ПКА сужена в устье на 40%, тип КК правый) и КТ ОГК с контрастированием острая коронарная патология и ТЭЛА были исключены. Коллегиально определена тактика ведения пациентки: т. к. у больной имеет место удлинённый QT (по поводу пароксизмальной форма фибрилляции предсердий ранее принимала соталекс 160 мг х 2 раза), учитывая необходимость антиаритмической терапии для контроля ритма, высокий риск жизнеугрожающих аритмий, а также анамнез больной, решено имплантировать однокамерный ИКД.
За время лечения состояние больной со значительной положительной динамикой: ангинозные боли и нарушения ритма не рецидивировали, симптомы недостаточности кровообращения и углеводного обмена компенсированы, расширен двигательный режим. На контрольной ЭКГ положительная динамика (См. Рис 3).
Для дальнейшей реабилитации пациентка переведена в реабилитационный центр.
По современным данным, выживаемость у больных с жизнеопасными желудочковыми нарушениями ритма при органических заболеваниях сердца улучшается при применении β-блокаторов, либо препаратов III класса (кордарон, соталол) в основном за счёт антифибрилляторного и антиишемического действия. Однако, во избежание нежелательных проаритмогенного и побочных эффектов медикаментов, больным с врожденным (и приобретенным) удлиненным QT интервалом показана имплантация ИКД.
Наш опыт стратификации риска ВСС указывает на преобладание в данной группе риска больных с ИБС, с жизнеугрожаемыми желудочковыми аритмиями. На втором месте - дилатационная и гипертрофическая КМП, реже встречается врожденная патология проводящей системы сердца.
Необходимо активное выявление групп повышенного риска ВСС и проведение всесторонних профилактических мероприятий, что позволит предотвратить фатальные осложнения у данной категории пациентов.
Ардашев В. Н1. , Бояринцев В. В. 1, Мезенцев П. В. 1, Кубенский Г. Е. 1, Николаева Э. А. 1, Г. Е. , Тарабарина Н. Б. 1, Мелкумова Е. Ю. 1
Рекомендации Европейского Общества Кардиологов по кардиологической поддержке пациентов, которым выполняются некардиальные операции 2022: краткий обзор
Ниже кратко изложены основные разделы и новшества, представленные в этом документе.
В рекомендациях представлен подробный алгоритм оценки риска периоперационных сердечно-сосудистых осложнений в зависимости от статуса пациента и характеристик самой операции. Приведена классификация хирургических вмешательств, характеризующихся низким (менее 1%), промежуточным (1-5%) и высоким (>5%) риском ССО (СС смерть, ИМ, инсульт) в течение 30 суток после операции (см. рисунок).

Представлен подробный алгоритм предоперационного обследования с разделением пациентов на 3 категории: 1) младше 65 лет без ССЗ и факторов риска, 2) пациенты старше 65 лет и/или имеющие факторы риска ССЗ, 3) пациенты с известными ССЗ.
Так, например, у пациентов 45-65 лет перед операциями высокого риска следует проводить ЭКГ и определение биомаркеров. У пациентов с семейным анамнезом генетически обусловленных кардиомиопатий показано проведение ЭКГ и ЭХО-КГ независимо от возраста.
В рекомендациях появился новый раздел о предоперационном обследовании у пациентов с недавно возникшими шумами в области сердца, болями в грудной клетке, одышкой или периферическими отеками. Например, если у пациента появляются одышка и/или отеки, необходимо перед операцией выполнить ЭКГ и определить NT-proBNP/BNP, даже если можно найти другое объяснение симптомам.
Пациентам старше 70 лет, которым планируется операция промежуточного/высокого риска, необходим скрининг старческой астении. В качестве экспресс-теста для оценки функционального статуса пациента предлагается выяснять, как пациент способен подняться на 2 пролета лестницы.
Если пациенту необходимо проведение ЭХО-КГ, но очередь на это исследование задерживает операцию, потенциально возможно проведение исследования по короткому протоколу (фокусное) (класс рекомендаций IIb).
Визуализирующие стресс-тесты рекомендуется проводить перед операциями высокого риска у бессимптомных пациентов с ЧКВ и коронарным шунтированием в анамнезе в случае плохой переносимости нагрузки.
В рекомендациях представлен раздел по коррекции факторов риска ССЗ.
Рекомендуется достижение контроля АД, липидов и гликемии перед операцией. Также следует рекомендовать пациенту бросить курить за 4 недели и более до операции, что ассоциируется с меньшей смертностью и частотой периоперационных осложнений.
Также текст содержит подробный раздел о медикаментозной терапии уже имеющихся ССЗ в периоперационном периоде. Так, если пациент принимает диуретики с гипотензивной целью, целесообразно пропустить их прием в день операции. Ингибиторы SGLT-2 необходимо отменять за 3 суток до операции.
Если планируется операция, сопряженная с высоким риском кровотечений (нейрохирургия, витреоретинальные офтальмологические вмешательства), пациентам со стабильной ИБС аспирин следует отменить не менее, чем за 7 суток до вмешательств. Если пациент получает двойную антитромбоцитарную терапию в связи с перенесенной ЧКВ, плановое вмешательство нужно отложить не менее, чем на 3 мес после ЧКВ.
Закономерно присутствует большой раздел о периоперационном ведении пациентов, получающих длительную антикоагулянтную терапию. Из нового: разрешено применение низкомолекулярных гепаринов как альтернатива НФГ в качестве терапии моста у пациентов с механическими протезами клапанов сердца. Терапия моста с использованием НФГ/НМГ показана пациентам с механическим протезом и необходимостью прервать терапию пероральными антикоагулянтами в следующих случаях: 1) протез в митральной или трикуспидальной позиции; 2) аортальный протез старого образца; 3) аортальный протез и дополнительный фактор риска тромбоза.
Пациентам, которым проводится артропластика коленного или тазобедренного сустава, профилактика ВТЭО может быть продлена до 14-35 суток в случае низкого риска кровотечения. В качестве альтернативы НМГ у этих пациентов можно рассмотреть назначение ПОАК (класс рекомендации IIb).
Отдельно рассмотрены особенности периоперационного ведения пациентов с той или иной сердечно-сосудистой патологией. Так, у пациента с показаниями к протезированию аортального клапана в связи со стенозом эта операция (открыто или эндоваскулярно) должна быть выполнена до иного внесердечного хирургического вмешательства промежуточного или высокого риска. Если операция на АК не выполнима, или нет времени ждать по основному заболеванию, в качестве моста к полноценной кардиохирургической операции можно рассмотреть баллонную вальвулопластику (класс рекомендаций IIb). Тяжелая митральная регургитация также должна быть скорректирована перед плановой внесердечной операцией промежуточного или высокого риска.
Перед плановой операцией по возможности должна быть выполнена аблация аритмогенного субстрата у пациентов с устойчивыми наджелудочковыми тахикардиями, а также с мономорфной желудочковой тахикардией, ассоциированной с рубцовым поражением миокарда, если эти аритмии устойчивы к медикаментозной терапии.
Если пациенту с имплантированными устройствами (стимуляторы, ИКД и проч) применялись хирургические методы, ассоциирующиеся с электромагнитным воздействием (например, монополярная электрокоагуляция в верхней половине туловища (выше пупка)), после ее завершения необходима проверка работы устройства.
Плановые операции следует отложить до полного разрешения перикардита. Как минимум, не следует проводить операции с использованием общей анестезии у пациентов, продолжающих прием колхицина и иммуносупрессивных препаратов.
У пациентов с легочной артериальной гипертензией исходя из гемодинамического статуса следует рассмотреть периоперационное использование инодилататоров (добутамина, милринона, левосимендана), которые увеличивают сердечный выброс и снижают легочную сосудистую резистентность.
Согласно данному документу, перед плановыми операциями в связи с периферическим атеросклерозом или аневризмой брюшного отдела аорты стресс-тесты или коронарография не требуются.
У пациентов с ожирением следует оценивать риск развития гиповентилляционного синдрома, при его наличии - дополнительное дообследование перед операциями высокого риска.
Возникшие в послеоперационном периоде осложнения следует лечить по стандартным рекомендациям (с поправкой на риск кровотечений).
Если в послеоперационном периоде клинически имеет место высокая или умеренная вероятность ТЭЛА, необходимо начинать терапию до получения результатов подтверждающих тестов при условии низкого риска кровотечений.
АКГ в связи с послеоперационной ТЭЛА необходимо продолжать не менее 3 месяцев.
Если ФП манифестирует впервые после внесердечной операции, длительную АКГ назначают по стандартным алгоритмам исходя из риска тромбоэмболических осложнений, принимая во внимание предпочтения пациента. Рутинное назначение бета-блокаторов для профилактики послеоперационной ФП не показано.
В рекомендациях подробно рассматривается диагностика периоперационных осложнений, прежде всего - повреждения миокарда. Острое повышение уровня тропонина может быть связано с внесердечными причинами (ТЭЛА, сепсис, инсульт), а также с сердечными - ИМ 1 или 2 типа (прежде всего, в связи с эпизодами гипотонии и анемией), тахиаритмия, острая сердечная недостаточность.
В рекомендациях используется понятие MINS «myocardial injury following non-cardiac surgery» - повреждение миокарда после некардиальной операции вследствие истинной сопутствующей ИБС. Для таких пациентов с классом рекомендаций IIb рассматривается назначение дабигатрана 110 мг 2 раза в день начиная с 7 суток после операции.
Также рекомендации содержат отдельный раздел про сердечно-сосудистые осложнения после операций у онкологических пациентов, а также про плановые операции у недавно перенесших COVID-19.
Читайте также:
