Строение и функции гепарансульфат-протеогликанов (ГСПГ)
Добавил пользователь Morpheus Обновлено: 02.02.2026
1) Кафедра внутренних болезней № 2 ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России;
2) Медицинский центр «Новомедицина»;
3) ГБУ Ростовской области «Ростовская клиническая областная больница № 2»
Цель исследования - определить взаимосвязь уровня гепарансульфата в сыворотке крови больных с различными формами хронического гломерулонефрита с различными морфологическими проявлениями в почечной ткани.
Материал и методы. Проведено детальное клинико-лабораторное обследование 80 больных с ХГН в стадии обострения, включавшее определение гепарансульфата в сыворотке крови методом иммуноферментного анализа и выполнение пункционной нефробиопсии с оценкой морфологических изменений.
Результаты и заключение. Данные, полученные в исследовании, демонстрируют важную роль гепарансульфата в процессе ремоделирования тубулоинтерстиция, подтверждают его роль как маркера повреждения почек в большей степени при IgA-нефропатии и нефритическом синдроме. Изученный показатель служит маркером тубулоинтерстициального фиброза, а также отражает выраженность активности воспалительного процесса. Определение уровня гепарансульфата в сыворотке крови может стать информативным неинвазивным методом, позволяющим оценивать активность заболевания и прогноз течения хронического гломерулонефрита.
Хроническая болезнь почек (ХБП) является серьезной проблемой общественного здравоохранения во всем мире. По данным на 2013 г., ее распространенность среди населения составляла от 8 до 16% [1, 2]. Только в США число пациентов, имеющих диагноз терминальной стадии почечной недостаточности, увеличилось с примерно с 10 000 человек в 1973 г. до 703 243 человек в 2015 г. [3].
Одной из основных причин терминальной почечной недостаточности служит хронический гломерулонефрит (ХГН). Тактика его лечения полностью основана на результатах нефробиопсии и оценке гистологического материала, но эта инвазивная процедура сопряжена со множеством рисков и часто не в состоянии предсказать клиническое течение или реакцию на лечение. Сегодняшние достижения в области генетики и молекулярной биологии позволяют выяснить новые патогенные механизмы развития иммунологических нарушений в почечной ткани. Эти открытия способствуют появлению новых биомаркеров и открывают перспективы неинвазивной диагностики для улучшения прогнозирования заболеваний почек.
Таким образом, помимо гистопатологической оценки, клинические биомаркеры специфических патогенных процессов помогут облегчить терапевтический выбор препаратов в процессе лечения гломерулопатий [4]. Гепарансульфат (Heparan sulfate) - один из видов гликозаминогликанов, входящих в состав базальной мембраны клубочков (БМК). При гломерулярных повреждениях снижение уровня гепарансульфата ведет к утере отрицательного заряда мембраны и, как следствие, повышению ее проницаемости для альбумина и других белков. Гепарансульфат относится к профиброгенным факторам. Он связывает экстрацеллюлярные матриксные компоненты и молекулы клеточной поверхности. Белок взаимодействует с ламинином, пролоргином, коллагеном IV типа, транстиретином, факторами роста и участвует в большом количестве биологических процессов в организме человека: ангиогенезе, свертывании крови и метастазировании, а также является ключевым компонентом сосудистого экстрацеллюлярного матрикса, выполняющего функцию эндотелиального барьера. Вследствие этого протеогликаны, в том числе и гепарансульфат, могут быть рассмотрены как профиброгенные факторы. Но в то же время в течение последнего десятилетия стало очевидно, что гепарансульфат имеет решающее значение для накопления лейкоцитов на эндотелии. Из этого можно сделать вывод, что гепарансульфат обладает не только профиброгенным действием, но и служит одним из факторов, влияющих на адгезию иммунокомпетентных клеток на эндотелии, тем самым ухудшая эндотелиальную дисфункцию.
Измерение сывороточных уровней гепарансульфата может дать ценную информацию в отношении оценки активности воспалительного процесса, выраженности эндотелиальной дисфункции, а также оценить риск развития тубулоинтерстициального фиброза.
Цель исследования - определить взаимосвязь уровня гепарансульфата в сыворотке крови больных с различными формами ХГН с различными морфологическими проявлениями в почечной ткани.
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 80 больных с ХГН в стадии обострения (48 мужчин и 32 женщины, средний возраст 35,6±10,8 лет). Медиана продолж.
Строение и функции гепарансульфат-протеогликанов (ГСПГ)
Гамма-глютамилтранспептидаза - фермент (белок) печени и поджелудочной железы, активность которого в крови повышается при заболеваниях печени и злоупотреблении алкоголем.
Синонимы русские
Гамма-глютаматтранспептидаза, гамма-глютаматтрансфераза, ГГТ, гамма-глутаматтранспептидаза, гамма-глутаматтрансфераза, ГГТП.
Синонимы английские
Gamma-glutamyl transferase, Gamma-glutamyl transpeptidase, GGTP, Gamma GT, GTP.
Метод исследования
Кинетический колориметрический метод.
Единицы измерения
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов до исследования.
- Исключить физическое и эмоциональное перенапряжение и не курить в течение 30 минут до исследования.
Общая информация об исследовании
Желчь образуется в клетках печени и выделяется по системе микротрубочек, которые называются желчными канальцами. Они затем объединяются в печеночные протоки, выходящие за пределы печени, и образуют общий желчный проток, впадающий в тонкий кишечник. Желчь необходима для всасывания жиров, поступающих с пищей. Также через желчь выделяются некоторые лекарственные вещества. Она образуется постоянно, но поступает в кишечник только во время и после приема пищи. Когда она не нужна - накапливается в желчном пузыре.
Гамма-глютамилтранспептидаза - фермент, который находится в клетках печени и желчевыводящих путей и является катализатором определенных биохимический реакций. В кровеносном русле она не содержится, только в клетках, при разрушении которых их содержимое попадает в кровь. В норме часть клеток обновляется, поэтому в крови обнаруживается определенная активность ГГТ. Если гибнет много клеток, ее активность может повышаться значительно.
Тест на ГГТ - самый чувствительный анализ в отношении застоя желчи - холестаза. Активность ГГТ при препятствии оттоку желчи, например при камнях в желчных протоках, повышается раньше, чем активность щелочной фосфатазы. Однако повышение это неспецифично, так как оно происходит при большинстве острых заболеваний печени и желчных ходов, например при остром вирусном гепатите или раке, и обычно такой результат не очень информативен при установлении конкретного заболевания или состояния, вызвавшего повреждение печени.
В отличие от других печеночных ферментов, производство ГГТ "запускается" алкоголем, поэтому у лиц, злоупотребляющих им, ее активность может быть повышена даже при отсутствии заболевания печени. Кроме того, выработка ГГТ стимулируется некоторыми лекарствами, включая фенобарбитал и парацетамол, поэтому на фоне их приема можно ожидать повышения ГГТ без повреждения печени.
ГГТ также содержится в почках, селезенке, поджелудочной железе, головном мозге, простате, и увеличение ее активности неспецифично только для нарушений печени.
Паратиреоидный гормон (ПТГ) - полипептидный гормон, который синтезируется паращитовидными железами и играет важную роль в регуляции уровня кальция и фосфора в организме.
Паратгормон, паратирин, ПТГ.
Parathyroid hormone, intact PTH, parathormone, parathyrin.
Твердофазный хемилюминесцентный иммуноферментный анализ ("сэндвич"-метод).
Диапазон определения: 1,2 - 5000 пг/мл.
Пг/мл (пикограмм на миллилитр).
- В течение суток до исследования не употреблять алкоголь, а также лекарственные препараты (по согласованию с врачом).
- Не есть 12 часов перед анализом.
- Исключить физическое и эмоциональное перенапряжение в течение 24 часов до исследования.
- Не курить 3 часа до исследования.
Паратиреоидный гормон (ПТГ) вырабатывается паращитовидными железами, расположенными попарно на задней поверхности каждой из долей щитовидной железы. Интактный ПТГ (цельная молекула гормона) состоит из 84 аминокислот, имеет короткий период полужизни (около четырех минут) и является главной биологически активной формой гормона. У его N- и C-терминальных фрагментов период существования более длительный, их активность и метаболизм изучаются.
ПТГ играет важную роль в регуляции фосфорно-кальциевого обмена и обеспечивает поддержание стабильной концентрации кальция и фосфора во внеклеточной жидкости. Уровень ПТГ тесно связан с количеством кальция, витамина D, фосфора, кальция, магния в организме, регуляция его секреции осуществляется по принципу обратной связи. При снижении концентрации кальция в крови (гипокальциемии) выделение ПТГ паращитовидными железами усиливается, а при повышении (гиперкальциемии) - наоборот, снижается. Данные механизмы направлены на поддержание стабильного уровня кальция в крови. Повышение ПТГ способствует активации остеокластов, резорбции костной ткани и высвобождению кальция из костей, усиливает всасывание кальция из кишечника, задерживает выделение кальция почками и ингибирует обратную реабсорбцию фосфора. Антагонистом ПТГ является гормон кальцитонин, секретируемый С-клетками щитовидной железы. В норме при достижении нормальной концентрации кальция в крови продукция ПТГ снижается.
При патологии и избыточном синтезе ПТГ (гиперпаратиреозе) развивается гиперкальциемия, гиперфосфатурия, генерализованный остеопороз, кальцификация сосудов, поражение слизистой желудочно-кишечного тракта. Недостаточная секреция ПТГ (гипопаратиреоз) сопровождается гипокальциемией и гиперфосфатемией, может привести к судорогам, тетании.
Важно одновременно оценивать уровень свободного, или ионизированного, кальция в крови и ПТГ с учетом клинических проявлений и результатов других лабораторных и инструментальных исследований, это позволяет провести дифференциальную диагностику очень схожих патологических состояний и разработать правильную тактику лечения.
Для чего используется исследование?
- Для оценки функции паращитовидных желез.
- Чтобы выяснить причины гипо- или гиперкальциемии, нарушений кальциевого обмена.
- Для дифференциальной диагностики первичного, вторичного и третичного гиперпаратиреоза.
- Для диагностики гипопаратиреоза.
- Для мониторинга пациентов с хроническим нарушением обмена кальция.
- Чтобы оценить эффективность лечения патологии паращитовидных желез и их оперативного удаления при новообразованиях.
Когда назначается исследование?
- При изменении уровня кальция в крови (гипер- или гипокальциемии).
- При симптомах гиперкальциемии (усталость, тошнота, боли в животе, жажда) или гипокальциемии (боли в животе, мышечные судороги, покалывание в пальцах).
- При изменении размеров и структуры паращитовидных желез по данным инструментальных методов (например, КТ).
- При лечении нарушений кальциевого обмена.
- При новообразованиях паращитовидных желез, а также сразу после их хирургического удаления.
- При остеопорозе и изменениях структуры костной ткани.
- При хронических заболеваниях почек и сниженной скорости клубочковой фильтрации.
Что означают результаты?
Референсные значения: 15 - 65 пг/мл.
Нормальный уровень ПТГ при низком кальции в крови - признак гипопаратиреоза (недостаточного синтеза ПТГ паращитовидными железами). Высокий ПТГ и повышенная концентрация кальция в крови указывают на гиперпаратиреоз. Уровень ПТГ оценивается совместно с уровнем кальция крови.
III. Гликозаминогликаны и протеогликаны
Гликозаминогликаны — линейные отрицательно заряженные гетерополисахариды. Раньше их называли мукополисахаридами, так как они обнаруживались в слизистых секретах (мукоза) и придавали этим секретам вязкие, смазочные свойства. Эти свойства обусловлены тем, что гликозаминогликаны могут связывать большие количества воды, в результате чего межклеточное вещество приобретает желеобразный характер.
Протеогликаны — высокомолекулярные соединения, состоящие из белка (5—10%) и гликозаминогликанов (90—95%). Они образуют основное вещество межклеточного матрикса соединительной ткани и могут составлять до 30% сухой массы ткани.
Белки в протеогликанах представлены одной полипептидной цепью разной молекулярной массы. Полисахаридные компоненты у разных про-теогликанов разные. Протеогликаны отличаются от большой группы белков, которые называют гликопротеинами Эти белки тоже содержат оли-госахаридные цепи разной длины, ковалентноприсоединённые к полипептидной основе. Углеводный компонент гликопротеинов гораздо меньше по массе, чем у протеогликанов, и составляет не более 40% от общей массы. Гликопротеины выполняют в организме человека разные функции и присутствуют во всех классах белков — ферментах, гормонах, транспортных, структурных белках и др. Представители гликопротеинов — коллаген и эластин, иммуноглобулины, ангиотен-зиноген, трансферрин, церулоплазмин, внутренний фактор Касла, тиреотропный гормон.
Гликозаминогликаны и протеогликаны, являясь обязательными компонентами межклеточного матрикса, играют важную роль в межклеточных взаимодействиях, формировании и поддержании формы клеток и органов, образовании каркаса при формировании тканей.
- они являются структурными компонентами межклеточного матрикса;
- протеогликаны и гликозаминогликаны специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином и другими белками межклеточного матрикса;
- все протеогликаны и гликозаминогликаны, являясь полианионами, могут присоединять, кроме воды, большие количества катионов (Na + , К + , Са 2+ ) и таким образом участвовать в формировании тургора различных тканей;
- протеогликаны и гликозаминогликаны играют роль молекулярного сита в межклеточном матриксе, они препятствуют распространению патогенных микроорганизмов;
- гиалуроновая кислота и протеогликаны выполняют рессорную функцию в суставных хрящах;
- гепарансульфатсодержащие протеогликаны способствуют созданию фильтрационного барьера в почках;
- кератансульфаты и дерматансульфаты обеспечивают прозрачность роговицы;
- гепарин — антикоагулянт;
- гепарансульфаты — компоненты плазматических мембран клеток, где они могут функционировать как рецепторы и участвовать в клеточной адгезии и межклеточных взаимодействиях. Они также выступают компонентами синаптических и других пузырьков.
А. Строение и классы гликозаминогликанов
Гликозаминогликаны представляют собой длинные неразветвлённые цепи гетерополисахаридов. Они построены из повторяющихся дисахаридных единиц. Одним мономером этого дисахарида является гексуроновая кислота (D-глюкуроновая кислота или L-идуроновая), вторым мономером — производное аминосахара (глюкоз- или галактозамина). NH2-rpynna аминосахаров обычно ацетилирована, что приводит к исчезновению присущего им положительного заряда. Кроме гиалуроновой кислоты, все гликозаминогликаны содержат сульфатные группы в виде О-эфиров или N-сульфата.
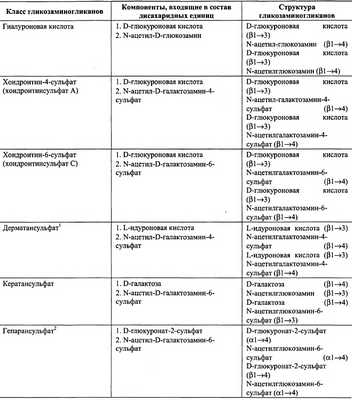
В настоящее время известна структура шести основных классов гликозаминогликанов, которые представлены в табл. 15-4.
Таблица 15-4.
Структура различных классов гликозаминогликанов
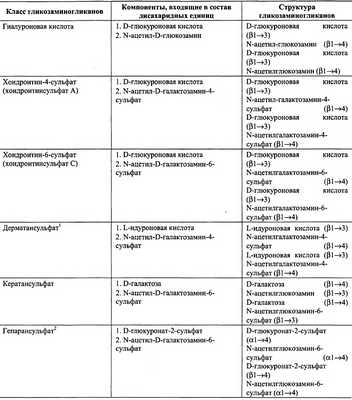
1 В состав дисахаридной единицы может входить D-глюкуроновая кислота.
Гиалуроновая кислота находится во многих органах и тканях. В хряще она связана с белком и участвует в образовании протеогликановых агрегатов, в некоторых органах (стекловидное тело глаза, пупочный канатик, суставная жидкость) встречается и в свободном виде. Предполагается, что в суставной жидкости гиалуроновая кислота выполняет роль смазочного вещества, уменьшая трение между суставными поверхностями.
Повторяющаяся дисахаридная единица в гиалуроновой кислоте имеет следующую структуру:
Гиалуроновая кислота содержит несколько тысяч дисахаридных единиц, молекулярная масса её достигает 10 5 —10 7 Д.
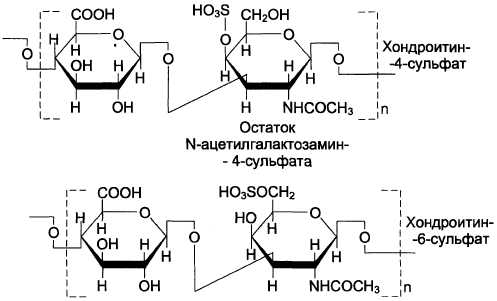
Хондроитинсульфаты — самые распространённые гликозаминогликаны в организме человека; они содержатся в хряще, коже, сухожилиях, связках, артериях, роговице глаза. Хондроитинсульфаты являются важным составным компонентом агрекана — основного протеогликана хрящевого матрикса. В организме человека встречаются 2 вида хондроитинсульфатов: хондроитин-4-сульфат и хондроитин-6-сульфат. Они построены одинаковым образом, отличие касается только положения сульфатной группы в молекуле N-ацетилгалакгозамина (см. схему А).
Схема А
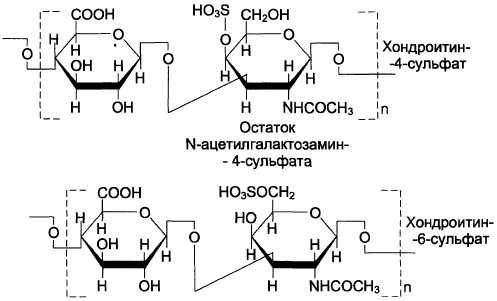
Одна полисахаридная цепь хондроитинсуль-фата содержит около 40 повторяющихся дисахаридных единиц и имеет молекулярную массу 10 4 -10 6 Д.
Кератансульфаты — наиболее гетерогенные гликозаминогликаны; отличаются друг от друга по суммарному содержанию углеводов и распределению в разных тканях. Кератансульфат I находится в роговице глаза и содержит кроме повторяющейся дисахаридной единицы L-фукозу, D-маннозу и сиаловую кислоту. Кератансульфат II был обнаружен в хрящевой ткани, костях, межпозвоночных дисках. В его состав помимо сахаров дисахаридной единицы входят N-ацетилгалактозамин, L-фукоза, D-манноза и сиаловая кислота. Кератансульфат II входит в состав агрекана и некоторых малых протеогли-канов хрящевого матрикса. В отличие от других гликозаминогликанов, кератансульфаты вместо гексуроновой кислоты содержат остаток галактозы (см. схему Б).
Схема Б
Молекулярная масса одной цепи кератансуль-фата колеблется от 4х10 3 до 20х10 3 Д.
Дерматансульфат широко распространён в тканях животных, особенно он характерен для кожи, кровеносных сосудов, сердечных клапанов.
В составе малых протеогликанов (бигликана и декорина) дерматансульфат содержится в межклеточном веществе хрящей, межпозвоночных дисков, менисков. Повторяющаяся дисахарид-ная единица дерматансульфата имеет следующую структуру (см. схему В).
Схема В
Молекулярная масса одной цепи дерматансульфата колеблется от 15х10 3 до 40х10 3 Д.
Гепарин — важный компонент противосвёр-тывающей системы крови (его применяют как антикоагулянт при лечении тромбозов). Он синтезируется тучными клетками и находится в гранулах внутри этих клеток. Наибольшие количества гепарина обнаруживаются в лёгких, печени и коже. Дисахаридная единица гепарина похожа на дисахаридную единицу гепаран-сульфата. Отличие этих гликозаминогликанов заключается в том, что в гепарине больше N-сульфатных групп, а в гепарансульфате больше N-ацетильных групп. Молекулярная масса гепарина колеблется от 6х10 3 до 25х10 3 Д (см. схему Г).
Схема Г
Гепарансульфат находится во многих органах и тканях. Он входит в состав протеогликанов базальных мембран. Гепарансульфат является постоянным компонентом клеточной поверхности. Структура дисахаридной единицы гепаран-сульфата такая же, как у гепарина. Молекулярная масса цепи гепарансульфата колеблется от 5x10 3 до 12х10 3 Д.
Б. Синтез и разрушение гликозаминогликанов
Метаболизм гликозаминогликанов зависит от соотношения скорости их синтеза и распада.
Синтез гликозаминогликанов
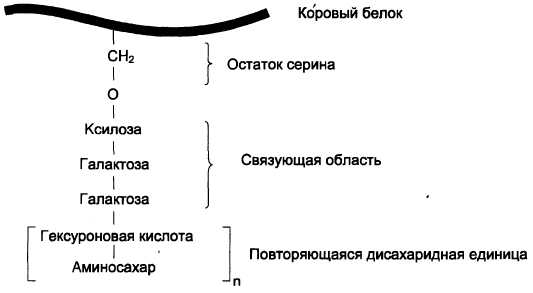
Полисахаридные цепи гликозаминогликанов практически всегда связаны с белком, который называется коровым, или сердцевинным. Присоединение полисахарида к белку осуществляется через связующую область, в состав которой чаще всего входит трисахарид галактоза-галактоза-ксилоза (рис. 15-14).
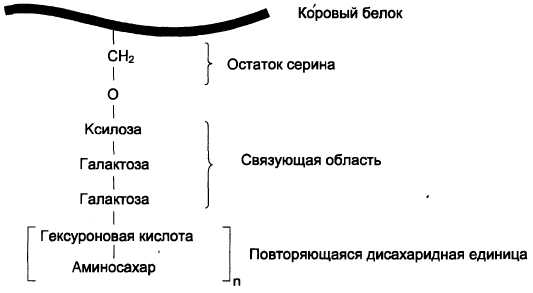
Рис. 15-14. Связующая область гликозаминогликанов
- О-гликозидной связью между серином и ксилозой;
- О-гликозидной связью между серином или треонином и N-ацетилгалактозамином;
- N-гликозиламиновой связью между амидным азотом аспарагина и N-ацетилглюко-замином.
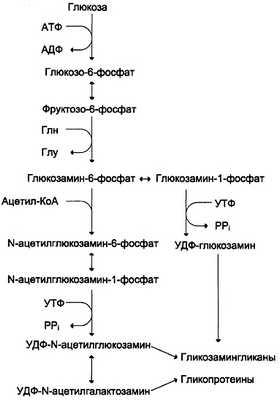
Полисахаридные цепи гликозаминогликанов синтезируются путём последовательного присоединения моносахаридов. Донорами моносахаридов обычно являются соответствующие нуклеотид-сахара. Реакции синтеза гликозаминогликанов катализируют ферменты семейства трансфераз, обладающие абсолютной субстратной специфичностью. Эти трансферазы локализованы на мембранах аппарата Гольджи. Сюда по каналам ЭР поступает коровый белок, синтезированный на полирибосомах, к которому присоединяются моносахариды связующей области и затем наращивается вся полисахаридная цепь. Сульфатирование углеводной части происходит здесь с помощью сульфотрансферазы, донором сульфатной группы выступает ФАФС (см. раздел 12).
Схема Д
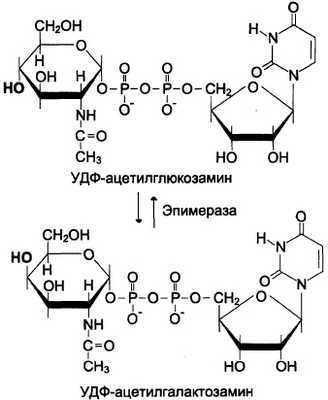
Аминосахара синтезируются из глюкозы; в соединительной ткани -20% глюкозы используется таким образом. Непосредственным предшественником N-ацетилглюкозамина, N-ацетилгалакто-замина и сиаловой кислоты является фрукгозо-6-фосфат. Источником NH2-rpynnы в этих сахарах служит глутамин. Аминосахар далее ацетилируется с помощью ацетил-КоА. Активированными формами этих аминосахаров служат их УДФ-производные (схема, рис. 15-15).
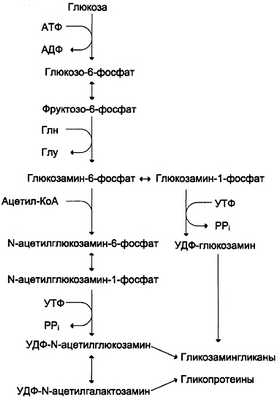
Рис. 15-15. Схема синтеза аминосахаров
Источниками глюкуроновой кислоты в организме человека могут быть пища, внутриклеточное лизосомальное разрушение гликозаминогликанов и синтез глюкуроновой кислоты. Активированная форма глюкуроновой кислоты (УДФ-глюкуронат) образуется при окислении УДФ-глюкозы (см. схему Е).
Схема Е
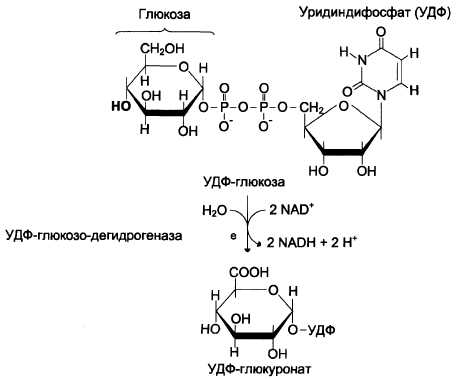
L-идуроновая кислота образуется после включения D-глюкуроновой кислоты в углеводную цепь в результате реакции эпимеризации.
На синтез гликозаминогликанов влияют глю-кокортикоиды: они тормозят синтез гиалуроно-вой кислоты и сульфатированных гликозаминогликанов. Показано также тормозящее действие половых гормонов на синтез сульфатированных гликозаминогликанов в органах-мишенях.
Разрушение гликозаминогликанов
Гликозаминогликаны отличаются высокой скоростью обмена: полупериод жизни (Т1/2) многих из них составляет от 3 до 10 дней (только для кератансульфата Т1/2 -120 дней). Разрушение полисахаридных цепей осуществляется экзо- и эндогликозидазами и сульфатазами, к которым относят гиалуронидазу, глюкуронидазу, галактозидазу, идуронидазу и др. Из внеклеточного пространства гликозаминогликаны поступают в клетку по механизму эндоцитоза и заключаются в эндоцитозные пузырьки, которые затем сливаются с лизосомами. Лизосомальные гидролазы обеспечивают постепенное полное расщепление гликозаминогликанов до мономеров.
Мукополисахаридозы — наследственные тяжёлые заболевания, проявляющиеся значительными нарушениями в умственном развитии детей, поражениями сосудов, помутнением роговицы, деформациями скелета, уменьшением продолжительности жизни. В основе мукополисахаридозов лежат наследственные дефекты каких-либо гидролаз, участвующих в катаболизме гликозаминогликанов. Эти заболевания характеризуются избыточным накоплением гликозаминогликанов в тканях, приводящим к деформации скелета и увеличению органов, содержащих большие количества внеклеточного матрикса. Обычно поражаются ткани, в которых в норме синтезируются наибольшие количества гликозаминогликанов. В лизосомах при этом накапливаются не полностью разрушенные гликозаминогликаны, а с мочой выделяются их олигосахаридные фрагменты. Известно несколько типов мукополисахаридозов, вызванных дефектами разных ферментов гидролиза гликозаминогликанов. Основные типы мукополисахаридозов приведены в табл. 15-5.
Таблица 15-5.
Типы мукополисахаридозов
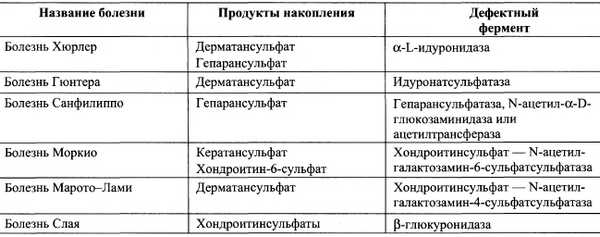
Для постановки диагноза конкретного заболевания обычно определяют активность лизосомальных гидролаз. Так как эти болезни в настоящее время не поддаются лечению, необходимо проводить пренатальную диагностику при подозрении на носительство дефектных генов.
В. Строение и виды протеогликанов
В межклеточном матриксе присутствуют разные протеогликаны. Среди них есть очень крупные — например агрекан и версикан. Кроме них, в межклеточном матриксе имеется целый набор так называемых малых протеогликанов, которые широко распространены в разных видах соединительной ткани и выполняют там самые разнообразные функции.
Основной протеогликан хрящевого матрикса называется агрекан, он составляет 10% по весу исходной ткани и 25% сухого веса хрящевого матрикса. Это очень большая молекула, в которой к одной полипептидной цепи присоединены до 100 цепей хондроитинсульфатов и около 30 цепей кератансульфатов. По форме молекула агрекана напоминает бутылочный «ёршик» (рис. 15-16).
Рис. 15-16. Строение агрекана. ГК — гиалуроновая кислота; 1 — хондроитинсульфат; 2 — кератансульфат; 3 — сердцевинный белок. В центре молекулы находится сердцевинный белок (молекулярная масса -220 кД), имеющий три глобулярных домена: G1, G2, G3, выполняющих разные функции. N-концевой домен G1 обеспечивает связывание агрекана с гиалуроновой кислотой и низкомолекулярным связывающим белком; функция домена G2 пока неизвестна; С-концевой домен G3 обеспечивает присоединение агрекана к другим молекулам межклеточного матрикса и, возможно, участвует в межклеточных взаимодействиях. Между доменами G2 и G3 находятся области, в которых к белку присоединяются кератансульфаты и хон-дроитинсульфаты. В этих областях в коровом белке имеются пептидные участки, состоящие из 6 и 19 аминокислотных остатков, которые повторяются от 10 до 20 раз
В хрящевой ткани молекулы агрекана собираются в агрегаты с гиалуроновой кислотой и небольшим связывающим белком. Оба компонента присоединяются к агрекану нековалентными связями в области домена G1. Домен G1 взаимодействует примерно с пятью дисахарид-ными единицами гиалуроновой кислоты, далее этот комплекс стабилизируется связывающим белком; домен G1 и связывающий белок вместе занимают 25 дисахаридных единиц гиалуроновой кислоты. Конечный агрегат с молекулярной массой более 200х10 6 Д состоит из одной молекулы гиалуроновой кислоты и —100 молекул агрекана (и такого же количества связывающего белка). Координация сборки этих агрегатов является центральной функцией хондроцитов. Агрекан и связывающий белок продуцируются этими клетками в необходимых количествах. Эти компоненты могут взаимодействовать друг с другом внутри клетки, но процесс агрегации полностью завершается в межклеточном матриксе. Показано, что гиалуроновая кислота образуется на поверхности хондроцитов специфической синтетазой и «выталкивается» в межклеточное пространство, чтобы связаться с агреканом и связывающим белком. Созревание функционально активного тройного комплекса составляет около 24 ч.
Катаболизм агрекана изучен в настоящее время недостаточно. Имеются данные о наличии в хрящевом межклеточном матриксе фермента агреканазы. Местом действия этого фермента является интерглобулярная область между доменами G1 и G2. Кроме того, в зоне присоеди расщепления агрекана. Конечный продукт расщепления агрекана представляет собой комплекс домена G1, связывающего белка и гиалу-роновой кислоты. Он поступает в хондроцит по механизму эндоцитоза и подвергается расщеплению лизосомальными гидроксилазами.
Малые протеогликаны
Малые протеогликаны — протеогликаны с низкой молекулярной массой. Они содержатся в хрящах, сухожилиях, связках, менисках, коже и других видах соединительной ткани.
Эти протеогликаны имеют небольшой кодовый белок, к которому присоединены одна или две цепи гликозаминогликанов. Наиболее изучены декорин, бигликан, фибромодулин, лю-микан, перлекан.
Коровые белки бигликана и декорина похожи по размерам и структуре (молекулярная масса 36 000 и 38 000 Д, соответственно). Они имеют несколько тандемных повторов, богатых лейцином, которые образуют а-спирали или β -структуры. На N- и С-концах этих белков имеются домены, содержащие S-S-связи. Коровые белки значительно различаются по первичной структуре в N-концевых областях, что определяет различия в присоединении гликозаминогликанов. Бигликан содержит серин в положениях 5 и 11, что обеспечивает присоединение двух полисахаридных цепей. Декорин содержит один серин в положении 4, поэтому к нему присоединяется одна полисахаридная цепь. У этих протеогликанов полисахаридные цепи представлены дерматансульфатом с молекулярной массой -30 000 Д (рис. 15-17).
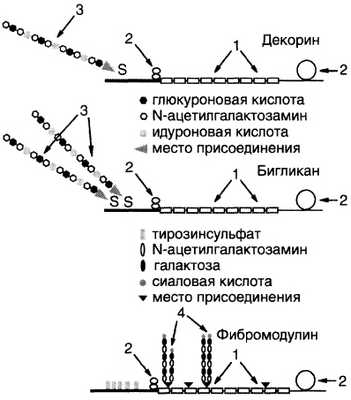
Рис. 15-17. Малые протеогликаны хряща. 1 — области повторяющихся аминокислотных последовательностей, богатых лейцином, образуют сх-спирали или p-структуры; 2 — домены в N- и С-концевых областях сердцевинных белков, содержащие S-S-связи; 3—цепи дерматансульфатов, которые присоединяются к ОН-группе серина (S) в N-концевой области; 4 — короткие цепи, которые присоединяются к белку в области повторов, богатых лейцином; это присоединение опосредовано олигосахаридами у, которые связываются с белком по NH2-rpynne аспарагина
Коровый белок фибромодулина (молекулярная масса ~40 000 Д) тоже имеет области тандемных повторов, богатые лейцином, но его N-концевая область отличается тем, что не содержит серина, а имеет несколько сульфатированных остатков тирозина, поэтому одна или две цепи кератансульфата присоединяются к коровому белку фибромодулина не в N-концевой, а в области, богатой лейцином, через NH2-rpynny аспарагина.
Малые протеогликаны являются мультифунк-циональными макромолекулами. Они могут связываться с другими компонентами соединительной ткани и оказывать влияние на их строение и функции. Например, декорин и фибромодулин присоединяются к фибриллам коллагена II типа и ограничивают их диаметр (т.е. препятствуют образованию толстых фибрилл). Декорин и бигликан, присоединяясь к фибронектину, подавляют клеточную адгезию, а присоединяясь к фактору роста опухолей β, снижают его митогенную активность. Кроме этого, имеется большое количество данных о том, что малые протеогликаны играют важную регуляторную роль в процессах развития и восстановления соединительной ткани.
Протеогликаны базальных мембран
Протеогликаны базальных мембран отличаются значительной гетерогенностью. Это преимущественно гепарансульфатсодержащие протеогликаны (ГСПГ), представленные двумя разновидностями: высокой и низкой плотности (рис. 15-18).
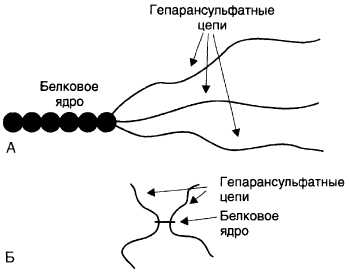
Рис. 15-18. Гепарансульфатсодержащие протеогликаны низкой (А) и высокой (Б) плотности. Гепарансульфатсодержащие протеогликаны высокой плотности имеют звездообразную форму и состоят из четырёх коротких гепарансульфатных цепей, связанных с небольшим белковым ядром. Гепарансульфатсодержащие протеогликаны низкой плотности имеют большое многодоменное белковое ядро, представленное одной по-липептидной цепью. К одному из полюсов ядра прикреплены три длинные гепарансульфатные цепи
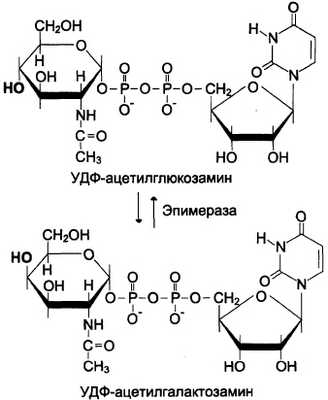
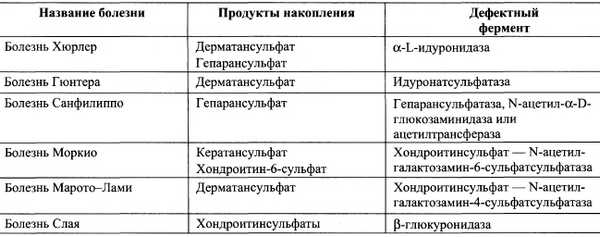
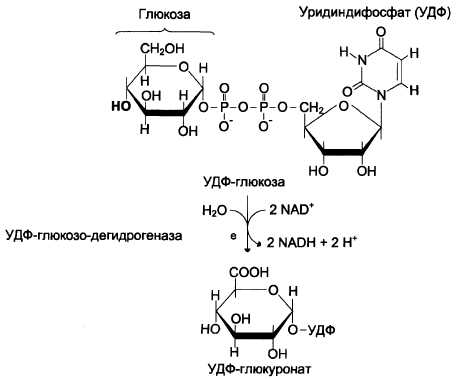
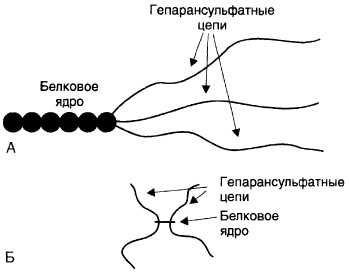
Рис. 15-18. Гепарансульфатсодержащие протеогликаны низкой (А) и высокой (Б) плотности. Гепарансульфатсодержащие протеогликаны высокой плотности имеют звездообразную форму и состоят из четырёх коротких гепарансульфатных цепей, связанных с небольшим белковым ядром. Гепарансульфатсодержащие протеогликаны низкой плотности имеют большое многодоменное белковое ядро, представленное одной полипептидной цепью. К одному из полюсов ядра прикреплены три длинные гепарансульфатные цепи
Читайте также:
- Транспорт кислорода артериальной кровью. Диффузия кислорода
- Укрепление сердечно-сосудистой системы у легочных больных. Подготовка сердечно-сосудистой системы к операции
- Типы каспаз и их участие в регуляции апоптоза
- Хронические пневмонии у детей с пороком сердца. Легочная гипертензия и повторные пневмонии
- Режимы проведения химиотерапии рака
