Техника бронхо-сосудистой окклюзии. Этапы бронхо-сосудистой окклюзии
Добавил пользователь Валентин П. Обновлено: 08.01.2026
В последнее десятилетие при лечении атеросклеротического поражения артерий нижних конечностей широкое распространение получили эндоваскулярные методики - баллонная ангиопластика и стентирование (эндопротезирование). Рекомендации наиболее известных Европейских, Американских и Российских обществ ангиологов и сосудистых хирургов (TASC, ACC/AHA, РОАСХ, CIRSE) рассматривают их в качестве метода выбора при сегментарных стенозах и окклюзиях артериального русла таза и нижних конечностей, вне зависимости от локализации поражения.
Рис. 1. Этапы эндоваскулярного стентирования при атеросклеротическом поражении поверхностной бедренной артерии (ПБА): а) окклюзия ПБА, б) реканализация окклюзии артерии с помощью проводника, в) имплантация внутрисосудистого стента в пораженный сосуд, г) после вмешательства — проходимость артерии полностью восстановлена.
Рис. 2. Эндоваскулярное стентирование при атеросклеротическом поражении артерий таза: а) стеноз общей подвздошной артерии (стрелка), тотальная окклюзия наружной подвздошной артерии (двойная стрелка), б) после вмешательства — проходимость артерий таза полностью восстановлена (стрелки).
Большинство специалистов из наиболее развитых стран рекомендуют в экстренных ситуациях, когда заболевание грозит ампутацией конечности, в первую очередь выполнять эндоваскулярные вмешательства при любых протяженности и характере поражения, надеясь на сохранение проходимости артерий в сроки 12 - 24 мес. послеоперационного наблюдения. Основой этого является быстрое устранение клинической симптоматики, а также тот факт, что эндоваскулярные вмешательства сохраняют возможность повторных чрескожных интервенций или традиционных сосудистых операций.
Несмотря на высокую эффективность эндоваскулярных способов лечения атеросклеротического поражения артерий таза и нижних конечностей, накопленный многолетний мировой опыт позволил установить, что в некоторых клинических ситуациях рентгенохирургические вмешательства имеют и определенные ограничения.
По данным наиболее современного конгресса Charing Cross (England, London, май 2013), классическое эндоваскулярное стентирование артерий на бедре и в подколенной зоне при постоянном движении приводит к отдаленным осложнениям в 10-30% случаев, сопровождаясь переломами металлической конструкции стента или рестенозу внутри него. В связи с этим 81% участников указанного конгресса проголосовали против имплантации традиционных внутрисосудистых стентов в зону артерий нижних конечностей.
Учитывая рекомендации ведущих специалистов в эндоваскулярном лечении атеросклеротического поражения артерий нижних конечностей, команда профессора С.А.Капранова в своей ежедневной практике использует лишь самые современные инструменты для восстановления проходимости сосудов, применение которых обеспечивает сохранение собственных тканей организма пациента, не требует в большинстве случаев имплантации внутрисосудистых протезов и приводит к положительному клиническому результату у 93% пациентов. В подавляющем большинстве случаев мы стараемся добиться не «косметического» результата операции, сопровождающегося «красивыми» эндоваскулярными картинками после имплантации внутрисосудистых стентов, которые, как правило, предоставляются больным в большинстве лечебных учреждений, а восстановления проходимости собственных сосудов пациентов.
. ИННОВАЦИЯ — для лечения атеросклеротического поражения артерий таза и нижних конечностей наша команда, в первую очередь, применяет самые современные эндоваскулярные устройства, предназначенные для устранения основной причины заболевания - атеросклеротических бляшек и тромботических масс. К ним относятся системы AngioJet (USA), TurboHawk (USA) для атерэктомии и Ocelot (USA) для восстановления проходимости протяженных окклюзий сосудов, получившие международное признание на международных конгрессах по эндоваскулярной хирургии 2010-2013 г.г.
Рис. 3. Эндоваскулярная тромбэктомия из подвздошных артерий системой AngioJet : а) тромбоз наружной подвздошной артерии (стрелки), б) после вмешательства — проходимость артерии полностью восстановлена (стрелки) — ИМПЛАНТАЦИЯ СТЕНТА НЕ НУЖНА!
Рис. 4. Принцип эндоваскулярного удаления бляшек из сосудов: а) увеличенное изображение карбонового ножа внутри катетера, б) катетер проводят через зону поражения артерии, в) при продвижении катетер срезает атеросклеротические бляшки, г) срезанные атероматозные массы попадают в конус-накопитель катетера.
Рис. 5. Эндоваскулярная атерэктомия из артерий нижних конечностей: а) окклюзия поверхностной бедренной артерии, б) катетер-атерэктом срезает бляшки внутри сосуда, в) после вмешательства проходимость сосуда полностью восстановлена — ИМПЛАНТАЦИЯ СТЕНТА НЕ НУЖНА!, г-д) срезанные атероматозные массы внутри катетера и после их извлечения
. ИННОВАЦИЯ — даже при тех критических ситуациях, когда в процессе эндоваскулярного лечения вынуждено требуется дилатация или имплантация внутрисосудистых стентов, команда профессора С.А.Капранова применяет только самые современные материалы - баллонные катетеры с лекарственным покрытием, которые увеличивают эффективность лечения в отдаленном периоде на 32-56%, и эндоваскулярные протезы, имеющие гарантию от поломки на 5 лет.
Список использованной литературы:
- «Стентирование левой поверхностной бедренной артерии (ПБА) при облитерирующем атеросклерозе». Клиническая хирургия (национальное руководство), под ред. акад. РАН и РАМН В.С. Савельева, чл.-кор. РАМН А.И. Кириенко, ГЭОТАР-МЕДИА, 2010, 1008 стр. (соавт. С.А. Капранов, А.Г. Златовратский, А.А. Хачатуров).
Автор: Капранов С.А
Доктор медицинских наук, профессор, дважды Лауреат Государственных Премий Правительства Российской Федерации в области науки и техники, Лауреат Премии Ленинского Комсомола, автор более 350 научных работ по медицине, 7 монографий, и 10 патентов на изобретения по медицине
Техника бронхо-сосудистой окклюзии. Этапы бронхо-сосудистой окклюзии
В.Ю. МАТВЕЕВ¹, Р.М. ХАСАНОВ², А.В. БОНДАРЕВ¹, Л.Ю. КУЛАГИНА¹
¹Республиканская клиническая больница МЗ РТ, 420064, г. Казань, Оренбургский тракт, д. 138
²Казанский государственный медицинский университет, 420012, г. Казань, ул. Бутлерова, д. 49
В обзоре представлен обобщенный анализ информации из научных публикаций российских и зарубежных торакальных хирургов по применению временной эндобронхиальной окклюзии в лечении больных эмпиемой плевры с бронхоплевральными свищами.
Ключевые слова: эмпиема плевры, бронхоплевральные свищи, временная окклюзия бронхов.
V.Yu. MATVEEV¹, R.М. KHASANOV², A.V. BONDAREV¹, L.Yu. KULAGINA¹
¹Rebublical Clinical Hospital of the MH of RT, 138 Orenburgskiy Trakt, Kazan, Russian Federation, 420068
²Kazan State Medical University, 49 Butlerov St., Kazan, Russian Federation, 420012
Method of temporary occlusion of the bronchi and its effectiveness in patients with pleural empyema with bronchopleural fistulas
The paper presents an analysis of the experience of the interim endobronchial occlusion in the treatment of patients with pleural empyema with bronchopleural fistulas Russian and foreign Thoracic Surgeons, on the basis of the available literature presented in scientific publications.
Key words: pleural empyema, bronchopleural fistulas, temporary occlusion of the bronchi.
Основные принципы лечения больных эмпиемой плевры с бронхоплевральными свищами (БПС) вытекают из понимания этиопатогенеза, патоморфологических изменений в плевральной полости, причин и механизмов развития дыхательной недостаточности, тяжелой интоксикации, нарушений функций важнейших систем организма и параметров его гомеостаза. Таким образом, лечение больных с эмпиемой плевры должно быть интенсивным, комплексным и патогенетическим [1, 2].
В настоящее время метод ВОБ находит применение у большого контингента взрослых больных со спонтанным и травматическим пневмотораксом [9], для остановки внутрибронхиального кровотечения [10,11], а также для интраоперационной блокады бронха пораженного участка легкого с целью предотвращения попадания патологического содержимого в противоположный бронх, однако наибольшее применение ВОБ находит у больных с острой инфекционной деструкцией легких, осложненной пиопневмотораксом, гигантскими абсцессами легких 13.
Механизм положительного действия временной окклюзии бронхов на течение гнойно-деструктивного процесса в легком при пиопневмотораксе состоит в следующем [17]:
Суммарный эффект воздействия ВОБ на организм больного зависит от соотношения отрицательных и положительных сторон воздействия метода, общего состояния больного, и во многом индивидуален. Прослеживаются некоторые общие закономерности развития функциональных изменений в организме больного, в связи с чем выделяют 4 фазы течения постокклюзионного периода. 1-я фаза — первичная реакция на окклюзию, она продолжается 1-2 суток и может протекать как с развитием положительных, так и отрицательных изменений основных показателей дыхания и кровообращения. 2-я фаза — адаптация, продолжается около недели и характеризуется постепенным улучшением общего состояния больных, стабилизацией основных показателей дыхания и кровообращения. 3-я фаза — приходится на 7-17-е сутки после начала окклюзии и характеризуется развитием воспалительных изменений в легком и бронхах. 4-я фаза — прослежена до 21-24 суток, в этот период происходит стабилизация общего состояния и стихание воспалительных изменений в легком на фоне продолжающегося гнойного эндобронхита. Выявленные особенности постокклюзионного периода диктуют необходимость дифференцированного подхода к выбору средств комплексной консервативной терапии, в зависимости от его фазы [18, 19].
К достоинствам ВОБ многие авторы относят ее непосредственное положительное влияние на общее состояние больных. После проведения временной окклюзии бронха в первые 2-3 суток нормализуется температура тела, уменьшается одышка, прекращается гнойное отделяемое из плевральной полости, повышается физическая активность больного. Уменьшение явлений дыхательной недостаточности происходит в результате герметизации бронхиального дерева пораженного легкого и исчезновения синдрома «бронхиального сброса», быстрого расправления непораженных участков легкого и их включения в функцию дыхания, снятия синдрома интоксикации [20, 21].
ВОБ положительно влияет на гемодинамику малого круга кровообращения и центральную гемодинамику. По данным О.Ф. Штыхно, после окклюзии бронхов и расправления здоровых отделов легкого отмечается значительное уменьшение анатомического шунтированияя крови в малом круге кровообращения (более чем в 2,5 раза), снижается или сразу же нормализуется давление в легочной артерии [22].
С.В. Гришаков и соавт. в своем исследовании показали, что динамика функциональных изменений кровообращения и легочного газообмена в различные сроки эндобронхиальной окклюзии зависит от уровня обтурации. При окклюзии долевого бронха нормализация функции внешнего дыхания (урежалась ЧД, уменьшался МОД до 20%, возрастала ЖЕЛ) и легочного газообмена (возрастало использование кислорода в сочетании с увеличением его потребления на 20-30%, нормализовался уровень РаСО2 и РаО2) происходит уже в первые сутки; после окклюзии главного бронха возрастают показатели напряженности дыхания, расстройство газообмена идет по механизму внутрилегочного шунтирования со снижением потребления кислорода и сохранением низкого КИО2. Изменения центральной гемодинамики после обтурации долевого бронха характеризовались возрастанием УО и повышением МОК, в то же время после окклюзии главного бронха УО снижался и поддержание МОК достигалось за счет возрастания тахикардии. Таким образом, авторы подчеркивают, что больные с окклюзией главного бронха находятся в менее выгодных функциональных условиях, что требует дополнительных интенсивных мер по поддержанию кардиодинамики и легочного газообмена [23].
Отрицательной стороной ВОБ является исключение бронхиального дренажа и ателектазирование легочной ткани, которое наступает на 2-3-и сутки обтурации. В совокупности эти два фактора могут привести к прогрессированию деструктивного процесса, вызванного зачастую анаэробной микрофлорой в отключенной от вентиляции части легкого [24].
Несмотря на многолетний опыт применения ВОБ в лечении эмпиемы плевры, осложненной БПС, показания и противопоказания к ее применению четко не определены. По мнению большинства авторов, непосредственным показанием к применению ВОБ у больных с пиопневмотораксом является невозможность расправления коллабированного легкого активной аспирацией и массивный сброс воздуха по дренажу [25]. Показанием к ВОБ считают большие размеры абсцесса без тенденции к уменьшению после дренирования, синдром «массивной утечки воздуха», обильное отделяемое из полости абсцесса, нарастание подкожной эмфиземы, возникающей после трансторакального дренирования полости [26].
Целесообразность применения ВОБ при лечении больных с хронической эмпиемой плевры (ХЭП) признается неоднозначно и не всеми авторами. Многие считают ее применение малоэффективным, однако большинство рекомендуют ее использование в качестве дополнительного лечебного мероприятия при подготовке больных к операции с целью улучшения условий санации плевральной полости и для профилактики аспирации гнойной мокроты в здоровые отделы легких [12, 28].
В.В. Уткин и соавт. считают бесперспективным применение ВОБ при распространенной гангрене, инфильтративной и фиброзно-кавернозной формах туберкулеза легких, а также с целью ликвидации свищей культи главного бронха после пульмонэктомии [29, 30]. В.Н. Перепилицын противопоказанием к ВОБ считает эндобронхит 3-й и 2-й ст. с выраженной тенденцией к отеку слизистой, в этой ситуации автор рекомендует проведение мероприятий, направленных на снижение воспалительного процесса в бронхе и в последующем применение прерывистой окклюзии. При гангрене легкого и гангренозном абсцессе, осложнившемся пиопневмотораксом, временная окклюзия хотя и не приводит к ограничению гнойного процесса, но может с успехом применяться при подготовке больных к оперативному лечению [12, 16, 28, 31].
До применения временной окклюзии бронхов всем больным необходимо проводить комплексное лечение, направленное на стабилизацию деструктивного процесса в легком, санацию бронхиального дерева и плевральной полости, уменьшение степени выраженности интоксикации и легочно-сердечной недостаточности, повышение иммунологической реактивности организма (6, 8, 12, 14, 17, 18).
Эффективность метода ВОБ обеспечивается многими факторами. Но вопрос о степени и коррекции их влияния на результат лечения методом ВОБ окончательно не решен. Среди них одним из самых важных является определение локализации «несостоятельного» бронха. Так Т.Б. Иванова, С.В. Гришаков, так же, как и R. Rafinski, применяли визуальный поиск устья несостоятельного бронха во время бронхоскопии [7, 12, 20]. Для определения локализации бронхиальных свищей в первую очередь используются данные различных рентгенологических исследований: анализ рентгенограмм грудной клетки больного, выполненных до коллапса легкого; использование бронхографии водорастворимыми рентгенконтрастными веществами; проведение плеврографии [16, 17].
С целью осмотра плевральной полости и выявления периферических бронхиальных свищей применяют торакоскопию [5]. А.Н. Кабанов и соавт., И.Н. Денисов и соавт., Е.А. Цеймах и соавт. вводили в плевральную полость раствор красящего вещества с одновременным осмотром бронхов пораженного легкого через бронхоскоп [9, 18, 35]. В.П. Молодцова наряду с другими методами применяла метод индикации гелия в плевральной полости с помощью газового анализатора, вводимого через канал бронхофиброскопа последовательно в каждый долевой бронх легкого [28].
Наиболее целесообразной при существующей технике выполнения окклюзии является обтурация долевого, двух долевых или промежуточного бронха. Изолированная окклюзия сегментарных бронхов, как правило, оказывается недостаточно эффективной. Применение окклюзии главного бронха может быть методом выбора только в тех случаях, когда использование других способов лечения невозможно в силу тяжести состояния больного, а выполнение окклюзии более дистальных отделов бронхиального дерева технически невыполнимо или неэффективно. Окклюзия главного бронха больными переносится тяжелее, и результаты лечения значительно хуже [18].
В то же время ряд авторов сообщают о благоприятных исходах лечения больных пиопневмотораксом окклюзией главного бронха, указывая при этом на ее более низкую эффективность по сравнению с окклюзией долевых бронхов [18, 28].
Эффективность метода ВОБ зависит и от качества материала, используемого для окклюзии. R. Rafinski в 1965 г. для обтурации бронха использовал эмульсию, содержащую 20 частей талька в 40% растворе иодолипола, Ю.Ф. Исаков и соавт. (1978) — эмульсии сульфадимезина в 40%-ном растворе иодолинола, а Ю.Н. Левашов и соавт. (1983) — иодполивинол. А.Н. Кабанов и Л.А. Ситко (1985) обтурацию периферических бронхоплевральных свищей осуществляли клеевыми цианокрилатными композициями путем селективной катетеризации бронхов под рентген-телевизионным контролем. О применении цианокрилатных композиций для закрытия послеоперационных бронхиальных свищей сообщали Ю.Н. Левашев и соавт. (1989), А.Н. Кабанов и соавт. (1992), В.П. Молодцова (1994). Тем не менее использование цианокрилатных композиций для временной окклюзии бронхов при пиопневмотораксе не нашло широкого применения [21, 28].
Большинство авторов предпочитают использовать нерассасывающиеся материалы. Лучшим на сегодняшний день является крупнопористый поролон, который обладает хорошей эластичностью, достаточной механической прочностью, плотно фиксируется в просвете бронха и обеспечивает полную его герметичность. В.П. Молодцова считает наиболее перспективным видом окклюзии сочетание обтурации мелких сегментарных бронхов рассасывающимися губками, а долевых бронхов — поролоновыми блокаторами [17]. Для повышения герметичности и возможности рентгенологического контроля некоторые ученые применяют импрегнирование поролона иодолиполом. Однако такая обработка обладает и существенными недостатками: в результате пропитывания иодолиполом губка плохо фиксируется в бронхе и может мигрировать в бронхиальное дерево. Поэтому В.П. Молодцова предлагает использовать обработку пopoлоновых обтураторов порошком тантала, который не имеет отмеченных недостатков и обладает большой рентгеноконтрастностью [28]. А.Ф. Греджев и соавт. изготавливают поролоновую пломбу на металлической основе [15]. Большинство авторов применяют поролоновые обтураторы в форме шара, диаметр которого в 2-3 раза превышает диаметр обтурируемого бронха [18, 20]. В то же время В.Ф. Соботович и А.С. Коган сообщают о применении поролоновых обтураторов, которые лишь в 1,5-2 раза превышали диаметр обтурируемого бронха, а Т.Ф. Петренко и соавт. применяли обтуратор, изготовленный в виде цилиндра диаметром 1,0-1,5 см и длиной 1,5-2 см. Однако существует опасность смещения таких узких обтураторов. При применении же обтураторов больших размеров возможно развитие выраженных деструктивных изменений в стенке обтурируемого бронха и окклюзированной легочной ткани [18, 28].
Я.Г. Колкин с соавт. использовали полый обтуратор из поролона на гибкой металлической основе с санационным катетером, через который проводилась проточная санация пораженного участка легкого ниже уровня окклюзии [24].
Противоречиво освещен в литературе вопрос о необходимых сроках окклюзии. В первых работах, опубликованных в нашей стране, оптимальными сроками считали 7-10 суток. Однако, как показывали результаты лечения, эти сроки ВОБ у взрослых больных с пиопневмотораксом оказались недостаточными для получения стойкого лечебного эффекта[29]. Поэтому большинство авторов чаше всего применяют 2-недельную временную окклюзию бронха [16, 18, 20]. В то же время А.Ф. Греджев и соавт. указывают, что обтурацию необходимо продолжать до 3 недель, а возникающие изменения в стенке бронха носят обратимый характер [15]. По данным С.В. Гришакова, Ю.Н. Левашева с соавт. срок окклюзии не должен превышать 21-24 дня, так как увеличение продолжительности окклюзии не улучшает результатов лечения больных и может привести к необратимым морфологическим изменениям в легком [18, 21]. По мнению Т.Б. Ивановой сроки ВОБ должны зависеть от общего состояния больного, уровня интоксикации и от степени выраженности воспалительных изменений в окклюзированной доле легкого. При наличии умеренных изменений автор рекомендует применять непрерывную методику с перетампонадой через 7 дней. При выраженных изменениях в окклюзированной доле рекомендуется применение прерывистой методики. Таким образом, можно добиться значительной продолжительности окклюзии [20]. Так В.П. Быков (1990) сообщает об увеличении общей продолжительности ВОБ у одного больного до 32 дней, Т.Ф. Петренко и соавт. (1987) — до 45 дней, а А.Ф. Греджев и соавт. (1983) — до 52 дней. Т.Ф. Петренко с соавт. (1987) показанием к удалению обтуратора считают расправление легкого при полном прекращении поступления воздуха по плевральным дренажам в течение 5-6 дней; уменьшение и очищении плевральной полости при стабилизации ее размеров в течении 5-6 дней; неэффективность временной окклюзии бронха [14].
Таким образом, из анализа известной литературы следует настоятельная необходимость дальнейшего усовершенствования методики временной окклюзии бронхов. В литературе отсутствуют четкие критерии оценки результатов лечения. Непосредственные результаты лечения с применением ВОБ оцениваются по совокупности клинических, рентгенологических и эндоскопических данных. В.П. Молодцова руководствуется следующими критериями: полное выздоровление, когда у пациентов отсутствовали клинико-рентгенологические признаки заболевания; клиническое выздоровление, когда отсутствовали клинические признаки заболевания, а при рентгенографии выявлялись незначительные изменения в виде сухих остаточных плевральных или внутрилегочных полостей; неудовлетворительные, когда не удалось добиться ликвидации бронхоплеврального или бронхиального свища и процесс принимал хроническое течение [17]. Ф.Ф. Агаев и соавт. считают хорошим результатом при создании стойкой герметичности в плевральной полости и полном расправлении легкого с последующим выздоровлением больного; удовлетворительным — при частичном расправлении легкого с наличием небольшой остаточной полости, исчезновением дыхательной недостаточности, тяжелой интоксикации, ускорением сроков последующего лечения; отрицательным — при сохранении бронхиального свища отсутствии тенденции к стойкому расправлению легкого, сохранении дыхательной недостаточности [3]. Большинство авторов, оценивая результаты лечения больных с пиопневмотораксом методом ВОБ, сообщает о хороших непосредственных результатах. Полное и клиническое выздоровление по данным И.Н. Денисова и соавт., Б.Я. Гаусмана и соавт., Т.Ф. Петренко и соавт., Ю.Н. Левашева и соавт., В.Н. Перепелицына достигается в 86-94,4% случаев [5, 26, 30, 35]. Несколько ниже процент полного и клинического выздоровления (от 71 до 83%) приводят А.Н. Кабанов и соавт., С.В. Грищаков, В.П. Молодцова 18.
Большинство авторов, применявших ВОБ при лечении острого пиопневмоторакса считают метод высокоэффективным и рекомендуют его к широкому применению [17, 18, 25]. Частым исходом пиопневмоторакса при применении ВОБ является расправление легкого с образованием остаточной плевральной полости (13-54% пациентов) [16-18, 26].
В научной литературе мало обсуждается вопрос о факторах, влияющих на эффективность проводимого лечения с применением ВОБ. Т.В. Иванова считает, что результаты лечения, прежде всего, зависят от длительности коллабирования легкого до применения окклюзии, от распространенности процесса и тяжести пиопневмоторакса [20].
Летальность при применении ВОБ колеблется от 1,9 до 10%. Причинами смерти являются пневмогенный сепсис, прогрессирование гнойного процесса, тотальная эмпиема плевры [14, 20].
Обобщая данные литературы, следует отметить, что за последние годы малотравматичные способы хирургического лечения нашли широкое применение в практике клиник, занимающихся проблемами торакальной хирургии. Особенно это актуально при лечении послеоперационных эмпием плевры с бронхиальными свищами. Актуальным остается вопрос об их сочетанном использовании с целью повышения эффективности хирургического лечения эмпиемы плевры больных эмпиемой плевры с БПС. Поэтому целесообразность поиска новых и совершенствование известных «щадящих» методов лечения эмпием плевры, определения их места в алгоритме комбинированного хирургического лечения не вызывает сомнений и в настоящее время.
Институт хирургии им. А.В. Вишневского Минздрава РФ, Москва
Институт хирургии им. А.В. Вишневского, Москва
ФГБУ НМИЦ «Институт хирургии им. А.В. Вишневского» Минздрава России, Москва, Россия
Несостоятельность шва бронха после пневмонэктомии — одно из самых тяжелых осложнений в торакальной хирургии, летальность в этом случае достигает 20—30%. Частота несостоятельности культи главного бронха после пневмонэктомии зависит от многих факторов: этиологии первичного заболевания, соматического статуса пациента и компенсации сопутствующих заболеваний, варианта формирования шва, длины культи бронха и в специализированных отделениях торакальной хирургии составляет от 2,5 до 13,3% [1—4].
Тактика лечения пациентов с БПС зависит от сроков диагностики несостоятельности культи бронха — при ранней несостоятельности оправданы попытки повторной резекции и ушивания культи главного бронха, в то время как при развитии эмпиемы плевры целесообразно этапное лечение с ликвидацией бронхоплеврального свища после санации плевральной полости. Сегодня нет единого взгляда на тактику лечения пациентов с несостоятельностью культи главного бронха при неспецифической эмпиеме плевры — предложены различные методы эндобронхиальной окклюзии главного бронха, трансцервикальной эндоскопической окклюзии культи бронха. Однако эти технологии не имеют широкого распространения, а их преимущества и недостатки описаны в отдельных сериях наблюдений [5—9]. Одна из радикальных операций при бронхиальных свищах — трансстернальная трансперикардиальная окклюзия культи главного бронха, подробно описанная Л.К. Богушем и соавт. [10] в 1972 г., до настоящего времени широко распространена во фтизиохирургии. Однако публикации о выполнении этой операции у пациентов с неспецифической эмпиемой плевры как в российской, так и в зарубежной литературе немногочисленны. В настоящей работе представлены дифференцированный подход к выбору метода ликвидации бронхоплеврального свища и результаты выполнения трансстернальной окклюзии культи главного бронха на фоне неспецифической эмпиемы плевры.
Материал и методы
В период с апреля 2005 г. по декабрь 2016 г. проведено лечение 32 пациентов с бронхоплевральными осложнениями после анатомических резекций легких. Пневмонэктомия выполнена 27 пациентам по поводу немелкоклеточного рака легкого, метастатического поражения и воспалительных заболеваний легких — 15 (55,5%), 3 (11,1%) и 9 (33,3%) больных соответственно. Два пациента исключены из анализа в связи с отсутствием данных в первичной медицинской документации.
Проанализированы результаты лечения 25 пациентов с несостоятельностью культи главного бронха и неспецифической эмпиемой плевры после пневмонэктомии. Медиана возраста составила 59 лет (50; 61 год), преобладали мужчины (23:2). Правосторонняя пневмонэктомия выполнена 15 (60%) пациентам (95% ДИ 40,7—66,7). Длительность течения заболевания от манифестации эмпиемы плевры до госпитализации в стационар составила 3—58 мес, медиана 21 (16; 36) мес. Таким образом, у всех пациентов наблюдали хроническую эмпиему плевры на фоне бронхоплеврального свища.
Основными жалобами пациентов были кашель с обильным отхождением слизисто-гнойной мокроты, одышка при физической нагрузке, нарушение фонации (вплоть до афонии), субфебрильная температура тела.
Пациенты обследованы по единому протоколу, который включал бронхоскопию с измерением длины культи главного бронха, диаметра свищевого хода; бронхоальвеолярный лаваж и бактериологическое исследование отделяемого из трахеобронхиального дерева; мультиспиральную компьютерную томографию (МСКТ) грудной клетки с трехмерной реконструкцией трахеобронхиального дерева и элементов корня легкого.
На первом этапе лечения проводили санацию остаточной плевральной полости. В связи с длительным течением заболевания для обеспечения адекватной санации плевральной полости формирование торакостомы потребовалось 12 (48%) пациентам, дренирование и торакоскопическая санация проведены 8 (32%) и 5 (20%) пациентам соответственно.
После завершения санации плевральной полости пациентов разделили на две группы в зависимости от длины культи главного бронха: 20 мм и более — 1-я группа (основная), менее 20 мм — 2-я группа (контроль). В 1-й группе 9 (36%) пациентам выполнена трансстернальная окклюзия культи главного бронха, во 2-й группе 16 (64%) пациентам выполнена пластика культи бронха перемещенным мышечным лоскутом на сосудистой ножке (14; 87,5%) или прядью большого сальника (2; 12,5%).
В основной группе диаметр свищевого хода составил от 2 до 15 мм, длина культи бронха варьировала от 20 до 60 мм. Преобладали мужчины — 8:1. Соотношение право- и левосторонней несостоятельности культи бронха составило 4:5. Одномоментное хирургическое лечение проведено 3 пациентам — выполнена трансстернальная окклюзия культи бронха с одномоментной торакоскопической санацией остаточной плевральной полости. Этапное лечение, включавшее формирование боковой торакостомы, в последующем основной этап (трансстернальная окклюзия) и отсроченная торакопластика осуществлены 5 пациентам. Время выполнения трансстернальной окклюзии 240—280 мин, медиана 261 (235; 300) мин.
Описание операции
Положение пациента на спине с приведенными вдоль тела руками и «валиком» под лопатками. Интубация главного бронха единственного легкого под контролем фибробронхоскопии. Все пациенты оперированы из полной срединной стернотомии. После выделения структур переднего средостения отдельными лигатурами фиксировали безымянную вену, брахицефальный ствол, общую сонную артерию. Переднебоковые стенки трахеи мобилизовали от шейного отдела до бифуркации. При правосторонней локализации бронхоплеврального свища после удаления медиастинальной клетчатки из аортокавального промежутка выполняли рассечение переднего листка перикарда. Из окружающих тканей выделяли культю главного бронха и через аортокавальный промежуток с помощью сшивающего аппарата выполняли его окклюзию на минимальном расстоянии от бифуркации трахеи (см. рисунок).
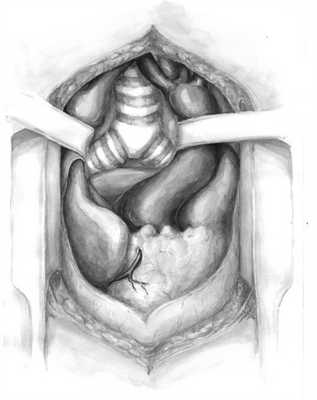
Аортокавальный промежуток (пространство Амбруцини) (рисунок Е.А. Воробьевой). Центральную культю главного бронха дополнительно укрепляли отдельными узловыми швами. При наличии факторов риска несостоятельности культи бронха формировали мышечный лоскут на питающей ножке из медиальной порции правой большой грудной мышцы, которым дополнительно укрепляли окклюзированную культю главного бронха. При левосторонней локализации мобилизацию осуществляли по левой стенке трахеи до бифуркации последней с диссекцией и мобилизацией дуги аорты и левого предсердия.
С целью контроля герметичности бронхиальной культи выполняли водную пробу и санационную бронхоскопию. В ретростернальное пространство устанавливали один термопластичный силиконовый дренаж. У 2 пациентов одномоментно выполнена санация остаточной плевральной полости через мини-торакотомию с установкой проточно-промывного дренажа.
Результаты
Результаты лечения пациентов прослежены в период от 18 до 110 мес, медиана 48 (19; 52) мес. Результаты хирургического лечения оценивали как хорошие (при купировании воспаления, отсутствии бронхоплеврального свища и ликвидации торакостомы), удовлетворительные (отсутствие бронхоплеврального свища при возможном сохранении, постоянном или временном, торакостомы) и неудовлетворительные (рецидив бронхоплеврального свища и/или эмпиемы плевры).
Умерли 2 (8%) пациента (95% ДИ 2,2—25), из них 1 — после трансстернальной окклюзии и 1 в группе контроля — после пластики культи бронха лоскутом широчайшей мышцы спины. Причины летальных исходов — острая дыхательная недостаточность на фоне острого респираторного дистресс-синдрома и прогрессирование полиорганной недостаточности на фоне гнойно-септических осложнений на 12-е и 36-е сутки после операции соответственно.
Рецидива заболевания после выполнения трансстернальной окклюзии не было. В группе контроля рецидив бронхоплеврального свища отмечен у 2 (12,5%) пациентов (95% ДИ 3,5—36).
Медиана продолжительности лечения в стационаре составила 13 (13;16) сут у пациентов после трансстернальной окклюзии культи главного бронха и 20 (11; 35) сут в группе контроля (p<0,05).
Таким образом, хороший и удовлетворительный результаты лечения после трансстернальной окклюзии культи главного бронха достигнуты у 23 (92%) из 25 пациентов (95% ДИ 75—97,8).
По данным Европейского общества торакальных хирургов (ESTS), частота несостоятельности культи главного бронха после пневмонэктомии составляет 1,8% [11]. Стандартизация лечения этой разнородной группы пациентов крайне сложна, в связи с этим до сих пор актуален опыт отдельных учреждений и публикации серий клинических наблюдений [12, 13]. Алгоритм лечения пациентов с несостоятельностью культи бронха после пневмонэктомии включает 3 основные задачи: санацию плевральной полости, ликвидацию патологического бронхоплеврального соустья и устранение дефекта мягких тканей грудной клетки. В систематическом обзоре I. Zahid и соавт. [14], проанализировав результаты исследований, отвечающих на вопрос о лучшем методе лечения эмпиемы плевры после пневмонэктомии, пришли к выводу, что открытые операции обеспечивают лучший контроль над заболеванием, сопряжены с меньшей продолжительностью стационарного лечения и меньшей частотой повторных операций. В нашей серии наблюдений торакостомия на первом этапе лечения была необходима 12 (48%) из 25 пациентов, дренирование и торакоскопическая санация проведены 8 (32%) и 5 (20%) пациентам соответственно.
Настоящая работа посвящена дифференциальному подходу к выбору метода ликвидации бронхоплеврального соустья, который традиционно основан на оценке длины культи бронха и диаметра свищевого хода, фазы эмпиемы плевры, выраженности интоксикационного синдрома, характера предшествующих операций.
Трансстернальная окклюзия культи главного бронха — один из методов лечения несостоятельности культи главного бронха, предложенный J. Ambruzini в 1961 г. В 1964 г. Л.К. Богуш и Ю.Л. Семененков модифицировали метод Ambruzini, для улучшения доступа к культе бронха стали широко вскрывать перикард по передней, верхней и задней поверхностям, повторно обрабатывать и рассекать культю легочной артерии, что создавало наилучшие условия для манипуляций в аортокавальном промежутке [10]. Отдельные технические особенности выполнения трансстернальной окклюзии модифицированы и оптимизированы разными авторами, однако до настоящего времени выполнение окклюзии главного бронха через срединную стернотомию остается сложной операцией, и выполнять ее рекомендуется только в специализированных отделениях торакальной хирургии. Медиастинальная лимфоаденэктомия при расширенной пневмонэктомии предопределяет сложность мобилизации трахеи и главных бронхов на фоне выраженного спаечного процесса, что является одной из особенностей операций при неспецифической эмпиеме плевры. При определении показаний к трансстернальной окклюзии в настоящем исследовании длина культи бронха не менее 20 мм была определена в качестве пограничной. Это обусловлено в первую очередь опытом выполнения трансстернальной окклюзии главного бронха в конкретном учреждении и выбором аппаратного шва для повторного формирования культи бронха, что требует большей длины бронха, чем при ручном шве. Необходимо отметить, что, по данным Л.К. Богуша и соавт. [10], минимально достаточная для выполнения трансстернальной окклюзии длина культи бронха определена равной 15 мм. Еще одной обсуждаемой технической особенностью операции остается необходимость иссечения дистальной части культи резецируемого бронха. В нашем исследовании экстирпация дистальной культи бронха не выполнена у 4 из 9 пациентов в связи с выраженностью спаечных процессов в области средостения, а также в связи с интимной связью с культей легочной артерии. При отказе от удаления дистальной части культи бронха выполняли электрокоагуляцию слизистой оболочки и его ушивание с медиастинальной стороны. С целью профилактики реканализации культи бронха проксимальную и дистальную культи бронха разобщали лоскутом перикарда или мышечным лоскутом (Ginsberg). За время наблюдения рецидива свища (т.е. реканализация культи бронха) не наблюдали. Небольшое количество наблюдений не позволяет сделать окончательное заключение о необходимости указанной манипуляции, однако полученные результаты свидетельствуют о целесообразности соотношения риска и потенциальной пользы, возможности обоснованного отказа у части пациентов от этой манипуляции.
К преимуществам трансстернальной окклюзии относят снижение количества рецидивов и длительности пребывания в стационаре. Однако необходимо отметить, что такое преимущество обусловлено в большей степени тяжестью общего состояния пациентов и фазой раневого процесса, в которой находятся больные при выборе других методов лечения.
Таким образом, меньшая травматичность и хорошая воспроизводимость трансстернальной окклюзии культи главного бронха в сравнении с транспозицией свободных тканевых лоскутов при длине культи бронха 20 мм и более на фоне хронической эмпиемы плевры позволяет рассматривать эту операцию в качестве метода выбора у отобранной группы пациентов.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Печетов А.А., Грицюта А.Ю., Есаков Ю.С., Леднев А.Н. Трансстернальная окклюзия культи главного бронха при бронхоплевральном свище и неспецифической эмпиеме плевры. Хирургия. Журнал им. Н.И. Пирогова. 2019;7:5-9. doi: 10.17116/hirurgia2019071
Одним из патогенетических факторов возникновения и хронизации эмпиемы плевры является бронхоплевральный свищ (БПС) [6].
Оперативные вмешательства, направленные на ликвидацию эмпиемы плевры, характеризуются высокими показателями рецидивов и летальности, обширным объемом повторных операций. Все это приводит к существенному увеличению сроков лечения, инвалидизации больных и снижению качества их жизни [7, 8, 11, 12].
Ранее для временной эндоскопической окклюзии бронха применяли поролоновый обтуратор, однако этот метод позволяет блокировать свищевой бронх на срок не более 14 дней. При большем сроке окклюзии бронха поролоновым обтуратором возможны осложнения, такие как ослизнение и миграция обтуратора в главные бронхи и трахею с развитием асфиксии [5]. В последние годы в клинической практике все чаще стали применять специальные клапаны, обеспечивающие разобщение БПС за счет одностороннего движения воздуха [1, 5, 8, 10]. Сравнительные результаты лечения пиопневмоторакса с применением эндобронхиального клапана и поролонового обтуратора показали отрицательную динамику соответственно в 9,6 и 68,6% наблюдений.
Цель нашего исследования - оценка эффективности применения эндобронхиального клапана у больных с бронхоплевральными свищами.
В НИИ СП им. Н.В. Склифосовского за период с февраля 2011 г. по май 2013 г. 24 больным с БПС было произведено 39 окклюзий свищевых бронхов обтураторами фирмы «Медланг». Среди больных было 16 мужчин и 8 женщин. Возраст пациентов колебался от 23 до 70 лет (в среднем 41,9±3,8 года). Причинами развития БПС у 18 (75%) больных явились гнойно-деструктивные процессы в легких, в том числе при сочетанной травме у 4 (22,2%), при пневмонии у 14 (77,8%). В 3 (12,5%) наблюдениях причиной формирования БПС были опухоли легких различной локализации, еще у 3 (12,5%) - идиопатический легочный фиброз.
Для диагностики БПС использовали три метода: хромоскопию, временную селективную окклюзию предполагаемого свищевого бронха катетером Фогарти и эндобронхиальным клапаном.
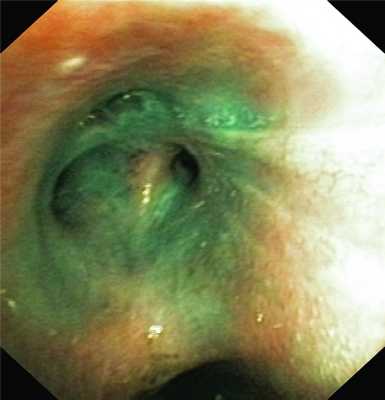
Для проведения хромоскопии использовали смесь 3% раствора перекиси водорода и 1% раствора бриллиантового зеленого в соотношении 10:1. Перекись водорода обеспечивала повышенное пенообразование, благодаря которому частота визуализации свищевого бронха увеличивалась (рис. 1 и далее на цв. вклейке). Рисунок 1. Эндофотография. Поступление красителя в просвет верхнедолевого бронха правого легкого.
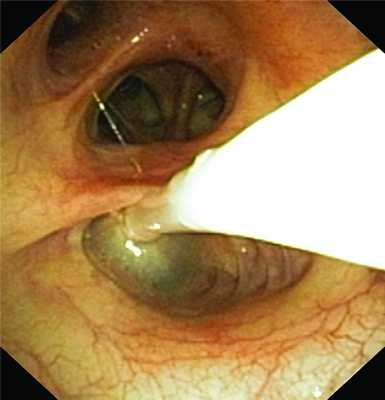
При временной диагностической окклюзии бронха баллонным катетером (рис. 2) критерием его правильной локализации являлось прекращение выделения пузырьков воздуха по дренажам из плевральной полости. Рисунок 2. Эндофотография. Селективная окклюзия бронха баллонным катетером.
Неэффективность перечисленных выше диагностических методов являлась показанием к селективной установке клапана в предполагаемый на основании данных компьютерной томографии свищевой бронх.
Перед установкой клапана осуществляли тщательную санацию трахеи и бронхов 0,01% раствором диоксидина и визуально оценивали диаметр устья бронха, в который предполагалось установить клапан.

Эндобронхиальный клапан устанавливали двумя методами. Стандартная методика заключалась в нанизывании клапана на дистальный конец эндоскопа в положении, соответствующем максимальному обзору (рис. 3). Рисунок 3. Фотография. Эндобронхиальный клапан, готовый к применению. В случае несоответствия диаметра клапана диаметру эндоскопа эндобронхиальный клапан нанизывали на биопсийные щипцы, выведенные из канала эндоскопа, и вводили в просвет трахеи впереди эндоскопа. При этом также подбирали удобное для обзора положение клапана.
При вмешательстве использовали как местную анестезию, так и общее обезболивание. При бронхоблокации под местной анестезией эндоскоп с клапаном во время глубокого вдоха проводили через голосовую щель в трахею и далее, в блокируемый бронх. В случае, если больной находился на ИВЛ, доставку эндобронхиального клапана в бронх осуществляли через интубационную, трахеостомическую трубки или тубус ригидного бронхоскопа.
Под местной анестезией установлено 18 (43,2%) клапанов. Больным с тяжелыми нарушениями дыхания, находящимся на ИВЛ, установку эндобронхиального клапана производили под общим обезболиванием - 21 (56,8%).
Установка клапана через тубус ригидного бронхоскопа выполнена 2 (8,3%) больным, через интубационную или трахеостомическую трубку - 12 (50%), через ротовую полость - 10 (41,7%). При несоответствии диаметра трахеостомической трубки диаметру эндобронхиального клапана выполняли деканюляцию с последующим проведением клапана через трахеостому. При этом дыхание больного поддерживали с помощью аппарата высокочастотной вентиляции.
Тромбоэмболия легочной артерии
В центре эндоваскулярной хирургии проф. Капранова осуществляется успешное хирургическое лечение такого заболевания, как тромбоэмболия легочной артерии (ТЭЛА). Клинику для проведения операции выбирает сам пациент.
Венозный тромбоз - опасное заболевание, вызванное формированием тромба (сгустка крови) в просвете венозного сосуда, характеризующееся нарушением оттока крови и(или) его полной закупоркой. Тромбоэмболия легочной артерии является разновидностью венозного тромбоза и, по мнению специалистов, одним из самых тяжелых острых сосудистых заболеваний. При его протекании происходит окклюзия (закупорка) тромбом легочного ствола или ветвей артериальной системы легких, что приводит к высокому проценту летальности у пациентов. Острые венозные тромбозы (ОВТ) вместе с тромбоэмболией легочных артерий (ТЭЛА) считаются одной из наиболее частых патологий сердечно-сосудистой системы. Летальный исход при ТЭЛА фиксируется в каждом 3-ем случае.
Причины развития тромбоэмболии легочной артерии
Обычно тромбообразование происходит в венах нижних конечностей или таза. Реже сгусток формируется в правом предсердии, на створках клапанов сердца, в системе верхней полой вены. По мере своего продвижения тромб может разрываться на отдельные фрагменты, вследствие чего закупорка сосудов происходит сразу в нескольких ветвях легочной артерии.
Причинами развития ТЭЛА выступают следующие факторы:
- Длительная обездвиженность. У таких пациентов поражения ветвей легочной артерии происходят чаще всего.
- Варикозная болезнь. Расширенные стенки вен становятся основной средой для развития патологии артерий.
- Курение.
- Избыточный вес (ожирение).
- Пожилой возраст.
- Химиотерапия.
- Прием мочегонных средств.
- Массивные травмы, хирургические вмешательства.
- Наличие катетера в вене.
В группе наибольшего риска развития тромбоэмболии легочной артерии находятся пациенты, страдающие:
- онкологическими заболеваниями;
- нарушениями мозгового кровообращения;
- различными тромбозами вен;
- наследственными заболеваниями крови.
Это связано с тем, что любые воздействия на артерии и кровоток в целом негативно сказываются на состоянии отдельных сосудов и степени их проходимости. В некоторых случаях тромбоз развивается совершенно бессимптомно и больной даже не подозревает о том, что его жизнь под угрозой! Между тем оторвавшийся от стенки сосуда сгусток крови способен закупорить легочную артерию в любой момент.
Важно! Пациентам с повышенным риском развития ТЭЛА следует постоянно контролировать состояние своего здоровья и легочных артерий.
Симптомы ТЭЛА
При тромбоэмболии ветвей легочных артерий или всей артерии существуют ярко выраженные симптомы, указывающие на данную патологию. К наиболее характерным признакам этого заболевания относятся:
- одышка;
- боль в грудной клетке, усиливающаяся при кашле;
- резкая слабость, обмороки;
- снижение артериального давления;
- учащение сердцебиения;
- пульсация шейных вен;
- кашель;
- бледность кожных покровов;
- повышение температуры тела;
- синюшность верхней половины тела и лица.
Важно! При появлении хотя бы одного из перечисленных признаков следует немедленно обратиться к врачу, чтобы предупредить образование тромбов. Опытный специалист определит состояние кровотока, общее состояние сосудов в легких, подберет подходящую терапию. Для постановки максимально точного диагноза врач назначит комплексную диагностику, которая позволит выяснить источник проблемы и в дальнейшем устранить его.
Формы окклюзии легочной артерии
Степень поражения тромбированных легочных артерий может существенно варьироваться. Специалисты выделяют следующие формы этого заболевания:
- Массивную тромбоэмболию, характеризующуюся быстрым развитием и тяжелым течением. При такой патологии сгусток крови перекрывает основной ствол легочной артерии. Пациенты страдают от выраженной одышки, теряют сознание, у больных также возникают судороги. В большинстве случаев приступ заканчивается летальным исходом.
- Эмболия мелких ветвей легочной артерии - сегментарных или долевых. Такая патология характеризуется средне-тяжелым течением. Пациенты страдают от выраженных болей за грудиной, возникает одышка. Поражение сердечно-сосудистой системы приводит к усилению сердцебиения, небольшому снижению артериального давления. Клинические проявления легочных поражений продолжаются несколько дней.
- Закупорку ответвлений легочной артерии. Клинические проявления патологии выражены слабо. Из-за этого тромбоэмболия зачастую не распознается. Пациента могут мучить периодические боли за грудиной. Нередко больные страдают от повторных легочных пневмоний, одышки.
Последствия и осложнения ТЭЛА
Основными последствиями возникновения эмболий в легочной артерии являются:
- плеврит;
- инфаркт легкого;
- рецидив;
- длительный дефицит кислорода в организме.
В зависимости от течения болезни различаются и ее последствия для больного, а именно:
- Тромбоэмболия в острой форме приводит к окклюзии главного ствола или обеих ответвлений. В результате развивается острая дыхательная недостаточность. Происходит остановка дыхания, нарушение сердечного ритма. Результатом приступа является летальный исход.
- Если заболевание приняло подострую (затяжную) форму, тромбом закупориваются крупные или средние ветви легочной артерии. В результате развивается острая дыхательная недостаточность. Поражение продолжается несколько недель, симптомы окклюзии сосудов возрастают.
- При хронической форме заболевания закупорка средних и мелких ветвей легочной артерии неизбежно возникает снова. Поражение проявляется повторными инфарктами легких или плевритами.
Обследование для выявления тромбоэмболии и диагностика ТЭЛА мелких ветвей легочной артерии
Чаще всего тромбоэмболия выявляется в ходе сбора информации для анамнеза. Правильно определить причину тромбоэмболии легочной артерии поможет наличие у пациента перенесенных операций, инфарктов и тромбозов.
Диагностика тромбоэмболии легочной артерии является комплексной и сложной, поскольку врач обязан учитывать возможность дальнейшего развития заболевания. Диагностические исследования делятся на обязательные и дополнительные; к обязательным диагностическим процедурам относятся:
- ЭКГ.
- Рентген.
- Эхокардиография.
- Сцинтиграфия легких.
- УЗИ вен ног.
Дополнительные исследования при диагностике тромбоэмболии легочной артерии проводятся по необходимости; в таких случаях обычно назначают:
- Измерение давления в предсердиях, желудочках и легочных артериях.
- Ангиопульмонография.
- Илеокаваграфия.
Специалисты во время диагностики также обращают внимание на такие важные лабораторные показатели, как:
- концентрация билирубина;
- количество лейкоцитов;
- СОЭ;
- количество продуктов деградации фибриногена в плазме крови.
Информативным методом диагностики легочной сосудистой патологии является электрокардиограмма. Изменения на ней позволяют не только обнаружить заболевание, но и определить его степень. Картину ЭКГ врач сопоставляет с историей заболевания, что позволяет точно диагностировать ТЭЛА.
Эхокардиография дает возможности для определения точной локализации патологии, объема, формы и размера тромба.
Метод перфузионной сцинтиграфии легких охватывает широкий объем диагностических критериев, поэтому исследование проводят в качестве скринингового теста для выявления заболевания. Сцинтиграфия позволяет получить «картинку» сосудов легких, на которой четко видны отграниченные зоны нарушения кровообращения, однако точное место тромбоэмболий не определяется.
Самым современным, надежным и чувствительным методом диагностики является ангиография, благодаря которой пустой сосуд выявляется визуально.
Если тромбами поражены ветви мелких артерий, симптомы могут быть слабовыраженными. В некоторых случаях признаки патологии вообще отсутствуют. Легочное дыхание является полным, пациент не испытывает дискомфорта. В то же время повреждение легочных сосудов прогрессирует и кровь не поступает в участок легочной ткани.
Поэтому при проведении диагностики важно учитывать различные рентгенологические синдромы. Они отражают поражение мелких сосудов определенного уровня. К сожалению, только рентген не позволяет поставить точный диагноз. Он назначается для того, чтобы отличить патологию легочных артерий от других заболеваний, имеющих сходные симптомы (пневмоторакс, крупозная пневмония, аневризма аорты и др.).
Способы лечения пораженных тромбозом легочных сосудов, основного ствола артерии подбираются строго индивидуально. При лечении тромбоэмболии легочной артерии необходимо правильно оценить состояние конкретного пациента, учесть все факторы и только затем выбрать определенный вариант терапии.
Например, если повреждены мелкие ветви легочных сосудов, терапия может быть консервативной. Возможности современной тромболитической терапии являются довольно широкими. В целом, для лечения тромбоэмболии легочных артерий используются следующие методики:
- Оксигенотерапия - вдыхание обогащенной кислородом смеси газов. Благодаря этому поврежденные артерии могут быть восстановлены. Такая терапия эффективна только на начальной стадии развития патологии.
- Прием антикоагулянтов. Препараты, разжижающие кровь, позволяют предотвратить образование новых тромбов. Успешность тромболитической терапии зависит от степени поражения сосудов. Если у пациента зафиксирована тромбоэмболия мелких ветвей, применения данных препаратов обычно достаточно. Они позволяют растворить отдельные сгустки крови в легочном кровотоке.
- Тромбоэмболэктомия. Данная методика представляет собой хирургическое вмешательство, позволяющее удалить сгусток крови. Существуют различные методики тромбоэмболэктомии, но все они сопряжены с определенным риском. Вмешательство (открытое) у пациентов с тромбоэмболией проводится в условиях искусственного кровообращения.
- Постановка кава-фильтра. Этот метод показан пациентам при рецидивирующих (повторяющихся) тромбоэмболиях легочных артерий.
Важно! При полностью закупоренных артериях вмешательство должно быть срочным, только в этом случае пациенту можно помочь! Следует помнить, что при выраженных дыхательных и сердечно-сосудистых нарушениях на фоне обширной легочной тромбоэмболии летальность превышает 30%!
Прогноз и профилактика ТЭЛА
При раннем оказании необходимой профессиональной помощи лечение ТЭЛА позволяет добиться благоприятного прогноза для жизни пациента. Возможно ли предупреждение развития данной патологии?
Для предупреждения заболевания следует регулярно проходить диагностику организма в целом, а также обращать внимание на все симптомы основной патологии и сопутствующих ей осложнений.
Профилактику ТЭЛА целесообразно проводить у людей, которые:
- перенесли инсульт или инфаркт;
- имеют избыточную массу тела;
- восстанавливаются после операции на органах малого таза, живота, грудной клетки и ног;
- с эпизодами ТЭЛА в прошлом.
Профилактические меры обязательно назначаются людям старше 40 лет. Особенно внимательно следует относиться к пациентам с тромбозом вен. В комплекс профилактических мер включают:
- тугое бинтование ног;
- сдавливание голени специальными манжетами;
- введение гепарина;
- перевязывание крупных вен;
- имплантацию специальных кава-фильтров различных модификаций.
Обратите внимание! Последняя мера может применяться не только как профилактическая, но и как лечебная.
Большая часть рецидивов развивается у тех пациентов, которые не получили антикоагулянты либо не согласились на операцию с использованием современной методики.
Преимущества эндоваскулярного лечения
Эндоваскулярная диагностика, профилактика и терапия тромбоэмболии легочной артерии являются наиболее эффективными и действенными. Это также относится и к острым венозным тромбозам.
Настоящий переворот в области хирургической профилактики заболевания произвело применение в клинической практике специальных эндоваскулярных фильтрующих устройств - кава-фильтров.
Кава-фильтр - это медицинское высокотехнологичное приспособление, которое имплантируют в просвет нижней полой вены. Данное устройство обладает способностью улавливать тромбы, находящиеся в потоке крови и представляющие реальную угрозу для жизни человека. Во многих странах мира для профилактики тромбоэмболии легочных артерий применяют такие фильтры, как Grienfield filter, LGM Vena Tech filter, Bird’s Nest filter, Simon nitinol filter, TrapeEase filter, OptEase filter, Gunther Tulip Vena Cava MREye filter, Recovery vena cava nitinol filter. Количество их аналогов и модификаций на сегодняшний день составляет более 100 разновидностей.
Особенности используемых кава-фильтров
Современный кава-фильтр представляет собой крошечную конструкцию из проволоки в виде зонта, песочных часов или гнезда. Все используемые изделия отличаются:
- устойчивостью к коррозии;
- высокой эффективностью;
- надежностью;
- легкостью установки.
Кроме того, кава-фильтры обладают ферромагнитными свойствами и способны улавливать все кровяные сгустки. При временной установке кава-фильтры легко извлекаются. Материалами для этих изделий могут служить:
- Титан.
- Сталь, покрытая гепариннасыщенной мембраной.
- Нитинол (сплав никеля и титана).
Кава-фильтры имеют различные размеры, поскольку подбираются они индивидуально. Специалисты учитывают диаметр нижней полой вены у пациента. После установки этих устройств эмболия перестанет представлять непосредственную угрозу жизни пациента.
Обратите внимание! Все кава-фильтры делятся на 2 группы:
- Постоянные. Такие фильтры устанавливаются навсегда. Они плотно прилегают к стенкам вены и имеют на опорах микроскопические усики или шипы.
- Временные (съемные). Такие фильтры могут быть удалены. Эти устройства не фиксируются, они связаны с проводником, зафиксированным под кожей.
Оценка эффективности применения кава-фильтров основана на одном из самых глубоких анализов клинических результатов эндоваскулярного вмешательства у 6500 пациентов. Данные исследование показали, что после вживления кава-фильтров в раннем постимплантационном периоде уровень возникновения патологии составляет от 0,5-4%, в позднем периоде - 2-5,6%, при этом проходимость НПВ - 79-97,2%.
После того как стало возможным внедрение в клиническую практику новейших съемных (удаляемых) моделей кава-фильтров, активно применяемых в ведущих мировых клиниках, удалось решить и эту серьезную проблему - благодаря эндоваскулярному извлечению данного приспособления.
Даже в тех случаях, когда кава-фильтр изменил свое положение и недоступен для традиционного извлечения, мы можем добиться положительного результата, благодаря применению инновационных эндоваскулярных инструментов.
Команда профессора С. А. Капранова в своей повседневной клинической практике с целью профилактики тромбоэмболии легочной артерии использует только новейшие импортные модели французских опциональных (удаляемых) кава-фильтров ALN, срок эффективного профилактического действия которых составляет ТРИ ГОДА!
Результаты, достигнутые специалистами центра эндоваскулярной хирургии профессора С. А. Капранова, способствуют расширению спектра показаний к эндоваскулярной профилактике тромбоэмболии мелких ветвей легочных артерий, иных их участков у больных.
Следует отметить, что после применения кава-фильтров у наших пациентов эффективность эндоваскулярной профилактики существенно возросла и в среднем составляет более 83%!
Стоимость лечения тромбоэмболии ветвей легочной артерии
| Вид вмешательсва | Стоимость |
| тромбоэмболия легочной артерии (тромбэктомия, тромболизис, роторная дезобструкция, баллонная дилатация) | 65.000 - 120.000 руб. |
Диапазон цен лечения зависит от многих внешних факторов (быстроты и удобства предоперационного обследования, комфортности и быстроты самой госпитализации и др.), не имеющих прямого отношения к лечебной деятельности. Даже с минимальными затратами вы получите полноценную профессиональную помощь.
Планируете вмешательство по поводу тромбоэмболии легочной артерии?
Обратитесь к профессору Капранову по личным телефонам:
Вместе со специалистом вы сможете обсудить все особенности терапии. Хирург расскажет о том, как будет проходить операция. Вы определите оптимальное для вас время эндоваскулярного вмешательства.
Также вы можете связаться с администраторами клиник, в которых принимает Сергей Анатольевич. Вам расскажут о том, как выполняется восстановление проходимости легочных артерий. Специалисты подробно ответят на возникшие вопросы, а также рассчитают примерную стоимость терапии тромбоэмболии конкретно в вашем случае.
- «Редкий случай аорто-кавального свища, осложненный тромбоэмболией ветвей легочной артерии». Грудная хирургия, 1985, 5, стр. 75-76 (соавт. Р.А.Григорян, А.В.Гогодзе, С.А.Капранов, А.Р.Зубарев).
- «Съемный кава-фильтр «Зонтик» - новые возможности эндоваскулярной профилактики тромбоэмболии легочной артерии», Ангиология и сосудистая хирургия, 2000, том 6, №3, стр. 17-24 (соавт. В.С.Савельев, В.И.Прокубовский, С.А.Капранов, В.П.Буров, А.Н.Балан).
- «Нетрадиционные эндоваскулярные вмешательства для профилактики тромбоэмболии легочной артерии», Ангиология и сосудистая хирургия, 2001, №1, стр. 81-89 (соавт. В.И.Прокубовский, С.А.Капранов, А.С.Солонко).
- «Анатомические и гемодинамические изменения нижней полой вены при профилактике тромбоэмболии легочной артерии», Ангиология и сосудистая хирургия, 2003, №2, том №9, стр. 51-60 (соавт. В.И.Прокубовский, С.А.Капранов, Е.П.Москаленко).
- «Эндоваскулярная роторная дезобструкция при массивной тромбоэмболии легочной артерии», Ангиология и сосудистая хирургия, 2003, том 9, №3, стр. 31-39 (соавт. В.И.Прокубовский, С.А.Капранов, Б.Ю.Бобров).
Читайте также:
- Тяжелый туберкулез тотальной распространенности. Оперативная тактика при распространенном туберкулезе
- Длинные кости плода. Развитие длинных костей у эмбриона
- ДНК и РНК слизистой рта. Содержание ДНК и РНК при потере зубов
- Влияние ацидоза на обмен калия. Механизмы регуляции концентрации кальция
- Инфекции вызванные бациллами (Bacillus anthracis, cereus): диагностика, лечение, профилактика
