Типы коллоидов, их источники и применение
Добавил пользователь Alex Обновлено: 01.02.2026
Коллоиды как основные компоненты биологических образований, их свойства, распространение в природе. Дисперсионные и конденсационные методы получения коллоидов, способы очистки. Применение коллоидных систем в медицине, косметологии, пищевой промышленности.
| Рубрика | Химия |
| Вид | лабораторная работа |
| Язык | русский |
| Дата добавления | 10.04.2014 |
| Размер файла | 677,4 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Государственное бюджетное образовательное учреждение города
Свойства и применение коллоидных систем
Выполнила: Назарова Д.В.
ученица 9-1 класса
учитель Белоусова М.Н.
1. Виды коллоидных растворов
1.1 Способы получения
1.2 Основные свойства коллоидов
1.3 Способы очистки: а) диализ б) ультрафильтрация
2. Практическая часть
Чистые вещества в природе встречаются очень редко. Коллоидные системы занимают промежуточное положение между грубодисперсными системами и истинными растворами. Они широко распространены в природе.
Глобальная роль коллоидов в естествознании заключается в том, что они являются основными компонентами таких биологических образований как живые организмы. Весь наш организм состоит из коллоидных систем. Существует целая наука - коллоидная химия. Передо мной сразу встал вопрос, почему природа отдает предпочтение именно коллоидному состоянию?
В связи с этим вытекают следующие цель и задачи:
Цель работы: выяснить, что такое коллоидные системы, какими свойствами они обладают.
Задачи: 1. Провести экспериментальные опыты по изучению свойств коллоидных растворов.
2. Ответить на вопрос: почему природа отдает предпочтение именно коллоидному состоянию.
Термин «коллоид» был введен в 1861 году английским химиком Томасом Грэмом. В его экспериментах он заметил, что растворы желатина, крахмала и других клееподобных веществ очень отличаются по ряду свойств от растворов неорганических солей и кислот. Название произошло от греческой приставки «коло» - клей. Правильно говорить не о коллоидных веществах, а о коллоидных системах. Этот термин ввел русский ученый П.П. Веймарн в 1908 году. Разнообразие коллоидных систем можно увидеть на картинках.
Частицы коллоидных размеров могут иметь различную внутреннюю структуру. Выделяют несколько основных видов коллоидных систем:
1) дым -- устойчивая дисперсная система, состоящая из мелких твёрдых частиц, находящихся во взвешенном состоянии в газах. Дым -- аэрозоль с размерами твёрдых частиц от 10?7 до 10?5 м. В отличие от пыли -- более грубодисперсной системы, частицы дыма практически не оседают под действием силы тяжести
2) аэрозоль -- дисперсная система, состоящая из взвешенных в газовой среде, обычно в воздухе, мелких частиц. Аэрозоли, дисперсная фаза которых состоит из капелек жидкости, называются туманами, а в случае твёрдых частиц, если они не выпадают в осадок, говорят о дымах (свободнодисперсных аэрозолях), либо о пыли (грубодисперсной аэрозоли).
3) эмульсия -- дисперсная система, состоящая из микроскопических капель жидкости (дисперсной фазы), распределенных в другой жидкости. Самым распространенным представителем этого вида коллоидной системы является молоко.
4) пена -- дисперсные системы с газовой дисперсной фазой и жидкой или твердой дисперсионной средой.
5) гель -- системы, состоящие из высокомолекулярных и низкомолекулярных веществ. Из-за наличия трёхмерного полимерного каркаса (сетки) гели обладают некоторыми механические свойства твёрдых тел (отсутствие текучести, способность сохранять форму, прочность и способность к деформации (пластичность и упругость).
6) суспензия -- это грубодисперсная система с твёрдой дисперсной фазой и жидкой дисперсионной средой.
Вот некоторые примеры коллоидных систем (рис.1-8).
1.1 Получение коллоидов
Коллоидные системы по степени дисперсности занимают промежуточное положение между молекулярными и грубодисперсными системами. Это определяет два возможных пути их получения:
1) Дисперсионные методы
2) Конденсационные методы.
Дисперсионные методы основаны на раздроблении твердых тел до частиц коллоидного размера и образовании таким образом коллоидных растворов. Процесс диспергирования осуществляется различными методами: механическим размалыванием вещества в т.н. коллоидных мельницах, электродуговым распылением металлов, дроблением вещества при помощи ультразвука.
Вещество, находящееся в молекулярно-дисперсном состоянии, можно перевести в коллоидное состояние при замене одного растворителя другим - т.н. методом замены растворителя. В качестве примера можно привести получение золя канифоли, которая не растворяется в воде, но хорошо растворима в этаноле. При постепенном добавлении спиртового раствора канифоли к воде происходит резкое понижение растворимости канифоли, в результате чего образуется коллоидный раствор канифоли в воде. Аналогичным образом может быть получен гидрозоль серы.
- Главная особенность коллоидных частиц - их малый размер от 1 до 100 нм.
- Коллоидные частицы не препятствуют прохождению света.
- Частицы коллоидных систем не выпадают в осадок за счет Броуновского движения.
- В прозрачных коллоидах наблюдается рассеивание светового луча (эффект Тиндаля).
- Дисперсные частицы не выпадают в осадок
1.3 Способы очистки коллоидов
Существуют три основных способа очистки коллоидов.
1) Диализ. Простейшим прибором для диализа - диализатором - является мешочек с полунепроницаемой мембраной (коллодий), в который помещается диализируемая жидкость. Мешочек опускается в сосуд с растворителем (водой). Меняя растворитель, можно добиться практически полной очистки от нежелательных примесей. Скорость диализа обычно крайне низка. Ускоряют процесс диализа, увеличивая площадь мембраны и температуру, непрерывно меняя растворитель. Материал, прошедший через мембрану называется диализат.
2) Ультрафильтрация - фильтрование коллоидных растворов через полупроницаемую мембрану, пропускающую дисперсионную среду с примесями и задерживающую частицы дисперсной фазы или макромолекулы. Для ускорения процесса ультрафильтрации ее проводят при перепаде давления по обе стороны мембраны: под вакуумом или повышенным давлением.
Ультрафильтрация есть не что иное, как диализ, проводимый под давлением.
1.4 Применение
Коллоидные системы широко распространены в природе: почва, глина, природные воды, многие минералы, драгоценные камни. Биологические жидкости: кровь, плазма, лимфа, спинномозговая жидкость, ядерный сок, цитоплазма. С химической точки зрения организм в целом - это совокупность многих коллоидных систем. В состав любого живого организма входят твердые, жидкие и газообразные вещества, находящиеся в сложном взаимоотношении с окружающей средой. Цитоплазма клеток обладает свойствами, характерными, как для жидких, так и студнеобразных веществ.
Большое значение имеют коллоидные системы не только для биологии, но и для медицины, косметологии, пищевой промышленности.
Свойства коллоидов необходимо учитывать при их использовании, например явление синерезиса (самопроизвольного уменьшения объема геля, сопровождающееся отделением жидкости) определяет сроки годности пищевых, медицинских и косметических веществ: гелей, мазей, мармелада, холодца, киселя. Для теплокровных животных очень важен биологический синерезис, который сопровождает свертывание крови. Под действием факторов растворимый белок крови фибриноген превращается в нерастворимый фибрин, сгусток которого и закупоривает рану. Если этот процесс затруднен, то говорят о возможности заболевания человека гемофилией.
Используются человеком и способы очистки коллоидов, так например, принцип компенсационного диализа (принцип метода в том, что в диализаторе вместо чистого растворителя используют растворы определяемых низкомолекулярных веществ различной концентрации.) был использован при создании аппарата, названного «искусственной почкой». С помощью него можно очищать кровь больного от различных продуктов обмена, замещая временно функцию больной почки при таких показаниях, как острая почечная недостаточность, например в результате отравлений.
Коллоидная химия играет большую роль в разработке эффективных методов охраны окружающей среды. Одна из главных проблем в этой области - очистка воды от различных загрязнений. Характерный пример - загрязнение водоёмов и рек белковыми веществами, содержащимися в сточных водах предприятий пищевой промышленности.
Особенно эффективная очистка достигается с помощью пен, обладающих определёнными коллоидно-химическими характеристиками. Другой пример - загрязнение поверхности воды нефтью при авариях танкеров. Нефтяное пятно может распространяться на очень большие расстояния от места аварии. Законы коллоидной химии и поверхностных явлений позволяют рекомендовать возможные приёмы блокирования растекания нефти и её сбора.
коллоидный биологический медицина косметология
В ходе работы мною были проведены следующие опыты:
1. Получение коллоидных систем.
Б) AgNO3 + KI = AgI + KNO3
2. Описание работы
3. Эффект Тиндаля
В наших опытах использовались прозрачные емкости - стеклянные цилиндры, химические стаканы, и лампа, дающая направленный пучок света (карманный фонарик).
В результате изучения литературы и проведения практических опытов я могу предположить, природа отдает предпочтение именно коллоидному состоянию потому, что:
Вещество в коллоидном состоянии имеет большую поверхность раздела между фазами. А это способствует лучшему протеканию обмена веществ.
- Биологический синерезис (самопроизвольное уменьшение объема геля, сопровождающееся отделением жидкости) играет важную роль в процессе свертывания крови.
- Явление коагуляции (слипания коллоидных частиц) при изменении кислотно-щелочной среды лежит в основе пищеварения.
Вся природа - организмы животных и растений, гидросфера и атмосфера, земная кора и недра - представляет собой сложную совокупность множества разнообразных и разнотипных грубодисперсных и коллоидно-дисперсных систем. Дисперсное состояние вполне универсально и при соответствующих условиях в него может перейти любое тело.
В практической части проделали опыты, позволяющие познакомиться с эффектом Тиндаля
Из коллоидов, богатых белками соединительной ткани (аминокислоты пролин и глицин), состоят кожа, мышцы, ногти, волосы, кровеносные сосуды, легкие, весь желудочно-кишечный тракт и многое другое, без чего немыслима сама жизнь.
Применение коллоидов находит все большее применение в медицинской практике.
От использования простых коллоидных золей для местной заживляющей терапии и применения солей алюминия и магния для понижения кислотности желудка, до использования гидроокиси алюминия в качестве стабилизатора и носителя лекарственных веществ.
Знания коллоидной химии необходимы и востребованы в наше время, что находит подтверждение в моих словах.
1. Шаде Г., Физическая химия во внутренней медицине, Л.,1930
2. Пасынский А.Г., Коллоидная химия, 3 изд., М., 1968
3. Г.Е. Рудзитис. Химия 11 класс. М., Просвещение, 2009 г.
4. Л.М. Пустовалова, И.Е. Никанорова. Химия, Кнорус.
5. Физколлоидная химия. Учебник для высшей школы. М., Просвещение, 1988 г.
6. Сайт с формулами коллоидов
Примеры коллоидных систем
Рис. 1. Продукты питания
Рис. 3. Коллоидное серебро
Рис. 4. Гели для бритья
Рис. 6. Обработанный алмаз
Кровь является типичными примером ткани организма, где одни коллоиды находятся внутри других. В.А. Исаев дает определение крови как дисперсной системе, в которой форменные элементы - эритроциты, тромбоциты, лейкоциты являются фазой, а плазма - дисперсной средой.
Подобные документы
Коллоидная химия как наука, изучающая физико-химические свойства гетерогенных, высоко-дисперсных систем и высоко-молекулярных соединений. Производство и методы очищения коллоидных растворов. Применение гелей в пищевой промышленности, косметике и медицине.
презентация [6,3 M], добавлен 26.01.2015
Классификация дисперсных систем. Основные факторы устойчивости коллоидных растворов. Методы их получения (диспергирование, конденсация) и очистки (диализ, ультрафильтрация). Мицеллярная теория строения коллоидных частиц. Коагуляция смесями электролитов.
презентация [2,8 M], добавлен 28.11.2013
Сущность и определяющие признаки коллоидных систем. Основные свойства и строение растворов такого типа. Характеристика эффекта Тиндаля. Различия гидрозолей и органозолей. Способы образования коллоидных систем, специфические свойства, сфера применения.
презентация [2,2 M], добавлен 22.05.2014
Способы получения коллоидных систем; факторы, влияющие на скорость отдельных стадий процесса, правила коагуляциии. Астабилизирующее действие низкомолекулярных примесей в коллоидных растворах, методы их удаления: диализ, электродиализ и ультрафильтрация.
презентация [1,1 M], добавлен 17.09.2013
Понятие коллоидной системы. Коллоидная химия. Развитие представлений о коллоидных системах, их типы и свойства. Лиофобные золи. Лиофильные коллоиды и области приминения коллоидов. Коллоидно-химическая физиология человека, клеток и тканей организма.
Коллоидные растворы: методы получения и использование
Многие люди, не имеющие дело с химией, слыша словосочетание «коллоидные растворы», представляют что-то наподобие геля, вязкой смеси. Дело в том, что изначально такое название произошло от греческого слова, в переводе означающего «клеевидные». При нарушении сбалансированности системы золи дают осадок, напоминающий студень.
Как правило, коллоидные растворы представляют собой абсолютно прозрачную жидкость. В зависимости от состава, она может быть бесцветной или окрашенной. На первый взгляд золи ничем не отличаются от истинных растворов. Изучением подобного рода субстанций занимается целый раздел - коллоидная химия.

Общая характеристика
Любой раствор представляет собой однофазную систему, включающую два компонента или более. В отличие от него, суспензия или эмульсия менее устойчивы. В жидких растворах при хранении может выпасть осадок, если, например, они помещены в негерметично закрытую тару и происходит испарение жидкости. В остальных случаях это инертная система, где компоненты не вступают в реакцию друг с другом, и поэтому она может оставаться неизменной в течение длительного времени.
Свойства коллоидных растворов

Молекулы вещества равномерно распределяются по всему растворителю, однако они постоянно совершают броуновское (колебательное) движение. Вследствие этого происходит полное перемешивание компонентов системы. Свойства коллоидных растворов в данном процессе немного другие. Частицы такой системы называются мицеллами. Они диффундируют из одного слоя жидкости в другой медленнее (в 100 раз). Причиной низкой скорости является больший объем мицелл по сравнению с молекулами истинных растворов.
В зависимости от размера частиц, их количества, коллоидные растворы отличаются по вязкости. Часто встречаются системы, переходящие в гелеобразное состояние при понижении температуры. Наличие слишком крупных мицелл и превышение предела растворимости приводит к помутнению.
Частицы коллоида, в отличие от молекул, имеют более крупные размеры и поэтому способны рассеивать свет. Таким образом, можно отличить эти растворы от истинных. При прохождении через такую систему пучок света будет виден.
Структура мицелл
Получение коллоидных растворов зиждется на образовании мицелл, которые должны пребывать для сохранения свойств системы в стабильном состоянии. Частица имеет сложную структуру, состоит из ядра, которое образуется малорастворимым веществом. Вокруг него распределяется слой потенциалоопределяющих ионов. Обычно они являются такими же, что и в малорастворимом веществе, расположенном в центре мицеллы (правило Панета-Фаянса). Такие ионы определяют заряд ядра.
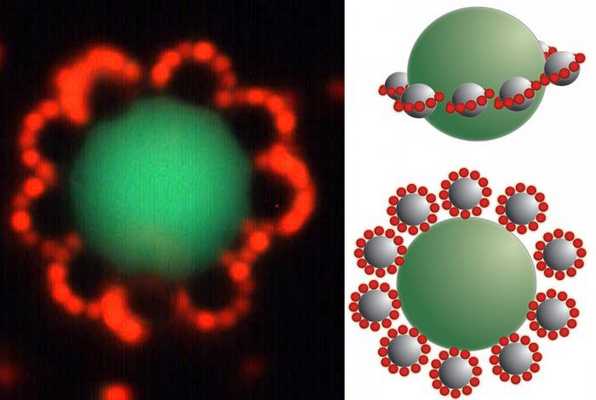
Например, при взаимодействии иодида калия и нитрата серебра образуются мицеллы. Ядром таких частиц является иодид серебра (AgI). Если преобладает второй компонент, то потенциалоопределяющими ионами будут Ag + , если первый - I - . Следующим слоем являются противоионы того вещества, которое было взято в избытке. Они образуют две зоны. Первая расположена близко к поверхности ядра, входит в состав адсорбированного слоя. Вторая входит в состав диффузионного слоя, состоит из ионов, свободно перемещающихся вблизи поверхности.
Коллоидной частицей называется ядро с адсорбированным слоем, который включает потенциалопределяющие ионы и противоионы. Данное образование имеет заряд. Мицелла включает коллоидную частицу и диффузионный слой противоионов и является нейтральной.
Как происходит образование мицеллы
Любые методы получения коллоидных растворов основаны на взаимодействии молекул труднорастворимого соединения с электролитом. Например, AgNO3 (нитрат серебра) с KI (иодидом калия). В результате реакции получается AgI и KNO3 (нитрат калия). Структуру мицеллы можно изобразить схематически. Есть 2 варианта образования коллоидных частиц из вышеуказанных соединений:
Вначале указывается ядро, потом потенциалоопределяющие ионы и противоионы адсорбированного и диффузионного слоя. Электрокинетический потенциал, который определяет заряд коллоидной частицы, обозначается буквой "x". Он возникает в силу разницы поверхностной энергии ядра частицы с потенциалоопределяющими ионами.
Стабильность

Коллоидные растворы способны сохраняться в неизменном состоянии достаточно долго. Стабильность таких систем является следствием одноименности зарядов мицелл, что приводит к их отталкиванию друг от друга. Однако при слишком больших размерах и высокой концентрации частицы могут сталкиваться и объединяться. Устойчивость коллоидных растворов - относительное понятие. Они могут храниться в неизменном состоянии достаточно долго.
Коагуляция коллоидных растворов представляет собой процесс слипания мицелл друг с другом. При стабильном состоянии системы данное явление происходит медленно, что позволяет ей сохраняться длительное (до 100 лет) время в однофазном состоянии. Такое явление получило название агрегативная неустойчивость.
Скорость коагуляции
Скорость агрегации частиц и, как следствие, разделения фаз зависит от многих факторов, в том числе от размера и концентрации мицелл, температуры хранения. К ускорению процесса коагуляции приводит добавление электролита. Данное явление наблюдается в гидрофильных системах. Известны методы замедления процесса агрегации частиц. Например, смешение липофильного коллоида с гидрофильным. На утрату стабильного состояния золей может повлиять нагрев или охлаждение, механическое воздействие.
Коагуляция коллоидных растворов с помощью электролитов
Существуют определенные закономерности влияния электролитов на коллоидный раствор. Так, для начала процесса нужна определенная концентрация последнего, не ниже определенного уровня - порог коагуляции. Электролит - вещество, способное проводить электрический ток в результате диссоциации в растворе или расплава на ионы. На состояние коллоидного раствора влияет ион, заряд которого противоположен таковому у мицеллы. Действие усиливается со степенью заряда (правило Шульце-Гарди).
Другой фактор, определяющий степень влияния ионов, - их гидратируемость. Частицы с одноименным зарядом оказывают разный уровень действия на процесс коагуляции. При разделении коллоидного раствора ионы, вызвавшие коагуляцию, присутствуют в осадке. При добавлении смеси электролитов ее компоненты могут ослаблять действие друг друга (антагонизм) или, наоборот, усиливать (синергизм). Реже наблюдается независимое (аддитивное) влияние.
Способы получения

Методы получения коллоидных растворов сводятся к двум. Одним из вариантов является диспергирование (измельчение) крупных частиц до размеров, соответствующих коллоидным. Такой процесс можно осуществлять, например, с использованием ультразвуковых приборов (механическое измельчение). Разновидностью дисперсных методов является формирование коллоидных частиц в результате добавления электролитов, которые адсорбируются на поверхности коллоидных ядер и переводят частицы в растворенное состояние.
Противоположным дисперсионному методу является конденсационный, заключающийся в агрегации мелких частиц в более крупные. Такое явление происходит, например, при замене растворителя. Каким образом можно добиться такого эффекта? Наблюдается резкое снижение растворимости в силу изменения среды. Далее вещество образует коллоидную частицу. В ее формировании участвуют молекулы растворителя, с которым оно лучше смешивается. Такой эффект, например, достигается при постепенном добавлении канифоли, растворенной в этаноле, к воде.
Различного рода конденсационные реакции, в том числе описанные выше, также относятся к методам агрегации. Другими примерами может являться гидролиз солей металлов, в частности хлорида железа (FeCl3), реакция нейтрализации в результате взаимодействия гидроксида бария (Ba(OH)2) с серной кислотой (H2SO4).
Солюбилизация
Значение коллоидных растворов в жизни человека велико в связи со способностью поверхностно-активных веществ повышать растворение гидрофобных соединений в воде. Такое явление получило название "солюбилизация". По своей сути данный процесс представляет растворение соединений в мицеллах. Благодаря этому явлению порошки способны удалять загрязнение с тканей, получаются устойчивые эмульсии углеводородов и красителей в воде.
Солюбилизация может проходить разными способами. Так, неполярные углеводороды проникают в ядро мицеллы, в то время как соединения, имеющие гидрофильную и гидрофобную часть (амины, спирты), встраиваются так, что первая находится снаружи, а вторая уходит вглубь коллоидной частицы. Существует также такое явление, как обратная солюбилизация, заключающаяся в растворении воды в маслах. В случае неионогенных ПАВов выделяют еще один способ повышения растворимости гидрофобных соединений - прикрепление к поверхности мицеллы посредством химических связей (водородных в частности).
Повсеместное распространение
Коллоидные растворы присутствуют неизменно внутри человека и вокруг него. К ним относятся кровь, лимфа, часто используемые в различных строительных и отделочных работах клеи и краски. Из коллоидных растворов в результате коагуляции и осаждения получают гели. К таковым можно, например, отнести холодец, мармелад, агар-агар, желатин, каррагинаны. Последние используются для улучшения структуры продуктов, в частности паштетов. Везде в организме человека присутствуют коллоидные растворы, обогащенные белками.
Использование в медицине

В медицине коллоидные растворы применяются повсеместно. Вот несколько примеров их использования. Коллоидное серебро, представляющее собой мелкие частицы металла, диспергированные в воде, применяется при лечении ожогов, язвенных болезней желудка и двенадцатиперстной кишки, для промывания слизистой носа в целях предотвращения распространения вирусных инфекций.
Фармацевтическая промышленность предлагает большой выбор коллоидных растворов для различных целей. Среди них встречают универсальные средства, которые можно применять как ранозаживляющие при ожогах, геморрое; противовоспалительные - при насморке, ангине, гайморите; анальгетики - для снятия зубной боли и не только. К таковым относится коллоидный раствор «Миллениум». В состав геля входит алоэ, белок пшеницы, женьшень, витамин Е и прочие полезные добавки. Многие фармацевтические средства для наружного применения на самом деле являют собой коллоидный раствор. Для суставов, например, используется "Артро Комплекс", содержащий такой полезный компонент, как акулий хрящ.
Применение в быту и промышленности
Коллоидные растворы составляют основу моющих и чистящих ПАВов. Загрязнения проникают внутрь мицеллы и таким образом удаляются с поверхности.
Другой важный аспект применения мицеллообразующих ПАВов - производство полимеров, в частности латексов, поливинилового спирта, клеев растительного происхождения. Различные пластмассы, кожзаменители получены на основе эмульсии. ПАВы применяются также при очистке сточных вод и питьевой воды.
Преимущества косметики на основе коллоидных растворов заключаются в проникновении действующих веществ через кожные покровы человека и структуру волос. Такие средства эффективно используются против старения. К ним относится, в частности, гель «Миллениум Нео». Коллоидный раствор помогает содержащимся в нем компонентам достичь глубоких слоев кожи, минуя эпидермис.
Коллоидные системы: типы, свойства и значение
Когда речь идет об агрегатном состоянии веществ, то принято выделять четыре основных типа:
Однако большинство биологических сред, жидкостей, природных явлений представляет собой некую смесь из нескольких вариантов. Значительная часть всех растворов обладает особыми свойствами. Они отличаются и внешними признаками, и внутренним строением. Называют их так: коллоидные системы. Это совокупная смесь веществ разной природы, находящихся в разных агрегатных состояниях. Чтобы лучше разобраться в данном вопросе, следует рассмотреть все свойства и характеристики подобных растворов, что мы и сделаем в ходе данной статьи.
Коллоидно-дисперсная система: характеристика
Если говорить простым обыденным языком, то данная система - это нечто среднее между истинным раствором, который является 100% гомогенной средой и грубодисперсными взвесями, в которых четко прослеживается граница раздела фаз.
Вообще коллоидные системы являются частью дисперсных систем, одной из их разновидностей. Поэтому неудивительно, что свойства их во многом схожи. Чтобы лучше представить себе, что же такое описываемое состояние вещества, приведем несколько примеров из жизни.
- Гели и гелеподобные тела. Например, те, что применяются для укладки прически. Также сюда можно отнести гелеобразные и студнеобразные крема, в том числе и кондитерские. Раствор агар-агара, набухший крахмал, раствор куриного белка - все это коллоидные системы. Химия, которая занимается изучением подобных структур, именуется физколлоидной или физической.
- Золи. Другими словами, это деструктурированные гели. Именно они и стоят на границе между грубодисперсными системами и истинными растворами. Примеры данного состояния: туман, дым или пыль в воздухе.
Также можно привести еще несколько общеизвестных соединений, которые считают коллоидами:
- пыль;
- аэрозоль;
- эмульсия;
- суспензия;
- туман и прочие.
Для каждого приведенного примера можно привести свои специфические свойства. Однако существуют и те, что являются для них общими.
Классификация коллоидных систем
Так как разнообразие рассматриваемых соединений велико, то естественно, что имеется их классификация. В основу положены признаки строения - структурированность, размеры дисперсной фазы по отношению к среде и прочие. Если все коллоидные системы разделить на типы по характеру входящих в их состав частиц, то можно выделить основные из них:
- жидкость в газе - туман, например;
- твердые частицы в газовой среде - дым, пыль;
- жидкость в жидкости - различные эмульсии;
- твердые частицы в жидкости - суспензии;
- жидкость в твердом - эмульсии;
- твердые частицы в твердой среде - твердые золи.
Также существует еще один признак, который ложится в основу разделения рассматриваемых систем. Это взаимодействие частиц фазы и среды друг с другом. Классификация коллоидных систем в этом случае принимает следующий вид.
- Лиофильные. Включают в себя те системы, в которых происходит взаимодействие и даже растворение частиц фазы в среде.
- Лиофобные. Не происходит ни взаимодействия между средой и фазой, ни их взаимного растворения.
Если речь идет о такой среде, как вода, то можно эти же группы назвать, соответственно, гидрофильными и гидрофобными.
Еще один вариант подразделения рассматриваемых систем следующий:
- Свободнодисперсные. Это такие, в которых частицы находятся в постоянном движении, взаимодействуют друг с другом и не формируют определенной структуры, то есть находятся в неком хаосе. Примеры: мелкодисперсные суспензии, эмульсии, лиозоли, аэрозоли.
- Связнодисперсные - это коллоидные системы, в которых внутренняя структура четко упорядочена и представляет собой некий молекулярный каркас из среды, заполненный внутри фазой. Примерами могут служить гели, пасты, порошки, густые эмульсии и суспензии.
Возможен самопроизвольный переход золя в гель, этот процесс имеет название гелеобразования. Однако нередко наблюдается и обратный процесс.
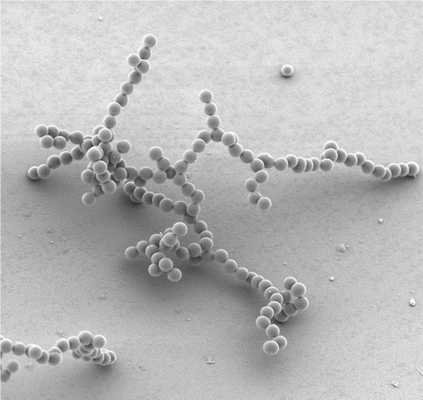
Лиофобные системы: золи
Это такая коллоидная система, фазы которой достаточно четко отделены друг от друга границей раздела. Однако увидеть это сложно, ведь размеры частиц дисперсных - не более 100 нм. Именно поэтому золи - промежуточное состояние между истинными растворами и грубодисперсными составами.
У данных систем есть своя классификация. Их разделяют в зависимости от вида дисперсионной среды. Можно выделить несколько основных вариантов:
- гидрозоли - среда водная;
- алкозоли - спирт;
- этерозоли - эфирная;
- органозоли - более общее обозначение органической природы среды.
Именно для лиозолей (среда - жидкая) характерно такое понятие, как мицелла. Им обозначают фазные частицы в совокупности с внешней сферой - частицами (ионами) окружающей среды. Для любой зольной системы можно записать свое химическое выражение, отражающее ее состав в виде мицеллы.
Пример: красный золь золота с составом NaAuO2 + HCOH + Na2CO3 → Au + HCOONa + H2O имеет мицеллу следующего вида: m· n AuO2 - · (n-x) Na + > x- · xNa + .
Свойства золей можно описать несколькими пунктами:
- Существует граница раздела фаз, у которой сильное поверхностное натяжение.
- Частица фазы и среды находятся в постоянном броуновском движении.
- Частицы способны к агрегации - слипанию и осаждению. Это объясняется их постоянным взаимодействием.
Если же говорить об использовании золей в промышленности, то оно достаточно широко. Если вспомнить, что все аэрозоли, суспензии и эмульсии относятся именно к ним, то становится ясно, что без подобных коллоидных систем не обходятся:
- химическая промышленность;
- фармацевтика;
- военное дело;
- пищевая отрасль и прочие.
При определенных условиях золи могут начать структурироваться. То есть выстраивать внутренний каркас из дисперсных частиц, ячейки в которых будут заполнены молекулами среды. Еще одно название происходящего - коагуляция или слипание. В этом случае говорят о гелеобразовании, так как продуктом станет гель.
Лиофильные системы
Данные структуры образуются благодаря тесному взаимодействию частиц среды и фазы. Это приводит к тому, что они растворяются друг в друге, набухают и образуются студенистые гелеобразные по консистенции соединения. Внутри же они представляют собой трехмерную пространственную сетку, в которой все поры заполняются частицами жидкой или твердой среды. Благодаря такому строению все лиофильные гели обладают следующими свойствами:
- упругость;
- способность сохранять постоянную форму;
- прочность;
- пластичность;
- нетекучесть.
Такие молекулярные коллоидные системы встречаются очень часто. Ведь по своей природе это как высокомолекулярные, так и низкомолекулярные вещества, подвергшиеся воздействию для изменения свойств. Приведем несколько всем известных вариантов:
- косметические гели для бритья, для волос;
- лекарственные препараты - от болей, ушибов, ран и прочего;
- бытовая химия;
- адсорбенты в химической промышленности.
Особое свойство данных веществ - способность самопроизвольно необратимо разрушаться при высушивании. Наверняка многие замечали, что есть обычный гель для волос оставить открытым, то через два-три дня от него останется лишь маленькая сухая масса, непригодная к использованию.
Это происходит из-за разрушения пространственной структуры и испарения влаги. Иногда влагу специально убирают из состава гелей, чтобы получить нужный продукт. Но делается это химическим путем, без разрушения общей структуры. Так получают силикагели, алюмогели.

Особенные и общие свойства коллоидов
Свойства коллоидных систем (или коллоидов) следующие:
- Отличительный внешний вид, особенно если речь идет о гелях, эмульсиях и суспензиях, аэрозолях.
- Особое отношение к проходящему сквозь вещество свету: большинство из них не препятствует этому, а часть (прозрачные) вообще рассеивают направленный пучок.
- Постоянное движение частиц не позволяет в коллоидных системах образовываться осадку.
- Так как среда и фаза могут быть очень разными по отношению друг к другу, то выделить общие физические параметры сложно. Они должны относиться к каждому конкретному веществу.
Если говорить об особых свойствах рассматриваемых состояний веществ, то следует указать на броуновское движение структурных элементов и на эффект Тиндаля, то есть на рассеивание света.
Эффект Тиндаля
Данное явление входит в особые оптические свойства коллоидных систем. Суть его заключается в следующем: пучок света, проходящий через раствор (или аэрозоль) системы, рассеивается. Однако делает это не совсем обычно. Так как способность отражать или поглощать пучки света у всех частиц разная, показатель преломления варьируется, то получается, что можно наблюдать конусообразное пятно на темном фоне.
Этот эффект используется для определения качества, количества и размеров частиц, составляющих данную систему. Впервые методика была разработана и введена в использование Джоном Тиндалем, за что и получила такое название.
Очень простой и доступный опыт в домашних условиях позволит убедиться в наличии данного эффекта. Нужно приготовить раствор куриного белка в воде. Получится типичная лиофильная коллоидная система. Затем пропустить через него лазерный луч и обеспечить позади сосуда темный фон. Таким образом, конус Тиндаля будет виден очень отчетливо, а свет внутри раствора рассеется.

Броуновское движение частиц
Это еще одно особое свойство рассматриваемых систем. Заключается в постоянном движении частиц фазы в среде раствора как газообразной, так и жидкой. Молекулы, атомы, ионы находятся в беспрерывном хаотическом круговороте. Это позволяет коллоиду существовать в неизменном виде. Кроме того, благодаря их одинаковым зарядам слипания между ними не происходит. Это позволяет системе быть достаточно устойчивой.
Это явление характерно лишь для тех частиц, размер которых не превышает 3 мкм. Иначе наступает седиментация раствора.
Способы образования коллоидов
Методы получения коллоидных систем достаточно разнообразны, поскольку и сами системы неодинаковы. Можно выделить несколько наиболее часто применяемых приемов.
- Конденсация.
- Диспергирование.
- Пептизация.
Все эти методы коллоидных систем имеют широкое промышленное значение при работе с ними, при их получении и изучении свойств. Рассмотрим более подробно каждый из них.
Конденсация - это метод, в основе которого лежит способность молекул и ионов ассоциироваться друг с другом, слипаться, образуя более крупные частицы. Таким образом, формируется новая система, чаще всего обладающая свойствами коллоида. Сделать это можно двумя путями:
- заменой растворителя (то есть среды);
- химической конденсацией, то есть рядом последовательных взаимодействий, приводящих к укрупнению частиц.
И в том, и в другом случае получаются настоящие коллоиды, в которых твердые частицы удерживаются броуновским движением во взвешенном состоянии.
Диспергирование, напротив, заключается в измельчении фазового компонента смеси до того состояния, когда раствор станет коллоидом. Делают это несколькими способами:
- механическим дроблением;
- электродуговым распылением;
- измельчением ультразвуком и прочее.
Пептизация - химическое расщепление слипшихся коагулированных частиц на более мелкие структуры. Таким способом получают растворы в промышленности. При этом обязательное участие принимают специфические агенты - пептизаторы.

Условия устойчивого состояния
Устойчивость коллоидных систем требует определенных условий. Ведь мы уже говорили, что с течением времени они могут разрушаться, иногда необратимо. Особенно это касается лиофобных систем - золей. Поэтому существуют методы, позволяющие сохранить и повысить устойчивость коллоидов:
- Добавление специальных антикоагулянтов - стабилизаторов.
- Введение постоянных и временных электролитов для изменения значения электродного потенциала участников системы.
Остальные способы являются узкоспецифичными для каждого конкретного коллоида, когда учитываются все свойства раствора.
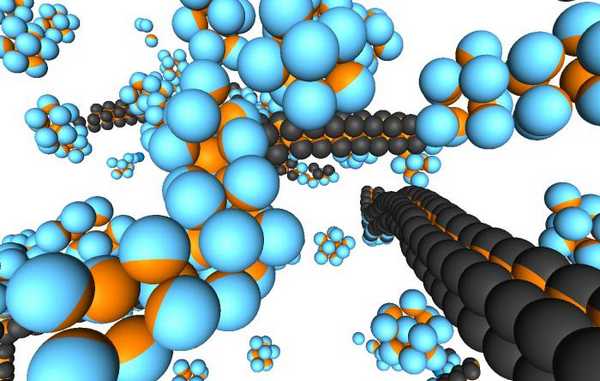
Распространение и значение коллоидных систем
Встретиться с коллоидами можно как в химической лаборатории, так и в природе. Известно, что практически все внутренние биологические вещества живого организма представляют собой именно такие дисперсные системы. Например:
- цитоплазма;
- строма;
- костный мозг и прочие.
Среди строительных материалов очень много именно коллоидных систем, которые обладают хорошими техническими характеристиками. Это бетон, металлические сплавы, глиносодержащие соединения, пены, аэрозоли и так далее.
Фармацевтика вообще невозможна без коллоидов. Все пасты, мази, гели, суспензии и эмульсии - это лекарственные средства, представляющие собой рассматриваемые нами системы. Поэтому переоценить значение и распространение коллоидов сложно, они одни из самых распространенных и широко используемых видов агрегатного состояния вещества.
Коллоидный раствор
Коллоидные растворы — это высокодисперсные двухфазные системы, состоящие из дисперсионной среды и дисперсной фазы, причем линейные размеры частиц последней лежат в пределах от 1 до 100 нм. Как видно, коллоидные растворы по размерам частиц являются промежуточными между истинными растворами и суспензиями и эмульсиями. Коллоидные частицы обычно состоят из большого числа молекул или ионов.
Коллоидные растворы иначе называют золями. Их получают дисперсионными и конденсационными методами. Диспергирование чаще всего производят при помощи особых “коллоидных мельниц”. При конденсационном методе коллоидные частицы образуются за счет объединения атомов или молекул в агрегаты. Так, если возбудить в воде дуговой электрический разряд между двумя проволоками из серебра, то пары металла конденсируются в коллоидные частицы. При протекании многих химических реакций также происходит конденсация и образуются высокодисперсные системы (выпадение осадков, протекание гидролиза, окислительно-восстановительные реакции и т.д.).
Золи обладают рядом специфических свойств, которые подробно изучает коллоидная химия. Золи в зависимости от размеров частиц могут иметь различную окраску, а у истинных растворов она одинаковая. Например, золи золота могут быть синими, фиолетовыми, вишневыми, рубиново-красными.
В отличие от истинных растворов для золей характерен эффект Тиндаля, т. е. рассеяние света коллоидными частицами. При пропускании через золь пучка света появляется светлый конус, видимый в затемненном помещении. Так можно распознать, является данный раствор коллоидным или истинным.
Одним из важных свойств золей является то, что их частицы имеют электрические заряды одного знака. Благодаря этому они не соединяются в более крупные частицы и не осаждаются. При этом частицы одних золей, например металлов, сульфидов, кремниевой и оловянной кислот, имеют отрицательный заряд, других, например гидроксидов, оксидов металлов, — положительный заряд. Возникновение заряда объясняется адсорбцией коллоидными частицами ионов из раствора.
Для осаждения золя необходимо, чтобы его частицы соединились в более крупные агрегаты. Соединение частиц в более крупные агрегаты называется коагуляцией, а осаждение их под влиянием силы тяжести — седиментацией.
Обычно коагуляция происходит при прибавлении к золю: 1) электролита, 2) другого золя, частицы которого имеют противоположный заряд, и 3) при нагревании.
Коллоидное состояние характерно для многих веществ, если их частицы имеют размер от 10?7 до 10?5 см. Суммарная их поверхность огромна, и она обладает поверхностной энергией, за счет которой может адсорбировать частицы из раствора. Образующаяся коллоидная частица называется мицеллой. Она имеет сложное строение и состоит из ядра, адсорбированных ионов, противоионов. Если растворитель взаимодействует с ядром частицы, то образуются лиофильные коллоиды, если не взаимодействует - то лиофобные коллоиды.
Человек как суперколлоид
Развитие представлений о коллоидных системах и их свойствах. Роль коллоидов в жизнедеятельности живых организмов. Гетерогенно-химическая физиология человека. Использование коллоидов как лекарственных средств. Формы взаимодействия липосом с клетками.
| Рубрика | Медицина |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 03.12.2018 |
| Размер файла | 779,2 K |
РГУ нефти и газа (НИУ) имени И.М. Губкина
Факультет Химической технологии и экологии
Кафедра физической и коллоидной химии
по дисциплине Коллоидная химия
на тему: Человек как суперколлоид
ПРОВЕРИЛ: Доцент кафедры физической и
коллоидной химии, к.т.н. Гришина И.Н.
ВЫПОЛНИЛ: Студент группы ХТ-15-04
Савкин Валентин Владимирович
СОДЕРЖАНИЕ
- ВВЕДЕНИЕ
- 1. ОБЩИЕ СВЕДЕНИЯ О КОЛЛОИДНЫХ СИСТЕМАХ
- 2. РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ О КОЛЛОИДНЫХ СИСТЕМАХ И ИХ СВОЙСТВАХ
- 3. КОЛЛОИДНО-ХИМИЧЕСКАЯ ФИЗИОЛОГИЯ ЧЕЛОВЕКА
- 4. ТКАНИ ОРГАНИЗМА КАК КОЛЛОИДНЫЕ СИСТЕМЫ
- 5. КОЛЛОИДЫ КАК ЛЕКАРСТВЕННЫЕ СРЕДСТВА. ПРИМЕНЕНИЕ КОЛЛОИДОВ В НАШЕЙ ЖИЗНИ
- ЗАКЛЮЧЕНИЕ
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
Коллоидная химия - отдельный раздел физической химии, который выделился в отдельную научную и учебную дисциплину, объектом изучения которого являются дисперсный системы.
Дисперсные системы - это гетерогенные системы, у которых одна из фаз сильно раздроблена (диспергирована) и представлена объектами, имеющими мельчайшие размеры в 1, 2 или 3 измерениях. Необходимо различать дисперсную фазу, которая диспергирована до малых частиц, и дисперсионную среду - сплошную и непрерывную фазу (она может быть жидкой, газообразной или твердой), в ней распределены частицы дисперсной фазы.
Реальные объекты природы почти всегда являются дисперсными системами. Сам человек - «ходячий коллоид» сказал Иван Иванович Жуков, советский химик, член-корреспондент АН СССР, профессор, который отдал всю свою жизнь коллоидной химии.[1]
1. ОБЩИЕ СВЕДЕНИЯ О КОЛЛОИДНЫХ СИСТЕМАХ
Коллоидные дисперсные системы (дисперсии) - микрогетерогенные образования, в которых одно мелкораздробленное вещество - дисперсная фаза - равномерно распределено (диспергировано) в другой фазе - дисперсионной среде. В коллоидных системах размер частиц дисперсной фазы составляет около 10-9-10-7 м, т.е. находится в интервале от нанометров до долей микрометров. Эта область больше размера типичной малой молекулы, но меньше размера объекта, видимого в обычном оптическом микроскопе.
Вся природа - организмы животных и растений, гидросфера и атмосфера, земная кора и недра - это сложная совокупность множества разнообразных и разных грубодисперсных и коллоидно-дисперсных систем. Дисперсное состояние универсально и при определенных условиях в него может перейти любое тело. Этим определяется особое положение коллоидная химия, развитие которой осуществляется в непосредственном контакте и взаимодействии со многими, часто не связанными между собой областями науки, промышленности, медицины и сельского хозяйства. Развитие коллоидной химии связано с важными проблемами различных областей естествознания и техники.
2. РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ О КОЛЛОИДНЫХ СИСТЕМАХ И ИХ СВОЙСТВАХ
Коллоидные процессы, такие, как крашение и склеивание, использовались даже в древнем Египте. Слово «коллоид» (от греческого слова, означающего «клей») было введено Т. Грэмом в 1862. Он установил различие между кристаллоидами (например, соль, сахар), которые после растворения в воде легко диффундируют через мембрану из пергамента, и коллоидами, такими, как желатин, которые не обладают такими свойствами. В 1857 М.Фарадей приготовил коллоидный раствор золя золота и показал, что сильный пучок (луч) света значительно рассеивается, проходя через эту дисперсию, таким образом, что его путь становится видимым - так же, как это происходит с лучом света в пыльной комнате или лучом от автомобильных фар туманным вечером. Это явление называется эффектом Тиндаля (в честь Дж. Тиндаля, который изучал его в 1869). Эксперименты по рассеянию света являются одним из наиболее эффективных средств для изучения коллоидных частиц и макромолекул; компьютерное обеспечение позволило достичь значительного успеха в этих исследованиях.
Каждая частица движется по зигзагообразной траектории. Это явление в 1827 впервые наблюдал Р.Броун в воде, в которой были суспендированы частицы цветочной пыльцы; оно было названо броуновским движением. В период 1902-1912 Р.Зигмонди создал ультрамикроскоп, который сделал возможной идентификацию коллоидных частиц по отраженному ими свету. Ультрамикроскоп позволял считать количество коллоидных частиц и изучать их движение.
Электрофорез (движение заряженных частиц в электрическом поле) впервые наблюдал Ф.Ройс в 1809, который показал, что отрицательно заряженные частицы суспензии глины мигрируют в сторону положительного электрода. А.Тизелиус в 1937 применил электрофорез для анализа биополимеров, в частности методом электрофореза разделял сыворотку крови на пять белковых фракций.
Особую роль коллоиды играют в жизнедеятельности живых организмов, включая организм человека.
3. КОЛЛОИДНО-ХИМИЧЕСКАЯ ФИЗИОЛОГИЯ ЧЕЛОВЕКА
Глобальная роль коллоидов заключается в том, что они являются основными компонентами таких биологических образований как живые организмы. Все вещества организма человека представляют собой коллоидные системы.
Коллоиды поступают в организм в виде пищевых веществ и в процессе пищеварения превращаются в специфические, характерные для данного организма коллоиды.
Коллоидно-химическая физиология человека - это раздел науки, изучающий функционирование систем организма человека, образующих коллоидные соединения.
Из 10 функций организма, выделенных в отдельные системы: пищеварительная, сердечно-сосудистая, дыхательная, нервная, иммунная, эндокринная, мочеполовая, крови, печени, почек, выделим те, которые представляют из себя коллоидные системы:
Можно смело сказать, что весь человек - это ходячий коллоид, а все органы и системы организма дисперсная система в их связи с поверхностными явлениями.
Кости - это коллаген, насыщенный кальцием и фосфором, мигрирующими в присутствии витамина Д.
Кровь - это дисперсная система, в которой ферментные элементы эритроциты, тромбоциты, лейкоциты являются фазой, а плазма - дисперсионной средой.
Все человеческое тело - это мир частиц, находящихся в постоянном движении строго по определенным правилам, подчиняющимся физиологии человека.
Коллоидные системы организмов обладают рядом биологических свойств, характеризующих то или иное коллоидное состояние:
С точки зрения коллоидно-химической физиологии человека его организм представляет собой сложный комплекс коллоидных систем в их постоянном динамическом взаимодействии. Мельчайшей структурно-функциональной единицей организма является клетка. Уже сама клетка представляет собой сложный комплекс коллоидных образований, основными из которых являются клеточные мембраны, гиалоплазма, ядро, ЭПР, рибосомы, лизосомы, комплекс Гольджи и др.
4. ТКАНИ ОРГАНИЗМА КАК КОЛЛОИДНЫЕ СИСТЕМЫ
Кровь является типичными примером ткани организма, где одни коллоиды находятся внутри других. В.А.Исаев дает определение крови как дисперсной системе, в которой форменные элементы - эритроциты, тромбоциты, лейкоциты являются фазой, а плазма - дисперсной средой. Однако по определению максимальных размеров, которых могут достигать коллоидные частицы он составляет 10-7 м., тогда как размер тромбоцитов равен 0,5-0,75 x 10-6 м, эритроцитов: 7x10-6 м., а размеры лейкоцитов превышают размеры эритроцитов в несколько раз. Таким образом, форменные элементы не могут считаться дисперсной фазой коллоидной системы и сами представляют из себя коллоид в коллоиде. Тем не менее именно они обусловливают вязкость крови, которая в 5 раз превышает вязкость воды.
К настоящему времени наиболее изученными являются коллоидные системы плазмы крови. Практически все органические составляющие плазмы находятся в ней в коллоидном состоянии.
Подобно крови лимфа состоит из жидкой части и форменных элементов. Причем эритроцитов в ней находится очень незначительное количество.
Качественный состав жидкой части лимфы совершенно одинаков с составом плазмы крови, но в количественном отношении резко отличается. Лимфа, оттекающая от кишечника, содержит в больших количествах продукты пищеварения, которые она получает во время всасывания. Она носит название хилюса и представляет собой эмульсию, содержащую крупные хиломикроны эмульгированного жира. Точный состава лимфы не известен. Он очень подвержен индивидуальным колебаниям. На него влияют такие факторы как состояние иммунной системы, деятельность различных органов и систем, кровяное давление и др.
Соединительная ткань является универсальной тканью организма. Соединительная ткань выполняет главную опорную функцию в организме, является основой построения костного скелета, суставов, связок, внутренних органов. К настоящему времени многие вопросы, связанные с изучением биохимических, коллоидных и других свойств соединительной ткани, остаются без ответа. Решение их помогло бы добиться значительных успехов в изучении патогенеза и лечении заболеваний опорно-двигательного аппарата, коллагенозов и соединительнотканных опухолей.
Практически любая жидкость или ткань организма человека представляет собой коллоидно-дисперсную среду. Таковыми являются, например, содержимое желудочно-кишечного тракта, желчь, спинномозговая жидкость, моча. При патологических изменениях в организме в коллоидном состоянии находятся белки отечной жидкости (транссудаты) или белки в воспалительных экссудатах. Нарушение коллоидных свойств вышеуказанных сред организма приводят в крови к образованию тромбов, и как следствие развитие инсультов и инфарктов. В желчи и моче при этом образуются камни, в суставной ткани - выпадение солей мочевой кислоты (подагра).
5. КОЛЛОИДЫ КАК ЛЕКАРСТВЕННЫЕ СРЕДСТВА. ПРИМЕНЕНИЕ КОЛЛОИДОВ В НАШЕЙ ЖИЗНИ
Большие молекулы протеинов, полисахаридов и нуклеиновых кислот в нашем организме являются не чем иным, как коллоидами.
В химии полимеров стали возможными новые методы синтеза, с помощью которых химическая система может быть нарезана на частички, имеющие размеры в области нанометров. Тем самым ученые могут изготовлять коллоидные шарики из полистирола, на которых они прикрепляют тысячи щупальцеобразных акцепторов. Такие ловушечки из блокполимера, состоящего из стирола и винилпиридина, позволяют, например, «выуживать» ртуть из крови при отравлении ртутью.
В настоящее время в медицине уже используются так называемые липосомы. Липосомы похожи на крохотные капсулы. Они состоят из обертывающей мембраны и внутренней полости, наполненной активным веществом, растворимым в воде или в масле. Поскольку структура липосомной оболочки воспринимается мембранами клеток как своя, у маленьких транспортных капсул меньше проблем при преодолении естественных барьеров кожи, чем у “незапакованных” активных веществ. В глубинных слоях верхней кожи липосомы должны отдать свой груз активного вещества клеткам, а своей опустевшей оболочкой укрепить межклеточное пространство.
Липосомы представляют собой замкнутые пузырьки воды, окруженные одним или несколькими слоями липидов.. Впервые на них обратил внимание английский исследователь Алек Бангем с коллегами в 1965 году. Они заметили, что липосомы весьма напоминают мембраны клеток. В те года уже было известно, что клеточные мембраны выполняют много функций, и липосомы сразу же стали важным инструментом для их изучения. Липосомы используются, для изучения действия на мембраны витаминов, гормонов, антибиотиков и других препаратов. Эта сторона дела привлекла наибольшее внимание исследователей, поскольку выяснилось, что липосомы хорошо справляются с ролью носителей лекарств.
Какие же качества липосом дают им преимущества перед другими носителями лекарств? Прежде всего, это сродство с природными мембранами клеток по химическому составу. Известно, что липиды, входящие в состав мембран, занимают от 20 до 80 процентов их массы. Поэтому при правильном подборе компонентов липосом их введение в организм не вызывает негативных реакций.
Второе важное свойство липосом - это универсальность. Благодаря полусинтетической природе можно широко варьировать их размеры, характеристики, состав поверхности. Это позволяет поручать липосомам переносить широкий круг фармакологически активных веществ: противоопухолевые и противомикробные препараты, гормоны, ферменты, вакцины, а также дополнительные источники энергии для клетки, генетический материал.
В-третьих, липосомы сравнительно легко разрушаются в организме, высвобождая доставленные вещества, но в пути следования липосомы, сами лишенные свойств антигена, надежно укрывают и свой груз от контакта с иммунной системой и, стало быть, не вызывают защитных и аллергических реакций организма.
Липосомы можно использовать и для борьбы с инфекционными заболеваниями. Обычный лейшманиоз лечат препаратами сурьмы, которые весьма токсичны. Но когда их ввели экспериментальным животным с помощью липосом, то они стали подавлять размножение возбудителей болезни в клетках печени в сотни раз эффективнее, чем обычно, а токсическое действие на сердце и почки заметно снизилось, что позволило увеличить дозу препарата. Сходные результаты были получены и при лечении похожих на лейшманиоз грибковых заболеваний - криптококкоза и гистоплазмоза.
Другие исследователи, используя антибиотик гентамицин, заключенный в липосомы, получили такие же результаты против возбудителей бруцеллеза, причем опыты были проведены как на культуре клеток, так и на животных - морских свинках.
Таким образом, липосомы помогают дольше сохранять высокий уровень концентрации лекарственных препаратов в крови и в клетках, а также помогают им проникнуть в те области, куда без липосом они попасть не могут.
Формы взаимодействия липосом с клетками, во многом объясняют их способность преодолевать некоторые анатомические барьеры организма, в частности, стенки желудочно-кишечного тракта. Это обстоятельство было использовано для лечения сахарного диабета путем введения инсулина преорально в липосомах. Опыты проводились на крысах, у которых предварительно искусственным путем вызывали сахарный диабет, И оказалось, что введение инсулина в липосомах вызывало снижение сахара в крови животных, ибо липосомы защищают этот гормон от разрушения желудочно-кишечном тракте. В настоящее время исследования в этом направлении продолжаются. Цель их - добиться возможности лечения диабета введением инсулина через рот, что будет большим подарком для больных этой тяжелой болезнью.
Во Всесоюзном кардиологическом научном центре, в лаборатории В.П. Торчилина был осуществлен направленный транспорт липосом в зону экспериментального инфаркта миокарда. Сделали это с помощью антител к миозину - белку сердечной мышцы. Антитела были прикреплены химически к поверхности липосом. Липосомы накапливались как в зоне инфаркта, так и в нормальной ткани сердца (то есть там, где был миозин), хотя значительная их часть все же локализовалась в клетках печени.
Весьма эффективным оказалось также введение липосом внутривенно. При этом в печень и селезенку попадает липосом во много раз больше, чем при введении их через брюшину и особенно под кожу.
Таким образом, комбинируя способы введения, можно надеяться на успешное лечение с помощью липосом и тех заболеваний, которые мало связаны с клетками ретикулоэндотелиальной системы.
Исследования последних лет установили, что система макрофагов играет важную роль в защите организма от различных инфекций и новообразований (опухолей). Макрофаги способны уничтожать как опухолевые клетки, так и клетки, пораженные вирусами, не затрагивая при этом нормальные, здоровые клетки. Но делают все это макрофаги лишь в активированном состоянии. А активируют их лимфоциты, которые выделяют для этого специальные вещества - лимфокины.
Таким образом, практическое использование липосом в лечении ряда заболеваний является весьма перспективным направлением фармакологии, основанном на достижениях в изучении коллоидных свойств веществ, частности билипидных слоев..
Но коллоиды в медицине, конечно, способны на большее. Гели, которые содержат полимеры коллоидных частиц, реагируют на внешние факторы, такие, как изменения значений рН, температуры или силы электрического поля. Гели могли бы стать идеальным транспортным средством для медикамента, который должен проявить свое действие только в кишечнике. коллоидный химический физиология лекарственный
Несомненно, существует целая палитра возможных новшеств в медицине. Например, в эндоскопии покрывают кабель-зонд из стекловолокна коллоидным гелем. Гель то разбухает, то снова сжимается, когда накладывается переменное напряжение. В результате кабель продвигается вперед. Сейчас в Японии проводят опыты по внедрению таких искусственных роботов - «дождевых червей» в хирургию минимального вмешательства в организм. Большим преимуществом метода является то, что не нужно с усилием проталкивать эндоскоп через сосуды, он сам себе прокладывает путь.
Как основа коллоиды применяются только в гелях. Коллоиды, входящие в состав косметических средств имеют полисахаридную или белковую структуры.
В масках для лица и средствах по уходу за волосами коллоиды добавляют в качестве стабилизаторов. В основном это целлюлоза. Целлюлозные основы нетоксичны, без вкуса и запаха, но их pH отклоняется в щелочную сторону (6.5-8)
Биополимерные коллоиды (полисахариды), например гиалуроновая кислота присутствуют и в нашем организме. Поэтому косметика на таких основах не вредит нашей коже. Кроме того, многие белковые коллоиды содержат свободные аминокислоты, способные проникать в кожу и поддерживать образование коллагена.
ЗАКЛЮЧЕНИЕ
Таким образом коллоидными системами в человеке являются абсолютно все функции организма:
Читайте также:
