Трансплантация печени у детей: показания, прогноз
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского»
ГБУЗ города Москвы «Московская городская онкологическая больница №62 ДЗМ»
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России
Московский научно-исследовательский онкологический институт им. П.А. Герцена
Трансплантация печени при гепатобластоме у детей
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2020;(11): 5‑13
Единственным методом лечения пациентов с терминальными диффузными заболеваниями и нерезектабельными опухолями печени является ее трансплантация. С 2008 по 2019 г. в отделении пересадки печени РНЦХ им. акад. Б.В. Петровского прооперировано 160 детей с очаговыми образованиями печени. Злокачественные новообразования диагностированы у 123 (77%) пациентов, в том числе гепатобластома (ГБ) у 106 (86%). У 19 (18%) из 106 пациентов с ГБ потребовалось выполнение трансплантации печени. Медиана сроков наблюдения за пациентами после трансплантации на декабрь 2019 г. составила 24,3 мес, а более чем у 2 /3 пациентов срок наблюдения не превышал 4 лет. Общая и бессобытийная выживаемость на сроке 10 лет достигла 87,1 и 82,7% соответственно. Аналогичные показатели наблюдали при резекциях — 91,1 и 86,6%. В то же время актуарная выживаемость при трансплантации по поводу ГБ на сроке до 4 лет составила 68%. Улучшение результатов лечения может быть достигнуто за счет мультидисциплинарного взаимодействия, обеспечивающего своевременное проведение лекарственной терапии и трансплантации печени.
Дата принятия в печать:
Введение
Единственным методом лечения пациентов с терминальными диффузными заболеваниями и нерезектабельными опухолями печени является ее трансплантация. Прогресс в области диагностики и противоопухолевой терапии вместе с накопленным хирургическим опытом расширяют критерии «резектабельности» опухоли и «операбельности» пациента с онкологическим заболеванием.
Успех в лечении пациентов с гепатобластомой (ГБ) заложен в грамотно выстроенном алгоритме ранней диагностики и своевременном начале неоадъювантной химиотерапии, что наиболее актуально при обширных опухолевых поражениях и/или экстраорганном распространении опухоли. Главной целью хирургического этапа лечения ГБ является полное удаление опухоли. У некоторых пациентов объем поражения печени и ее сосудистых структур исключает получение функционально сохранного резидуального объема паренхимы с полноценным афферентным и эфферентным кровотоком. В качестве единственной возможности полного удаления опухоли у таких пациентов остается трансплантация печени [1—8].
При выборе между резекцией и трансплантацией в случаях распространенного опухолевого процесса очень важен учет отдаленных результатов первично выполненных трансплантаций и трансплантаций по поводу рецидива ГБ после резекции печени. J. Otte и соавт. в 2005 г. представили статистику по 147 трансплантациям печени, выполненных в 24 медицинских центрах: 106 наблюдений первичных трансплантаций и 46 (группа сравнения) наблюдений трансплантаций печени после ранее выполненных резекций печени (rescue transplantation). Безрецидивная 6-летняя выживаемость при первично выполненных трансплантациях достигла 82%, тогда как в контрольной группе этот показатель составил лишь 30% [5]. Аналогичные данные представлены в упомянутом обзоре A. Trobaugh-Lotrario и соавт. [7]: выживаемость на момент публикации составила 85% среди 175 пациентов при первичной трансплантации и 41% среди 41 пациента при трансплантации «второй линии».
Показания к трансплантации печени при гепатобластоме
Показания к трансплантации печени всегда продиктованы невыполнимостью радикальной резекции. Сегодня бесспорным является наличие показаний у пациентов со стадией POST-TEXT IV вне зависимости от вида поражения печени — уни- или мультифокальное.
Трансплантация печени при ГБ не выступает в качестве облигатной хирургической опции с доказанными преимуществами у пациентов с «сосудистым конфликтом» опухоли с обеими долевыми ветвями воротной вены, и/или нижней полой веной, и/или всеми тремя печеночными венами при сохранном и достаточном в функциональном плане и свободном от опухоли левого латерального или правого заднего сектора печени (PRETEXT/POST-TEXT III). Оценка истинной инвазии в просвет сосуда на этапе дооперационной диагностики затруднена, а окончательное решение о резектабельности может быть принято при интраоперационной ревизии, а зачастую только в процессе разделения печеночной паренхимы. Кроме того, даже при наличии признаков прорастания опухоли или наличия опухолевого тромбоза возможно принятие решения в пользу органосохраняющей операции с протезированием пораженных сосудов. До сих пор продолжаются научно-клинические дискуссии, касающиеся отдаленных результатов у отдельных пациентов с мультифокальной ГБ, когда в процессе неоадъювантной химиотерапии отмечается «полный радиологический регресс» меньших по размеру очагов в контралатеральной части печени (левый латеральный или правый задний сектор) [1, 4, 8, 12—15]. На чаше весов pro et contra для таких пациентов находятся следующие контраргументы:
1) в ходе регенерации резецированной печени увеличивается выработка факторов роста, в том числе фактора роста гепатоцитов — hepatocyte growth factor (HGF), что может рассматриваться в качестве пускового механизма развития местного рецидива ГБ;
2) отдаленные результаты трансплантации по поводу рецидива ГБ после резекции значительно уступают таковым при первично выполненных трансплантациях;
3) иммуносупрессия, обязательная у пациентов после трансплантации, всегда повышает онкологические риски, тем более при предсуществующем онкологическом заболевании;
4) при выполнении трансплантации от живого родственного донора последний подвергается медицинским рискам, присущим любому хирургическому вмешательству.
Как и наши зарубежные коллеги, мы считаем, что в случаях, когда решение о резектабельности может быть принято только интраоперационно, операция должна проводиться при наличии резервного донора (back-up living donor) в клиниках, располагающих опытом и возможностями выполнения как расширенных резекций, так и трансплантаций печени [14, 16, 17].
Противопоказания к трансплантации печени при гепатобластоме
Единственным абсолютным противопоказанием к трансплантации печени при ГБ с позиции распространенности онкологического процесса является наличие на момент трансплантации внепеченочных метастазов, резистентных к проводимой неоадъювантной химиотерапии и не подлежащих хирургическому удалению. Даже у пациентов с PRETEXT IV стадией при наличии метастазов в легких на момент постановки диагноза выполнение трансплантации печени возможно при условии их эрадикации в процессе неоадъювантной химиотерапии или полном хирургическом удалении перед трансплантацией. Обнаружение пораженных лимфатических узлов во время операции также не исключает возможность трансплантации при условии выполнения радикальной расширенной лимфаденэктомии.
При оценке противопоказаний у пациентов с ГБ также следует помнить о том, что неоадъювантная химиотерапия сопряжена с рисками развития инфекционных осложнений. Сепсис исключает возможность выполнения трансплантации, а выявленные очаги инфекции требуют обязательной санации.
Программа детской трансплантации печени в России развивается с 1997 г., когда бригада хирургов отделения пересадки печени Российского научного центра хирургии им. акад. Б.В. Петровского под руководством акад. РАН С.В. Готье выполнили первую в стране успешную родственную трансплантацию части печени 3-летнему ребенку по поводу болезни Кароли [18]. Для детей с ГБ широкие возможности выполнения трансплантации открылись позже, по мере оптимизации протоколов химиотерапии и формирования стратегии межклинического взаимодействия детских онкологов и трансплантологов [19]. Встречная инициатива детских онкологов РДКБ (с 2008 г.), НИИ ДОГ РОНЦ им. Н.Н. Блохина (с 2010 г.) и НМИЦ ДГОИ им. Дмитрия Рогачева (с 2012 г.), с одной стороны, и трансплантологов РНЦХ им. акад. Б.В. Петровского, с другой, послужила началом реализации научно-клинического междисциплинарного взаимодействия по лечению детей с ГБ.
Материал и методы
С 2008 по 2019 г. в отделении пересадки печени РНЦХ им. акад. Б.В. Петровского прооперировано 160 детей с очаговыми образованиями печени, в том числе 123 (77%) ребенка со злокачественными новообразованиями (рис. 1). ГБ отмечена у 106 (86%) пациентов. Более 2 /3 — 58 (67%) из 87 резекций печени по поводу ГБ были представлены расширенной гемигепатэктомией. Все резекции выполнены в объеме R0. Одному пациенту выполнена первая в России (2012 г.) ALPPS-резекция печени в детской возрастной группе [20]. В 5 наблюдениях расширенные гемигепатэктомии выполнены при наличии подготовленного резервного родственного донора (back-up living donor). У 19 (18%) из 106 пациентов с ГБ потребовалось выполнение трансплантации печени (рис. 2): левый латеральный сектор у 17, левая доля печени у 1, правая доля печени у 1.
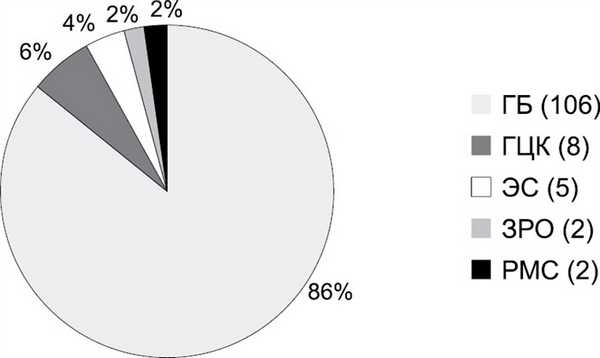
Рис. 1. Нозологические формы злокачественных новообразований печени у детей, оперированных в РНЦХ им. акад. Б.В. Петровского.
ГБ — гепатобластома, ГЦК — гепатоцеллюлярная карционма, ЭС — эмбриональная саркома, ЗРО — злокачественная рабдоидная опухоль, РС — рабдомиосаркома.
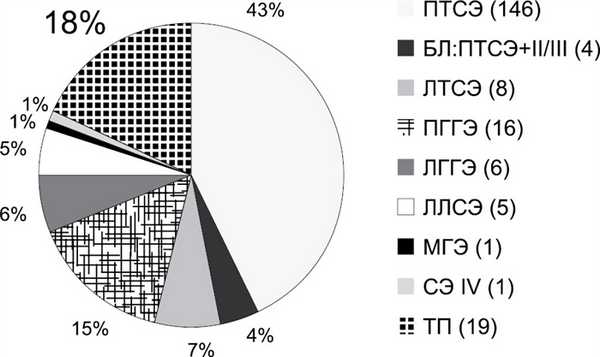
Рис. 2. Хирургические вмешательства у пациентов с гепатобластомой.
ПТСЭ — правосторонняя трисекторэктомия; БЛ — билобарная резекция, ЛТСЭ — левосторонняя трисекторэктомия; ПГГЭ — правосторонняя гемигепатэктомия; ЛГГЭ — левосторонняя гемигепатэктомия; ЛЛСЭ — левая латеральная секторэктомия; МГЭ — мезогепатэктомия; СЭ — сегментэктомия; ТП — трансплантация печени.
Таблица. Характеристика клинических наблюдений трансплантации печени при гепатобластозе
Трансплантация печени у детей
Категории МКБ: Ангиосаркома печени (C22.3), Атрезия желчных протоков (Q44.2), Болезни накопления гликогена (E74.0), Веноокклюзионная болезнь печени (K76.5), Гепатобластома (C22.2), Доброкачественное новообразование печени (D13.4), Другие болезни желчевыводящих путей (K83), Другие врожденные аномалии желчных протоков (Q44.5), Другие врожденные аномалии печени (Q44.7), Другие саркомы печени (C22.4), Другие уточненные болезни печени (K76.8), Другие уточненные раки печени (C22.7), Злокачественное новообразование переднего средостения (C38.1), Злокачественное новообразование печени неуточненное (C22.9), Злокачественное новообразование: поражение желчных путей, выходящее за пределы одной и более вышеуказанных локализаций (C24.8), Кистозная болезнь печени (Q44.6), Классическая фенилкетонурия (E70.0), Нарушения обмена белков плазмы, не классифицированные (E88.0), Нарушения обмена меди (E83.0), Нарушения обмена цикла мочевины (E72.2), Наследственный дефицит фактора VIII (D66), Острая и подострая печеночная недостаточность (K72.0), Отмирание и отторжение пересаженных органов и тканей (T86), Печеночноклеточный рак (C22.0), Привычный выкидыш (N96), Синдром Бадда-Киари (I82.0), Синдром Криглера-Найяра (E80.5), Фиброз и цирроз печени (K74), Хроническая печеночная недостаточность (K72.1), Хронический активный гепатит, не классифицированный в других рубриках (K73.2), Чистая гиперхолестеринемия (E78.0), Энцефалопатия неуточненная (G93.4)
Общая информация
Краткое описание
Одобрен объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «28» ноября 2017 года
Протокол №33
Трансплантация печени у детей - это органозамещающий/органосовмещающий метод оперативного лечения терминальных стадий заболеваний печени.
Дата разработки/пересмотра протокола: 2017 год.
Пользователи протокола: детские трансплантологи, анестезиологи-реаниматологи, детские хирурги, детские инфекционисты, педиатры, врачи общей практики.
Категория пациентов: дети.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
| По типу пересаживаемого органа: | · трансплантация целой печени, полученной от посмертного донора; · трансплантация части печени (редуцированная печень или часть разделенной печени - сплит-трансплантация), полученной от посмертного донора; · трансплантация части печени, полученной от живого донора. |
| По варианту модели трансплантации: | · ортотопическая трансплантация печени - пересадка донорской печени на место удалённой печени реципиента; · гетеротопическая трансплантация добавочной печени - в этом случае донорская ткань печени пересаживается реципиенту и при этом сохраняется его собственная печень. |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Перечень основных и дополнительных диагностических мероприятий
Перечень основных диагностических мероприятий:
· определение группа крови, Rh-фактор;
· общий анализ крови;
· общий анализ мочи;
· развернутый биохимический анализ крови (общий белок и белковые фракции, электролиты, трансаминазы, билирубин и его фракции, амилазу, креатинин, мочевина, аммиак, лактат, С - реактивный белок, глюкоза, щелочная фосфатаза, ГГТП, холестерин );
· развернутая коагулограмма (протромбиновое время, АЧТВ, ПТИ, МНО, фибриноген А, антитромбин-III, D-димер);
· определение онкомаркеров (CA 19-9, CA 125; АФП; РЭА);
· ИФА: определение антинуклеарных аутоантител (AMA, ANA, ат к LKM) в сыворотке крови;
· ИФА: вирусные гепатиты В, С и D;
· анализ крови на ВИЧ-инфекцию;
· ИФА на вирусы группы герпесов (герпес 1,2,8, цитомегаловирус, вирус Эбштейн-Барра, краснухи, кори, паротит, ВПГ);
· ИФА на сифилис;
· ПЦР крови и мочи на ЦМВ, ВПГ, ЭБВ;
· УЗИ брюшной полости и плевральных полостей;
· ЭКГ;
· спирография;
· обзорная рентгенография органов грудной клетки;
· эзофагогастродуоденоскопия;
· эхокардиография;
· допплерография сосудов брюшной полости;
· КТ брюшной полости с ангиографией.
· консультация кардиолога;
· консультация психолога;
· консультация оториноларинголога;
· консультация стоматолога;
· консультация гепатолога;
· консультация пульмонолога;
· консультация врача-инфекциониста.
Перечень дополнительных диагностических мероприятий:
· ПЦР (качественный, количественный тест): определение вирусов - герпес 1,2,8, цитомегаловирус, вирус Эбштейн-Барра, токсоплазмоз.
· ПЦР (качественный, количественный тест): определение вирусов гепатитов В, С и D;
· определение общих антител классов А, М,G в сыворотке крови серологическим методом;
· исследование с применением моноклональных антител иммуногистохимическим методом;
· МРХПГ;
· МРТ головного мозга;
· бактериальный посев асцитической жидкости;
· HLA-типирование по показаниям;
· cross-match с донором по показаниям.
Лечение
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Цель проведения процедуры/вмешательства:
· радикальное лечение пациента с терминальной стадией заболевания печени.
Показания и противопоказания к процедуре/вмешательству:
Показания к процедуре/вмешательству:
· фульминантный гепатит;
· терминальные стадии заболевания печени, при которых ожидаемая продолжительность жизни составляет менее 1 года (классы В и С по Child-Turcotte-Pugh);
· билиарная атрезия и врожденные аномалии желчных протоков
· цирроз печени со стойкой паренхиматозной желтухой;
· цирроз печени с энцефалопатией;
· цирроз печени с повторными кровотечениями из расширенных вен пищевода;
· цирроз печени, сопровождающийся гепаторенальным синдромом, устойчивым асцитом, нарастающей печеночной недостаточностью;
· очаговое заболевание печени, при котором технически невозможна резекция (из-за большого очага или при множественных очагах);
· гепатоцеллюлярная карцинома в пределах Миланских критериев или UCSF;
· острая печеночная недостаточность;
Противопоказания к процедуре/вмешательству
· непонимание родителями: характера операции, ее необходимости, риска а также необходимости пожизненного приема имуносупресоров;
· заболевания сердца, легких, ЦНС в стадии декомпенсации;
· резистентный туберкулез;
· ВИЧ-инфекция;
· сифилис в активной фазе;
· инфекции, не контролируемые терапией;
· онкологические заболевания, за исключением гепатоцеллюлярной карциномы в пределах Миланских или UCSF критериев;
· полное отсутствие психологической готовности пациента к пересадке печени.
Требования к проведению процедуры/вмешательства
Требование к соблюдению мер безопасности, санитарно-противоэпидемическому режиму: «Санитарно-эпидемиологические требования к объектам здравоохранения», утвержденным постановлением Правительства Республики Казахстан от 17 января 2012 года № 87.
Требования к оснащению: согласно приказа и.о. Министра здравоохранения Республики Казахстан от 3 ноября 2011 года № 763 «Об утверждении Положения о деятельности медицинских организаций, оказывающих нейрохирургическую помощь»; приказа МЗ РК № 199 от 29 марта 2013 года «О мерах по развитию службы трансплантации органов и тканей в Республике Казахстан».
Техническое оснащение:
· кавитационный хирургический аспиратор (ультразвуковой и/или водоструйный);
· электрохирургический коагулятор с наличием режимов резания (рассечения), коагуляции, биполяра и лигирования сосудов;
· система для непрерывной аутотрансфузии крови;
· микрохирургический набор инструментов;
· стационарный операционный микроскоп;
· мобильная рентгенологическая установка (С-дуга);
· многофункциональный ранорасширитель;
· оптические приборы (бинокулярная лупа);
· аппарат для быстрой инфузии, с подогревом растворов;
· аппарат искусственного кровообращения (вено-венозный обход - байпас);
· прибор для пункционной биопсии печени (пистолет) и одноразовые иголки;
· аппарат для мониторинга центральной гемодинамики;
· аппарат для определения глубины анестезии;
· аппарат для согревания пациентов;
· зажим для пережатия нижней полой вены;
· клипаторы с клипсами (маленькие, средние, большие);
· УЗИ аппарат с плоским датчиком;
· холодильники с морозильными камерами;
· передвижной операционный стол для подготовки печеночного графта.
· ангиография.
Требования к расходным материалам:
· сшивающие аппараты для сосудов;
· сшивающие аппараты для кишечника;
· синтетические сосудистые протезы;
· двухбаллонные катетеры;
· контейнер для перевозки органа;
· рассасывающийся и нерассасывающийся монофиламентный шовный материал;
· каркасные билиарные дренажи.
Требования к подготовке пациента:
· вечером накануне операции легкий ужин до 18:00 час, в день операции - голод;
· очистка кишечника;
· побрить операционное поле утром в день операции;
· провести перед операцией все гигиенические процедуры.
· стандартная для хирургических пациентов подготовка операционного поля (асептическим раствором).
Антибиотикопрофилактика:
· антибиотик широкого спектора действия;
· антибиотик вводится внутривенно за 30-60 минут до начала операции.
Профилактика и лечение цитомегаловирусной инфекции:
Рутинная профилактика ЦМВИ не рекомендуется у большинства пациентов D-R- реципиентов печени.
Профилактика для реципиентов с высоким риском развития ЦМВИ: валганцикловир внутрь для профилактики ЦМВИ из расчета 15-18 мг/кг в сутки в 2 приема (доза препарата зависит от функции почек).
NB! Валганцикловир проивопоказан детям до 12 лет, назначать с осторожностью
Профилактика других герпетических инфекций (простой герпес, герпес зостер) проводится с помощью ацикловира /валацикловира (УД - В) детям младше 5 лет - 200 мг/доза 2 раза, старше 5 лет - 400 мг/доза 2 раза
Профилактика антисекреторными препаратами:
· ранитидин (УД - В) 2-4 мг/кг/ 3 раза в сутки, внутрь, в течение часа;
Лечение портальной гипертензии:
· пропранолол (УД - В) 1-2мг/кг 2 раза в сутки в сочетании со склеротерапией или перевязкой варикозных сосудов
Остановка кровотечения:
· соматостатин* при портальной гипертензии 3мкг/кг/час в течение 5 дней, если еще сохранились кровоточащие узлы.
· Омепразол 0.5мг/кг 2 раза в сутки в/в.
Медикаментозная поддержка во время операции:
Иммуносупрессивная терапия (с целью профилактики отторжения трансплантата):
· метилпреднизолон (УД - В) интраоперационно: перед реперфузией трансплантата - 600 мг /м2 поверхности тела или 10мг/кг в/в;
· базиликсимаб (УД - А) -до 20кг массы тела 10 мг, свыше 20кг массы тела 20мг в/в, перед реперфузией (по показаниям).
Операция
Подготовка печеночного графта (как целого органа или фрагмента печени (Baсk Table):
Консервация и подготовка для трансплантации печеночного графта: донорской печени (от кадавра) или фрагмента печени (от прижизненного донора) выполняется в условиях операционной, на отдельном операционном столе (Back table).
Донорская печень или фрагмент печени помещается в специальный лоток, наполненный ледяной крошкой, после чего
графт взвешивается, производятся измерения диаметров сосудистых и билиарных структур.
Последовательно канюлируются кровеносная (воротная) вена, затем инкреторная (печеночная) вена, производится промывание/перфузия печеночного графта до «чистых вод» через артерию и вену физиологическим раствором с гепарином 1000 ед, а затем консервирующим раствором (1000-3000 мл).
После перфузии, производится препаровка кровеносных и инкреторных сосудов, а также, желчного протока, для формирования анастомозов.
Перед имплантацией, производится промывание/перфузия графта раствором альбумина 5%.
По мере готовности бригады, выполняющей основной этап операции, лоток с печеночным графтом транспортируется к операционному столу, для проведения трансплантации.
Трансплантация печени реципиенту:
До начала операции, производится подготовка к работе аппарата для реинфузии крови и аппарата общего вено-венозного шунтирования (при планировании их использования), а также, подготовка энергетического коагуляционно-ультразвукового комплекса, операционного микроскопа.
Положение пациента: лежа на спине.
Обезболивание: Общая анестезия.
NB! проводится катетеризация центральных вен (до 4), катетеризация лучевой артерии, датчика пульс-оксиметрии и инвазивного давления, сердечного выброса, температуры тела, ЭКГ, механики дыхания, газового состава вдыхаемой/выдыхаемой газовой смеси.
Обработка операционного поля у реципиента: не менее трех раз, с применением антисептических растворов и бетадиный операционный скотч.
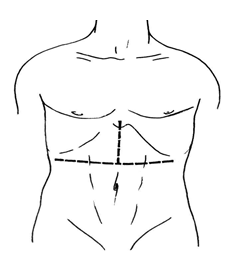
Операционный доступ:
доступ Старлза (лапаротомия трехлучевой формы по типу символа «Мерседес») (Рисунок 1).
Рис. 1 Доступ Старлза
Ревизия органов брюшной полости:
Производится ревизия органов брюшной полости, оценка состояния печени, селезенки, степени выраженности венозных коллатералей, эвакуация асцитической жидкости, с определением её количества, бактериологический посев асцитической жидкости.
Производится холецистэктомия.
В случае выраженной спленомегалии с синдромом гиперспленизма, может быть произведена спленэктомия.
Мобилизация левой и правой доли печени:
Поэтапно мобилизируются левая и правая доли печени, с освобождением задней поверхности печени от нижней полой вены, путем тщательного лигирования и пересечения ветвей мелкого порядка.
Выделяется надпеченочный отдел нижней полой вены, дифференцируются печеночные вены. Дифференцируются элементы гепатодуоденальной связки, с прослеживанием печеночной артериальной ножки, общего портального сосуда, гепатикохоледоха. Выделяется подпеченочный отдел нижней полой вены.
Производится подключение аппарата общего вено-венозного шунтирования (допускается также выполнение операции без аппарата вено-венозного шунтирования).
Последовательно пережимаются кровеносные и инкреторные сосуды: печеночная артерия, сосуд портальной системы, желчный проток и сосуды, впадающие в нижнюю полую вену (ветви печеночной вены). Пересекаются желчные протоки; те их ветви, которые не планируется вовлекать в анастомоз, ушиваются ручным способом. На сосудистых зажимах, отсекаются сосудистые структуры (печеночной артерии, воротной вены, печеночной вены), с которыми планируется производить анастомозы. Ветви сосудов, не планируемые к вовлечению в анастомоз, прошиваются ручным или аппаратным способом.
Гепатэктомия:
· производится гепатэктомия;
· производится частичное или полное пережатие нижней полой вены;
· производятся замеры сосудистых и билиарных элементов реципиента.
Имплантация печеночного графта:
Формирование вено-венозного анастомоза:
В позицию удаленной печени помещается ранее подготовленный графт.
Формируется анастомоз между соответствующими стволами печеночной вены реципиента и печеночной вены графта непрерывным швом нитью «пролен 4,0» или «пролен 5,0» одним из двух способов:
· «конец в конец» (при имплантации фрагмента печени);
· широкий кава-кавальный анастомоз «бок в бок» (анастомоз по типу «Piggy back») (при имплантации целой донорской печени).
Формирование анастомозов между венами портальной системы:
Формируется анастомоз между веной портальной системы реципиента и ветвью воротной вены печеночного графта, «конец в конец», также однорядным швом, нитью «пролен 4,0» или «пролен 5,0».
Запуск кровотока (реперфузия):
Поэтапно снимаются зажимы с нижней полой вены и воротной вены (по согласованию с анестезиологами).
Донорская печень и брюшная полость омываются теплым физиологическим раствором.
Производится контрольная ультразвуковая допплерография, оценивается внутрипеченочный венозный кровоток.
Формирование артериального анастомоза:
С использованием операционного микроскопа, производится формирование анастомоза артериальных структур реципиента и графта, «конец в конец», узловыми швами «пролен 7,0 - 8,0».
Поэтапно снимаются зажимы и запускается кровоток по артериальной системе.
Производится контрольная ультразвуковая допплерография, оценивается внутрипеченочный артериальный кровоток.
Формирование анастомоза билиарной системы производится путем:
· билио-билиоанастомоза «конец в конец»
· билиодегистивного анастомоза на сформированной по Roux петле тощей кишки (при сложной анатомии желчных протоков).
Ушивание анастомозов проводится на каркасном дренаже или без него (в зависимости от размера желчного протока/протоков) однорядными узловыми швами, монофиламентным синтетическим рассасывающимся шовным материалом 4-0 или 5-0.
Наружное дренирование желчевыводящей системы: с целью создания декомпрессии желчевыводящих путей и контроля состояния желчевыводящих путей в послеоперационном периоде (с оставлением до 3-х месяцев);
Проводится контроль наличия желчеистечения: через дренажную трубку вводится метиленовая синька. При обнаружении желчеистечения из сформированных анастомозов и/или мелких желчных протоков проводится их прошивание шовным материалом (пролен 4,0-5,0).
Оценка послеоперационного гемостаза:
Проводится визуальная оценка брюшной полости на наличие кровотечения.
При обнаружении кровотечения осуществляется прошивание шовным материалом (пролен 4,0-5,0).
Завершающий этап операции:
Проводится подсчет гемостатических пеленок и салфеток.
Устанавливаются контрольные дренажи - в правое поддиафрагмальные пространства, подпеченочное пространство и в малый таз.
Рана послойно ушивается наглухо.
Накладываются асептические повязки на рану.
Основные методы лечения/ведения реципиентов в послеоперационном периоде: антибактериальная терапия, иммуносупрессивная терапия, противовирусная терапия, противогрибковая терапия, симптоматические и синдромальные лечения проводятся согласно клиническому протоколу.
Другие виды лечения: при фульминантной печеночной недостаточности/выраженной печеночно-клеточной недостаточности:
· плазмаферез;
· альбуминовый диализ (МАРС-терапии);
при печеночно-почечной недостаточности:
· гемодиализ.
Индикаторы эффективности процедуры:
· нормализация показателей крови (тромбоцитов, общего белка, альбумина, мочевины, креатинина, общего билирубина, АлТ, АсТ, ГГТП, щелочная фосфатаза, триглицериды, лактат, МНО, протромбиновый индекс, АЧТВ).
· нормальное кровообращения печени на УЗДГ.
Трансплантация (пересадка) печени
Печень - жизненно важный орган, который из-за ряда причин может утратить свою функциональность. Если это становится причиной интоксикации всего организма, требуется срочная операция, чтобы предотвратить летальный исход. Пересадка печени - сложная хирургическая процедура, требующая тщательной подготовки, имеющая длительный реабилитационный период. Однако, если удается подыскать подходящего донора и своевременно выполнить операцию, прогноз благоприятный.
Немного истории и статистики
Первая пересадка или трансплантация печени была выполнена в 1963 году в США. Орган был взят у умершего человека, хирургическое вмешательство было сенсацией по всему миру. С тех пор в разных странах специалисты практикуют подобную операцию. Больше всего случаев ее проведения зафиксировано в США. Однако далеко не все клиники предлагают такую услугу. Почему?
Все дело в большом риске, ведь пересадка этого жизненно важного органа требует соблюдения множества правил. Ткани печени очень тонкие, поэтому их легко повредить. Кроме того, серьезной проблемой является вероятность отторжения организмом донорского органа, ведь он будет чужеродным телом.
Сегодня больше всего специалистов, выполняющих трансплантацию печени, находятся, кроме Штатов, в Японии и Европе. В России также существуют центры, предлагающие операцию по пересадке печени, большая часть из них находится в Москве и Санкт-Петербурге. Однако их немного, что объясняется проблемами с нахождением доноров, пробелами в законодательстве по таким серьезным медицинским манипуляциям.
Основные показания к операции
Основное показание к операции - цирроз. Это заболевание, при котором здоровые клетки печени погибают, замещаются соединительной тканью. Если вовремя начать лечение, то разрушительный процесс можно приостановить, поддерживающая терапия поспособствует восстановлению функциональности печени. В противном случае развиваются осложнения.
При запущенном циррозе происходят массовые кровопотери, нарушаются функции других органов ЖКТ, легких, головного мозга. В этот период единственным вариантом лечения является трансплантация здорового органа. Если затянуть с операцией, когда во внутренних органах начинаются необратимые изменения, она противопоказана, скорость наступления летального исхода увеличивается.
Больные циррозом обычно погибают из-за внутреннего кровотечения, энцефалопатии, других осложнений, поэтому затягивать с пересадкой органа опасно для жизни.
Кроме цирроза, показаниями являются:
- онкология - только в случаях, когда рак поразил печень, но метастазы в других органах отсутствуют, в противном случае пересадка органа бесполезна;
- острая печеночная недостаточность, часто возникающая при сильном отравлении, интоксикации организма;
- вирусные гепатиты, чаще гепатит С;
- гемохроматоз - нарушение обменных процессов, при котором в организме переизбыток железа, и оно откладывается в печени, нарушая ее функциональность;
- болезнь Вильсона-Коновалова.
Показанием к проведению операции у ребенка также может быть билиарная атрезия. Это врожденная патология, подразумевающая отсутствие или непроходимость желчных протоков.
Сами по себе цирроз и все остальные диагнозы не являются основанием для проведения операции. Сначала врачи назначают консервативную терапию, при болезнях печени также важно соблюдение диеты. Если вовремя начать принимать меры большинство из них можно вылечить. Если заболеванием имеет хроническую форму, удается достичь длительной ремиссии. Такие серьезные хирургические вмешательства как трансплантация органа требуются лишь в запущенных состояниях или если консервативная терапия не принесла результата.
Противопоказания
Решать, можно ли делать пересадку должны врачи, учитывая многие факторы. В них входят индивидуальные особенности организма пациента, его данные (возраст, пол, наличие хронических болезней), характер и степень поражения печени. К относительным противопоказаниям относятся:
- возраст старше 80 лет;
- тромбоз вен в брюшной полости;
- проведенные ранее операции на печени.
В этих случаях при острой необходимости трансплантация может провестись, но обычно ее не делают. Абсолютными противопоказаниями, при которых пересадка печени категорически запрещена, являются:
- СПИД, сепсис, герпес и другие вирусные инфекции;
- инсульты, инфаркты в анамнезе;
- хроническая сердечная недостаточность;
- хроническая почечная недостаточность;
- поликистоз почек;
- сахарный диабет и другие хронические заболевания эндокринной системы;
- хронические болезни крови.
Противопоказанием также является алкоголизм и наркомания, которые часто и становятся причиной проблем с печенью.
Как подбираются доноры
Вначале для трансплантации печени брали орган умерших людей, но затем медики начали проводить операции по пересадке его части. С тех пор донором может выступать живой человек. Что касается умерших, то некоторые решают подписать документ, разрешающий использование их органов после смерти. Если печень здоровая, она может использоваться для пересадки.
Однако лучше приживается часть органа, взятая у живого человека. У донора должна быть такая же группа крови, как у больного. При трансплантации печени у детей также важно учитывать размеры органа. Если возможна родственная пересадка, врачи советуют сделать выбор в ее пользу. Реакция отторжения в таких случаях встречается редко.
Перед операцией проверяется состояние печени и здоровья родственника, который хочет стать донором. Если все в норме, назначается пересадка. Родственная трансплантация имеет ряд преимуществ:
- уменьшается время ожидания - некоторые люди, которые стоят в очереди на трупную печень, просто не доживают до операции;
- за короткий срок можно подготовить к пересадке и донора, и больного;
- печень живого донора всегда лучшего качества, чем трупа;
- больной легче переносит психологически и морально операцию, когда донором является родственник.
Для пересадки взрослому достаточно одной доли печени донора, ребенку - половины.
Вероятность того, что у донора начнут развиваться осложнения, присутствует всегда. Если у родственников нет возможности отдать часть органа, многие становятся в очереди за печенью от мертвых доноров. Обычно ими являются люди, которые при поражениях головного мозга находятся в коме. Дать согласие на использование органов может либо человек еще при жизни, либо его ближайшие родственники в течение нескольких часов после смерти.
После изъятия печень хранится не более 12-15 часов, поэтому ортотопическая трансплантация назначается экстренно. Для облегчения поиска существуют международные базы, в которых находится информация о реципиентах (больных, нуждающихся в трансплантации).
Лучшие клиники мира
В России первая трансплантация печени была выполнена относительно недавно - в 1990 году. К сожалению, законодательство страны не предусматривает много нюансов о проведении подобных операций. Например, добиться разрешения на использование органов мертвого донора очень сложно. Из-за этого многие вынуждены обращаться в зарубежные клиники.
В России большим спросом пользуются врачи, выполняющие трансплантацию печени в НИИ Склифосовского.
Кроме США и стран Европы, все больше центров, в которых выполняют трансплантацию печени, открываются в Индии, Корее, Израиле, Сингапуре, Казахстане. Лучшими считаются центры в таких странах:
в США - медцентр Вандербильта, в нем произвели около 8% операций по трансплантации по всему миру;
- в Израиле - медццентр им. Рабина - ежегодно проводят около 300 операций по трансплантации печени;
- в Корее - медцентр Самсунг;
- в Германии - клиника Эссен.
Стоимость пересадки печени
Данный вид хирургического вмешательства могут позволить себе не все. Дешевле всего обходится трансплантация, когда донором выступает родственник. Сама печень бесплатная, за нее Государству и клинике платить не нужно, требуется лишь его письменное согласие донора. Все же пересадка печени - одна из наиболее дорогостоящих операций в мире.
В России средняя стоимость составляет 3 миллиона рублей, однако по оборудованию, используемым материалам и условиям, отечественные клиники уступают зарубежным. За границей средняя стоимость составляет 250-400 тысяч долларов. В США цены достигают 500 тысяч долларов, но именно американские клиники и специалисты считаются лучшими в мире.
Подготовка к операции
Учитывая сложность операции и длительность восстановительного периода, подготовка должна быть тщательной. Ее цель - убедиться в том, что состояние пациента стабильное, организм сможет принять трансплантат и восстановиться после пересадки.
Подготовка включает в себя сдачу таких анализов:
- клиника крови;
- биохимия крови и мочи;
- клиника мочи;
- анализ крови на холестерин;
- коагулограмма;
- анализ крови на гормоны (обычно щитовидки, при необходимости - другие);
- бактериологическое исследование мочи, кала.
После сдачи анализов назначается инструментальная диагностика, ее подбирает врач в индивидуальном порядке - в зависимости от того, какое поражение печени привело к ее гибели и почему требуется пересадка. Обычно назначаются:
- УЗИ печени и органов брюшной полости;
- электрокардиограмма;
- КТ или МРТ органов брюшной полости;
- ЭГДС или колоноскопия кишечника.
При необходимости, особенно при подозрении на рак, назначается биопсия - забор тканей печени для дальнейшего исследования.
Если диагностика показала, что трансплантация возможна, пациент начинает готовиться к операции. Он должен соблюдать диету, отказаться от вредных привычек, выполнять гимнастику, назначенную врачом. Следить за своим здоровьем должен также донор. Обычно назначается экстренная пересадка, поэтому донору долго ждать не приходится.
Этапы проведения операции
Списки нуждающихся в пересадке по всему миру велики, ждать органы мертвых доноров приходится годами, многие просто не доживают до операции. Поэтому на сегодняшний день актуальной является ортотопическая пересадка, то есть донором является живой человек.
Она проходит в несколько этапов:
- Удаление больной печени. Орган удаляется целиком вместе с участком нижней полой вены. Сосуды, ведущие к печени, пересекаются, для поддержания кровотока устанавливаются временные шунты.
- Установка донорской печени. Если донором стал живой человек, устанавливается часть органа, если мертвый - целый орган. Все сосуды и артерии сшиваются, чтобы восстановился кровоток.
- Возобновление оттока желчи. На месте соединения нового органа с сосудами устанавливают дренаж, когда показатели билирубина нормализуются, его снимают. Через час после завершения процедуры сшивается брюшная полость.
Длительность пересадки составляет от 4 до 12 часов, на ней обязательно присутствует сосудистый хирург и анестезиолог.
Реабилитация
Первые 3 недели после пересадки новый орган не функционирует. Для поддержания жизни используют специальный аппарат, с ним человек находится в стационаре. В это время и после того, как донорская печень прижилась, назначается лекарственная терапия. Первое время применяются препараты, цель которых заключается в предотвращении отторжения нового органа.
В большинстве случаев сразу после пересадки назначается Циклоспорин - средство, подавляющее отторжение печени.
Иммунносупрессоры назначаются пожизненно, их подбирает врач-гепатолог. В реабилитационный период необходимо регулярно сдавать анализы мочи, крови, проходить инструментальные исследования по назначению врача.
Ежемесячно на протяжении длительного времени, рекомендованного врачом, выполняется УЗИ печени, желчного пузыря и сосудов.
Особенно важно соблюдать диету и придерживаться правильного образа жизни. Категорически запрещаются алкоголь, курение. Диета подразумевает присутствие в рационе только легко усваиваемой пищи, чтобы не перегружать печень. Ее основными принципами являются такие правила:
- питание должно быть дробным и частым - 5-6 раз в день небольшими порциями;
- большая часть рациона - овощи и фрукты;
- рыба, мясо разрешены только нежирных сортов;
- все блюда запекаются, варятся, тушатся;
- категорически запрещено все острое, жирное, жареное, копчености, соленья, полуфабрикаты, фастфуд, газированные напитки.
От соблюдения рекомендаций врача в реабилитационный период и соблюдения пожизненных назначений зависит не только то, приживется ли новый орган, но и сколько проживет человек.
Возможные осложнения
Отторжение пересаженного органа - самое опасное осложнение. Врачи ждут трое суток, если за это время признаки отторжения не проявляются, значит, его вероятность уменьшается. В противном случае возникает вопрос об экстренной повторной пересадке, но найти донора за короткий срок бывает невозможно.
И также к возможным осложнениям относятся:
- внутренние кровотечения;
- разлитие желчи;
- перитонит;
- инфекционные осложнения;
- закрытие просвета вен печени;
- сосудистые патологии.
Одними из частых осложнений являются инфекционные: гнойные процессы в органах брюшной полости, грибковые и вирусные поражения, туберкулез, воспаление легких. Учитывая то, что после трансплантации органа организм ослаблен, требуется срочная противовоспалительная, антибактериальная терапия.
Сколько живут после пересадки печени
То, сколько живут после пересадки печени, зависит от многих факторов. В первую очередь, на продолжительность жизни влияет состояние больного перед операцией. Если человек был работоспособный, вовремя обнаружил и обратился в больницу с заболеваниями печени, прогноз благоприятный. И также важную роль играет послеоперационный период - соблюдение рекомендаций врача по питанию, образу жизни, приему препаратов.
Особенно опасно самопроизвольное резкое прекращение приема иммунносупрессоров, которые назначены пожизненно, печень страдает, состояние человека резко ухудшается.
Выживаемость на протяжении года составляет около 80%, на протяжении 5 лет - 60-70%. Некоторым с пересаженным органом удается поддерживать здоровье и жить 20-25 лет. К группе высокого риска, в которой часто не доживают до 5 лет относятся пациенты с гепатитом В, раком, люди старше 60 лет и те, у кого возникли осложнения.
Пересадка печени - сложная операция, на которую идут те, у кого это единственный шанс выжить. Показаниями к ее проведению являются цирроз и других тяжелые поражения органа. Чаще всего используется часть печени живых доноров, желательно родственников, что снижает риск отторжения. Чтобы прогноз был благоприятным, важно вовремя выполнить трансплантацию и соблюдать правила реабилитации.
Трансплантация печени у детей: показания, прогноз
Проф. д-р A. Vos и г-жа C.F. Kuijper, детские хирурги.
Корреспонденция: проф. д-р A. Vos, Pediatric Surgical Centre Amsterdam, location Academic Hospital Vrije Universiteit, P.O. Box 7057, 1007MB Amsterdam, Netherlands.
Среди всех первичных опухолей печени у детей 70% являются злокачественными. Наиболее часто встречаются гепатобластома и гепатоцеллюлярная карцинома. Доброкачественные опухоли редки; большинство из них сформировано гемангиомами или гемангиоэндотелиомами. Зачастую опухоль печени у маленького ребенка обнаруживается поздно, и при использовании картинообразующего исследования, как правило, выясняется, что полное оперативное удаление ее невозможно, потому что, например, поражены обе доли печени, опухоль слишком велика или мультифокальна или потому, что она вышла за пределы печени.
В связи с открытием чувствительности большинства злокачественных опухолей печени у детей к некоторым цитостатикам лечение их в последнее время сильно изменилось. Одновременно значительно возросли шансы на выживание. Все чаще применяется химиотерапевтическое лечение перед операцией.
Предоперативная система распределения по стадиям по "Societe d'Oncologie Pediatrique liver tumour study"
(SIOPEL I); I- три граничащих друг с другом сектора свободны; II- два граничащих друг с другом сектора свободны; III- свободны один сектор или два, не граничащих друг с другом; IV- свободных секторов нет.
Первые результаты законченного недавно "изучения опухолей печени Общества Педиатрической Онкологии" ("Societe d'Oncologie Pediatrique liver tumour study" - SIOPEL 1) подтверждают преимущества выбора этого метода. В связи с этим становится важной разработка новой системы градации для разделения опухолей по группам уже до операции и возможного сравнения эффективности различных цитостатиков.
Экспериментальное исследование показало недавно генетические аспекты, главным образом, для гепатобластомы.
Эпидемиология
Первичные эпителиальные опухоли печени у детей стоят на 3-м месте среди наиболее часто встречающихся новообразований брюшной полости (после нейробластомы и нефробластомы). Первичные опухоли печени составляют примерно 1 % от общего числа злокачественной патологии у детей. Гепатобластома встречается в 1,5 - 6,5 раза чаще гепатоцеллюлярной карциномы, но в областях, эндемичных по гепатиту В, часто наблюдается обратное.
Увеличение размера всего живота или наличие массы, прощупываемой в животе, чаще всего являются первыми проявлениями. У мальчиков опухоли встречаются в 2 раза чаще, чем у девочек. Сопровождающими симптомами зачастую являются анемия и уменьшение аппетита. Значительное снижение массы тела встречается нечасто. Гепатобластома наблюдается практически исключительно у очень маленьких детей, а гепатоцеллюлярная карцинома чаще наблюдается у детей более старшего возраста. Иногда первые симптомы вызываются интраабдоминальным кровотечением при разрыве опухоли, что при карциноме встречается чаще, чем при бластоме.
Лабораторное обследование Обычно имеется анемия. При гепатобластоме часто наблюдается тромбоцитоз. Также описана гиперхолестеролемия. У подавляющего большинства пациентов (70%) с гепатобластомой сильно повышено содержание альфа-фетопротеина в крови. Поэтому эта величина может быть использована для определения эффективности лечения.
Картинообразующее обследование
Определение стадий
Наиболее используемая система определения стадий при солитарных опухолях у детей базируется на операционных находках. Известная американская система разделяет опухоли на 4 стадии:
- I стадия: полная резекция;
- II стадия: микроскопически неполная резекция;
-III стадия: макроскопически неполная резекция;
- IV стадия: отдаленные метастазы.
Также часто применяется система опухоль - узел метастаз (TNM). В 1990 г. исследовательской группой SIOPEL 1 была разработана система, благодаря которой опухоли могут быть разделены на стадии до химиотерапевтического или хирургического лечения (см. рисунок). В этой системе, которая использует исключительно картинообразующее обследование, печень подразделяется на 4 сектора. Левая доля печени состоит из латерального (сегменты II и III) и медиального сектора (сегмент IV), а правая доля из переднего (сегменты V и VIII) и заднего сектора (сегменты VI и VII). Для определения не затронутых опухолью секторов может применяться разделение в одну из четырех групп. Внепеченочное распространение опухоли обозначается одной из четырех букв. Опыт с этой системой разделения, примененной у 115 пациентов с гепатобластомой, которым была проведена резекция части печени с имеющейся опухолью, показывает, что систему можно эффективно использовать.
Стратегии лечения
Резекция с последующей химио- и радиотерапией. В 1972 г. американская группа по изучению рака у детей (Childrens Cancer Study Group - CCSG) начала первое изучение опухолей печени у детей (CCG 831 ).
Пациенты, у которых опухоль могла быть полностью удалена, не получали дополнительного лечения. Если опухоль локализовалась в доле печени, применялось лечение дактиномицином (dactinomycine), винкристином и циклофосфамидом, плюс - радиотерапия. Дети с распространенной мультифокальной патологией получали только цитостатическое лечение.
Из 40 пациентов лишь 7 продолжительное время оставались живы и всем им было проведено или радикальное иссечение опухоли, или, при микроскопически определяемом остатке, последующее лечение радиотерапией. В исследовании CCG 881 были добавлены доксорубицин и 5-xFU. Это привело примерно к 44% излечению. Исследование позволило сделать 2 важных вывода: опухоли, которые изначально невозможно было подвергнуть резекции, стали операбельными благодаря применению химиотерапии, и комбинация доксорубицина и цисплатина дала хороший результат, в особенности у детей с гепатобластомой.
Нынешняя точка зрения CCSG состоит в том, что первичное лечение должно состоять из оперативного удаления опухоли. При неоперабельных опухолях назначается химиотерапия. После этого опухоль все-таки может стать операбельной или назначается радиотерапия. Ясно, что дети с гепатобластомой имеют лучший прогноз, чем дети с гепатоцеллюлярной карциномой.
Первичная диагностическая операция и резекция в "простых" случаях. В другом варианте - сначала химиотерапия, а затем операция "второго взгляда". Немецкое Общество Педиатрической Онкологии и Гематологии (German Society for Pediatric Oncologie and Hematologie) с января 1988 г. применяет следующую схему: первичная лапаротомия у всех детей с опухолью печени. Резекция опухоли выполняется лишь тогда, когда обычная лобэктомия может быть проведена достаточно широко вокруг опухоли. Опухоли, которые распространяются на обе доли печени, лишь биоптируются. Затем, если подтвержден злокачественный характер, следует химиотерапия. Вторая операция проводится после 2 или 3 курсов химиотерапии, уже с целью удалить всю опухолевую ткань, даже если это предполагает развернутую резекцию. Химиотерапия состоит из применения комбинации ифосфамида, цисплатина и доксорубицина. Если лечение опухоли было недостаточно эффективным, то цисплатин и доксорубицин применяются в высоких дозах путем постоянного вливания, аналогично тому, как это проводилось в исследовании CCG 832. Средствами второй фазы являются карбоплатин, этопозид, метотрексат (трексан) и эпирубицин (epirubicine).
С 1988 по 1993 г. в исследование были включены 94 ребенка, из которых 64 имели гепатобластому. У 30% пациентов опухоль могла быть полностью удалена при первом вмешательстве. У 6% из них остался микроскопически определяемый остаток. В 56% случаев не была выполнена первичная резекция, а в 8% случаев имелись метастазы. Из 36 пациентов, которые подверглись второй операции, у 30 была выполнена резекция. Ни один из пациентов, у которых не было полного удаления опухоли, не выздоровел после химиотерапии.
Шансы на излечение у пациентов с гепатобластомой равнялись 100% для 1 стадии, 75% для II стадии, 67% для III стадии и 0% для IV стадии. Имелись осложнения, но не было случаев смертности из-за операции.
Следующее исследование имеет новый протокол, в котором первичная лапаротомия не обязательна для детей от 6 мес до 3 лет с опухолью, которая растет в обеих долях печени и вызывает сильно повышенное содержание альфа-фетопротеина.
Предоперативная химиотерапия во всех случаях. Различные публикации о предоперативной химиотерапии при лечении гепатобластомы появились уже много лет назад.
Исследование SIOPEL 1 было организовано по этому принципу. После проведения биопсии опухоли пациенты получали лечение цисплатином (80 мг/м 2 в сутки) и доксорубицином (60 мг/м 2 (PLADO) в течение 2 сут) путем внутривенного вливания. Затем пациенты оценивались на возможность проведения резекции после 4 или 5 курсов химиотерапии.
Исследование осуществлялось в период с 1990 по 1994 г. Участвовал 91 центр из 30 различных стран.
Были включены 193 пациента, из которых 153 имели гепатобластому и 40 - гепатоцеллюлярную карциному. Первые результаты указывают на то, что для пациентов с гепатобластомой выживаемость составляет 76%. В этой группе рецидив встречается нечасто. Для гепатоцеллюлярной карциномы выживаемость составляет 40%. Пациенты с гепатоцеллюлярной карциномой имеют гораздо худший прогноз из-за более высокой смертности и гораздо большего риска рецидива.
Роль цитостатического лечения при этой опухоли ясна гораздо меньше. Для неоперабельных пациентов, которые хорошо реагируют на применение PLADO, необходимо принимать в расчет трансплантацию.
Альтернативные методы лечения. К. Yokomori и соавт. недавно сообщили о полном излечении нерезецируемой гепатобластомы после вливания через а. hepatica 5 FU, винкристина, доксорубицина и цисплатина. Также наблюдался успех химиоэмболизации после неудачного предшествовавшего лечения.
Гепатобластома
Исходно это эмбриональная опухоль, которая может встречаться также антенатально не только у человека, но и у других млекопитающихся. Роль окружающей среды как фактора риска возникновения этой опухоли неизвестна. Не имеется связи с инфекцией гепатита В.
По сравнению с нормальной популяцией гепатобластома чаще встречается у лиц с семейным полипозом толстого кишечника и синдромом Beckwith Wiedemann, что указывает на возможные изменения в 5 и 11 хромосомах. В одной из статей также сообщается факт о том, что 6 из 7 пациентов имели силь ную реакцию на цитокератин (cytokeratine).
Обычно различают 4 гистологических типа. Дифференциацию проводят на основе важнейшего эпителиального компонента: фетальный, эмбриональный, мелкоклеточный недифференцированный и макротрабекулярный анапластический. Хотя большое прогностическое значение имеют другие факторы, прогноз при лучшем дифференцированном (фетальном) типе более благоприятен, тогда как анапластический тип менее благоприятен и иногда дает более слабый ответ на химиотерапию. В 10-20% случаев метастазы имеются уже при постановке диагноза, но даже при их наличии эффективное лечение может привести к излечению значительный процент пациентов.
Гепатоцеллюлярная карцинома
Гепатоцеллюлярная карцинома в большинстве случаев связана с вирусной инфекцией гепатита В. Метастазы с момента наблюдения имеются уЗО - 50% пациентов. Билобарное поражение наблюдается в 5070% случаев. В связи с тем что полное хирургическое удаление опухоли является единственной возможностью излечения, прогноз значительно хуже, чем при гепатобластоме. Единственное исключение составляет фиброламеллярный тип, который исключительно подходит для оперативного лечения, хотя при этом типе опухоли химиотерапия не имеет абсолютно никакого успеха. Выживаемость при гепатоцеллюлярной карциноме в некоторых группах не выше 10 20%. Первые результаты исследования SIOPEL 1, похоже, также указывают и на то, что шанс на выживание приближается к 40%.
В последние годы результаты комбинированного химиотерапевтического и оперативного лечения первичных злокачественных опухолей печени у детей демонстрируют значительное улучшение. При гепатобластоме, наиболее часто встречающейся опухоли, процент излечения ныне приближается к 80%, однако мультифокальность, рецидив и возникновение нечувствительности к химиотерапии все еще формируют серьезные препятствия.
Лечение гепатоцеллюлярной карциномы продолжает оставаться дискуссионным и показывает более худшие результаты.
Читайте также:
