УЗИ, ЭхоКГ при атриовентрикулярном септальном дефекте сердца плода
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Московский областной НИИ акушерства и гинекологии (МОНИИАГ), Россия.
Гомельский областной медико-генетический центр с консультацией "Брак и семья", Гомель, Беларусь.

УЗИ аппарат HM70A
Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
- Семьи, имеющие ребенка с ВПС.
- Семьи с ВПС у одного или обоих супругов.
- Женщин, страдающих сахарным диабетом, системными заболеваниями соединительной ткани, гипотиреозом.
- Беременных с тератогенной экспозицией в ранние сроки беременности (герпес ранее 6-7-й недели) [2].
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): "Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга".
Главная цель пренатальной диагностики сформулирована специалистами пренатальной диагностики всего мира - это обеспечение женщины максимально возможной информацией о пороке как можно раньше. Мы должны дать право женщине и семье в целом решать вопрос о пролонгировании беременности с грубыми пороками развития у плода [4].
С каждым годом все большее количество публикаций посвящается диагностике ВПС в ранние сроки - в I триместре беременности 6. Практически ни один из выпусков журнала ISUOG (Ultrasound In Obstetrics and Gynecology, или "белого" журнала, как его называют специалисты) не обходит своим вниманием тему ранней диагностики врожденных пороков развития.
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат "перу" специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
При эхокардиографии изучались четырехкамерный срез сердца плода (рис. 1) и срез через три сосуда (рис. 2). УЗИ проводилось трансабдоминальным датчиком, лишь при необходимости (затрудненная визуализация) использовался внутриполостной датчик. Четырехкамерный срез сердца плода при ультразвуковом сканировании трансабдоминальным датчиком визуализировался в 85% случаев, срез через сосуды - в 73%, при использовании трансвагинального датчика эти цифры существенно возрастали до 100 и 91% соответственно. Оптимизация пренатальной диагностики ВПС может быть достигнута путем строгого соблюдения основных методических правил. При оценке четырехкамерного среза плода необходимо оценить нормальное расположение сердца плода, исключив его эктопию (рис. 3), положение оси сердца плода, что не представляет никаких трудностей, нормальные пропорции и размеры камер сердца, движение створок атриовентрикулярных клапанов должно быть свободным, септальная створка трикуспидального клапана должна располагаться ближе к верхушке сердца (рис. 4). При оценке среза через три сосуда необходимо оценить взаиморасположение сосудов и их диаметр.
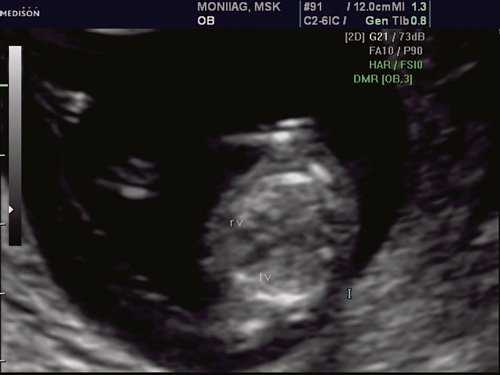
Рис. 1. Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.
Аномалия Эбштейна (эхографические, клинические и патоморфологические сопоставления)
Идеальный инструмент для пренатальных исследований. Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
Необычный порок сердца впервые был описан германским ученым Вильгельмом Эбштейном в 1866 г. у 19-летнего юноши с цианозом, одышкой, расширением югулярных вен. В 1927 г. назван как болезнь (аномалия) Эбштейна [1]. Аномалия Эбштейна - редкий врожденный порок сердца, характеризующийся смещением атриовентрикулярного кольца трехстворчатого клапана в сторону верхушки сердца. Часть полости правого желудочка атриализируется, так что собственно полость желудочка уменьшается. Неизбежно формируется сердечная недостаточность, степень которой и время манифестации полностью определяются величиной смещения правого атриовентрикулярного кольца. Редкость порока сказывается на его диагностике. Но вспомнить о заболевании - на 50% диагностировать его.
Распространенность аномалии Эбштейна низкая. Более чем за 40 лет работы патологоанатомического отделения областной больницы данный порок был диагностирован всего в 2 случаях (на более чем 6000 секционных исследований): у одного взрослого и одного ребенка [2, 3]. За 40-летний период (1979-2019 гг.) работы в кабинетах ультразвуковой диагностики многопрофильных детских больниц аномалия Эбштейна выявлена нами в 2 случаях.
Манифестация порока сердца у всех наблюдавшихся нами детей развивалась рано, в первые 3 мес жизни. Взрослый пациент был занят тяжелым физическим трудом (каменщик). Манифестная сердечная недостаточность развилась у него в возрасте 62 лет. Клиническая симптоматика во всех случаях сводилась к тахикардии, расширению границ сердца, одышке, застойным явлениям в легких и увеличению размеров печени. Аускультативно определялся грубый систолический шум на основании сердца и на сосудах.
Рентгенологически обращали на себя внимание кардиомегалия, легочная олигемия, расширение правого предсердия и расширение правого силуэта сердца. При отсутствии цианоза сосудистый рисунок легких не изменялся.
Определяющим для диагноза является ультразвуковое исследование. Для аномалии Эбштейна типичной находкой было апикальное смещение септальной и/или задней створок трехстворчатого клапана. В норме кольца атриовентрикулярных клапанов располагаются на одном уровне. При аномалии Эбштейна степень смещения правого атриовентрикулярного кольца прямо коррелирует с тяжестью порока. Атипично большая передняя створка пролабировала, обусловливая струю регургитации (рис. 1).
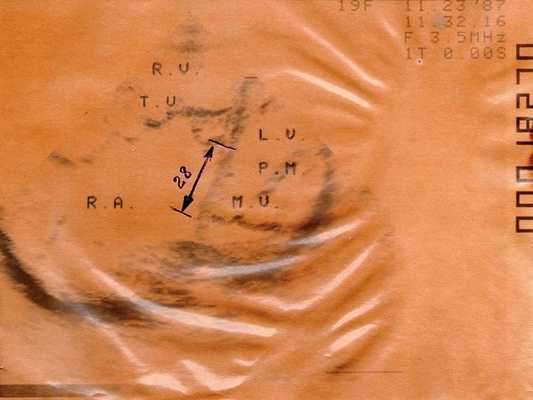
Хорошо видны резко увеличенное правое предсердие, уменьшенный правый желудочек. Смещение правого атриовентрикулярного кольца относительно левого.
RV - правый желудочек, TV - трехстворчатый клапан, RA - правое предсердие, LV - левый желудочек, PM - сосочковая мышца, MV - митральный клапан.
На ЭКГ регистрировались высокая острая волна Р (расширение правого предсердия), удлинение интервала PR, отклонение электрической оси сердца вправо и блокада правой ножки пучка Гиса.
При анатомо-гистологических исследованиях (2 наблюдения) сердце было резко увеличено в размерах. Фиброзное правое атриовентрикулярное кольцо резко смещено к верхушке сердца. Правое предсердие представляло собой большую тонкостенную полость. Внутренняя поверхность правого предсердия лишена трабекулярных мышц, гладкая. Папиллярные мышцы смещены к верхушке, тонкие. Овальное окно открыто. У взрослого смещение правого атровентрикуярного кольца относительно левого было меньше. За счет длительного существования порока стенки правого желудочка были утолщены до 1,5 см, в области верхушки - до 3,5 см. Гипертрофия межжелудочковой перегородки. Эндокард правого желудочка утолщен, белого цвета. Фиброзные тяжи от эндокарда проникают на всю толщу стенки правого желудочка. Между гипертрофированными мышечными пучками стенки правого желудочка широкие прослойки зрелой соединительной ткани. Среди коллагеновых волокон располагаются фибробласты.
Аномалия Эбштейна - редкий врожденный порок сердца, встречающийся с частотой приблизительно 1 : 200 000 живорожденных, составляя значительно менее 1% от всех врожденных пороков сердца. Причины аномалии Эбштейна гетерогенные. По результатам семейных и близнецовых исследований в качестве возможных причинных факторов указывают на генетические, репродуктивные и средовые факторы (бензодиазепены и литиевые препараты у матерей). Подавляющее большинство случаев данной аномалии - спорадические, семейные случаи встречаются нечасто. У родственников в редких случаях обнаруживают мутации кар диального фактора транскрипции NKX2.5, делеции 10p13-p14 и 1p34.3-p36.11 [4, 5].
Морфогенез аномалии Эбштейна заключается в незавершенном отслоении септальной и задней створок трикуспидального клапана в процессе развития от миокарда, что приводит к кольцевому смещению и атриализации правого желудочка. Это влечет за собой перегрузку остающейся части правого желудочка и его дисфункцию. Передняя створка трехстворчатого клапана часто избыточна и обычно описывается как «подобная парусу». Несбалансированная деформация приводит к вращательному смещению трикуспидального клапана в выносной тракт правого желудочка, вызывая обструкцию различной степени.Тяжесть заболевания варьирует и зависит от степени смещения клапана, степени атриализации правого желудочка, обструкции выносного тракта и желудочковой дисфункции.
Клиническая картина неспецифична. Степень сердечной недостаточности и ее выраженность варьируют в зависимости от выраженности атриализации правого желудочка. У некоторых пациентов порок, как в одном из наших наблюдений, может манифестировать в зрелом возрасте. По зарубежным данным, возраст пациентов колеблется от 1 дня до преклонного. Чем раньше развивается симптоматика, тем тяжелее порок. Новорожденные с аномалией Эбштейна при наличии кардиомегалии, сердечной недостаточности, повышении давления в легочной артерии, цианоза и ацидоза должны быть немедленно направлены в специализированное кардиохирургическое отделение [5, 6].
В зависимости от анатомических нарушений клапанного аппарата выделяют следующие варианты (по мере ухудшения прогноза):
- Объем сохранившейся части правого желудочка достаточен для полноценной гемодинамики.
- Атриализированная часть правого желудочка велика, но передняя створка трикуспидального клапана движется свободно.
- Передняя створка существенно ограничена в движении и создает обструкцию выносного тракта.
- Практически полная атриализация правого желудочка [4, 7].
Заключение
Эхокардиография - неинвазивный метод выбора в диагностике аномалии Эбштейна. Ультразвуковое исследование позволяет выявить степень смещения створок, функцию желудочков сердца, наличие дополнительных пороков. Выявление морфологических деталей аномалии Эбштейна - главное условие определения тактики ведения пациента. Эхокардиография позволяет поставить диагноз порока сердца уже внутриутробно.
Литература
- Balaguru D. Pediatric Ebstein Anomaly. Updated: Aug 14, 2018.
- Делягин В.М. Врожденные пороки сердца у детей Актюбинской области по секционным данным за 22 года // Педиатрия. 1977; 9: 87.
- Делягин В.М. Врожденные пороки сердца у близнецов // Врачебное дело. 1978; 12: 42-44.
- Attenhofer Ch., Connolly H., Dearani J., Edwards W. et al. Ebstein's Anomaly. Circulation. 2007; 115: 277-285.
- Cherry C., DeBord S., Moustapha-Nadler N. Ebstein's Anomaly: A Complex Congenital Heart Defect. AORN J. The official voice of perioperative nursing. 2009; 89 (6): 1098-1114.
- Nihoyannopoulos P., McKenna W., Smith G., Foale R. Echocardiographic Assessment of the Right Ventricle in Ebstein's Anomaly: Relation to Clinical Outcome. JACC 1986; 8 (3): 627-635.
- Munoz-Castellanos L., Espinola-Zavaleta N., Kuri-Nivon M., Candace Keirns C. Ebstein's Anomaly: Anatomoechocardiographic correlation. Bio Med Central. Cardiovascular Ultrasound; 2007; 5: 43. doi: 10.1186/1476-7120-5-43.
УЗИ сканер WS80
Закономерности изменений показателей ультразвукового исследования при врожденных пороках сердца у плода в зависимости от особенностей внутрисердечной гемодинамики антенатального периода
ФГУ Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова Минздравсоцразвития России,
Москва.
УЗИ сканер RS80
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Врожденные пороки сердца редко влияют на развитие плода. Впервые это было отмечено в исследованиях B. Mac Mahon и соавт. [1]. Однако есть пороки, не совместимые с жизнью, и после рождения ребенок тотчас погибает. Некоторые врожденные пороки сердца, даже несложные формы, в раннем неонатальном периоде протекают злокачественно, обусловливая развитие декомпенсации кровообращения и дыхательную недостаточность. Главной причиной этого является несовершенство компенсаторных механизмов.
Диагностика врожденных пороков сердца у плода - одна из труднейших задач перинатологии. Многие врожденные пороки сердца, даже сложные, практически не совместимые с жизнью, антенатально не проявляются в силу особенностей внутрисердечной гемодинамики и после рождения становятся катастрофой для жизни ребенка.
Антенатальный период характеризуется особенностями кровообращения, такими как высокое давление в правом желудочке, незначительный объем кровотока в легочной артерии, параллельность работы желудочков сердца, функционирующие артериальный проток и овальное окно, нагнетающие кровь как обходные анастомозы в большой круг кровообращения за счет усиленной работы правого желудочка. Эти особенности внутрисердечной гемодинамики плода, безусловно, должны корректировать характер гемодинамических изменений ультразвуковых показателей сердца в норме и при пороках сердца у плода.
Известно, что у пациентов с врожденными пороками сердца нарушения гемодинамики в результате анатомических изменений в значительной степени влияют на данные ультразвукового сканирования сердца, такие как размеры полостей сердца, степень гипертрофии миокарда, функция клапанного аппарата, сократительная способность миокарда, направленность движения межжелудочковой перегородки.
Метод оценки внутрисердечной гемодинамики базируется на широко известных понятиях о систолической, объемной и смешанной перегрузках сердца, предложенных в 1952 г. E. Cabrera и J. Monroy [2].
В основе разделения использован следующий принцип.
Нагрузка сопротивлением возникает при ситуации, когда выброс крови из желудочков сердца в магистральные сосуды затруднен на уровне полулунных клапанов (стеноз аорты и легочной артерии), подклапанного пространства (идиопатический гипертрофический субаортальный стеноз, подклапанный стеноз аорты или легочной артерии), на протяжении сосудистого русла (коарктация аорты) либо при значительном увеличении выходного сопротивления (синдром Эйзенменгера). В результате затруднения выброса крови резко возрастает напряжение миокарда соответствующего желудочка при относительно стабильном объеме крови, что служит проявлением систолической перегрузки сердца. При систолической перегрузке желудочков сердца независимо от нозологической формы порока полость желудочка, несущего основную нагрузку сопротивлением, умеренно увеличивается в размерах. В ответ на нагрузку сопротивлением на эхокардиограмме выявляется гипертрофия миокарда соответствующего желудочка, и чем больше сопротивление выбросу, тем резче выражена степень гипертрофии миокарда соответствующего желудочка и межжелудочковой перегородки (рис. 1) [3].
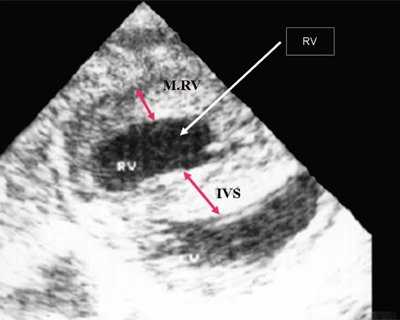
Рис. 1. Систолическая перегрузка правого желудочка. Поперечное сечение желудочков сердца при стенозе легочной артерии. Градиент давления правый желудочек - легочная артерия равен 200 мм рт.ст. Выраженная гипертрофия межжелудочковой перегородки и миокарда передней стенки правого желудочка.
Нагрузка объемом возникает при дополнительном притоке крови в желудочки и в результате шунтирования крови через септальные перегородки или артериальный проток (дефекты межпредсердной и межжелудочковой перегородок, открытый артериальный проток), а также в результате обратного тока крови через атриовентрикулярные клапаны (клапанная недостаточность).
Характерными особенностями выраженной объемной перегрузки правого желудочка являются дилатация желудочка, при которой толщина миокарда не превышает верхней границы нормы, увеличение правого предсердия, парадоксальный характер движения межжелудочковой перегородки и увеличение амплитуды движения трикуспидального клапана (рис. 2, 3).
Рис. 2. Длинная ось сердца. Объемная перегрузка правого желудочка при дефекте межпредсердной перегородки. Объем сброса крови превышает 200% МОС. Отмечается выраженная дилатация правого желудочка.
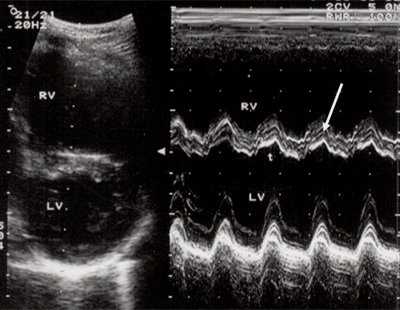
Рис. 3. Объемная перегрузка правого желудочка при дефекте межпредсердной перегородки. В- и М-сканирование. Стрелкой показан парадоксальный характер движения межжелудочковой перегородки.
Для левого желудочка признаком объемной перегрузки являются увеличение полости левого предсердия и желудочка, а также экскурсии межжелудочковой перегородки и миокарда задней стенки левого желудочка (рис. 4).
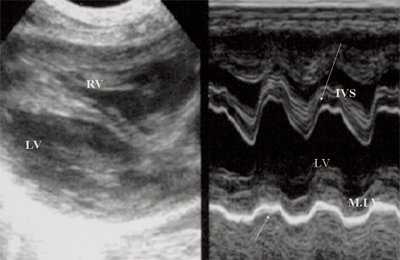
Рис. 4. Объемная перегрузка левых отделов сердца. В- и М-сканирование. Отмечается усиление экскурсии межжелудочковой перегородки и миокарда задней стенки левого желудочка.
IVS - межжелудочковая перегородка, MLV - миокард левого желудочка, LV и RV - левый и правый желудочек.
При сочетании нагрузки сопротивлением и объемом возникает смешанная перегрузка (например, при дефекте межжелудочковой перегородки и повышении давления в легочной артерии для правого желудочка систолическая перегрузка сочетается с нагрузкой объемом, для левого желудочка в результате артериальновенозного сброса крови через дефект).
За многолетний период (с 1980 г. по настоящее время) наблюдений в ФГУ Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова Минздравсоцразвития России было замечено, что в антенатальном периоде не всегда работают принципы гемодинамических эхокардиографических проявлений врожденного порока сердца, которые ранее были разработаны и представлены в современной литературе 4.
Анализ более 2000 наблюдений врожденных пороков сердца у плода показал, что в ряде наблюдений имеются лишь анатомические изменения, характерные для определенной нозологической формы порока. При других врожденных пороках сердца изменения на эхокардиограмме связаны с характером гемодинамической нагрузки на сердце и аналогичны тому, что наблюдается после рождения. Наконец, в ряде наблюдений врожденных пороков сердца у плода вторичные изменения на эхокардиограмме, вызванные гемодинамическими нарушениями, отличаются от гемодинамических проявлений ультразвуковых показателей у детей и взрослых. Это позволило разделить все врожденные пороки сердца плода на три группы в зависимости от изменений на эхокардиограмме, обусловленных особенностями антенатальной внутрисердечной гемодинамики.
В первую группу вошли пороки сердца, которые, имея отчетливые анатомические проявления патологии, при ультразвуковом исследовании не имеют гемодинамических проявлений врожденного порока сердца. К ним относятся: дефект межпредсердной перегородки, дефект межжелудочковой перегородки, общий желудочек, простая форма транспозиции магистральных сосудов и также при наличии дефекта межжелудочковой перегородки общий артериальный ствол, двойное отхождение сосудов от желудочков сердца.
- дилатации правого желудочка (см. рис. 2, 3);
- увеличению правого предсердия;
- парадоксальному характеру движения межжелудочковой перегородки (см. рис. 2, 3).
Антенатально при равных величинах давления в желудочках сердца и в предсердиях объемной перегрузки не возникает. В связи с этим ни один из эхокардиографических гемодинамических признаков, используемых у детей и взрослых, не выявляется у плода. К эхокардиографическим проявлениям порока антенатально относится только прямой признак - перерыв ультразвукового луча в области дефекта. Размеры сердца, соотношение размеров желудочков сердца не отличаются от нормы (рис. 5).
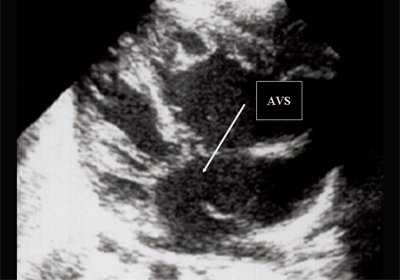
Рис. 5. Четырехкамерное сечение сердца плода. Стрелкой указан первичный дефект межпредсердной перегородки (АVS).
В равной степени это относится к дефекту межжелудочковой перегородки (рис. 6), простой форме транспозиции магистральных сосудов (рис. 7, 8), транспозиции магистральных сосудов с дефектом межжелудочковой перегородки (синдром Тауссиг - Бинга) (рис. 9), общему желудочку (рис. 10), общему артериальному стволу (рис. 10), двойному отхождению сосудов от одного из желудочков сердца (рис. 11).
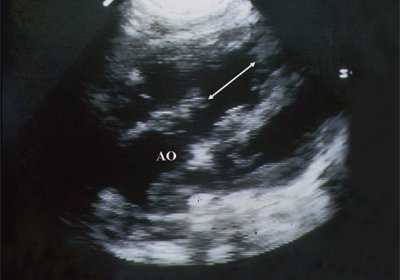
Рис. 6. Дефект межжелудочковой перегородки. Длинная ось сердца. Стрелками показан дефект межжелудочковой перегородки.
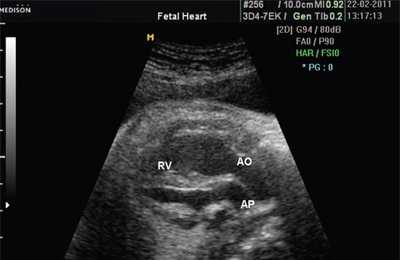
Рис. 7. Транспозиция магистральных сосудов.
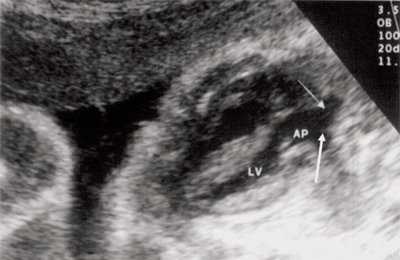
Рис. 8. Транспозиция магистральных сосудов, стрелками показаны ветви легочной артерии.
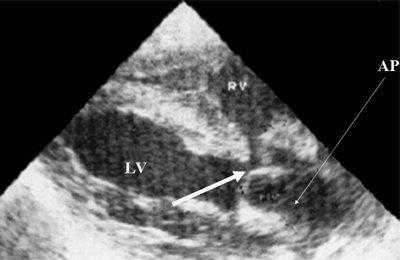
Рис. 9. Синдром Тауссиг - Бинга. Легочная артерия (отмечена стрелкой) расположена над дефектом межжелудочковой перегородки.
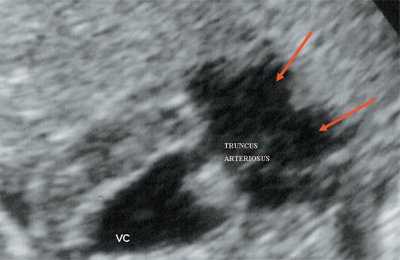
Рис. 10. Общий желудочек с отхождением TRUNCUS ARTERIOSUS. Стрелками показано разделение TRUNCUS ARTERIOSUS на аорту и ствол легочной артерии.
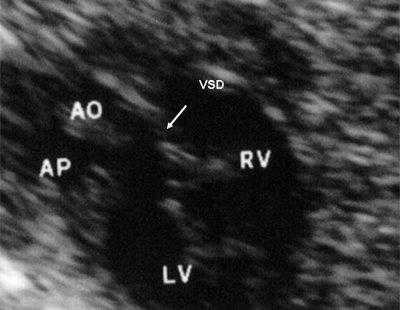
Рис. 11. Двойное отхождение магистральных сосудов от левого желудочка. Длинная ось сердца. Магистральные сосуды инвертированы и отходят от левого желудочка. Аорта расположена "верхом" над дефектом межжелудочковой перегородки (стрелка).
LV и RV - левый и правый желудочек, АР - легочная артерия, АО - аорта, VSD - дефект межжелудочковой перегородки.
Таким образом, диагностика перечисленных выше врожденных пороков сердца основывается на знании анатомических изменений, характерных для определенной нозологической формы патологии.
Вторая группа врожденных пороков сердца. При ультразвуковом исследовании регистрируются анатомические и гемодинамические изменения, характерные для определенной нозологической формы порока. В эту группу были отнесены: стеноз аорты, стеноз легочной артерии, врожденный митральный стеноз, транспозиция магистральных сосудов с сужением легочной артерии, обструкция опухолью выходного тракта одного из желудочков, аномалия Эбштейна, синдром гипоплазии правого и левого желудочков сердца, фиброэластоз, преждевременное закрытие овального окна.
Как пример можно разобрать изменения эхокардиографических показателей при клапанном стенозе легочной артерии. Нарушение гемодинамики при изолированном стенозе легочной артерии обусловлено препятствием на пути выброса крови в легочную артерию. Тяжесть стеноза определяется разницей систолического давления в правом желудочке и легочной артерии, т.е. градиентом давления.
При двухмерной эхокардиографии выявляется утолщение створок клапана легочной артерии, экскурсия их уменьшена, а в систолу они образуют купол. Это анатомические проявления порока. К ним добавляются гемодинамические проявления: выраженная гипертрофия миокарда передней стенки правого желудочка и межжелудочковой перегородки, значительно превышающие нормативы. Степень выраженности гипертрофии миокарда правого желудочка зависит от степени стенозирования легочной артерии и соответственно от величины градиента давления. Эти данные получены при сопоставлении результатов ультразвукового сканирования и данных катетеризации полостей сердца у детей [6]. Следует особо отметить, что при выраженной гипертрофии миокарда полость правого желудочка увеличивается незначительно. Отмечается также увеличение размера правого предсердия.
У плода получены аналогичные изменения, зависящие также от степени стенозирования легочной артерии. Полость правого желудочка, как видно на рис. 12, не увеличена. В то же время имеется значительная гипертрофия стенок правого желудочка. Как и в постнатальном периоде отмечено увеличение полости правого предсердия (рис. 13). После рождения при катетеризации полостей сердца в данном наблюдении был выявлен градиент давления на выходе из правого желудочка, равный 200 мм рт.ст.
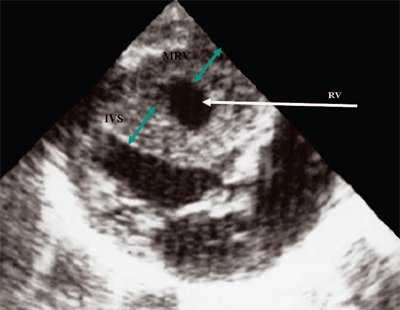
Рис. 12. Стеноз легочной артерии. Гипертрофия миокарда правого желудочка.
Открытый атриовентрикулярный канал
Открытый атриовентрикулярный канал - сложная внутрисердечная аномалия, включающая дефекты межжелудочковой и межпредсердной перегородок и дефекты обоих атриовентрикулярных клапанов. Открытый атриовентрикулярный канал приводит к отставанию в физическом развитии, появлению одышки, тахикардии, утомляемости, цианоза, частой заболеваемости респираторным инфекциями. Инструментальная диагностика открытого атриовентрикулярного канала включает проведение ЭКГ, ЭхоКГ, рентгенографии органов грудной клетки, катетеризации полостей сердца, атриографии, вентрикулографии. При открытом атриовентрикулярном канале показана хирургическая коррекция - пластика ДМПП, ДМЖП, митрального и трикуспидального клапанов.
Общие сведения
Открытый атриовентрикулярный канал - сочетанный врожденный порок сердца, характеризующийся недоразвитием внутрисердечных перегородок и аномалиями предсердно-желудочковых клапанов. Частота выявления открытого атриовентрикулярного канала в кардиологии составляет 2-6% от всего числа врожденных пороков сердца. Открытый атриовентрикулярный канал обычно обнаруживается в возрасте до 1 года.
В 25-30% случаев открытый атриовентрикулярный канал встречается при синдроме Дауна. У 13-18% пациентов, кроме открытого атриовентрикулярного канала, выявляются другие сердечные аномалии: стеноз или атрезия легочной артерии, тетрада Фалло, коарктация аорты и пр.
Причины открытого атриовентрикулярного канала
В основе формирования открытого атриовентрикулярного канала лежат эмбриологические нарушения. Факторами, способными вызвать недоразвитие перегородок и клапанов сердца, могут являться наследственная история по врожденным порокам, хромосомные нарушения, токсикозы беременности, вирусные инфекции беременной (краснуха, герпес, ветрянка, грипп), эндокринные нарушения у матери (сахарный диабет), употребление алкоголя или лекарственных препаратов с тератогенным действием.
Структуру дефекта при открытом атриовентрикулярном канале составляют следующие компоненты: дефекты предсердной и желудочковой перегородок, нарушение строения клапанов (митрального и трикуспидального).
Классификация открытого атриовентрикулярного канала
Различают неполную (частичную), полную и промежуточные формы открытого атриовентрикулярного канала. На частичный открытый атриовентрикулярный канал приходится 70% случаев порока, на полную и промежуточные формы - 30%.
Особенности гемодинамики при открытом атриовентрикулярном канале
Нарушения внутрисердечной гемодинамики при открытом атриовентрикулярном канале зависят от анатомической формы порока. Наличие частично открытого атриовентрикулярного канала обусловливает лево-правое шунтирование крови; легочная гипертензия незначительна, митральная недостаточность выражена умеренно.
При общем открытом атриовентрикулярном канале имеется лево-правый сброс и небольшой шунт крови справа налево. Митральная и трикуспидальная недостаточность приводит к систолической регургитации крови из желудочков в предсердия. В этом случае рано развиваются легочная гипертензия и синдром Эйзенменгера. Промежуточные формы открытого атриовентрикулярного канала сопровождаются поступлением крови из левого желудочка непосредственно в правое предсердие, перегрузкой правого желудочка, расширением ствола легочной артерии.
Симптомы открытого атриовентрикулярного канала
Клинические проявления открытого атриовентрикулярного канала развиваются на первом году жизни, в дальнейшем состояние больных прогрессирующе ухудшается. Отмечается отставание ребенка в физическом развитии, быстрая утомляемость при кормлении, снижение аппетита, бледность кожи и слизистых. При полной форме открытого атриовентрикулярного канала вследствие артериальной гипоксемии выражен цианоз кожных покровов в области носогубного треугольника, ладоней и стоп.
О наличии сердечной недостаточности позволяют думать тахипноэ, тахикардия, застойные хрипы в легких, увеличение печени. Дети с открытым атриовентрикулярным каналом склонны к частому возникновению простудных заболеваний, бронхитов, пневмоний. К 4-7 годам у детей развивается асимметричная деформация грудной клетки - сердечный горб. Большинство детей с полной формой открытого атриовентрикулярного канала погибает к исходу 1-го года жизни.
Диагностика открытого атриовентрикулярного канала
Открытый атриовентрикулярный канал обычно диагностируется в первые дни или месяцы жизни ребенка. При физикальном обследовании определяются увеличенные границы сердца, усиление верхушечного толчка, систолическое дрожание над верхушкой. Характерным аускультативным признаком служит выслушивание двух различных по локализации и тембру шумов - систолического шума недостаточности митрального клапана на верхушке и систолического шума ДМПП во II-III межреберье, а также расщепление II тона над легочной артерией.
Для подтверждения диагноза открытого атриовентрикулярного канала проводятся ЭКГ, фонокардиография, УЗИ сердца, зондирование полостей сердца, рентгенографическое исследование органов грудной клетки, атрио- и вентрикулография.
На электрокардиограмме регистрируется отклонение ЭОС влево, гипертрофия левого предсердия, гипертрофия желудочков, блокада правой ножки пучка Гиса или атриовентрикулярная блокада. Рентгенография выявляет кардиомегалию за счет увеличения обоих желудочков и правого предсердия, усиление легочного рисунка, умеренное выбухание дуги легочной артерии, признаки митральной недостаточности.
Прямые указания на открытый атриовентрикулярный канал дает эхокардиография: при сканировании виден ДМЖП, ДМПП, расщепление и аномалии прикрепления створки митрального клапана, регургитация крови в области клапанов. Полученные данные подтверждаются при катетеризации полостей сердца и вентрикулографии.
Комплексное обследование позволяет дифференцировать открытый атриовентрикулярный канал от изолированного дефекта межпредсердной перегородки, дефекта межжелудочковой перегородки, единого желудочка сердца, транспозиции магистральных сосудов, а также исключить сопутствующие пороки - тетраду Фалло, открытый артериальный проток, стеноз легочной артерии, что чрезвычайно важно для правильного планирования лечения.
Лечение открытого атриовентрикулярного канала
Медикаментозная терапия при открытом атриовентрикулярном канале направлена на профилактику инфекционного эндокардита и купирование сердечной недостаточности. Радикальное устранение порока может быть проведено только хирургически. Раннее оперативное лечение показано при полной форме открытого атриовентрикулярного канала; при частичной и промежуточных формах корригирующая операция проводится в 6-10 лет.
Коррекция неполной формы атриовентрикулярного канала предусматривает восстановление передней створки митрального клапана, закрытие дефекта межпредсердной перегородки, при необходимости - пластику трикуспидального клапана.
Коррекция полного открытого атриовентрикулярного канала включает одномоментную пластику ДМПП, ДМЖП, митрального и трехстворчатого клапанов. У детей раннего возраста иногда предварительно выполняется паллиативная операция по сужению легочного ствола. При промежуточных вариантах открытого атриовентрикулярного канала проводится пластика ДМЖП и аннулопластика трикуспидального клапана. Операции производятся в условиях искусственного кровообращения.
Прогноз при открытом атриовентрикулярном канале
Течение полной формы открытого атриовентрикулярного канала неблагоприятно: без своевременной коррекции порока 95% пациентов погибают в течение первых 5 лет жизни. При частичной форме открытого атриовентрикулярного канала средняя продолжительность жизни больных без операции - 15-20 лет. Промежуточные формы протекают относительно благоприятно, однако также нуждаются в хирургической коррекции. Послеоперационные результаты открытого атриовентрикулярного канала удовлетворительные.
Несвоевременное обращение к кардиологу или кардиохирургу увеличивает риск сердечных осложнений - тяжелой сердечной недостаточности, аритмии, бактериального эндокардита и высокой легочной гипертензии, делающей оперативное лечение невозможным.
Патологии сердца плода, которые можно определить на скрининговом УЗИ
Основные пороки сердца у плода формируются в 1 триместре беременности на сроке 12-14 недель. Это может быть реакция на внешние факторы либо генетические проблемы. К этому сроку происходит формирование сердечной мышцы плода, поэтому будущей матери необходимо пройти УЗИ обследование на выявление патологий органа.

Во внутриутробном развитии пороки сердца возникают как реакция организма на нарушение плацентарного кровообращения либо воздействие канцерогенных веществ (формальдегиды, никотин, токсические вещества).
Аномалии положения сердца плода
Среди аномалий расположения сердца выделяют эктопию сердца (размещение вне грудной клетки). К таким патологиям относят декстрокардию (смещение сердца в правую сторону относительно нормального положения) и мезокардию (расположение сердца не с левой стороны грудины, а по срединной линии тела).
Эктопия сердца у плода возникает на сроке 14-18 дней с момента зачатия мезадерма начинает развиваться неправильно, что вызывает неправильное срастание брюшной стенки. У плода либо отсутствует диафрагма вообще, либо нет диафрагмального сегмента перикарда.
Из-за отверстия в стенке между правым и левым желудочком слышны интракардиальные шумы. Также у плода эктопия сердца нередко сопровождается другими аномалиями — гидроцефалией, энцефалоцеле и пр.
Надо сказать, что существует высокая вероятность ошибочного диагноза по установки положения сердца. При тазовом предлежании плода на УЗИ сердца визуализируется справа, хотя на самом деле оно располагается в положенном месте.
В 71% случаев эктопия сердца вызывается плевральным выпотом, кистозным аденоматозным пороком развития лёгкого, диафрагмальной грыжей.
Различают четыре вида эктопии:
- абдоминальная (сердце находится в брюшине);
- грудная (сердце выходит наружу через дефекты грудины);
- торакоабдоминальная (пентада Кантрелла — сложнейшая патология, имеющая комплекс отклонений от нормы);
- шейная (сердце смещается в область сердца).
Грудная эктопия встречается в 55-60% случаев, торакоабдоминальная — в 38%, шейная — почти в 3%. Выживаемость составляет около 10%. В большинстве случаев при эктопии младенец либо рождается мёртвым, либо умирает сразу после рождения.
Патология сопровождается смещением других внутренних органов, которые не защищены от механических повреждений и подвержены инфекциям и вирусам больше обычного.
Врождённые дефекты сердца
Пять наиболее встречаемых дефектов — это тетрада Фалло, дефект межжелудочковой перегородки, транспозиция магистральных сосудов, коарктация аорты, гипоплазия левых камер.
Оптимальным сроком для проведения ультразвуковой диагностики сердца плода считается период 24-26 недель беременности. Именно в это время анатомические структуры сердца максимально визуализируются, а на более ранних сроках можно увидеть только явные и глобальные пороки сердца.
Наиболее информативен ультразвуковой осмотр 4-камерного среза сердца. После которого при любом отклонении от нормы женщина отправляется на более детальное обследование плода с использованием допплеровской эхокардиографии. Также проводится кариотипирование, потому что в 30% случаев аномалии являются результатом хромосомных нарушений.
Что выявляет УЗИ
В нашей клинике используется современное 4D оборудование, имеющее допплеровский режим. С его помощью можно получить изображение 3-х главных сосудов — верхней полой вены, лёгочного ствола и восходящей аорты. Во время обследования выявляется не только расположение сосудов, но и их диаметр и другие параметры.
На экране монитора будут видны следующие патологии плода:
- Уменьшение диаметра аорты при расширении лёгочного ствола можно говорить об гипоплазии (недоразвитости) левых отделов сердца малыша, отвечающих за начало кровообращения;
- Уменьшение ствола лёгочной артерии в размерах при сохранении в норме диаметров аорты и верхней полой вены указывает на стеноз (сужение) лёгочной артерии. У плода выявляются только выраженные формы;
- Маленький диаметр аорты при нормальном 4-камерном строении сердца является следствием коарктации аорты (сужение аорты сердца в определённом сегменте);
- Визуализация 2 сосудов вместо 3 может быть следствием соединения сосудов в общий артериальный ствол;
- Смещение аорты вперёд или правее лёгочной артерии наблюдается при транспозиции магистральных сосудов;
- Диаметр аорты расширен, но при этом сужен диаметр лёгочной артерии, а аорта смещена вперёд. Это может является тетрадой Фалло (очень тяжёлая сочетанная аномалия сердца). Проблема включает в себя стеноз или гипертрофию выходного отдела правого желудочка, дефект межжелудочковой перегородки, декстропозицию аорты (отхождение в правую сторону). Диагностика плода крайне затруднительна, поэтому на помощь приходит допплеровский режим, помогающий визуализировать поток крови в аорту из обоих желудочков;
- Гипоплазия (недоразвитость) правых камер сердца определяется по уменьшению их размеров относительно левых камер. Эта патология сопровождается обычно дисплазией (провисанием или выбуханием) митрального клапана;
- Общий предсердно-желудочковый канал виден как дефект перегородки сердца с расщеплением атриовентрикулярного клапана;
- Гипопластический синдром левых отделов сердца проявляется в виде недоразвития желудочка и митрального и аортального клапанов;
- Единственный желудочек также не является нормой, потому что их должно быть два и они хорошо просматриваются в четырёхкамерном срезе;
- При недоразвитости трёхстворчатого клапана кровь из правого предсердия не попадает в левое, что хорошо видно при допплеровском исследовании;
- Со 2 триместра фиброэластоз эндокарда визуализируется как утолщение миокарда и ухудшении его сокращения;
- Недоразвитие миокарда одного из желудочков (аномалия Уля) заметна на 2 триместре.
Какие патологии сердца у плода сложно выявить на скрининговом УЗИ
Трудности в диагностике заболеваний сердца на УЗИ вызывают следующие патологии органа:
- дефект межпредсердной перегородки;
- дефект межжелудочковой перегородки;
- транспозиция главных артерий.
При подозрении на их наличие, пациентка должна регулярно наблюдаться и соблюдать все рекомендации гинеколога.
Читайте также:
