УЗИ при анемии у плода
Добавил пользователь Alex Обновлено: 28.01.2026
Анемия при беременности — это уменьшение уровня гемоглобина, возникшее в период гестации и связанное с ней патогенетически. Проявляется слабостью, быстрой утомляемостью, головокружениями, извращением вкуса и обонятельных предпочтений, кардиальными болями, мышечной слабостью, парестезиями, поражением слизистых, изменением кожи, ногтей, волос. Диагностируется с помощью общеклинического анализа крови и лабораторного исследования метаболизма железа. Для лечения применяют железосодержащие препараты, фолиевую кислоту, цианокобаламин, по показаниям проводят комплексную противогипоксическую терапию.
МКБ-10
Общие сведения
Существование физиологических предпосылок для возникновения гестационной анемии (гидремии) делает это заболевание одним из наиболее распространенных видов патологии при беременности. Манифестные формы болезни с клинически выраженной симптоматикой в экономически развитых государствах встречаются у 16-21% пациенток, в развивающихся странах их распространенность достигает 80%. При этом скрытый (латентный) дефицит железа с учетом полноценности рациона к концу беременности наблюдается у 50-100% женщин. Преобладающая форма анемии гестационного периода — железодефицитная, диагностируемая в 75-95% случаев. Актуальность своевременного выявления патологии связана с высокой вероятностью осложненного течения беременности и возникновения гипоксических состояний на фоне физиологического повышения потребности в кислороде на 15-33%.
Причины анемии при беременности
Недостаточное содержание гемоглобина и эритроцитов в крови беременной женщины обусловлено как факторами, непосредственно связанными с гестацией, так и предшествующими заболеваниями. По наблюдениям специалистов в сфере акушерства, у большинства пациенток гестационная гидремия имеет такие легко объяснимые физиологические причины, как:
- Повышенная потребность в железе. Начиная со II триместра беременности, для адекватного обслуживания фетоплацентарного комплекса требуется больше железа. Этот микроэлемент ускоренно потребляется растущим плодом, поступает в плаценту, используется для увеличения общего числа эритроцитов, циркулирующих в крови женщины. К началу III триместра суточная потребность беременной в железе составляет минимум 4-6 мг, а на 32-34 неделях его требуется не менее 10 мг/сут.
- Физиологическая гемодилюция. При беременности объем циркулирующей плазмы возрастает на 40-50%, а объем эритроцитарной массы лишь на 20-35%. Это обусловлено повышенной потребностью организма в железе и пластических веществах, при недостаточном поступлении которых темпы эритропоэза не соответствуют скорости нарастания ОЦК. Согласно рекомендациям ВОЗ, допустимый уровень гемоглобина у беременных снижен до 110,0 г/л, а гематокрит — до 33%.
Фактором, усугубляющим анемию в послеродовом периоде, становится физиологическая потеря до 150 мл крови в родах, в каждых 2,0-2,5 мл которой содержится до 1 мг железа. Специалисты также выделяют ряд патологических причин, вызывающих заболевание. Уменьшение объема эритроцитов (микроцитарный вариант анемии) с соответствующим падением уровня гемоглобина наблюдается при отравлении производственными ядами (например, свинцом), многих хронических болезнях (ревматизме, сахарном диабете, язвенной болезни, гастрите, хронических инфекционных процессах), сидеробластной анемии, талассемии. Данное состояние также возникает при железодефиците, обусловленном недостаточностью в рационе мяса и потреблением продуктов, содержащих негемовые формы микроэлемента (растительная пища, молоко и молокопродукты).
Нормоцитарная анемия со сниженным содержанием нормальных эритроцитов чаще отмечается при кровопотерях вследствие патологии плаценты, хронической почечной недостаточности, гипотиреозе, гипопитуитаризме, аутоиммунной гемолитической форме заболевания, угнетении эритропоэза в костном мозге. Макроцитарный тип анемии с увеличением объема эритроцитов характерен для дефицита фолиевой кислоты и витамина В12, острого миелодиспластического синдрома, печеночной патологии (гепатиты, цирроз), алкогольной зависимости, ретикулоцитоза. Дополнительными факторами риска являются низкий материальный уровень жизни беременной, частые роды, многоплодная беременность, долгое вскармливание грудью с коротким межродовым промежутком, осложненное течение настоящей беременности (выраженный ранний токсикоз с многократной рвотой, гестозы).
Патогенез
Механизм формирования анемии при беременности обычно связан с нарушением баланса между поступлением железа в организм, особенно в сочетании с дефицитом белка, фолиевой кислоты, витамина В12, и их высоким расходом в пластических целях. Дополнительным звеном патогенеза является угнетение эритропоэза за счет повышения концентрация эстрадиола и накопления метаболитов, токсически воздействующих на костный мозг. Ситуация усугубляется иммунологическими изменениями, связанными с постоянной стимуляцией организма матери антигенами плода, что повышает противотканевую сенсибилизацию. Результатами патофизиологических процессов становятся тканевая, гемическая и циркуляторная гипоксия с нарушениями метаболизма и дальнейшим накоплением вредных продуктов обмена.
Классификация
Оптимальными критериями систематизации форм анемии беременных являются концентрация гемоглобина в крови и элемент или вещество, дефицит которого привел к возникновению заболевания. Такой подход к классификации позволяет более точно прогнозировать вероятные осложнения и подбирать схему ведения беременности. Современные акушеры-гинекологи выделяют следующие формы гестационной анемии:
- По степени тяжести: согласно классификации ВОЗ с учетом уровня гемоглобина заболевание бывает легким (90-109 г/л), умеренно выраженным (70-89 г/л), тяжелым (менее 70 г/л).
- По типу дефицита: наиболее распространенной является железодефицитная анемия (в структуре заболеваемости занимает около 95%), реже встречаются фолиеводефицитная и В12-дефицитная формы болезни.
Симптомы анемии при беременности
Легкая степень обычно протекает латентно. При понижении концентрации железа менее 90 г/л становятся заметными признаки гемической гипоксии (собственно анемического синдрома) и железодефицита в тканях (сидеропенического синдрома). О возможном развитии кислородного голодания свидетельствуют общая слабость, головокружения, шум в ушах, дискомфорт и боль в прекардиальной области, жалобы на учащение сердцебиения, одышка при физнагрузках. Слизистые оболочки и кожа выглядят бледными. Женщина становится раздражительной, нервозной, невнимательной, у нее снижается память, ухудшается аппетит.
Тканевый железодефицит проявляется быстрой утомляемостью, извращенным вкусом (желанием есть штукатурку, мел, глину, песок, фарш, сырое мясо), утолщением и ломкостью ногтевых пластин, сухостью и выпадением волос, мышечной слабостью, недержанием мочи вследствие ослабления сфинктерного аппарата. У части пациенток поражаются эпителиальные оболочки: возникают трещины («заеды») в уголках рта, воспаляется слизистая ротовой полости, появляются жалобы на зуд, жжение в области вульвы. При умеренно выраженных и тяжелых анемиях нередко наблюдается незначительная желтизна ладоней и носогубного треугольника, связанная с нарушенным метаболизмом каротина при железодефиците, и «синева» склер, вызванная дистрофическими процессами.
Осложнения
Вероятность осложнений беременности напрямую зависит от выраженности нарушений и времени возникновения заболевания. Особенно неблагоприятна анемия, развившаяся до зачатия. В таких случаях возможны первичная плацентарная недостаточность, гипоплазия плодных оболочек, низкое расположение плаценты и ее предлежание, ранний выкидыш, неразвивающаяся беременность. При появлении анемического симптомокомплекса во II-III триместрах повышается риск гестозов, поздних выкидышей и преждевременных родов, преждевременной отслойки нормально расположенной плаценты.
При тяжелом течении заболевания возникает миокардиодистрофия, ухудшается сократительная способность сердечной мышцы. Как следствие, гемическая и тканевая гипоксии усугубляются циркуляторной, в результате страдают паренхиматозные органы беременной, наблюдается декомпенсация их функции. В родах у 10-15% рожениц выявляется слабость родовых сил, часто наблюдаются обильные кровотечения гипотонического типа. После родов у 10-12% родильниц и у 35-37% новорожденных развиваются различные гнойно-септические процессы. У 4 кормящих матерей из 10 отмечается гипогалактия.
Наличие у беременной анемии представляет непосредственную угрозу для ребенка. Перинатальная заболеваемость при такой патологии может возрастать до 100%, а смертность — до 14-15%. Вследствие фетоплацентарной недостаточности в 63% случаев отмечается гипоксия плода, в 40% — гипоксическая травма мозга, в 32% — задержка развития. Почти треть новорожденных рождаются в асфиксии. Дефицит витамина В12, фолиевой кислоты вызывает аномалии развития позвоночника и нервной системы (spina bifida и др.). У детей, матери которых при беременности страдали выраженной или тяжелой анемией, хуже устанавливается функция внешнего дыхания. В постнатальном периоде они чаще отстают в росте и массе тела, более склонны к возникновению инфекционных заболеваний.
Диагностика
Ключевыми задачами диагностического поиска при подозрении на анемию при беременности считаются оценка степени тяжести расстройства и своевременное выявление осложнений. Поскольку в большинстве случаев анемия является железодефицитной, для постановки диагноза наиболее информативны лабораторные методы определения уровня железа и гемоглобина:
- Общий анализ крови. Содержание гемоглобина составляет менее 110 г/л. Цветовой показатель снижен до 0,85. Количество эритроцитов ниже 3,5х10 12 клеток/л. Отмечаются признаки микроцитоза (уменьшения диаметра эритроцитов менее 6,5 мкм). В морфологической картине эритроцитов возможны пойкилоцитоз, анизоцитоз.
- Исследование обмена железа. Уровень сывороточного железа составляет менее 12 мкмоль/л. Общая железосвязывающая способность сыворотки (ОЖСС) повышена до 85 мкмоль/л и более. Снижены концентрация ферритина (менее 15 мкг/л) и насыщение железом трансферрина (менее 16%). Увеличена латентная железосвязывающая способность крови (ЛЖСС).
Для исключения В12-дефицитного и фолиеводефицитного вариантов анемии, возникшей при беременности, определяют сывороточный уровень цианокобаламина и фолиевой кислоты. С учетом возможных осложнений со стороны плода рекомендована оценка его состояния в динамике с проведением фетометрии, кардиотокографии, фонокардиографии. Дифференциальная диагностика осуществляется между разными формами заболевания, гемоглобинопатиями, синдромом анемизации, вызванным осложнениями беременности, и экстрагенитальной патологией.
Лечение анемии при беременности
Основными задачами терапии у беременных со сниженным гемоглобином являются коррекция железодефицита, устранение проявлений гипоксии, стабилизация гемодинамики и метаболизма. При умеренно выраженном и тяжелом течении анемии особое внимание уделяется поддержке адекватного функционирования фетоплацентарного комплекса. Схема лечения включает лекарственные средства, позволяющие:
- Восстановить содержание гемоглобина. При железодефицитной анемии рекомендован пероральный прием оптимально высоких доз железа в удобной для усвоения двухвалентной форме. Предпочтительно использование препаратов-депо с медленным высвобождением элемента. Парентеральная коррекция анемии проводится при непереносимости двухвалентного железа, принимаемого внутрь, нарушении его всасывания слизистой ЖКТ, обострившейся язвенной болезни желудка или двенадцатиперстной кишки. Для более эффективного усвоения микроэлемента назначают аскорбиновую кислоту. Эксперты ВОЗ рекомендуют дополнять прием железосодержащих препаратов фолиевой кислотой, предупреждающей развитие фолиеводефицитной анемии. Дефицит цианокобаламина является основанием для парентерального введения витамина В12.
- Устранить последствия гипоксии. Чтобы обеспечить адекватное снабжение плода кислородом и питательными веществами, комплексно воздействуют на разные элементы системы маточно-плацентарного кровотока. Для усиления притока крови к плаценте применяют токолитики, расслабляющие маточную стенку. Микроциркуляцию можно улучшить при помощи ангиопротекторов и препаратов, оказывающих влияние на реологию крови. Назначение мембраностабилизаторов, антикосидантов, актовегина позволяет повысить устойчивость плода к гипоксии. Антигипоксическую терапию обычно применяют при II-III степенях анемии, осложнившейся фетоплацентарной недостаточностью. При необходимости используют препараты для коррекции метаболического ацидоза и улучшения сердечной деятельности беременной.
Противоанемическая терапия обычно является длительной, позволяет полностью нормализовать показатели красной крови только на 5-8 неделях лечения. Для повышения эффективности лекарственных средств обязательна коррекция диеты. Рекомендуется дополнить рацион продуктами, богатыми железом: говядиной, телятиной, нежирной ветчиной, свиной, говяжьей, куриной печенью, рыбой. Следует уменьшить количество пищи, ухудшающей всасывание железа: хлебных злаков, отрубей, сои, кукурузы, чая, кофе, молока, карбонатной, гидрокарбонатной, фосфатной минеральной воды. С осторожностью назначают альмагель, тетрациклины, соли магния и кальция, способные усугубить анемию.
Прогноз и профилактика
Анемия легкой степени, диагностируемая у большинства беременных женщин со сниженным уровнем гемоглобина, не представляет угрозы жизни матери и плода. Своевременная коррекция умеренной и тяжелой форм заболевания позволяет существенно улучшить показатели крови, предупредить развитие осложнений. Для предупреждения перинатальных и материнских осложнений рекомендованы сбалансированное питание, раннее назначение препаратов железа пациенткам с меноррагиями в анамнезе, коротким интервалом между родами, длительной лактацией после предыдущих родов, многоплодием. Женщинам с анемией следует уделять повышенное внимание в период родов для быстрого выявления и коррекции возможных нарушений родовой деятельности, послеродовых кровотечений.
2. Анемия беременных. Принципы современной терапии/ Короткова Н.А., Прилепская В.Н.// Медицинский совет. - 2015.
3. Дефицит железа у беременных, пути профилактики/ Якунина Н.А., Зайдиева З.С.// медицинский совет. - 2014.
Гемолитическая болезнь плода
Гемолитическая болезнь плода - внутриутробный иммунологический конфликт, обусловленный несовместимостью крови плода и матери по ряду антигенов, что приводит к гемолизу эритроцитов ребенка под влиянием материнских антител, преодолевающих плацентарный барьер. Гемолитическая болезнь плода может протекать в отечной, желтушной, анемической форме и даже приводить к внутриутробной гибели плода. В диагностике проводится исследование околоплодных вод (амниоцентез), пуповинной крови, билирубина и гемоглобина у новорожденного. Лечение гемолитической болезни плода требует проведения фототерапии, внутривенной инфузии растворов, обменного переливания крови.
Патогенетическую основу гемолитической болезни составляют процессы, вызванные иммунологической (антиген-антитело) несовместимостью крови плода и матери. В этом случае имеющиеся в крови у плода антигены наследуются от отца, а в крови матери отсутствуют. Чаще всего (1 случай на 250 беременностей) гемолитическая болезнь плода развивается при конфликте по резус-фактору; также может возникнуть при групповой несовместимости крови и другим менее изученным антигенам. Гемолитическая болезнь плода в 3,5% случаев приводит к перинатальной смертности.
При гемолитической болезни плода под влиянием материнских антител, образующихся к антигенам плода и проникающих через плаценту, у ребенка развивается гемолиз эритроцитов и угнетение гемипоэза. Токсическое воздействие продуктов распада эритроцитов на организм плода (новорожденного) приводит к развитию анемии, увеличению билирубина и бластных (незрелых) эритроцитов.
Причины гемолитической болезни плода
Иммунологический конфликт, приводящий к гемолитической болезни плода, чаще всего развивается при изосерологической несовместимости крови по системе Резус (Rh), когда у матери имеется Rh-отрицательная кровь, а у плода - Rh-положительная. В таком случае он носит название резус-конфликт. Изоиммунизация при этом может происходить двумя путями: ятрогенным (при сенсибилизации женщины переливаниями Rh(+) крови в прошлом) или при плодово-материнском трансплацентарном переносе эритроцитов плода в материнский кровоток в процессе беременности и родов. В случае Rh-несовместимости гемолитическая болезнь плода редко бывает сопряжена с первой беременностью; чаще развивается от 2-ой или 3-ей беременности с возрастанием рисков с каждой последующей гестацией.
Другой возможной причиной гемолоитической болезни служит несовместимость крови плода и матери по системе АВ0, т. е. при группе крови матери 0 (I), а у плода любой другой. При этом антигены А и В от плода проникают через плаценту в материнский кровоток и вызывают выработку иммунных α- и β- антител с последующим конфликтом «антиген-антитело». Гемолитическая болезнь плода при АВО-несовместимости имеет более легкое течение, чем при Rh-несовместимости. При АВ0-несовместимости гемолитическая болезнь плода может развиться уже в течение 1-ой беременности.
В относительно редких случаях гемолитическая болезнь плода может быть связана с иммунологическими конфликтами по системам Даффи, Келл, MNSs, Кидд, Лютеран и др. или антигенам P, S, N, М.
Проявления гемолитической болезни плода
У беременных специфической картины патологии не наблюдается; иногда нарастание внутриутробных реакций может вызывать у женщины симптомокомлекс, сходный с гестозом. Гемолитическая болезнь плода может проявляться следующими вариантами: внутриутробной гибелью плода в период с 20 по 30 неделю беременности; отечной, желтушной или анемической формах. Общими проявлениями, характерными для всех форм гемолитической болезни плода, служат наличие нормохромной анемии с увеличением в крови эритробластов, гепатомегалии и спленомегалии.
При отечном варианте гемолитической болезни у плода увеличиваются размеры селезенки, печени, сердца, желез, нарастает гипоальбуминемия. Эти изменения сопровождаются выраженным отеком подкожно-жировой клетчатки, асцитом, перикардитом, плевритом, увеличением массы ребенка в 2 раза по сравнению с нормой. При отечном варианте гемолитической болезни плода отмечается резко выраженная анемия (Er -1-1,5 x 1012/л, Нb 35-50 г/л), эритробластемия, увеличение и отечность плаценты. Тяжелые нарушения обмена могут вызывать внутриутробную гибель плода или смерть ребенка вскоре после родов. Отечную форму гемолитической болезни плода отличает крайне тяжелое течение, что в большинстве случаев приводит к летальному исходу.
При желтушном варианте гемолитической болезни плода ребенок чаще рождается от срочных родов, доношенным, чаще с нормальным цветом кожи. В этом случае гемолитическая болезнь плода проявляется спустя несколько часов после рождения - у ребенка стремительно нарастает желтушная окраска кожи; реже желтуха бывает врожденной. У новорожденных с желтушной формой гемолитической болезни увеличены селезенка, печень, лимфоузлы, иногда сердце, отмечается интенсивный прирост непрямого билирубина в крови.
Гипербилирубинемия опасна возможностью повреждения гепатоцитов, кардиомиоцитов, нефронов, нейронов с развитием билирубиновой энцефалопатии. При ядерной желтухе (билирубиновой интоксикации) ребенок вялый, плохо сосет, часто срыгивает, у него развивается гипорефлексия, рвота, судороги. Критический уровень непрямого билирубина, опасный в плане поражения ЦНС, - более 306-340 мкмоль/л у доношенных и 170-204 мкмоль/л у недоношенных. Следствием билирубиновой энцефалопатии может являться гибель ребенка или последующее отставание в психическом развитии.
При анемической форме гемолитической болезни повреждающее воздействие на плод, как правило, невелико. На первый план выходят анемия, бледность кожи, гепатомегалия и спленомегалия. Тяжесть проявлений гемолитической болезни плода определяется титром антител у беременной и степенью зрелости новорожденного: тяжелее заболевание протекает у недоношенных детей.
Диагностика гемолитической болезни плода
В настоящее время акушерство и гинекология придает важное значение своевременному выявлению и правильному ведению беременности, угрожаемой по развитию гемолитической болезни плода. При постановке беременной на учет у нее определяют группу крови и Rh-фактор, выясняют аналогичные данные отца ребенка, интересуются гемотрансфузионным анамнезом, наличием в прошлом мертворожденных детей, самопроизвольных выкидышей или детей с гемолитической болезнью плода. При угрозе развития гемолитической болезнью плода у женщины в динамике контролируют титр специфически антител.
Пренатальная диагностика гемолитической болезни плода включает проведение акушерского УЗИ, допплерографии маточно-плацентарного кровотока и максимального кровотока в средней мозговой артерии с оценкой функционального состояния развивающегося ребенка. Характерными ультразвуковыми критериями гемолитической болезни плода являются плацентомегалия, многоводие, расширение пуповинной вены; сплено- и гепатомегалия, кардиомегалия, наличие перикардиального выпота, гидроторакса.
Учитывая, что гемолитическая болезнь часто сопровождается гипоксией, проводится кардиотокография с оценкой сердечной деятельности плода. В случае получения данных за гемолитическую болезнь плода требуется проведение инвазивных исследований - кордоцентеза и амниоцентеза под контролем УЗИ. При рождении ребенка сразу определяется его резус и групповая принадлежность, исследуется содержание Hb и билирубина в пуповинной крови.
Лечение гемолитической болезни плода
Лечебными задачами при гемолитической болезни плода служат быстрое выведение из крови ребенка токсических факторов гемолиза - непрямого билирубина и антител, а также повышение функций страдающих систем и органов. Выбор способа родоразрешения женщин с изоиммунизацией определяется состоянием плода, сроком беременности, подготовленностью родовых путей. В случае отсутствия данных за тяжелую форму гемолитической болезни плода, на сроке беременности свыше 36 недель, зрелости шейке матки возможны естественные роды. При тяжелом состоянии плода предпочтительнее кесарево сечение за 2-3 недели до ожидаемого срока.
У новорожденных с гемолитической болезнью плода ежедневно контролируется показатели Hb, Ht, билирубина. При необходимости проводится коррекция анемии эритроцитарной массой, инфузионная дезинтоксикационная терапия. Важной составляющей лечения гемолитической болезни плода служит фототерапия, способствующая разрушению непрямого билирубина в коже ребенка. Светолечение проводится в импульсном или непрерывном режиме с помощью ламп дневного или синего света.
При более тяжелых проявлениях гемолитической болезни плода показано проведение капельного внутрижелудочного введения жидкости и заменного переливания крови. При гемолитической болезни плода, обусловленной Rh-конфликтом, при заменном переливании используется одногруппная Rh (-) кровь. В случае несовместимости по ABO переливается эритроцитная масса 0(I) группы в соответствии с Rh-принадлежностью новорожденного и одногруппная плазма. Развитие отека легких и выраженной дыхательной недостаточности требует проведения ИВЛ; наличие асцита диктует необходимость выполнения лапароцентеза под УЗИ-контролем.
Профилактика гемолитической болезни плода
Заключается в предупреждении Rh-иммунизации женщин - внимательном переливании крови с учетом Rh-принадлежности. Женщинам с Rh(-) кровью категорически не рекомендуется прерывание беременности, наступившей впервые. Методом специфической профилактики Rh-конфликта у женщин с Rh(-) кровью служит введение иммуноглобулина антирезус Rho человека после абортов, родов Rh(+) плодом, внематочной беременности, а также после инвазивной пренатальной диагностики - биопсии хориона, амниоцентеза, кордоцентеза.
Антенатальные эхографические мониторинги при гемолитической болезни плода
Идеальный инструмент для пренатальных исследований. Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
Введение
Гемолитическая болезнь плода и/или новорожденного (ГБП, ГБН, ГБПН) - гемолитическая анемия, развивающаяся вследствие выработки иммунокомпетентной системой матери антител, разрушающих эритроциты плода. Наиболее часто антитела резус-отрицательной матери направлены против плодовых антигенов Rh, реже антитела вырабатываются в организме матери, имеющей группу крови 0, и направлены против групповых антигенов. Антитела проникают к плоду через плаценту.
Этиопатогенез ГБПН у Rh-отрицательной матери представлен следующей последовательностью: предшествующая беременность Rh-положительным плодом, плодово-материнские трансфузии в родах либо при прерывании беременности, иммунизация матери с формированием в ее крови anti-Rh антител (Rh-сенсибилизация), проникновение антител в кровь Rh-отрицательного плода, повреждающее (гемолитическое) действие антител на эритроциты плода, интоксикация плода и новорожденного продуктами распада гемоглобина. ГБПН является фактором высокого риска перинатальной смертности и заболеваемости [1, 2].
Существуют три клинические формы ГБПН: отечная, желтушная и анемическая. Проявления желтушной формы болезни: гипербилирубинемия, изменение окраски кожи и билирубиновая интоксикация новорожденного. При анемической форме имеются изолированные гематологические изменения (анемия, эритробластоз). Отечная форма (генерализованный врожденный отек) - наиболее тяжелая, имеющая крайне неблагоприятный прогноз, сопровождается значительным скоплением внеклеточной жидкости в тканях и полостях плода, фетальной гепато- и спленомегалией.
Инвазивный забор фетальной крови и гематологическое исследование позволяют наиболее точно диагностировать ГБП на антенатальном этапе. Очевидно, что поиск критериев, обеспечивающих неинвазивную, т. е. эхографическую, диагностику и оценку степени перинатального риска при сенсибилизированной беременности, является важной задачей современной перинатологии.
В акушерской клинике ультразвуковое (УЗ) исследование плода играет важную роль в диагностике ГБПН. Эхографические находки при отечной форме ГБП зависят от степени выраженности водянки. УЗ-проявления иммунной и неиммунной водянки плода практически одинаковы, к настоящему времени они подробно описаны в руководствах [2, 3]. К ранним признакам отечной формы ГБП относят плацентомегалию, гепатоспленомегалию плода и многоводие, к поздним - кардиомегалию и перикардиальный выпот, асцит, гидроторакс, повышенную эхогенность кишечника вследствие отека его стенки, отек подкожной клетчатки головы, туловища и конечностей плода (двойной контур) и расширение вены пуповины [4]. Некоторые авторы рекомендуют измерение длины печени плода в качестве критерия фетальной гепатомегалии [4, 5]. Что касается УЗ-биометрии фетальной селезенки, по мнению экспертов пренатальной эхографии, эти измерения чаще бывают неточными в связи с малым размером органа и методологической сложностью [6]. К сожалению, косвенные УЗ-признаки ГБП, которые рассматриваются как возможные индикаторы доклинических форм водянки плода (полигидрамнион, плацентомегалия, гепатомегалия и эхогенность кишечника плода), имеют недостаточную предсказательную ценность [7, 8].
Все перечисленное затрудняет пренатальное консультирование и прогнозирование результата беременности у сенсибилизированных женщин.
Кроме того, отсутствие стандартного регламента и алгоритма перинатальной тактики при аномальных показателях антенатальных мониторингов иммуноконфликтной беременности объясняется крайне низкой современной частотой подобных клинических случаев, что исключает получение доказательных выводов. Так, в крупном американском центре за 17 лет наблюдений было выявлено всего 167 случаев иммунной водянки плода, т. е. патология встречалась с частотой менее 10 случаев в год [3]. Опубликованный в 2009 г. ретроспективный анализ всех случаев Rh-иммунизации, имевших место в двух французских административных районах c 3 млн жителей, показал, что популяционная частота Rh-иммунизации в настоящее время ниже 0,41%о [13]. Это, по-видимому, связано с широким внедрением профилактических технологий Rh-десенсибилизации и с высоким уровнем контрацепции в экономически развитых регионах.
В настоящее время отсутствуют четкие протоколы ведения сенсибилизированной беременности в зависимости от результатов антенатальных УЗ-мониторингов, поскольку отсутствует доказательная база, основанная на результатах больших исследований. В каждом случае акушерская ситуация оценивается индивидуально, а алгоритмы отсутствуют. В частности, отсутствуют алгоритмы изменения перинатальной и акушерской тактики на основании допплерографии венозного протока (ВП) плода.
В то же время исследование гемодинамики ВП плода - важный компонент антенатальных допплеровских мониторингов беременности высокого перинатального риска (рис. 1). Различают два типа патологических изменений допплерограмм ВП: наличие а-реверсной волны и снижение фазы изоволюметрической релаксации (ИВР). Возрастание давления, гемодинамическая перегрузка и застой в правом предсердии отражаются возрастанием индексов сосудистого сопротивления ВП и появлением а-реверса. Фаза ИВР ВП - показатель функции миокарда. Период между систолическим и диастолическим пиками спектра кровотока ВП соответствует периоду ИВР миокарда, когда давление в предсердии и убывающее систолическое давление выброса сравнительно одинаковы. В этот период сердечная мышца расслабляется. Способность к полноценной релаксации в диастолу - важная функция миокарда. При гипоксии миокарда или ацидозе сердечная мышца становится менее податливой, хуже расслабляется и фаза ИВР снижается.

а) Норма, углубление между систолическим и диастолическим пиками (между 1 и 2) отражает период ИВР миокарда.
Случай острого развития синдрома анемии-полицитемии (TAPS) у монохориальной диамниотической двойни с синдромом селективной задержки роста плода (sIUGR)
Перинатальный центр РКБ МЗ Республики Татарстан, Казанская государственная медицинская академия - филиал ФГБОУ ДПО РМАНПО МЗ РФ, Казань.
УЗИ сканер RS80
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
По данным ISUOG, в последние десятилетия отмечено увеличение более чем на 70% случаев рождения двоен [1]. Это связано с широким внедрением вспомогательных репродуктивных технологий, отсроченным поздним зачатием, использованием противозачаточных препаратов.
По типу хориальности различают дихориальные и монохориальные двойни, причем 2/3 из них составляют дихориальные двойни.
Каждый плод из дихориальной двойни имеет собственную плаценту, свое отдельное сосудистое русло, и каждый развивается по своему сценарию, общим для них является состояние матери, которое, естественно, отражается на состоянии плодов.
Монохориальные двойни имеют одну общую плаценту. Практически в 100% случаев в общей плаценте имеются многочисленные сосудистые анастомозы, связывающие напрямую системы кровообращения обоих плодов. Плацентарные анастомозы бывают артерио -артериальные (АА), вено-венозные (ВВ) и артериовенозные (АВ) [2]. Все эти анастомозы могут располагаться и на поверхности плаценты, и в глубине. И если АА- и ВВ-анастомозы в большинстве случаев скомпенсированы, то АВ-анастомозы, где кровь из артерий одного плода дренируется напрямую в вены другого плода, являются причиной многочисленных осложнений.
Фето-фетальные трансфузионные синдромы
По статистике, течение беременности при монохориальных двойнях осложняется в 10-15% случаев фето-фетальными трансфузионными синдромами (ФФТС) разной степени тяжести 5, причем клинические проявления ФФТС зависят от наличия именно АВ-анастомозов, их количества и размеров. Классический ФФТС диагностируется обычно на сроках от 16 до 26 нед и характеризуется наличием маловодия, максимальный вертикальный карман (МВК) менее 2 см у плода-донора, и многоводием, МВК более 8 см у плода-реципиента. Практически одновременно с этим первым признаком ФФТС при ультразвуковом исследовании (УЗИ) выявляется второй признак: у плода-донора мочевой пузырь или не визуализируется, или бывает значимо маленьким, а у реципиента - переполнен, или значимо большой. Эта самая частая форма ФФТС в настоящее время называется синдромом олигурии-полиурии (TOPS), связана с наличием крупных АВ-анастомозов на поверхности плаценты, приводящих к гиперволемии плода-реципиента и гиповолемии плода-донора. При своевременной ультразвуковой диагностике эта форма поддается антенатальной коррекции фетоскопической лазерной коагуляцией АВ-анастомозов.
При наличии глубоких АВ-анастомозов малого диаметра (до 1 мм) и в отсутствие компенсирующих АА-анастомозов в 3-5% случаев у монохориальной двойни может развиваться еще одна форма ФФТС - синдром анемии-полицитемии (TAPS), когда по мельчайшим анастомозам происходит хроническое медленное кровотечение от донора к реципиенту [6]. При УЗИ количество околоплодных вод может быть приблизительно одинаково нормальным, и заподозрить TAPS можно, если обратить внимание на разницу в толщине и эхогенности территорий плацент донора и реципиента. При измерении пиковой систолической скорости (ПСС) в средней мозговой артерии (СМА) каждого плода подтверждается, что у плода с признаками анемии с ПСС выше 1,5 МоМ территория плаценты утолщена, эхогенность ее повышена, а у реципиента с признаками полицитемии с ПСС ниже 1,0 МоМ территория плаценты обычной толщины и низкой эхогенности. В случае ФФТС в виде TAPS в отличие от TOPS существующие методы пренатального лечения не так эффективны, так как мелкие глубокие АВ-анастомозы практически не видны при фетоскопии. Некоторые специалисты проводят полную лазерную дихорионизацию плаценты по сосудистому руслу с предварительной амниоинфузией. Методом выбора является внутриутробная гемотрансфузия плоду-донору, однако она эффективна только в отсутствие значимо крупных анастомозов, усугубляющих полицитемию плода-реципиента. Таким образом, эффективность однократной гемотрансфузии плоду-донору имеет и лечебное, и диагностическое значение. В противном случае некоторые специалисты проводят обменные гемотрансфузии с возмещением реципиенту объема изъятой крови физиологическим раствором [7]. Так как в большинстве случаев TAPS возникает после 26 нед, все мероприятия направлены на продление беременности с целью достижения периода жизнеспособности плодов.
Синдром селективной задержки внутриутробного роста
Синдром селективной задержки внутриутробного роста (сЗВУР) выражается в отставании в росте одного из плодов и характеризуется дискордантностью фетометрических показателей двух плодов более чем на 25% и высчитывается по формуле:
(Масса тела большего плода - Масса тела меньшего плода) / Масса тела большего плода × 100 ≥ 25%.
Селективная ЗВУР не считается уникальным осложнением монохориальной двойни и не относится к ФФТС. У дихориальной двойни также может возникать дискордантность в росте и развитии одного из плодов, причиной может быть хромосомная аномалия одного из плодов дихориальной двойни, например трисомия 18, или триплоидия, оболочечное прикрепление пуповины, пороки развития плода типа скелетных дисплазий и т.д. Причиной может быть и истинная плацентарная недостаточность одной из плацент, когда недоразвиты ворсины, сосуды ворсин и соответственно сосудистое русло плаценты. Терминальная плацентарная недостаточность может привести к гибели меньшего плода, однако отсутствие каких-либо общих сосудов между плацентами позволяет оставшемуся плоду развиваться без осложнений до доношенного срока.
При синдроме сЗВУР у монохориальной двойни при идентичном генном и хромосомном наборе может быть катастрофическая разница по площади принадлежащих плодам плацентарных территорий с аномальным развитием ворсин и сосудистого русла плацентарной ткани у плода с сЗВУР (рис. 1).
При терминальной плацентарной недостаточности происходит гибель меньшего плода, которая в большинстве случаев влечет за собой гибель нормального плода. Объясняется это наличием сосудистых анастомозов (АА и ВВ) в одной общей плаценте, но в отличие от ФФТС плацентарные анастомозы здесь играют положительную роль, долгое время компенсируя и поддерживая жизнь плода с маленькой плацентарной территорией (рис. 2).
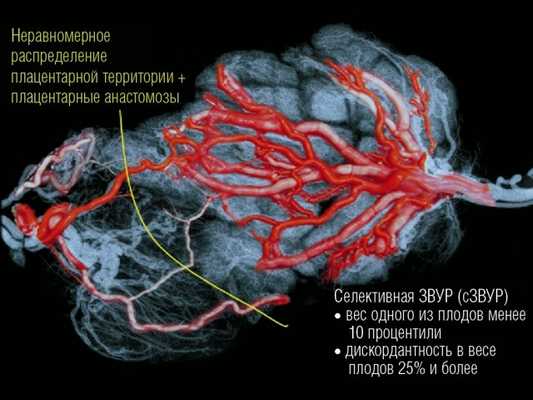
Рис. 1. Распределение сосудов в плаценте монохориальной двойни при селективной ЗВУР.
Гемолитическая болезнь плода и новорождённого (синоним — эритробластоз плода) классифицируется по 3 степеням в зависимости от тяжести гемолитической анемии и способности плода ее компенсировать без развивающихся поражений печени, портальной обструкции и генерализованного отёка.
Выделяют гемолитическую болезнь лёгкой степени (50%), средней степени (25-30%) и тяжелой степени (20-25%).
Гемолитическая болезнь плода в подавляющем большинстве случаев является следствием резус-сенсибилизации беременной.
Как это происходит?
Первичным ответом иммунной системы матери на попадание в кровоток резус-антигенов является выработка IgM-антител, которые не проникают через плацентарный барьер к плоду из-за большой молекулярной массы. Первичный иммунный ответ после попадания D-антигена в кровоток матери проявляется через определенное время, которое составляет от 6 нед до 12 мес. Именно поэтому большинство резус-отрицательных женщин, как правило, благополучно вынашивают свою первую беременность. При повторном попадании резус-антигенов в сенсибилизированный организм матери происходит быстрая и массивная продукция IgG, которые вследствие низкой молекулярной массы способны проникать через плацентарный барьер. В половине случаев для развития первичного иммунного ответа достаточно попадания 50-75 мл эритроцитов, а для вторичного — 0,1 мл.
Проходя через плацентарный барьер, резус-антитела разрушают эритроциты плода, вызывая гемолитическую анемию и образование в большом количестве непрямого билирубина, что вызывает желтуху. В результате возникает компенсаторное экстрамедуллярное кроветворение, очаги которого локализуются преимущественно в печени плода и неизбежно приводят к нарушению её функций. Развиваются портальная гипертензия, гипопротеинемия, водянка плода, т.е. комплекс нарушений, называемый эритробластозом плода. Это состояние требует лечения плода внутриутробно, либо родоразрешения и лечения новорожденного, если срок беременности и возможности неонатальной службы позволяют подобное лечение провести.
Ведение резус-иммунизированных (сенсибилизированных) беременных
При ведении резус-сенсибилизированных беременных крайне важна информация о предыдущих детях или исходах предыдущих беременностей. Особый акцент ставится на тяжести гемолитической болезни у предыдущего ребёнка.
- В связи с возрастающим риском для плода при последующей беременности важно выяснить, на каком гестационном сроке проявились признаки гемолитической болезни у предыдущего ребёнка и тяжесть гемолитической болезни новорождённого.
- Особенности терапии предыдущего ребёнка, в частности, проводилось ли заменное переливание крови (сколько раз) или фототерапия, косвенно указывают на степень гипербилирубинемии и анемии.
При появлении и нарастании титра резус-антител особое значение приобретают неинвазивные методы оценки тяжести состояния плода:
УЗИ и допплерометрия.
Доплерометрия. В настоящее время для оценки тяжести анемии у плода с 20 недель используется допплерометрический метод, который являясь неивазивным, имеет определяющее значение при выборе тактики ведения сенсибилизированной беременной.
При анемии отмечается значительное повышение скорости кровотока в средней мозговой артерии, которое коррелирует с тяжестью анемии у плода.
Ультразвуковая диагностика. Наиболее точно при УЗИ ставится диагноз отечной формы гемолитической болезни плода.
При выраженной водянке плода отмечают:
- гидроперикард (один из ранних признаков);
- асцит и гидроторакс в сочетании с многоводием (очень неблагоприятный прогностический признак);
- кардиомегалию;
- отёк кожи головы (особенно выражен) и кожи конечностей;
- плохую сократимость и утолщение стенок желудочков сердца;
- увеличение эхогенности кишечника из-за отёка его стенок;
- гипертрофию и утолщение из-за отёка плаценты (структура плаценты гомогенная);
- необычную позу плода, известную как «поза Будды», при которой позвоночник и конечности плода отведены от раздутого живота;
- общее снижение двигательной активности, которое характерно для плода, страдающего тяжёлой гемолитической болезнью.
Тактика ведения беременности при гемолитической болезни плода
В гестационный срок менее 33 недель при наличии у пациентки допплерометрических признаков тяжелой анемии плода, либо проявлений отечной формы гемолитической болезни плода, должно быть предпринято родоразрешение либо внутриутробное переливание крови плоду (в зависимости от возможностей клиники).
В сроках более 33 недель при аналогичных показателях, как правило, принимается решение о досрочном оперативном родоразрешении и переливании крови новорожденному.
Окончательное решение должно быть принято на основании оценки зрелости лёгких плода, данных акушерского анамнеза и показателей гематокрита, гемоглобина, билирубина в крови плода и возможностей перинатальной службы.
Внутриутробное переливание крови плоду проводится в Центре в течение 8 лет.
Внутрисосудистое внутриуробное переливание крови плоду
Является методом выбора в связи с меньшим риском осложнений и возможностью контроля над тяжестью анемии и эффективностью лечения. Кроме того, при данной методике интервал между трансфузиями составляет 1,5-2 недели и роды могут быть отсрочены до достижения плодом более зрелого гестационного возраста.
Бригада специалистов состоит: из врача функциональной диагностики, врача акушера-гинеколога, анестезиолога, гемотрансфузиолога.
Техника. Под контролем УЗИ определяют положение плода и место пункции вены пуповины. Иглой 20-го или 22-го калибра трансабдоминально под контролем УЗИ пунктируют пупочную вену недалеко от места отхождения её от плаценты. Перед внутрисосудистой гемотрансфузией проводится кордоцентез и осуществляется забор крови плода для определения предтрансфузионного гематокрита плода.
Объем донорской крови, необходимый для переливания, рассчитывается индивидуально с учетом предполагаемой массы плода, гематокрита крови плода, гематокрита крови донора и фетоплацентарного объема крови, который соответствует сроку беременности.
Гемотрансфузию проводят с начальной скоростью 1-2 мл/мин. До и после гемотрансфузии эритроцитной массы, обедненной лейкоцитами и тромбоцитами определяют гематокрит плода. Конечный гематокрит определяет адекватность гемотрансфузии.
Желательный конечный гематокрит (после трансфузии) — 45%. При тяжёлой анемии плода с гематокритом ниже 30% трансфузии позволяют поддерживать гематокрит на уровне, близком к нормальному для данного гестационного возраста (45-50%).
Требования к эритроцитной массе: группа крови 0, резус-отрицательная, тестированная и негативная на вирус гепатита В, С, цитомегаловирус и ВИЧ, совместимая с матерью и плодом, отмытая в физиологическом растворе для сведения к минимуму риска вирусного заражения. Интервал между трансфузиями зависит от посттрансфузионного гематокрита и составляет в среднем около 1,5- 2 недель.
Внутрисосудистое внутриутробное переливание крови плоду обеспечивает:
- подавление продукции фетальных эритроцитов (в ответ на меньшее количество резус-положительных клеток снижается стимуляция материнской иммунной системы);
- пролонгирование беременности до более зрелого гестационного возраста плода и предотвращение осложнений, связанных с глубокой недоношенностью.
Роды должны быть предприняты только тогда, когда риск, связанный с преждевременными родами, меньше риска, связанного с внутриуробным переливанием крови плоду, обязательно после проведения профилактики респираторного дистресс-синдрома плода. В типичных случаях это происходит к 33 неделе гестации. Кесарево сечение является оптимальным методом родоразрешения при водянке и тяжёлой анемии у плода, когда имеется высокий риск нарушения его состояния в родах. Во время родов должна присутствовать неонатальная бригада, имеющая в своем распоряжении кровь для заменного переливания.
В целом, мы располагаем опытом многократных внутриутробных переливаний крови плоду с последующим успешным родоразрешением и выхаживанием новорожденных.
Читайте также:
- Типы мономорфных аденом. Базально-клеточные аденомы слюнной железы.
- Микроскопия. Выделение возбудителя инфекции у детей
- Управление гневом. Как научиться контролировать свою агрессию?
- Признаки повреждения сухожилия общего разгибателя на уровне локтевого сустава
- Объективные методы обследования в легочной хирургии. Виды биопсий в торакальной хирургии
