Влияние радия на костный мозг. Развитие остеосарком под действием радия
Добавил пользователь Morpheus Обновлено: 21.01.2026
А.С. Кулакова, Д.Л. Бенцион, В.Г. Елишев, В.А. Ветров
Свердловский областной онкологический диспансер, Екатеринбург, Россия
Пациенты с метастатическим кастрационно-резистентным раком предстательной железы (мКРРПЖ) представляют собой сложную и неоднородную группу, основной целью лечения которой является как увеличение продолжительности жизни, так и сохранение ее качества. Наиболее частой локализацией метастазирования рака предстательной железы (РПЖ) являются кости скелета, поражение которых связано с высоким риском скелетных осложнений, что затрудняет дальнейшее лечение данной группы пациентов. Рост заболеваемости РПЖ требует поиска новых методов лечения этой категории пациентов. В настоящее время существует несколько терапевтических опций в лечении мКРРПЖ: химиотерапия, ингибиторы андрогенного сигнала, системная альфа-радиотерапия. Радия хлорид [Ra223] является первым излучающим α-частицы радиофармацевтическим препаратом (РФП), одобренным для лечения пациентов с КРРПЖ с метастазами в кости, а также первым РФП, увеличивающим общую выживаемость пациентов. Цель исследования: оценить эффективность и безопасность применения Ra223 у пациентов с мКРРПЖ. В данный анализ нами были включены 54 пациента с мКРРПЖ, получивших от 1 до 6 инъекций радия-223 [Ra-223] в рамках рутинной клинической практики. Большинство пациентов имели более 6 метастазов - 92,6%, у 4 было менее 6 метастазов - 7,4 %. Радий-223 [Ra223] продемонстрировал эффективность для пациентов с мКРРПЖ. Максимальный эффект от терапии наблюдался у пациентов, получивших 5 и более введений. При этом отмечались хорошая переносимость препарата и невысокий уровень токсичности.
Введение
Рак предстательной железы (РПЖ) занимает 2-е место по числу выявленных злокачественных опухолей у мужчин. В 2020 г. доля РПЖ от общего числа выявленных онкологических заболеваний составила 7,3%, т.е. это четвертый показатель после рака молочной железы (11,7%), рака легкого (11,4%) и колоректального рака (10,0%). Среди мужчин доля РПЖ от общего числа выявленных онкологических заболеваний составила 14,1%, уступив только раку легкого (14,3%) [1]. В большинстве случаев пациентам с местнораспространенными формами РПЖ удается достичь локального контроля. У пациентов с рецидивом после проведенного радикального лечения (операция, лучевая терапия), а также с впервые выявленным метастатическим заболеванием, к целям лечения относятся увеличение выживаемости и сохранение качества жизни [2].
Особого внимания заслуживает кастрационно-резистентный рак предстательной железы (КРРПЖ) - форма заболевания, критериями определения которой являются уровень тестостерона 2,0 нг/мл) или рентгенологическим прогрессированием (появление новых очагов: два и более новых очагов в костной ткани или очага в мягких тканях согласно критериям RECIST). Метастатический КРРПЖ в 90% случаев характеризуется появлением костных метастазов. Развитие костных метастазов нередко ассоциировано с выраженным болевым синдромом, патологическими переломами, что ухудшает качество жизни пациентов, может быть причиной инвалидизации пациентов и приводит к снижению общей выживаемости (ОВ). На сегодня существует несколько терапевтических опций в лечении пациентов с мКРРПЖ: химиотерапия (ХТ), ингибиторы андрогенного сигнала (ИАС), системная альфа-радиотерапия, а также PARP (поли-[АДФ рибоза] полимераз), ингибиторы для пациентов с выявленными мутациями BRCA1/BRCA2. Было проведено несколько исследований, доказывающих, что существует минимальное преимущество выживаемости пациентов, которые продолжают применение агонистов лютеинизирующего гормона рилизинг-гормона (аЛГРГ) после наступления кастрации [4, 5]. Для применения в качестве первой линии терапии пациентов с мКРРПЖ в Российской Федерации, согласно рекомендациям Ассоциации онкологов России по лечению РПЖ, применяются абиратерон ацетат в сочетании с преднизолоном, энзалутамид, доцетаксел. Радий-223 [Ra223] является одним из препаратов выбора во второй линии терапии наряду с кабазитакселом, а также допустимой опцией лечения в третьей линии терапии (после прогрессирования на доцетакселе и ИАС) [6].
Радия хлорид [Ra223] - альфа-эмиттер, по строению схожий с кальцием, что позволяет ему образовывать комплексное соединение с минералом костной ткани гидроксиапатитом. Благодаря данному соединению радий-223 [Ra223] избирательно воздействует на костную ткань, в особенности на костные метастазы РПЖ, характеризующиеся зонами активной ремодуляции костной ткани. Данный радиофармпрепарат обладает высоким значением энергии переноса ɑ-частиц (80 кэВ/мкм), вызывающим высокую частоту разрыва двухцепочечной молекулы ДНК, что приводит к сильному цитотоксическому эффекту на поврежденные клетки, при этом за счет короткой длины пробега ɑ-частиц здоровые клетки остаются неповрежденными. Результатом терапии является высоколокализованный противоопухолевый эффект на костные метастазы предстательной железы.
В Российской Федерации радий-223 применяется в отношении пациентов с мКРРПЖ с 2016 г. во второй и последующих линиях терапии. Однако в рекомендациях NCCN препарат разрешен к применению и в первую линию пациентами с мКРРПЖ с изолированным поражением костей скелета.
Цель исследования: оценить эффективность и безопасность применения радия-223 (Ксофиго) в отношении пациентов с мКРРПЖ в рамках рутинной клинической практики.
Методы
В ГАУЗ СО «СООД» радий-223 (Ксофиго) начал использоваться в терапии мКРРПЖ у пациентов с множественными метастазами в кости с 2019 г. За 2 года в нашем лечебном учреждении пролечены 129 пациентов с мКРРПЖ, которым было проведено 475 введений радия-223 (Ксофиго). В данный анализ нами были включены 54 пациента с мКРРПЖ, которые получили от 1 до 6 инъекций радия-223 [Ra-223] в рамках рутинной клинической практики.
Возраст пациентов, получавших терапию Ксофиго, cоставил от 48 до 83 лет (средний возраст - 66 лет). Объективный статус по шкале ECOG для большинства пациентов был 0-1, 96% (n=52), и лишь у 4% (n=2) на момент начала терапии радием-223 был ECOG 2. Стоит отметить, что, опираясь на данные регистрационного исследования ALSYMPCA, максимальные терапевтический эффект от терапии радием-223 получили пациенты с функциональным статусом по шкале ECOG 0 и 1.
Большинство пациентов, находившихся в нашем отделении, имели более 6 костных метастазов - 92,6% (n=50), у четырех было менее 6 метастатических очагов в костях, это составило 7,4% пациентов от общего количества (рис. 1).
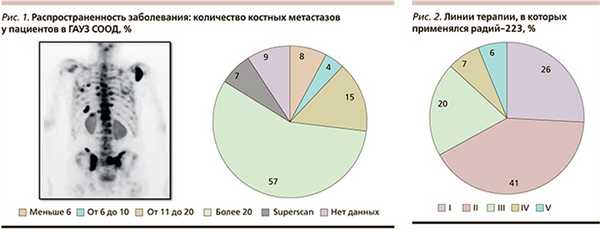
Нами также был проведен анализ исходного уровня щелочной фосфатазы (ЩФ). Пациенты распределились следующим образом: у 42 человек - 77,7%, ее уровень составил менее 220 ЕД/л, у 12 пациентов - 22,3%; более 220 ЕД/л.
Симптомные пациенты (имевшие болевой синдром по визуально-аналоговой шкале [ВАШ] от 2 до 5 баллов) составили большинство среди наших пациентов - 85% (n - 46), что соответствовало критериям включения в исследование ALSYMPCA. Однако данные исследования IIIb-фазы подтверждают, что пациенты с асимптоматическим течением мКРРПЖ также получают преимущество от терапии радием-223 по показателю ОВ (медиана ОВ в группе пациентов с отсутствием болевого синдрома составила 16 месяцев). На основании полученных результатов исследования iEAP в Клинических рекомендациях Ассоциации онкологов России (АОР) были расширены показания к применению радия-223, которые включают пациентов как с наличием, так и с отсутствием болевого синдрома.
Большинству наших пациентов не была проведена радикальная простаткэтомия на момент начала терапии радием-223 - 83,4% (n=45). И только 9 (16,6%) пациентам простатэктомия была выполнена.
Пациенты получали радий-223 в различных линиях терапии при мКРРПЖ: в первой линии терапию радием-223 получили 14 (26%) пациентов, во второй - 22 (41%), в третьей - 11 (20%), в четвертой - 4 (7%), в пятой - 3 (6%) (рис. 2).
У пациентов, получивших радий-223 во второй линии, первая линия терапии была представлена: ХТ (доцетаксел) у 17 (77%) пациентов, ИАС у 5 (23%).
При анализе данных пациенты были разделены на две группы. Первая группа: пациенты, получившие 1-4 введения радия-223, 16 (29,6%) человек. Вторая группа: пациенты, получившие 5- 6 введений радия-223, - 38 (70,4%) человек.
Результаты
Мы оценивали ответ на терапию радием-223 в обеих группах по результатам контрольных радиологических исследований. Для оценки динамики со стороны костных очагов и исключения висцерального метастазирования части пациентов проводилась остеосцинтиграфия c Тc99 и компьютерная томография органов грудной клетки (КТ ОГК), компьютерная томография органов брюшной полости (КТ ОБП), магнитно-резонансная томография органов малого таза (МРТ ОМТ), другой части пациентов выполнялось ПЭТ-КТ с GA-PSMA68, которые проводились перед первым введением радия-223 и через 4 недели после завершения терапии. Критерии прогрессирования: появление новых костных очагов, увеличение уровня накопления РФП, появление висцеральных метастазов. Нежелательные явления оценивались по шкале CTC AE 5.0.
В группе пациентов, получивших 1-4 введения, проведена оценка 11 пациентам. Пяти пациентам оценка не проводилась по причине ранней смерти. Шестью (54%) пациентами достигнута стабилизация, у 1 (9%) - положительная динамика, у 4 (37%) выявлена отрицательная динамика.
В группе пациентов, получивших 5-6 введений: у 17 (45%) больных отмечена стабилизация процесса, у 10 (26%) - положительная динамика, среди этой когорты пациентов в одном случае выявлен полный радиологический ответ по данным остеосцинтиграфии (клинический случай представлен ниже), у 11 (29%) выявлена отрицательная динамика.
В процессе терапии радием-223 оценивалась динамика уровня ЩФ в обеих группах. У 33 (61%) пациентов ЩФ была без изменения уровня от исходного значения, у 17 (32%) отмечалось ее снижение, у 4 (7%) наблюдалось увеличение уровня ЩФ. Повышение уровня ЩФ коррелировало с радиологическим прогрессированием.
Летальность составила 22% (n=12).
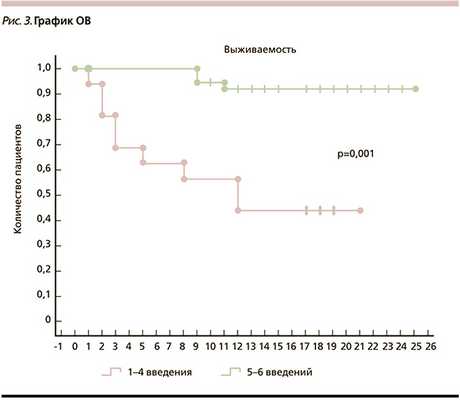
В группе 1-4 введений умерли более половины пациентов - 9 (56%). Период наблюдение составил от 1 до 21 месяца (от даты первого цикла). Медиана ОВ составила 12 месяцев (рис. 3). В группе 5-6 введений смерть наступила только у 3 (8%) пациентов. Период наблюдение составил от 10 до 25 месяцев. Медиана ОВ не была достигнута (рис. 3).
Причиной смерти всех пациентов стало прогрессирование РПЖ.
Клинический случай
Пациент Д. 60 лет. Диагноз: злокачественное новообразование предстательной железы, cT3N1M1, IV стадия, метастазы в кости.
ПСА исходное - 8 нг/мл. Гистологическое заключение - аденокарцинома. По шкале Глисона 9 баллов (4+5).
09.12.2016 проведена трансуретральная резекция (ТУР) предстательной железы. КТ ОГК, КТ ОБП, и МРТ ОМТ от 20.12.2016: признаки рака простаты с распространением на парапростатическую клетчатку и семенные пузырьки, метастатическое поражение костей скелета. ПЭТ/КТ с GA-PSMA68 от 11.01.2017: накопление фармпрепарата в подвздошных лимфоузлах справа (2,56), в остаточной ткани предстательной железы (3,10), в костях - вертлужная впадина справа (1,64), левая седалищная кость (1,5), L3 (3,55), Th7 (3,23).
С июля 2018 г. (мКРРПЖ) терапия энзалутамидом, бисфосфонатами, дегареликсом. Уровень ПСА от 30.03.2019 - 12,38 нг/мл. 10.2019 отмечен рост ПСА до 52 нг/мл.
С октября 2019 по февраль 2020 г. (мКРРПЖ) проведено 6 курсов МХТ кабазитакселом, продолжена терапия золедроновой кислотой, дегареликсом. Наблюдалось резкое увеличение ПСА от 06.07.2020 до 132,93 нг/мл. По данным сцинтиграфии, от 07.07.2020 выявлено множественное поражение костей скелета (более 20) - кости свода черепа, левой ключицы, ребер, лопаток, позвоночного столба, таза, трубчатых костей. КТ ОМТ от 28.07.2020: состояние после ТУР, КТ-признаки кальцинатов оставшейся паренхимы предстательной железы. Уровень ПСА от 31.07.2020 - 151 нг/мл, тестостерон от 07.08.2020 - 0,56 нмоль/дл, ЩФ от 31.07.2020 - 941 ЕД/л.
С 14.08.2020 по 30.12.2020 проведено 6 курсов терапии радием-223.
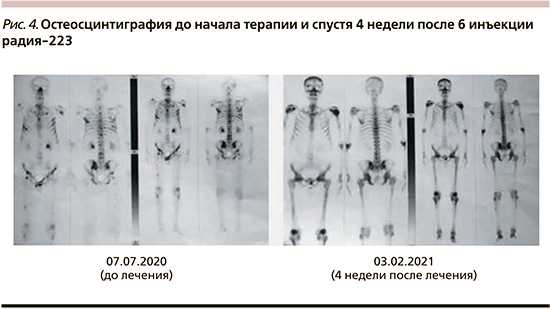
Через 4 недели после завершения терапии радием-223 выполнена контрольная остеосцинтиграфия. Выявлен полный радиологический ответ (рис. 4).
Заключение
Радий-223 [Ra223] продемонстрировал эффективность у пациентов с мКРРПЖ. Максимальный эффект от терапии наблюдался у пациентов, получивших 5 и более введений. При этом отмечены хорошая переносимость препарата и невысокий уровень токсичности.
Планируется дальнейшая оценка ОВ и времени до возникновения первого скелетного события в обеих группах.
Литература
1. Sung H. PhD, Ferlay J., et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. СA: Cancer J Clin. 2021;71(3):209-49. Doi: 10.3322/caac.21660.
2. Гафанов Р.А., Гармаш С.В., Кравцов И.Б., Фастовец С.В. Метастатический кастрационно-резистентный рак предстательной железы: современный взгляд на медикаментозную терапию и альтернативная регуляция опухолевых клеток. Онкоурология. 2018;14(1):107-16.
3. Scher H.I., Morris M.J., Stadler W.M. et al. Trial design and objectives for castration-resistant prostate cancer: updated recommendations from the prostate cancer clinical trials working group 3. J Clin Oncol. 2016;34(12):1402-18. Doi: 10.1200/JCO.2015.64.2702.
4. Hussain M., Wolf M., Marshall E., et al. Effects of continued androgen-deprivation therapy and other prognostic factors on response and survival in phase II chemotherapy trials for hormone-refractory prostate cancer: a Southwest Oncology Group report. J Clin Oncol. 1994;12(9):1868-75. Doi: 10.1200/JCO.1994.12.9.1868.
5. Taylor C.D., Elson P., Trump D.L. Importance of continued testicular suppression in hormone-refractory prostate cancer. J Clin Oncol. 1993;11(11):2167-72. Doi: 10.1200/JCO.1993.11.11.2167.
6. Рак предстательной железы. Клинические рекомендации. Ассоциация онкологов России. 2021.
7. Sartor O., Coleman R., Nilsson S., et al. Effect of radium-223 dichloride on symptomatic skeletal events in patients with castration-resistant prostate cancer and bone metastases: results from a phase 3, double-blind, randomised trial. Lancet Oncol. 2014;15(7):738-46. Doi: 10.1016/S1470-2045(14)70183-4.
8. Saad F., Keizman D., O’Sullivan J.M. Analysis of overall survival by number of radium-223 injections received in an international expanded access program (iEAP)
9. Pezaro C.J., Omlin A., Lorente D., et al. Visceral disease in castration-resistant prostate cancer. Eur Urol. 2014;65(2):270-73. Doi: 10.1016/j.eururo.2013.10.055.
10. Sartor O., Hoskin P., Coleman R.E., et al. Chemotherapy following radium-223 dichloride treatment in ALSYMPCA. Prostate. 2016;76(10):905-16. Doi: 10.1002/pros.23180.
Об авторах / Для корреспонденции
Радия хлорид [223 Ra] (Radii chloridum [223 Ra])
Фармакологическая группа вещества Радия хлорид [223 Ra]
Нозологическая классификация
Фармакологическое действие
Характеристика
Радия хлорид [ 223 Ra] испускает альфа-частицы и имеет период полураспада 11,4 дня. Удельная активность радия-223 1,9 МБк/нг.
Радиоактивный распад радия-223 до свинца-207 состоит из шести звеньев цепочки короткоживущих дочерних изотопов и сопровождается испусканием α-, β- и γ-частиц с разной вероятностью эмиссии и величиной энергии распада. Величина энергии α-излучения составляет 95,3% (диапазон энергии 5-7,5 МэВ), величина энергии β-излучения — 3,6% (среднее значение энергии 0,445 и 0,492 МэВ), величина энергии γ-излучения — 1,1% (диапазон энергии 0,01-1,27 МэВ).
Фармакология
Фармакодинамика
Терапевтическое действие радия хлорида обусловлено эмиссией α-частиц.
Изотоп радия, радия хлорид [ 223 Ra], имитирует кальций и образует комплексное соединение с минералом костной ткани гидроксиапатитом. Благодаря этому изотоп радия избирательно воздействует на костную ткань, в частности на костные метастатические очаги рака предстательной железы. Высокое линейное значение энергии переноса α-частиц (80 кэВ/мкм) приводит к высокой частоте разрыва двухцепочечной молекулы ДНК и вызывает сильный цитотоксический эффект. На моделях in vivo было показано дополнительное воздействие радия хлорида на микроокружение опухоли, включая остеокласты и остеобласты, что способствовало его дополнительной эффективности. Диапазон действия α-частиц радия хлорида — менее 100 мкм (менее десяти диаметров клетки), что минимизирует повреждение здоровых окружающих тканей.
Фармакокинетика
Всасывание. При в/в введении радия хлорида его биодоступность составляет 100%.
Распределение и накопление в органах. После в/в введения радий-223 быстро выводился из системного кровотока и накапливался в первую очередь в костях и костных метастазах или выделялся непосредственно в кишечник.
Около 20% введенной дозы оставалось в системном кровотоке через 15 мин после введения. Около 4% введенной дозы оставалось в системном кровотоке через 4 ч после введения, снижаясь до менее 1% через 24 ч. Vd превышал ОЦК , что свидетельствует о распределении в периферических полостях.
Радиофармацевтическая активность отмечалась в костях и кишечнике через 10 мин после введения. Уровень активности в костях был 44-77% через 4 ч после введения. Не отмечалось значительное накопление изотопа радия в таких органах, как сердце, печень, почки, мочевой пузырь и селезенка через 4 ч после инъекции.
Биотрансформация. Радий-223 подвергается радиоактивному распаду и не метаболизируется.
Выведение. Изотоп радия в основном выводится из организма через кишечник. Около 5% выводится почками. Данные о гепатобилиарной экскреции отсутствуют.
Результаты измерения радиоактивности всего тела через 7 дней после введения (с учетом фактора распада) показывают, что 76% введенной дозы выводятся из организма. На скорость выведения радия-223 из ЖКТ влияет высокая вариабельность скорости прохождения содержимого через кишечник в популяции. Нормальный диапазон частоты опорожнения кишечника составляет от 1 раза в день до 1 раза в неделю.
Линейность. В исследованном диапазоне активности (51-276 кБк/кг) фармакокинетические показатели радия хлорида были линейными.
Дети. Безопасность и эффективность радия хлорида не изучались в возрасте до 18 лет.
Применение вещества Радия хлорид [223 Ra]
Кастрационно-резистентный рак предстательной железы с костными метастазами и отсутствием висцеральных метастазов.
Противопоказания
Гиперчувствительность; возраст до 18 лет (информация об эффективности и безопасности применения у детей отсутствует).
Ограничения к применению
Снижение функции костного мозга; рак предстательной железы на стадии прогрессирующей диффузной инфильтрации костей; риск возникновения компрессии спинного мозга или состоявшаяся компрессия спинного мозга; переломы костей; болезнь Крона и язвенный колит; нарушение функции печени; нарушение функции почек тяжелой степени (Cl креатинина
Применение при беременности и кормлении грудью
Не применяется у женщин.
Побочные действия вещества Радия хлорид [223 Ra]
Общий профиль безопасности радия хлорида основывается на данных клинических исследований с участием 600 пациентов, получавших терапию в клинических исследованиях III фазы.
В клинических исследованиях наиболее частыми нежелательными реакциями (>10% пациентов) были диарея, тошнота, рвота и тромбоцитопения.
Наиболее серьезными нежелательными реакциями при применении радия хлорида были тромбоцитопения и нейтропения (см. «Меры предосторожности»).
Перечисленные ниже нежелательные реакции, отмеченные при применении радия хлорида в ходе клинических исследований, представлены в соответствии с системно-органной классификацией MedDRA (в наиболее подходящих терминах) и распределены по частоте возникновения в следующей градации: очень часто (≥1/10); часто (≥1/100,
В каждой частотной группе нежелательные явления представлены в порядке уменьшения их значимости.
Со стороны крови и лимфатической системы: очень часто — тромбоцитопения; часто — нейтропения, панцитопения, лейкопения; нечасто — лимфопения.
Со стороны ЖКТ: очень часто — диарея, рвота, тошнота.
Общие расстройства и нарушения в месте введения: часто — реакции в месте введения.
Описание отдельных нежелательных реакций
Тромбоцитопения и нейтропения. Тромбоцитопения (все степени тяжести) наблюдалась у 11,5% пациентов, получавших терапию радия хлоридом и 5,6% пациентов, получавших плацебо. Тромбоцитопения 3-й и 4-й степени наблюдалась у 6,3% пациентов, получавших радия хлорид и 2% пациентов, получавших плацебо (см. «Меры предосторожности»). В целом, частота случаев тромбоцитопении 3-й и 4-й степени была ниже у пациентов, ранее не получавших доцетаксел (2,8% у пациентов, получавших радия хлорид, в сравнении с 0,8% у пациентов, получавших плацебо), чем у пациентов, которые ранее получали доцетаксел (8,9 и 2,9% пациентов соответственно).
У пациентов с распространенной диффузной инфильтрацией костей сообщалось о случаях тромбоцитопении (все степени) у 19,6% пациентов, получавших терапию радия хлоридом, и 6,7% пациентов, получавших плацебо. Тромбоцитопения 3-й и 4-й степени наблюдалась у 5,9% пациентов, получавших радия хлорид, и 6,7% пациентов, получавших плацебо (см. «Меры предосторожности»).
Сообщалось о случаях нейтропении (все степени) у 5% пациентов, получавших терапию радия хлоридом, и 1% пациентов, получавших плацебо. Нейтропения 3-й и 4-й степени наблюдалась у 2,2% пациентов, получавших радия хлорид, и 0,7% пациентов, получавших плацебо. В целом частота случаев нейтропении 3-й и 4-й степени была ниже у пациентов, ранее не получавших доцетаксел (0,8% у пациентов, получавших радия хлорид, и 0,8% у пациентов, получавших плацебо), в сравнении с пациентами, которые ранее получали доцетаксел (3,2 и 0,6% пациентов соответственно).
В клиническом исследовании I фазы максимальное снижение количества нейтрофилов и тромбоцитов возникало через 2-3 нед после однократного в/в введения радия хлорида.
Реакции в месте введения. Сообщалось о реакциях в месте введения 1-й и 2-й степени тяжести, которые включали эритему, боль и отек, у 1,2% пациентов, получавших радия хлорид, и 0% пациентов, получавших плацебо.
Вторичные злокачественные опухоли. Терапия радия хлоридом приводит к длительному суммарному накоплению радиационного воздействия у пациентов. Длительное накопление радиационного воздействия может быть связано с повышенным риском возникновения рака и наследственных пороков развития. В частности, может повышаться риск развития остеосаркомы, миелодиспластического синдрома и лейкозов.
В клинических исследованиях радия хлорида не сообщалось о вторичных онкологических заболеваниях на фоне терапии при последующем наблюдении до трех лет.
Взаимодействие
Клинические исследования взаимодействия радия хлорида с другими ЛС не проводились.
Существует вероятность взаимодействия радия хлорида с кальцием и фосфатами.
Следует прекратить прием ЛС, содержащих данные вещества и/или витамин D, за несколько дней до начала терапии радия хлоридом.
Сочетанное проведение химиотерапии и терапии радия хлоридом может оказывать аддитивное действие на подавление функции костного мозга (см. «Меры предосторожности»). Безопасность и эффективность сочетанной химиотерапии и терапии радия хлоридом не установлены.
Передозировка
Симптомы: не сообщалось о случаях непреднамеренной передозировки радия хлорида в клинических исследованиях.
Лечение: специфический антидот отсутствует. В случае непреднамеренной передозировки радия хлорида следует принять стандартные поддерживающие меры, включая контроль токсического действия на систему крови и ЖКТ.
В клиническом исследовании I фазы оценивалась разовая активная доза радия хлорида, которая составляла 276 кБк/кг. Ограничивающая дозу токсичность не наблюдалась.
Способ применения и дозы
В/в, медленно (как правило до 1 мин).
Меры предосторожности
Подавление функции костного мозга
Сообщалось о случаях подавления функции костного мозга (тромбоцитопения, нейтропения, лейкопения, панцитопения) у пациентов, получавших терапию радия хлоридом (см. «Побочные действия»).
Следует проводить общий анализ крови у пациентов перед каждым применением радия хлорида. Перед первым введением радия хлорида абсолютное число нейтрофилов (АЧН) должно быть >1,5×10 9 /л, количество тромбоцитов — >100×10 9 /л и Hb — >10 г/дл. Перед последующими введениями АЧН должно быть >1,0×10 9 /л, количество тромбоцитов — >50×10 9 /л. Если, несмотря на проведение поддерживающей терапии, данные показатели не нормализуются в течение 6 нед после последнего введения радия хлорида, дальнейшую терапию следует продолжать только после тщательной оценки соотношения пользы и риска.
В клинических исследованиях III фазы наблюдалось повышение частоты нежелательных реакций со стороны крови (нейтропения и тромбоцитопения) у пациентов со снижением функции костного мозга (например после предшествующей цитотоксической химиотерапии и/или наружной дистанционной лучевой терапии) или пациентов с раком предстательной железы на стадии прогрессирующей диффузной инфильтрации костей по данным радиоизотопного исследования (см. «Побочные действия»). При лечении таких пациентов следует соблюдать осторожность.
Эффективность и безопасность цитотоксической химиотерапии, проводившейся после терапии радия хлоридом, не установлены. Имеющиеся ограниченные данные показывают, что пациенты, получавшие химиотерапию после терапии радия хлоридом, имели сопоставимые гематологические показатели в сравнении с пациентами, получавшими химиотерапию после приема плацебо.
Болезнь Крона и язвенный колит
Безопасность и эффективность радия хлорида у пациентов с болезнью Крона и язвенным колитом не изучались. Поскольку радия хлорид выводится через кишечник, радиоактивное излучение может привести к обострению острого воспалительного заболевания кишечника. Следует внимательно оценивать соотношение пользы и риска при назначении радия хлорида пациентам с острым воспалительным заболеванием кишечника.
Компрессия спинного мозга
Следует завершить стандартную поддерживающую терапию, проводимую по клиническим показаниям, у пациентов с нелеченой угрожающей или выявленной компрессией спинного мозга до начала или возобновления терапии радия хлоридом.
Переломы костей
У пациентов с переломами костей ортопедическую стабилизацию переломов следует выполнить до начала или возобновления терапии радия хлоридом.
Остеонекроз челюсти
У пациентов, получавших терапию бисфосфонатами и радия хлоридом, не может исключаться повышенный риск остеонекроза челюсти. В клиническом исследовании III фазы сообщалось о случаях остеонекроза челюсти у 0,67% пациентов (4/600) в группе радия хлорида в сравнении с 0,33% (1/301) у пациентов в группе плацебо. При этом все пациенты с остеонекрозом челюсти получали предшествующую или сопутствующую терапию бисфосфонатами (например золедроновая кислота) и предшествующую химиотерапию (например доцетаксел).
Вторичные злокачественные опухоли
Терапия радия хлоридом приводит к длительному суммарному накоплению радиационного воздействия у пациентов. Длительное накопление радиационного воздействия может быть связано с повышенным риском возникновения рака и наследственных пороков развития. В частности, может повышаться риск развития остеосаркомы, миелодиспластического синдрома и лейкозов.
Фертильность. Данные о влиянии радия хлорида на фертильность человека отсутствуют.
Данные исследований на животных показали возможность риска негативного влияния радия хлорида на фертильность. Мужчинам следует проконсультироваться относительно консервации спермы перед началом терапии.
Контрацепция у мужчин
Не проводилось исследований применения радия хлорида для оценки его влияния на репродуктивную функцию у животных.
Вследствие возможного влияния на сперматогенез, связанного с радиоактивным воздействием, следует рекомендовать мужчинам применять надежные методы контрацепции во время лечения и в течение 6 мес после терапии.
Влияние на способность управлять транспортными средствами, работать с механизмами. Данные о влиянии радия хлорида на способность управлять транспортными средствами и работать с другими механизмами отсутствуют.
Остеосаркома
Остеосаркома — это злокачественная опухоль, произрастающая из клеток костной ткани. Это очень редкий вид новообразования, большинство видов которого характеризуется быстрым ростом и агрессивным течением. Остеосаркому не надо путать с метастазами в кости, поскольку те являются результатом распространения новообразований, первично развившихся в других органах.
Главной особенностью остеосаркомы является то, что ее клетки способны производить костную ткань, но она является незрелой. Из нее не может образовываться основное костное вещество, и в ней не происходит кальцинирования. Эта черта отличает остеосаркомы от других злокачественных и доброкачественных опухолей костей.
Что касается эпидемиологии, то частота заболеваемости составляет 10-26 случаев на 1 млн человек в год. Чаще страдает мужское население. Соотношение мужчин и женщин 1,36/1. Имеется два пика подъема заболеваемости. Первый приходится на возраст 10-14 лет, а второй на возраст старше 40 лет. Очень редко новообразование регистрируется у детей младше 5 лет.
Остеосаркома может поражать абсолютно любые кости, но чаще всего опухоль диагностируют в длинных трубчатых костях конечностей в местах так называемой «ростовой пластики» — метафизе.
Остеосаркомы плоских костей чаще наблюдаются у людей старшей возрастной группы. При этом, в основном страдает кость нижней челюсти и кости таза. Могут поражаться и позвонки.
Причины возникновения
Причины возникновения саркомы костей пока изучены недостаточно. Раньше считалось, что спровоцировать развитие опухоли могут травмы, но на сегодняшний день многие врачи склоняются к мнению, что травма только способствует скорейшему росту уже образованной остеосаркомы, но не ее возникновению.
Возможными предрасполагающими факторами являются:
- Воздействие ионизирующего излучения. Например, прохождение лучевой терапии. В этом случае остеосаркомы могут развиваться через несколько лет от момента завершения терапии.
- Наличие инородных тел в кости — импланты, ортопедические конструкции.
- Есть данные, что риски развития остеосаркомы выше у детей, у которых масса тела при рождении превышала 4046г, а также у людей с ростом выше среднего.
- Наличие генетических синдромов — врожденная ретинобластома, синдром Ротмунда-Томпсона, синдром Ли-Фраумени и др.
- Наличие доброкачественных новообразований костей — фиброзная дисплазия, костные кисты.
Однако чаще всего опухоль возникает de novo, без каких-либо предрасполагающих факторов.
Симптомы
Нарастание симптоматики при саркоме происходит постепенно. Сначала пациенты отмечают боль в области локализации опухоли. Она может быть сходна с болью при артритах, миозитах и миалгиях, усиливается по ночам или после физических нагрузок. Но в отличие от вышеперечисленных заболеваний, она со временем не ослабевает, а наоборот, усиливается.
Постепенно размеры новообразования увеличиваются, и в процесс вовлекаются мягкие ткани. Над местом поражения возникает припухлость. Кожа в этой области может быть покрасневшей, с усиленным венозным рисунком. В запущенных стадиях на ней образуются изъязвления.
При возрастании объема поражения, развиваются ограничения объема движения в пораженном сегменте скелета. Кроме того, может образовываться внутрисуставной выпот, патологические переломы (которые возникают без существенных нагрузок). На последних стадиях заболевания присоединяется потеря массы тела, вплоть до кахексии.
Диагностика
Для диагностики остеосаркомы используются следующие методы обследования:
- Клинический осмотр и сбор анамнеза.
- Рентгенологические исследования.
- Лабораторные исследования.
Во время осмотра доктор обращает внимание на локализацию боли, на изменения конфигурации пораженного сегмента, кожной гиперемии и венозного рисунка. Также отмечают наличие или отсутствие ограничений движения в пораженных конечностях.
Далее пациента направляют на рентгенологическое исследование. Это может быть простой рентген или компьютерная томография. В пользу остеосаркомы говорят следующие признаки:
- Очаг костной деструкции.
- Опухоль со смазанными границами, в которой может обнаруживаться облаковидный паттерн из-за неравномерной оссификации.
- Периостальные реакции, которые на снимках выглядят как козырек или отслоение надкостницы.
- Игольчатый периостит — тонкие костные образования (их называют спикулами), которые идут перпендикулярно к кости, создавая картину «солнечных лучей».
С помощью компьютерной томографии более точно оценивают размеры новообразования, место его локализации и вовлеченность соседних мягких тканей (мышц, сухожилий, синовиальных оболочек). Также с ее помощью можно обнаружить скип-метастазы — близкорасположенные или прыгающие метастазы. С помощью МРТ оценивается вовлеченность в процесс костного мозга.

Для окончательной постановки диагноза и определения вида остеосаркомы, необходимо провести морфологическое исследование. Для этого с помощью биопсии берут небольшой фрагмент новообразования и направляют его в лабораторию для специального исследования.
Также в рамках диагностики осуществляют поиск отдаленных метастазов. Как правило, ограничиваются костями, легкими и головным мозгом, поскольку изолированное метастазирвание в другие органы встречается крайне редко. Для обследования легких и головного мозга проводят спиральную КТ. Для поиска метастазов в других костях скелета применяют сцинтиграфию или ПЭТ.
Лечение
Как правило, остеосаркома требует комплексного подхода в лечении, и с этой целью применяется хирургия, химиотерапия и лучевая терапия. Хирургия, как самостоятельный метод лечения, применяется только при низкозлокачественных остеосаркомах, например, при хондросаркоме. Если же опухоль высокозлокачественная, помимо операции потребуется длительный курс химиотерапии, чтобы уничтожить возможные метастазы и предотвратить их возникновение.
Хирургическое лечение
Как мы уже говорили, операция является краеугольным камнем в лечении большинства видов остеосарком. Стандартом является радикальное иссечение опухоли в пределах здоровых тканей. С этой целью проводят вмешательства в следующих объемах:
- Ампутации — полное удаление пораженной конечности или фрагмента скелета.
- Экзартикуляция — вычленение пораженного сегмента по линии суставной щели. При этом опиливание костей не производится.
- Органосохраняющие вмешательства.
На сегодняшний день, по возможности, стараются провести органосохраняющее лечение, например, удаление пораженного фрагмента кости с последующей костной пластикой или эндопротезированием сустава. В качестве костной пластики используются либо синтетические материалы, либо собственные костные ткани пациента, взятые из другого отдела скелета. При лечении детей используют растущие эндопротезы.
К сожалению, органосохраняющее лечение удается провести не всегда. Противопоказанием к нему служат:
- Наличие патологических переломов с сильным болевым синдромом.
- Обширное вовлечение в процесс мягких тканей, в частности мышц.
- Распад опухоли.
- Вовлечение в процесс кровеносных сосудов и нервных стволов на большом протяжении.
- Кровотечение из вовлеченных кровеносных сосудов.
- Наличие инфекционных осложнений со стороны опухоли.
- Наличие массивного обсеменения злокачественными клетками костных тканей.
- Выраженные симптомы интоксикации.
При обнаружении одиночных метастазов, также проводят их хирургическое удаление. Если имеются одиночные очаги в легких, проводят торакотомию, однако во время операции требуется тщательная пальпация обоих легких, поскольку есть высокая вероятность обнаружения большего количества метастазов, чем те, которые были выявлены лучевыми методами диагностики.
Лучевая терапия
Некоторые остеосаркомы (саркома Юинга) являются радиочувствительными. При их лечении можно избежать операции и ограничиться облучением и химиотерапией. Но большинство костных опухолей резистентны к лучевому воздействию, поэтому данное лечение применяется только на распространенных стадиях для уменьшения болевого синдрома.
Химиотерапия
Химиотерапия имеет большое значение при лечении высокозлокачественных остеосарком. Ее назначают в неоадъювантных и адъювантных режимах, и у большинства пациентов продолжительность лечения может достигать 12 месяцев.
Неоадъювантная химиотерапия проводится в течение нескольких недель перед операцией. Ее целью является уменьшение размеров опухоли, создание условий для радикальной операции и определение индивидуальной химиочувствительности остеосаркомы. Последний момент является очень важным для определения прогноза заболевания.
Послеоперационная химиотерапия проводится в течение нескольких месяцев после удаления опухоли. Используются полихимиотерапевтические схемы, включающие в себя адриамицин, метотрексат в высоких дозах совместно с фолиевой кислотой, цисплатин и фосфамид. При выборе схемы послеоперационной ХТ основываются на ответе опухоли на неоадъювантную химиотерапию. Если ответ был неудовлетворительным, используют особые схемы лечения, которые называют постоперационной терапией спасения.
Осложнения
Остеосаркома может привести к развитию следующих осложнений:
- Патологические переломы — это переломы, которые возникают без воздействия травмирующего фактора. Дело в том, что остеосаркома приводит к нарушению остеогенеза, в месте локализации опухоли костная ткань не является достаточно прочной и не может выдержать обычную нагрузку, что приводит к образованию перелома от малейшего воздействия.
- При поражении ростовой пластинки трубчатых костей может нарушаться синхронный рост конечностей.
- При лечении заболевания может потребоваться обширная операция или ампутация конечностей, что приводит к инвалидизации пациента.
Прогноз при остеосаркомах
Прогноз заболевания будет зависеть от многих факторов, например:
- Место локализации опухоли. Наиболее неблагоприятно протекает остеосаркома, локализующаяся в области метафиза трубчатых костей, а, например, остеосаркома, которая располагается в области свода черепа, отличается более медленным течением и редко дает метастазы, даже если это высокозлокачественный тип опухоли.
- Размер первичного очага. Чем больше новообразование, тем хуже прогноз.
- Возраст и общее состояние пациента. Более благоприятно протекает остеосаркома у детей. Хуже обстоят дела у людей пожилого и старческого возраста ввиду изначально ослабленного здоровья и ограничений в проведении агрессивных курсов химиотерапии.
- Чувствительность новообразования к проводимому химиотерапевтическому лечению.
- Возможность проведения радикальной операции.
Раньше остеосаркома считалась агрессивной опухолью, и результаты ее лечения были неудовлетворительными даже после проведения обширных радикальных операций. Пятилетний рубеж переживало около 10% больных. На сегодняшний день с введением новых химиотерапевтических схем результаты лечения стали намного лучше. Пятилетняя выживаемость при локализованной опухоли составляет более 70%, а при хорошей химиочувствительности — 80%.
Профилактика
На сегодняшний день эффективных методов профилактики остеосаркомы нет, тем не менее может быть рекомендовано соблюдение общих принципов здорового питания и физической активности, борьба с вредными привычками.
Рак костного мозга
Костный мозг — это особый орган, главной функцией которого является кроветворение — создание новых клеток крови вместо погибающих. Он располагается внутри пластинчатых и губчатых костей. У взрослых людей в костном мозге содержится самое большое количество недифференцированных (незрелых) клеток (стволовых). Под влиянием факторов внутренней среды они могут развиваться в любой росток гемопоэза (кроветворения).
Такой термин, как «рак костного мозга» некорректен. Однако под ним пациенты, как правило, понимают злокачественную опухоль, которая произрастает из клеток костного мозга. Так как называется рак костного мозга правильно? Это целая группа заболеваний, у каждой есть свое название:
- Миелома — злокачественная опухоль, произрастающая из плазматических клеток (дифференцированных В-лимфоцитов).
- Лейкозы — злокачественные новообразования кроветворной системы. Это наиболее обширная и часто выявляемая группа заболеваний данной локализации.
- Лимфомы — злокачественные опухоли лимфатической ткани. Обычно лимфомы дебютируют с поражения лимфоузлов, но есть редкие случаи, когда первичные очаги обнаруживаются сразу в костном мозге. В основном же он поражается при 4 стадии лимфомы, когда опухоль покидает пределы лимфатической системы и начинает распространяться на внелимфатические органы и ткани.
Причины возникновения рака костного мозга
Чаще всего причинами развития так называемого рака костного мозга являются мутации в гемопоэтических стволовых клетках. Следует отметить, что мутации в человеческом организме возникают каждую секунду, но в норме есть много механизмов, которые исправляют ошибки, либо уничтожают поврежденные клетки. При раке эти механизмы нарушаются и злокачественно трансформированные клетки начинают активно делиться, колонизируя собою костный мозг и вытесняя здоровые клетки.
Чтобы развился рак, нужны особые обстоятельства, например, повторные мутации в уже мутировавших клетках, или нарушения иммунной защиты, которая вовремя не распознает патологию и пропускает ее.
Кто входит в группу риска
- Лица, ближайшие кровные родственники которых страдали миеломой, лейкозом или лимфомой.
- Больные первичными и вторичными иммунодефицитами.
- Лица, подвергавшиеся воздействию ионизирующего излучения (проходившие лучевую терапию, ликвидаторы последствий катастрофы на ЧАЭС) или химических канцерогенов.
- Лица, принимавшие или принимающие лекарственную противоопухолевую терапию.
- Наличие предрасполагающих заболеваний — мононуклеоз, моноклональная гаммапатия.
Симптомы рака костного мозга
Симптомы рака костного мозга определяются видом опухоли и ее патогенезом. Например, для миеломы характерны боли в костях. Сначала они носят мигрирующий характер и усиливаются при движении. Со временем симптоматика нарастает, боль становится нестерпимой и даже может полностью обездвижить больного.
Помимо этого, при раке костного мозга симптомы могут проявляться следующим образом:
- Из-за расплавления костной ткани в крови повышается уровень кальция, что приводит к развитию симптомов интоксикации, тошноты и рвоты, нарушения сознания вплоть до комы.
- Поражение почек.
- Синдром гипервязкости крови: кровотечения, нарушение зрения и сознания.
- Неврологические признаки рака костного мозга: парезы, параличи, онемение, боль. Развиваются при поражении позвонков и сдавлении корешков спинномозговых нервов.
При разных онкологических заболеваниях костного мозга симптомы могут различаться. Проявления лейкозов в основном связаны с вытеснением опухолевыми клетками нормальных ростков кроветворения, что приводит к развитию анемии, глубоким иммунодефицитам и кровотечениям. При развитии нейролейкемии наблюдаются менингеальные симптомы: головная боль, тошнота и рвота, ригидность затылочных мышц. На поздних стадиях рака костного мозга признаки включают увеличение лимфатических узлов, селезенки и печени.
Для диагностики рака костного мозга требуется комплексный подход. Первым моментом является сбор анамнеза с оценкой имеющихся жалоб и проведением физикального осмотра. Далее пациент направляется на обследование. Заподозрить миелому можно на основании рентгенограммы костей, лейкозов — по общему анализу крови.
Для подтверждения диагноза опухоли костного мозга требуется морфологическое исследование опухолевого субстрата. С этой целью проводят биопсию или пункцию костного мозга. Помимо этого, проводят дополнительные тесты, направленные на уточнение молекулярно-генетического профиля рака. Это необходимо для определения тактики лечения и выбора оптимального метода химиотерапии.
В подавляющем большинстве случаев так называемый рак костного мозга является системным заболеванием с большим объемом опухолевой массы, распространенной по всему организму. Поэтому для радикального лечения требуется системное воздействие на организм, что достигается с помощью химиотерапии, иммунотерапии и таргетной терапии.

Схема лечения будет определяться видом рака. Например, при лейкозах терапию проводят в несколько стадий:
- Индукция ремиссии. На этом этапе преследуется цель уничтожить как можно больше раковых клеток, поэтому используются мощные многокомпонентные схемы химиотерапии. При этом на организм оказывается токсическое действие с двух сторон — непосредственное воздействие химиотерапевтических препаратов плюс воздействие продуктов распада опухоли.
- Консолидация ремиссии. Индукционные препараты, какими мощными они бы не были, не могут за один курс уничтожить все раковые клетки, потому что часть из них находится в неактивном состоянии и «просыпается» по истечении какого-то времени, давая второе начало опухоли. Чтобы их уничтожить, проводится консолидационная терапия.
- Реиндукция ремиссии. Это повторение курса индукционной терапии с целью максимально полного уничтожения оставшихся раковых клеток.
- Поддерживающая терапия. Это последний этап. Его цель — уничтожение оставшихся злокачественных клеток. Для этого назначаются длительные курсы цитостатических препаратов в низких дозах.
При высокозлокачественных формах рака костного мозга (миеломы, агрессивные формы лейкозов, рецидивы заболевания) проводят мощную высокодозную химиотерапию, которая позволяет преодолеть резистентность опухоли. Однако она оказывает мощный уничтожительный эффект на костный мозг, оставляя больного фактически без кроветворения. Чтобы преодолеть это осложнение, проводят трансплантацию гемопоэтических стволовых клеток, которые в последующем послужат основой для восстановления кроветворения.
Стволовые клетки могут забираться у самого пациента на этапе консолидации ремиссии, или от донора. В последнем случае новый клон лейкоцитов будет оказывать противоопухолевое действие на возможные оставшиеся раковые клетки. Таким образом, лечебный эффект будет усиливаться. Однако аллогенные трансплантации могут приводить к развитию такого грозного осложнения, как реакция трансплантат против хозяина, которая в тяжелых случаях может привести к гибели реципиента.
Аллогенные трансплантации показаны далеко не всем пациентам. Их рекомендуют делать, например, при лечении миеломы. Некоторым таким пациентам показана двойная или тандемная трансплантация, при которой проводится две пересадки стволовых клеток.
Особенности болезни у беременных и пожилых
Рак костного мозга более неблагоприятно протекает у пожилых людей. Это связано с наличием сопутствующей патологии и наличием ограничений при применении высокодозной химиотерапии, которая потенциально могла бы привести к стойкой ремиссии. Например, при миеломе пациентам старше 65 лет двойная трансплантация стволовых клеток не проводится ввиду высоких рисков летальности.
Что касается беременности, то рекомендуется использовать надежную контрацепцию минимум в течение 2-х лет после достижения ремиссии. Если заболевание было впервые диагностировано на фоне беременности, то тактика выбирается индивидуально с учетом срока гестации и вида опухоли. Пациенткам в первом триместре беременности рекомендуется прерывание и незамедлительное начало химиотерапии. При вялотекущих формах лейкоза возможна выжидательная тактика. Начиная со второго триместра беременности, есть возможность проведения химиотерапевтического лечения препаратами, не оказывающими негативного влияния на плод. За несколько недель до родов терапию приостанавливают, чтобы костный мозг успел восстановиться. Метод родоразрешения избирается исходя из акушерской ситуации.
Если рак костного мозга диагностирован в конце третьего триместра, возможен вариант досрочного родоразрешения с последующим назначением полноценного курса химиотерапии.
При прогрессировании заболевания и неэффективности терапии происходит тотальное замещение костного мозга раковыми клетками. Это радикально угнетает кроветворение и приводит к тяжелым анемиям, иммунодефицитам, тромбоцитопениям с развитием кровотечений. Также для многих видов лейкозов и миеломы характерно нарастание болевого синдрома, который требует применения наркотических анальгетиков.
Рецидив
Вероятность развития рецидива зависит от вида рака. Например, большинство форм острого лейкоза хорошо поддаются терапии и дают высокую вероятность полного излечения. Хронические лейкозы склонны к медленному течению, но очень сложно поддаются излечению. Миелома также относится к неизлечимым формам рака костного мозга. Время до рецидива при применении стандартной терапии составляет около 29 месяцев, а при тандемной трансплантации — около 42 месяцев.
При развитии рецидива тактика лечения определяется в зависимости от периода безрецидивной выживаемости. Как правило, если прошло более 6-12 месяцев, можно использовать схемы химиотерапии первой линии. При меньших сроках тактику меняют и назначают препараты второй и последующих линий терапии, к которым рак еще не выработал устойчивость.
Прогноз и профилактика рака костного мозга
Прогноз при раке костного мозга определяется видом опухоли. Например, при острых лейкозах пятилетняя безрецидивная выживаемость колеблется в пределах 80%. При этом, чем больше времени прошло от начала ремиссии, тем вероятнее, что болезнь отступила полностью. Но в любой момент может развиться рецидив — возврат заболевания, который потребует повторного лечения. У некоторых больных таких рецидивов может быть несколько, при этом с каждым разом добиться ремиссии сложнее, но это не значит, что невозможно. У ряда пациентов даже после нескольких рецидивов можно добиться выздоровления.
Что касается хронических лейкозов, то они очень сложно поддаются излечению, но протекают длительное время с периодами обострения и затухания. Учитывая то, что в большинстве случаев они развиваются у людей старшего возраста, радикальное лечение может быть противопоказано ввиду наличия сопутствующей патологии. В этих случаях назначают поддерживающую терапию.
Миелома также относится к неизлечимым патологиям. Даже при успешном ответе на двойную пересадку стволовых клеток вероятность развития рецидива в ближайшие 3-4 года остается очень высокой.
На вопрос о том, сколько живут при раке костного мозга, нельзя дать однозначного ответа, и уж тем более не стоит применять к отдельно взятому пациенту общую статистику. О прогнозе может судить только лечащий врач. Он расскажет, сколько живут с раком костного мозга при конкретном диагнозе, стадии и особенностях течения, какой результат ожидается от лечения.
Методов профилактики рака костного мозга на сегодняшний день нет. Единственное что можно рекомендовать, это защиту от воздействия канцерогенных факторов и по возможности предотвращение развития приобретенных иммунодефицитов. Пациентам, находящимся в группе риска, необходимо не пренебрегать ежегодной диспансеризацией.
Читайте также:
- Потери тепла. Кровоток кожи в регуляции теплообмена
- Преимущества внебольничной психиатрической помощи. Внебольничная медицина Фрайерна и Клейбери
- Хронический тонзиллит: лечение, симптомы, причины, диагностика
- Протоковый рак молочной железы: симптомы и прогноз, инфильтрирующая протоковая карцинома, диагностика и лечение
- Факторы влияющие на функциональные шумы сердца. Функциональные шумы сердца беременных
