Высвобождение энергии из глюкозы через пентозофосфатный цикл. Превращение глюкозы в жиры
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
Пентозофосфатный путь - альтернативный путь окисления глюкозы. Его функции:
- поставляет клеткам кофермент НАДФН, использующийся как донор водорода в реакциях восстановления;
- обеспечивает клетки пентозофосфатами для синтеза нуклеотидов и нуклеиновых кислот.
Пентозофосфатный путь не приводит к синтезу АТФ.
Ферменты пути локализованы в цитозоле.
Пентозофосфатный путь образования пентоз протекает в печени, жировой ткани, молочной железе, коре надпочечников, эритроцитах.
В пентозофосфатном пути превращения глюкозы выделяют окислительный и неокислительный пути образования пентоз.
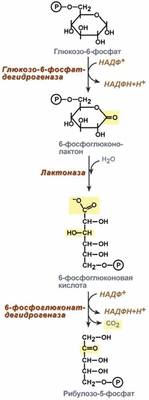
Окислительный путь включает две реакции дегидрирования. Коферментом дегидрогеназ является НАДФ + , восстанавливающийся в НАДФН. Пентозы образуются при окислительном декарбоксилировании.
Неокислительный путь включает реакции переноса 2- и 3-х углеродных фрагментов с одной молекулы на другую. Этот путь служит для синтеза пентоз. Процесс обратим, и из пентоз могут образовываться гексозы.
1). Дегидрирование глюкозо-6-фосфата при участии глюкозо-6-фос-фатдегидрогеназы и кофермента НАДФ + с образованием 6-фосфоглюконо-d-лактона и НАДФН:
2). 6-фосфоглюконо-d-лактон нестабилен и гидролизуется с образованием 6-фосфоглюконата (фермент - 6-фосфоглюконолактоназа):
3). Дегидрирование и декарбоксилирование 6-фосфоглюконата с образованием рибулозо-5-фосфата (пентоза) и НАДФН при участии декарбоксилирующей 6-фосфоглюконатдегидрогеназы:
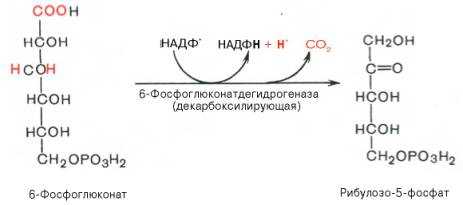
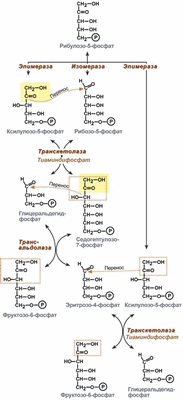
4). Под действием эпимеразы из рибулозо-5-фосфата образуется ксилулозо-5-фосфат (пентоза). Под влиянием изомеразы рибулозо-5-фосфат превращается в рибозо-5-фосфат (пентоза). Между формами пентозофосфатов устанавливается равновесие:
На этом этапе пентозофосфатный путь может быть завершен.
При определенных условиях наступает неокислительная стадия пентозофосфатного цикла, протекающая анаэробно: образуются вещества, характерные для гликолиза (фруктозо-6-фосфат, фруктозо-1,6-бисфосфат, фосфотриозы), и вещества, специфические для пентозофосфатного пути (седогептулозо-7-фосфат, пентозо-5-фосфаты, эритрозо-4-фосфат).
5). Транскетолазная реакция взаимодействия ксилулозо-5-фосфата и рибозо-5-фосфата (кофермент - тиаминпирофосфат, переносит гликоальдегидную группу от ксилулозо-5-фосфата к рибозо-5-фосфату):
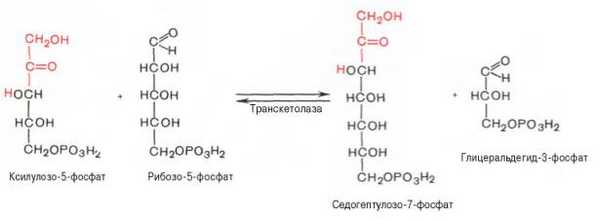
6). Транскетолазная реакция взаимодействия ксилулозо-5-фосфата и эритрозо-4-фосфата:
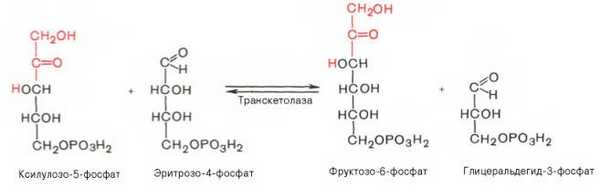
7). Трансальдолазная реакция - трансальдолаза катализирует перенос остатка диоксиацетона от седогептулозы-7-фосфата на глицеральдегид-3-фосфат:
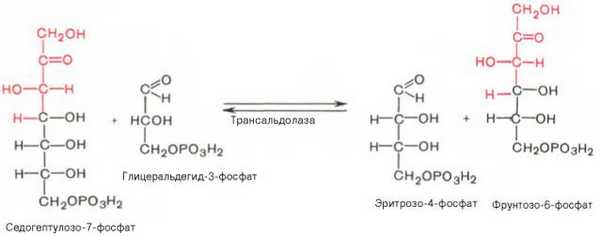
Шесть молекул глюкозо-6-фосфата в пентозофосфатном цикле образуют 6 молекул рибулозо-5-фосфата и 6 молекул СО2. Из 6 молекул рибулозо-5-фосфата регенерируется 5 молекул глюкозо-6-фосфата:
6Глюкозо-6-фосфат + 7Н2О + 12НАДФ + ®
® 5Глюкозо-6-фосфат + 6СО2 + Pi + 12НАДФН + 12Н + .
Промежуточные продукты цикла (фруктозо-6-фосфат и глицеральдегид-3-фосфат) включаются в гликолиз.
Пентозофосфатный путь окисления глюкозы.
В клетках растений наряду с гликолизом и циклом Кребса, являющимся главным поставщиком свободной энергии в процессах дыхания, существует и другой важнейший способ катаболизма гексоз — пентозофосфатный путь (ПФП), в котором участвуют пятиуглеродные сахара (пентозы). Окисление глюкозы (глюкозо-6-фосфата) по этому пути связано с отщеплением первого (альдегидного) атома углерода в виде С02.
Все реакции ПФП протекают в растворимой части цитоплазмы клеток, а также в пропластидах и хлоропластах. ПФП дыхания особенно активен в тех клетках и тканях растений, в которых интенсивно идут синтетические процессы, такие, как синтез липидных компонентов мембран, нуклеиновых кислот, клеточных стенок, фенольных соединений.
В ПФП АТР используется только для образования исходного продукта: для фосфорилирования глюкозы до глюкозо-6-фосфата; ни в одной реакции этого цикла АТР не образуется. ПФП, как и цикл Кребса, — циклический процесс, поскольку окисление глюкозы сопровождается регенерацией исходного субстрата ПФП — глюкозо-6-фосфата.
Этапы пентозофосфатного пути окисления глюкозы. В ПФП можно выделить два этапа:
1) окисление глюкозы,
2) рекомбинацию сахаров для регенерации исходного субстрата.
Для каждого оборота цикла суммарное уравнение ПФП имеет следующий вид:
6Глюкозо-6-фосфат + 12NADP+ + 7Н20 ->-> 5Глюкозо-6-фосфат + 6С02 + 12NADPH + 12Н + + Н3Р04
Энергетический выход ПФП и его роль в обмене веществ.
36 АТР, что составляет 41,868 кДж х х 36 = 1507 кДж/моль. Практически это не уступает энергетическому выходу дихотомического пути дыхания (гликолиз и цикл Кребса), в котором образуется 1591 кДж/моль (38 АТР).
Однако основное назначение ПФП состоит в участии не столько в энергетическом, сколько в пластическом обмене клеток.
Это участие в пластическом обмене включает несколько аспектов:
1. NADPH используется главным образом в различных синтетических реакциях. ПФП служит основным внемитохондриальным и внехлоропластным источником NADPH, который необходим для синтеза жирных кислот, жиров, изопреноидов, для восстановительного карбоксилирования пирувата, восстановления нитрата и сульфата и т. д.
2. В ходе пентозофосфатного цикла синтезируются пентозы, входящие в состав нуклеиновых кислот и различных нуклеотидов (пиридиновых, флавиновых, адениловых и др.).
3. ПФП имеет большое значение как источник образования углеводов с различным числом углеродных атомов в цепи (от С3 до С7).— предшественника многих ароматических соединений, таких, как ароматические аминокислоты, витамины, дубильные и ростовые вещества, лигнин клеточных стенок и др.
4. Компоненты ПФП (рибулозо-1,5-дифосфат, NADPH) принимают участие в темновой фиксации С02.
5. В хлоропластах окислительный ПФП функционирует в темноте, предотвращая резкое изменение концентрации NADPH в отсутствие света.
Окисление глюкозы по ПФП осуществляется в результате 12 реакций, тогда как в дихотомический (гликолитический) путь через ПВК и далее через цикл ди- и трикарбоновых кислот включаются более 30 различных реакций.
Фиксация молекулярного азота.
Химический и биологический пути связывания молекулярного азота.
В природе существуют два пути превращения NО2 в доступную растениям форму. Это химическая и биологическая азотфиксация.
Химическое связывание N2 в форме ионов NH4+ или NO3- небольших размерах осуществляется в результате фотохимических процессов и электрических разрядов в атмоcaepe.
В настоящее время в ряде стран больших масштабов достигло промышленное производство HNO3 и NH3 из азота воздуха. Химическое связывание молекулярного азота с образованием аммиака (N2 + ЗН2 ---> 2NH3) осуществляется в присутствии катализаторов при температуре свыше 500°, давлении около 35 МПа и составляет основу синтеза аммонийных удобрений.
Микроорганизмы, осуществляющие биологическую азотфиксацию, можно разделить на две основные группы: а) свободноживущие азотфиксаторы Clostridium pasteurianum, Clostridium pasteurianum и б) микроорганизмы, живущие в симбиозе с высшими растениями - ризобиум образующие клубеньки на корнях бобовых растений, а также некоторые актиномицеты и цианобактерии..
Инфицирование растения-хозяина начинается с проникновег ния бактерий рода Rhizobium в клетку корневого волоска. Затем бактерии мигрируют в клетки коры и вызывают интенсивное деление инфицированных клеток, что приводит к образованию клубеньков на корнях. При этом сами бактерии превращаются в бактероиды, которые в среднем в 40 раз больше по объему, чем исходная бактерия. Образование бактероидов тесно связано с синтезом нитрогеназной ферментативной системы.
Молекулярный механизм азотфиксации.
Молекула азота N2(N = N) чрезвычайно прочна и химически инертна. Биологическая фиксация N2 микроорганизмами осуществляется при нормальной температуре и давлении, что свидетельствует об исключительно высокой эффективности участвующего в этом процессе фермента нитрогеназы,
Азотфиксация представляет собой восстановительный процесс и первым стабильным продуктом ее действительно является аммиак.
Процессу азотфиксации необходим постоянный приток электронов и энергии в форме АТР. Источником электронов и АТР для функционирования нитрогеназы у разных типов микроорганизмов могут быть процессы фотосинтеза, дыхания или брожения. Симбиотрофные бактерии рода Rhizobium в качестве источников электронов и АТР используют фотоассимиляты, синтезирующиеся в листьях растения-хозяина и поступающие в корневые клубеньки.
Процесс протекает в бактероиде, окруженном мембраной и локализованном в кортикальных клетках корня растения-хозяина. Основная роль в процессе азотфиксации принадлежит ферменту нитрогеназы. Нитрогеназа катализирует три типа сопряженных реакций: восстановление субстратов, зависимый от восстановителя гидролиз АТР и АТР-зависимое выделение Н2.
Поскольку нитрогеназа разрушается в присутствии 02, у азотфиксирующих микроорганизмов используется ряд механизмов для ее защиты.
Функционирующий в бактероиде цикл Кребса служит источником субстратов для окисления в электронтранспортной цепи, осуществляющей синтез АТР; обеспечивает нитрогеназу электронами через ферредоксин; поставляет кетокцслоты (а-кетоглутарат и др.), которые, реагируя с образуют аминокислоты, транспортируемые затем в клетки растения-хозяина.
Глиоксилатный цикл.
Глиоксилатный цикл можно рассматривать как модификацию цикла Кребса. Он активно функционирует в прорастающих семенах масличных растений и в других растительных объектах, где запасные жиры превращаются в сахара (глюконеогенез).
Глиоксилатный цикл локализован в специализированных микротелах — глиоксисомах. В отличие от цикла Кребса в глиоксилатном цикле в каждом обороте участвует не одна, а две молекулы ацетил-СоА и используется для синтеза янтарной кислоты. Янтарная кислота выходит из глиоксисом, превращается в ЩУК и участвует в глюконеогенезе (обращенном гликолизе) и других процессах биосинтеза.
Глиоксилатный цикл позволяет утилизировать запасные жиры, при распаде которых образуются молекулы ацетил-СоА. Кроме того, на каждые две молекулы ацетил-СоА в глиоксилатном цикле восстанавливается одна молекула NADH, энергия которой может быть использована на синтез АТР в митохондриях или на другие процессы.
18. Цикл ди - и трикарбоновых кислот (цикл Кребса).
В анаэробных условиях пировиноградная кислота (пируват) подвергается дальнейшим превращениям в ходе спиртового, молочнокислого и других видов брожений, при этом NADH используется для восстановления конечных продуктов брожения, регенерируя в окисленную форму.
Последнее обстоятельство поддерживает процесс гликолиза, для которого необходим окисленный NAD+. В присутствии достаточного количества кислорода пируват полностью окисляется до С02 и Н20 в дыхательном цикле, получившем название цикла Кребса.
Все участки этого процесса локализованы в матриксе или во внутренней мембране митохондрий.
Непосредственно в цикле окисляется не сам пируват, а его производное — ацетил-СоА.
На протяжении одного оборота цикла при окислении пирувата происходит выделение трех молекул С02, включение трех молекул Н20 и удаление пяти пар атомов водорода.
Энергетический выход цикла Кребса, его связь с азотным обменом.
Цикл Кребса играет чрезвычайно важную роль в обмене веществ растительного организма. Он служит конечным этапом окисления не только углеводов, но также белков, жиров и других соединений. В ходе реакций цикла освобождается основное количество энергии.
При окислении одной молекулы пирувата может образоваться 15 молекул АТР + 8АТФ гликолиз = 38 АТФ = 1591 кДж/моль (380 ккал/моль).
Значение цикла Кребса не исчерпывается его вкладом в энергетический обмен клетки. Не менее важную роль играет то обстоятельство, что многие промежуточные продукты цикла используются при синтезе различных соединений. азотном обмене, синтезе и распаде белковых веществ, образуются аминокислоты. Для синтеза липидов, полиизопренов, углеводов и ряда других соединений используется ацетил-СоА. Особенно важно, что через реакции цикла Кребса устанавливается тесная связь между обменом трех важнейших групп соединений — белков, жиров и углеводов.
Вопрос.
Гликолиз.
Гликолиз — процесс анаэробного распада глюкозы, идущий с освобождением энергии, конечным продуктом которого является пировиноградная кислота.
Гликолиз — общий начальный этап аэробного дыхания и всех видов брожения. Реакции гликолиза протекают в растворимой части цитоплазмы (цитозоле) и в хлоропластах.
Этапы гликолиза, фосфорилирование на уровне субстрата.
Цепь реакций, составляющих суть гликолиза, можно разбить на три этапа:
I. Подготовительный этап — фосфорилирование гексозы и ее расщепление на две фосфотриозы.
II. Первое субстратное фосфорилирование, которое начинается с 3-фосфоглицеринового альдегида и кончается 3-фосфоглицериновой кислотой. Окисление альдегида до кислоты связано с освобождением энергии. В этом процессе на каждую фосфотриозу синтезируется одна молекула АТР.
III. Второе субстратное фосфорилирование, при котором 3-фосфоглицериновая кислота за счет внутримолекулярного окисления отдает фосфат с образованием АТР. Пируват 2 молекулы— конечный продукт гликолиза.
Энергетический выход гликолиза.
Всего в процессе гликолиза образуются 8 молекул АТР (335 кДж/моль, или 80 ккал).
Функции гликолиза в клетке.
В аэробных условиях гликолиз выполняет ряд функций:
1) осуществляет связь между дыхательными субстратами и циклом Кребса;
2) служит основным источником АТР в клетке;
3) производит интермедиаты, необходимые для синтетических процессов в клетке;
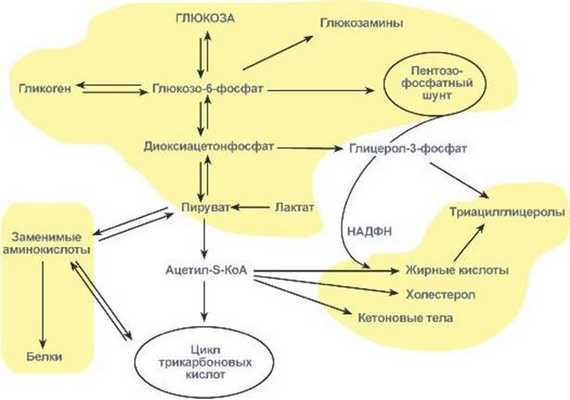
Превращение глюкозы в клетках
Энергетика любой клетки нашего организма основана на окислении глюкозы. Окисление глюкозы происходит по двум направлениям:
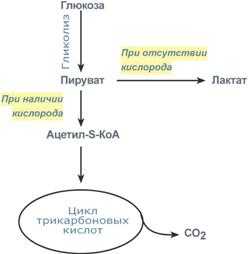 Пути метаболизма пирувата в присут- ствии и в отсутствии кислорода |
1. Окисление с образованием пентоз: рибозы, рибулозы, ксилулозы. Этот путь называется пентозофосфатный шунт и не связан с получением энергии
2. Окисление с получением энергии.
Второй путь, т.е. тот по которому глюкоза окисляется для получения энергии, называется гликолиз(греч. glykos — сладкий и греч. lysis — растворение). Конечным продуктом гликолиза является пировиноградная кислота (пируват).
В зависимости от дальнейшей судьбы пирувата различают аэробноеи анаэробноеокисление глюкозы. Целью обоих типов окисления является получение АТФ.
В аэробном процессе пировиноградная кислота превращается в ацетил-SКоА (реакции ПВК-дегидрогеназы) и далее окисляется в митохондриях в цикле трикарбоновых кислот до углекислого газа и воды с накоплением энергии в виде АТФ. Кроме того, промежуточные продукты гликолиза являются материалом для синтеза многих важных соединений и используются организмом как еще один источник материала для процессов ассимиляции.
Общее уравнение аэробного окисления глюкозы:
В анаэробных условиях гликолиза из каждой молекулы расщепившейся глюкозы образуются 2 молекулы аденозинтрифосфата (АТФ) и 2 молекулы молочной кислоты.
У большинства позвоночных, в том числе и у человека, анаэробный гликолиз встречается только на короткое время при напряженной работе мышц, например, при беге на 100м, т.е. когда кислород не успевает достаточно быстро поступать в ткани и не успевает обеспечить окисление пирувата и сопряженный с ним синтез АТФ. В крови при этом накапливается лактат, который позднее в печени превратится обратно в глюкозу (цикл Кори). Бескислородное окисление глюкозы усиливается при гипоксииклеток при анемиях, нарушении кровообращения в тканях.
Суммарное уравнение анаэробного гликолиза:
Процесс гликолиза катализируется одиннадцатью ферментами, гликолиз протекает в гиалоплазме (цитозоле) клетки.
Гликолиз включает 2 стадии: 1 - подготовительная, 2 -«выплата процентов», т.е.
1 стадия - фосфорилирование глюкозы и ее превращение в глицеральдегид-3-фосфат с использованием 2 молекул АТФ (1 - 5 реакции)
1 этап. Активирование глюкозы с образованием фруктозо-1,6-бифосфата.
2 этап. Дихотомический распад активированной гексозы (фруктозы-1,6-бифосфата) пополам с образованием 2 триоз.
2 стадия - превращение глицеральдегид-3-фосфата в лактат и сопряженное образование 4х молекул АТФ (6 - 11 реакции).
3 этап. Окисление и фосфорилирование триоз, синтез 2 АТФ путем первого субстратного фосфорилирования
4 этап. Внутримолекулярное окисление фосфоглицерата (енолазная реакция), возникновение макроергической связи (фосфоенолпируват), синтез 2 АТФ путем второго субстратного фосфорилирования
Параграф 53. превращение углеводов в жиры и нуклео
ПАРАГРАФ 53.
Превращение углеводов в жиры и нуклеотиды.
Если Вы знаете параграфы 32-48 и 67, то здесь легко.
53. 1. Превращение углеводов в жиры.
Глюкоза превращается в жиры легко и полностью.
Поэтому все продукты, которые при переваривании образуют глюкозу, могут превращаться в жир и приводит к накоплению лишнего жира:
сахарозные сладости, крахмалосодержащие овощи (картофель), злаки, каши, мучное.
А при желании избавиться от лишнего веса (п.44 3) целесообразно умерить употребление названных продуктов.
Такой углевод пищи, как целлюлоза, глюкозы при переваривании не даёт, и поэтому в жир не превращается.
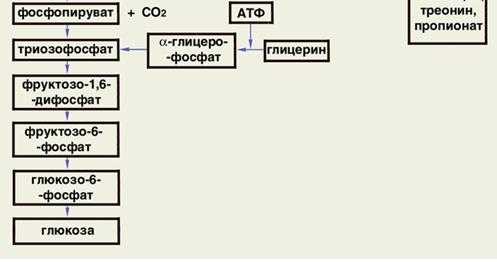
Этапы превращения глюкозы в жир:
1 - глюкоза при гликолизе превращается в пируват,
2 - пируват под действием ПДГ превращается в ацетилКоА,
3 - ацетилКоА при реакциях синтеза жирных кислот в печени превращается в жирную кислоту (пальмитиновую),
4 - жирные кислоты активируются, превращаясь в ацилКОА,
5 - активные формы жирных кислот (ацилКоА) и активная форма глицерина при реакциях синтеза жира превращаются в жир.
Схема: глюкоза ; пируват ; ацетилКоА ; жирные кислоты ; ацилКоА ; жир.
Активная форма глицерина - это 3-фосфоглицерин (3-фосфоглицерол, 3-глицерофосфат, ;-глицерофосфата).
3-фосфоглицерин может образоваться из глюкозы и из глицерина (п.44).
При получении 3-фосфоглицерина из глюкозы:
глюкоза сначала в ходе реакций превращается в ДОАФ (дигидроксиацетонфосфат),
затем ДОАФ восстанавливается до 3-фосфоглицерина.
Эти реакции характерны для жировой ткани.
При получении из глицерина фосфат переносится на глицерин от АТФ глицерокиназой. Характерно для печени.
В печень глицерин поступает с током крови, в которую поступает при расщеплении жиров в липопротеинах (ЛПОНП, хиеломикронах) и жировой ткани.
Схема: глюкоза ; ДОФА ; 3-фосфоглицерин ; жир.
Или глицерин ; 3-фосфоглицерин ; жир.
Значение превращения глюкозы в жиры:
оно позволяет организму избавиться от лишней глюкозы
и избежать последствий гипер/гликемии.
А также - превратить глюкозу в вещество, которое может дать много энергии при голоде или работе (жир).
Превращение глюкозы в жир происходит, когда глюкозы много - то есть при сытости.
Если есть гормон, стимулирующиё реакции превращения глюкозы в жир - ИНСУЛИН.
Добавка - для синтеза жирных кислот нужен НАДФН - он тоже образуется за счёт глюкозы в пентозофосфатном пути (п.35):
Глюкоза ; НАДФН ; жирные кислоты ; ацилКоА ; жир.
Все схемы можете свести в одну.
Глюкоза используется также для образования и углеводных компонентов ГЛИКОЛИПИДОВ - п.52.
Углеводные компоненты гликолипидов образуются из моносахаридов, которые образуются из глюкозы.
53. 2. ПРЕВРАЩЕНИЕ ЖИРОВ В УГЛЕВОДЫ
начинается с расщепления жира на глицерин и жирные кислоты (то есть с липолиза).
Жирные кислоты превращаться в глюкозу не могут.
Глицерин превращается в глюкозу так:
1 - к нему присоединяется фосфат путём переноса от АТФ, образуя 3-фосфоглицерин,
2 - от 3-фосфоглицерина отщепляются 2 атома водорода, превращая его в ДОАФ,
3 - ДОАФ в ходе реакций глюконеогенеза превращается в глюкозу.
Таким образом, из примерно 50 атомов молекулы жира только 3 могут использоваться для синтеза глюкозы. Это очень мало. Поэтому при голоде для синтеза глюкозы организму приходится разрушать белки (см. гликогенные аминокислоты п.67).
Схема: жир ; глицерин ; 3-фосфоглицерин ; ДОАФ ; глюкоза.
53. 3. Взаимосвязь обмена углеводов С ОБМЕНОМ НУКЛЕОТИДОВ.
Нуклеотиды в углеводы НЕ превращаются.
ПРЕВРАЩЕНИЕ УГЛЕВОДОВ В НУКЛЕОТИДЫ.
Из глюкозы для нуклеотидов образуется РИБОЗО-5-ФОСФАТ,
к которому остаётся присоединить азотистое основание, чтобы получился нуклеотид.
Процесс, в котором происходит превращение глюкозы в риозо-5-фосфат, называется пентозофосфатным путём.
Для его протекания тоже нужно влияние инсулина. А также витамины РР и В1.
Основное количество нуклеотидов используется для синтеза из них полимеров - нуклеиновых кислот ДНК и РНК.
Их синтез необходим ДЛЯ ПРОЛИФЕРАЦИИ (деления клеток).
Кроме этого, синтез РНК нужен и в неделящихся клетках для синтеза белка (рецепторов, миозина, ферментов и т.д.).
Превращение рибозы в дезоксирибозу происходит уже в составе нуклеотидов (см. п.72),
с использованием НАДФН, который тоже образуется в ПФП за счёт глюкозы.
Схема: глюкоза ; рибозо-5-фосфат и НАДФН ; нуклеотиды ; ДНК и РНК.
Общая схема (см. п.53 и 54) краткая:
(«взаимно» - только с аминокислотами)
РНК и ДНК; Нуклеотиды ; Глюкоза ; аминокислоты ; белки
;
Жир
глюкоза (в ПФП) ; рибозо-5-фосфат и НАДФН ; нуклеотиды ; ДНК и РНК.
глюкоза (гликолиз) ; пируват (ПДГ); ацетилКоА ; жирные кислоты ; ацилКоА ; жир.
глюкоза (гликолиз) ; ДОАФ ; 3-фосфоглицерин ; жир
жир (липолиз) ; глицерин ; 3-фосфоглицерин ; ДОАФ ; (ГНГ) глюкоза.
Схема превращения глюкозы в жиры
Основная роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы в крови. Это достигается регуляцией между синтезом и распадом гликогена, депонируемого в печени.
Влияние инсулина, глюкагона и адреналина на обмен жиров и углеводов.
Основное действие инсулина заключается в снижении концентрации глюкозы в крови. Инсулин увеличивает проницаемость плазматических мембран для глюкозы, активирует ключевые ферменты гликолиза, стимулирует образование в печени и мышцах из глюкозы гликогена, усиливает синтез жиров и белков
Механизм действия глюкагона обусловлен его связыванием со специфическими глюкагоновыми рецепторами клеток печени. Это приводит к повышению опосредованной G-белком активности аденилатциклазы и увеличению образования цАМФ. Результатом является усиление катаболизма депонированного в печени гликогена (гликогенолиза)
Адреналин — катаболический гормон и влияет практически на все виды обмена веществ. Под его влиянием происходит повышение содержания глюкозы в крови и усиление тканевого обмена. Будучи контринсулярным гормоном и воздействуя на β2 адренорецепторы тканей и печени, адреналин усиливает глюконеогенез и гликогенолиз, тормозит синтез гликогена в печени и скелетных мышцах, усиливает захват и утилизацию глюкозы тканями, повышая активность гликолитических ферментов. Также адреналин усиливает липолиз (распад жиров) и тормозит синтез жиров
Роль пентозофосфатного пути обмена глюкозы для синтеза жиров
Глицеральдегид-3-фосфат в зависимости от условий и вида клеток может либо "проваливаться" во 2-й этап гликолиза либо через диоксиацетонфосфат восстанавливаться до глицерол-3-фосфата и далее направлятьяся в синтез триацилглицеролов.
Зависимость скорости биосинтеза жиров от ритма питания и состава пищи
После приема пищи концентрация хиломикронов в крови повышается, достигает максимума примерно через 5 ч, затем начинает снижаться.
Если во время приема пищи в печень поступает избыток глюкозы, который не используется для синтеза гликогена и других синтезов, то она превращается в липиды
Регуляция обмена жиров тесно сопряжена с регуляцией обмена глюкозы. Как и в случае обмена глюкозы, в регуляции обмена жиров важную роль играют гормоны инсулин, глюкагон, адреналин и процессы переключения фосфорилирования-дефосфори-лирования белков.
Напомним, что в печени после приема пищи ускоряется аэробный гликолиз и образование ацетил-КоА и оксалоацетата, а из них — цитрата (рис. 10.22; см. также рис. 10.5). Повышение концентрации цитрата активирует цикл переноса ацетильных остатков в цитозоль. В цитозоле в результате активации ацетил-КоА-карбоксилазы путем дефосфорилирования (см. рис. 10.10) ускоряется синтез жирных кислот. Одновременно стимулируется образование НАДФН в результате реакции малат -» пируват, а также в результате активации пентозофосфатного пути (инсулин индуцирует синтез глюкозо-6-фосфатдегидрогеназы). Жирные кислоты и глицерол-3-фосфат, образующийся тоже из глюкозы, превращаются в жиры, которые в печени упаковываются в ЛОНП и секретируются в кровь, а в жировой ткани пополняют запасы жира в адипоцитах. Таким образом в печени и в жировой ткани при пищеварении одновременно активируются гликолиз и синтез жиров из глюкозы. Перенос ацил-КоА в митохондрии не происходит вследствие высокой концентрации малонил-КоА, который ингибирует карни-тин-ацилтрансферазу (см. рис. 10.22); следовательно, не происходит и [3-окис-ление жирных кислот.
Механизмов, способных осуществлять синтез глюкозы из жирных кислот, у животных нет, но у растений такие механизмы имеются.
Синтез происходит только из глицерина.
Строение кетоновых тел
Кетоацидозразвивается при уменьшении концентрации инсулина крови, существенном недостатке углеводов в пище при достаточном или избыточном потреблении белков и жиров, при отравлении алкоголем, при голодании.
Механизм развития кетоацидоза состоит в избыточном окислении жирных кислот, поступающих в печень с пищей или из жировой ткани (активация липолиза) либо недостаточно эффективное сжигание "алкогольного" ацетил-SКоА.
Кетонемия (повышение концентрации кетоновых тел в крови) возникает при нарушении равновесия — скорость синтеза кетоновых тел превышает скорость их утилизации периферическими тканями организма.
Кетонурия Повышенное выведение кетоновых тел с мочой; наблюдается при сахарном диабете, отравлениях ацетоном, голодании
Диабетический кетоацидоз (ДКА) обусловливается резкой недостаточностью регуляторного действия инсулина на обмен глюкозы и жира. При ДКА к эффектам высокой гипергликемии добавляются последствия увеличения печеночного синтеза и поступления в кровь кетоновых тел, так что количество их намного превышает потребность периферических тканей в энергии. Основные кетоновые тела - ацетоуксусная и Р-гидроксимасляная кислоты - являются сильными органическими кислотами; гиперкетонемия вызывает метаболический ацидоз с последующей дыхательной компенсацией, а резкое повышение экскреции с мочой ацетоуксусной и бета-гидроксимасляной кислот неизбежно приводит к дополнительным потерям Na и К.. В результате спонтанного декарбоксилирования ацетоуксусной кислоты в плазме накапливается ацетон, который медленно выводится из организма через дыхательные пути.
Уровень свободных жирных кислот в плазме и их поступление в печень резко увеличиваются. В норме инсулин регулирует окисление свободных жирных кислот и кетогенез в печени за счет непрямого торможения транспорта КоА-производных длинноцепочечных жирных кислот через внутреннюю мембрану митохондрий в их матрикс. Эти производные, попав в митохондриальный матрикс, быстро окисляются, а повышение скорости их окисления в печени сверх определенного предела автоматически приводит к увеличению и высвобождению ацетоуксусной кислоты; большая, но непостоянная часть последней перед выходом в плазму восстанавливается до бета-гидроксимасляной кислоты. Глюкагон стимулирует транспорт ацил-КоА-производных длинноцепочечных жирных кислот и их окисление и кетогенез в митохондриях печени, а нормальный противодействующий эффект инсулина при ДКА отсутствует. Соотношение p-гидроксимасляной и ацетоуксусной кислот, в норме составляющее 3:1, при ДКА резко возрастает, достигая иногда 8:1.
Читайте также:
