Значение нейтрофилов. Механизмы фагоцитоза
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
Фагоцитоз и система комплемента- вторая линия защиты организма против микроорганизмов, преодолевших поверхностные барьеры. Клеточные факторы системы видовой резистентности- фагоциты, поглощающие и разрушающие патогенные микроорганизмы и другой генетически чужеродный материал. Представлены полиморфоядерными лейкоцитами или гранулоцитами- нейтрофилами, эозинофилами и базофилами (клетками миелопоэтического ряда), а также моноцитами и тканевыми макрофагами (клетками макрофагально- моноцитарной системы).
Значение фагоцитирующих клеток для защиты организма впервые доказал И.И.Мечников, разработавший фагоцитарную теорию иммунитета.
Процесс фагоцитоза (поглощения твердофазного объекта) состоит из пяти стадий.
1.Активация (усиление энергетического метаболизма). Факторами активации и хемотаксиса являются бактериальные продукды (ЛПС, пептиды), компоненты комплемента (С3 и С5), цитокины и антитела.
Адгезия связана с наличием ряда рецепторов на поверхности фагоцитов ( к Fc- фрагментам антител, компонентам комплемента, фибронектину), обеспечивающих прочность рецептор- опосредованных взаимодействий опсонинов, обволакивающих микроорганизмы и ограничивающих их подвижность (антитела, С3в, фибронектин).
Фагоциты обладают амебоподобными псевдоподиями. При поглощении образуется фагосома с поглощенным объектом (бактерией), к ней присоединяется и сливается содержащая литические ферменты лизосома, образуется фаголизосома.
Возможно три исхода фагоцитоза:
Завершенный фагоцитоз- полное переваривание микроорганизмов в клетке- фагоците.
Незавершенный фагоцитоз- выживание и даже размножение микроорганизмов в фагоците. Это характерно для факультативных и особенно - облигатных внутриклеточных паразитов. Механизмы персистирования в фагоцитах связаны с блокадой фагосомо- лизосомального слияния (вирус гриппа, микобактерии, токсоплазмы), резистентностью к действию лизосомальных ферментов (гонококки, стафилококки), способностью микробов быстро покидать фагосомы после поглощения и длительно пребывать в цитоплазме (риккетсии).
В процессе фагоцитоза происходит “окислительный взрыв” с образованием активных форм кислорода, что обеспечивает бактерицидный эффект.
К одной из важнейших функций макрофагов (наряду с хемотаксисом, фагоцитозом, секрецией биологически активных веществ) является переработка (процессинг) антигена и представление его иммунокомпетентным клеткам с участием белков главной системы гистосовместимости (МНС) класса 2.
Гуморальные факторы врожденного иммунитета: комплемент, лизоцим, пропердин, бета-лизины, противовирусные ингибиторы, интерферон, их биологические свойства, механизм действия, методы выявления.
Врожденный, иди видовой, иммунитет, он же наследственный, генетический, конституциональный — это выработанная в процессе филогенеза генетически закрепленная, передающаяся по наследству невосприимчивость данного вида и его индивидов к какому-либо антигену (или микроорганизму), обусловленная биологическими особенностями самого организма, свойствами данного антигена, а также особенностями их взаимодействия.
Примером может служить невосприимчивость человека к некоторым возбудителям, в том числе к особо опасным для сельскохозяйственных животных (чума крупного рогатого скота, болезнь Ньюкасла, поражающая птиц, оспа лошадей и др.), нечувствительность человека к бактериофагам, поражающим клетки бактерий. К генетическому иммунитету можно также отнести отсутствие взаимных иммунных реакций на тканевые антигены у однояйцовых близнецов; различают чувствительность к одним и тем же антигенам у различных линий животных, т. е. животных с различным генотипом.
Объяснить видовой иммунитет можно с разных позиций, прежде всего отсутствием у того или иного вида рецепторного аппарата, обеспечивающего первый этап взаимодействия данного антигена с клетками или молекулами-мишенями, определяющими запуск патологического процесса или активацию иммунной системы. Не исключены также возможность быстрой деструкции антигена, например, ферментами организма или же отсутствие условий для приживления и размножения микроба (бактерий, вирусов) в организме. В конечном итоге это обусловлено генетическими особенностями вида, в частности отсутствием генов иммунного ответа к данному антигену.
Видовой иммунитет может быть абсолютным и относительным. Например, нечувствительные к столбнячному токсину лягушки могут реагировать на его введение, если повысить температуру их тела. Белые мыши, не чувствительные к какому-либо антигену, приобретают способность реагировать на него, если воздействовать на них иммунодепрессантами или удалить у них центральный орган иммунитета — тимус
Физиология иммунного ответа ( по материалам статьи Angel A. Justiz Vaillant с соавторами)
Иммунный ответ - это способность организма оставаться в безопасности, обеспечивая защиту от вредных агентов, и включает в себя линии защиты от большинства микробов, а также специализированную и высокоспецифичную реакцию на конкретного агента - "преступника". Этот иммунный ответ классифицируется как врожденный, который является неспецифическим, и как адаптивный, приобретенный, который является высокоспецифичным. Иммунная система эволюционировала для поддержания гомеостаза, поскольку она может различать чужеродные антигены и собственные; однако, когда эта специфичность нарушается, развивается аутоиммунная реакция или заболевание.
Пржденный иммунитет
Врожденный иммунный ответ ( реакция), часто наша первая линия защиты от всего постороннего, всегда защищает организм от патогена аналогичным образом. Эти естественные механизмы включают кожный барьер, слюну, слезы, различные цитокины, белки комплемента, лизоцим, бактериальную флору и многочисленные клетки, включая нейтрофилы, базофилы, эозинофилы, моноциты, макрофаги, ретикулоэндотелиальную систему, естественные клетки-киллеры (NK-клетки), эпителиальные клетки. , эндотелиальные клетки, эритроциты и тромбоциты. Воспалительный иммунный ответ является примером врожденного иммунитета, поскольку он блокирует проникновение вторгающихся патогенов через кожу, дыхательные пути или желудочно-кишечный тракт. Если патогены могут пробить эпителиальные поверхности, они сталкиваются с макрофагами в субэпителиальных тканях, которые будут не только пытаться поглотить их, но и продуцировать цитокины для усиления воспалительной реакции.
Приобретенный иммунитет
Адаптивный приобретенный иммунный ответ будет использовать способность конкретных лимфоцитов и их продуктов (иммуноглобулинов и цитокинов) генерировать ответ против вторгшихся микробов, и проявляет типичные особенности. Активный иммунитет возникает в результате реакции иммунной системы на антиген и, следовательно, приобретается. Иммунитет, возникающий в результате передачи иммунных клеток или антител от иммунизированного человека, является пассивным иммунитетом .
Аутоиммунитет
Хотя иммунная система предназначена для защиты человека от угроз, иногда чрезмерный иммунный ответ вызывает реакцию против аутоантигенов, приводящую к аутоиммунитету. Кроме того, иммунная система не может постоянно защищаться от всех угроз.
Основные тезисы аутоиммунитета
Отказ от трансплантации является иммуноопосредованным ответом, представляет собой препятствие для трансплантации. Этиология многих аутоиммунных заболеваний неясна - реальность такова, что распространенность этих расстройств увеличивается и проявляется более агрессивно.
Расстройства гиперчувствительности I типа являются иммуноопосредованными и включают аллергическую бронхиальную астму, пищевую аллергию и анафилактический шок. Нарушения иммунодефицита встречаются редко, но они поражают некоторых детей.
Вакцинация
Вакцинация необходима для индукции адекватного активного иммунного ответа на определенные патогены. Живые аттенуированные вакцины: вызывают как гуморальный, так и клеточный ответ. Эти вакцины противопоказан при беременности и состояниях с ослабленным иммунитетом. Примеры включают аденовирус, полиомиелит, ветряную оспу, оспу, БЦЖ, желтую лихорадку, грипп (интраназальный), MMR, ротавирус и т. д. Убитые или инактивированные вакцины: вызывают только гуморальный ответ. Примеры включают бешенство, грипп (инъекции), полиомиелит , гепатит А и т. д. Субъединичные вакцины: Примеры включают HBV, HPV (типы 6,11,16 и 18), бесклеточный коклюш, Neisseria meningitides, Streptococcus pneumoniae, Hemophilus influenza типа b и т. д. Анатоксиновая вакцина: примеры включают Clostridium tetani, Corynebacterium diphtheria и т. д.
Генез клеток иммунной системы
Клетки мезодермы индуцируются с образованием гемангиобластов, общих предшественников сосудов и образования клеток крови. Окончательные гемопоэтические стволовые клетки происходят из мезодермы, окружающей аорту, называемой областью аорта-гонад-мезонефрос. Эти стволовые клетки колонизируют печень и после этого к седьмому месяцу беременности активно вырабатываются костным мозгом. Т-лимфоциты созревают в тимусе, где эти клетки достигают стадии функциональной компетентности, в то время как В-лимфоциты созревают в костном мозге, месте образования всех циркулирующих клеток крови.
Системы органов, учавствующих в иммунном ответе
Системы органов, участвующие в иммунном ответе, - это прежде всего лимфоидные органы, которые включают селезенку, тимус, костный мозг, лимфатические узлы, миндалины и печень. Система лимфоидных органов классифицируется следующим образом: 1) первичные лимфоидные органы (тимус и костный мозг), где Т- и В-клетки сначала экспрессируют антигенные рецепторы и становятся функционально зрелыми; 2) вторичные лимфоидные органы, такие как селезенка, миндалины, лимфатические узлы, кожная и слизистая иммунная система; именно здесь В- и Т-лимфоциты распознают чужеродные антигены и вырабатывают соответствующие иммунные ответы.
Иммунный ответ на бактерии
Здесь ответ часто зависит от патогенности бактерий : нейтрализующие антитела синтезируются, если бактериальная патогенность обусловлена токсином; опсонизирующие антитела - вырабатываются, поскольку они необходимы для уничтожения внеклеточных бактерий; система комплемента активируется, в частности, липидными слоями грамотрицательных бактерий; фагоциты убивают большинство бактерий, используя положительный хемотаксис, прикрепление, захват и, наконец, поглощение бактерий; CD8 + Т-клетки могут убивать клетки, инфицированные бактериями.
Иммуный ответ на грибы
Врожденный иммунитет к грибам включает дефенсины и фагоциты. CD4 + Т-хелперные клетки несут ответственность за адаптивный иммунный ответ против грибов. Дендритные клетки секретируют IL-12 после употребления в пищу грибов, а IL-12 активирует синтез гамма-интерферона, который активирует клеточный иммунитет.
Иммунный ответ на вирусы
Интерферон, NK-клетки и фагоциты предотвращают распространение вирусов на ранней стадии. Специфические антитела и белки комплемента участвуют в нейтрализации вирусов и могут ограничивать распространение и повторное заражение. Адаптивный иммунитет имеет первостепенное значение для защиты от вирусов - они включают CD8 + Т-клетки, которые их убивают, и CD4 + Т-клетки как доминирующую популяцию эффекторных клеток в ответ на многие вирусные инфекции.
Иммуный ответ на паразитов
Паразитарная инфекция стимулирует различные механизмы иммунитета из-за их сложного жизненного цикла. Клетки CD4 + и CD8 + защищают от паразитов. Макрофаги, эозинофилы, нейтрофилы и тромбоциты могут убивать простейших и червей, высвобождая реактивные радикалы кислорода и оксид азота. Повышенное количество эозинофилов и стимуляция IgE Th-2 CD4 + Т-клетками необходимы для уничтожения кишечных червей. Воспалительные реакции также борются с паразитарными инфекциями.
Уклонение от иммунного ответа
Несмотря на иммунный ответ (ы), генерируемый неповрежденной и функциональной иммунной системой, мы все равно болеем, и это часто происходит из-за механизмов уклонения, используемых этими микробами. Вот некоторые из них:
Стратегия вирусов
Антигенная вариация : это мутация белков, которые обычно распознаются антителами и лимфоцитами. ВИЧ постоянно мутирует, что затрудняет защиту иммунной системы от него, а также препятствует разработке вакцины. Нарушая активность 2 ', 5'-олигоаденилатсинтетазы или продуцируя растворимые рецепторы интерферона, вирусы нарушают интерфероновую реакцию. Вирусы влияют на экспрессию молекул MHC по нескольким механизмам. Вирус может инфицировать иммунные клетки : нормальные Т- и В-клетки также являются местами персистенции вируса. ВИЧ скрывается в CD4 + Т-клетках, а ВЭБ - в В-клетках.
Стратегия бактерий
Внутриклеточные патогены могут скрываться в клетках : бактерии могут жить внутри метаболически поврежденных лейкоцитов хозяина и ускользать из фаголизосом ( Shigella spp). Прочие механизмы: производство токсинов, подавляющих фагоцитоз; предотвращания убийства путем инкапсуляции; высвобождение каталазы инактивирующей перекись водорода; заражение клетки, а затем нарушение антигенной презентации; уничтожение фагоцитов путем апоптоза или некроза.
Стратегия грибов
Грибы производят полисахаридную капсулу, которая подавляет процесс фагоцитоза и преодолевает опсонизацию, комплемент и антитела.Некоторые грибы подавляют активность Т-клеток-хозяев, замедляя клеточно-опосредованное уничтожение. Другие организмы (например, Histoplasma capsulatum ) избегают гибели макрофагов, проникая в клетки через CR3 и избегая образования фагосом.
Стратегия паразитов
Паразиты могут противостоять разрушению за счет дополнения. Паразиты могут противостоять разрушению за счет дополнения. Паразиты маскируются под защитный механизм. Антигенная вариация (например, африканская трипаносома) - важный механизм уклонения от иммунной системы. Паразиты выделяют молекулы, которые мешают нормальному функционированию иммунной системы.
Механизмы иммунного ответа
Наиболее важные механизмы иммунной системы, с помощью которых она генерирует иммунный ответ, включают: макрофаги, которые производят лизосомальные ферменты и активные формы кислорода для устранения проглоченных патогенов. Эти клетки производят цитокины, которые привлекают другие лейкоциты к месту инфекции, чтобы защитить организм. Врожденный ответ на вирусы включает синтез и высвобождение интерферонов, а также активацию естественных клеток-киллеров, которые распознают и уничтожают инфицированные вирусом клетки. Врожденный иммунитет против бактерий состоит из активации нейтрофилов, которые поглощают патогены, и перемещения моноцитов к воспаленной ткани, где они превращаются в макрофаги. Они могут поглощать и обрабатывать антиген, а затем представлять его группе специализированных клеток приобретенного иммунного ответа. Эозинофилы защищают от паразитарных инфекций, высвобождая содержимое своих гранул.
Антителозависимая клеточно-опосредованная цитотоксичность (ADCC) : цитотоксическая реакция, при которой клетки-киллеры, экспрессирующие Fc-рецептор, распознают клетки-мишени через специфические антитела. Созревание аффинности : увеличение средней аффинности антител, в основном наблюдаемое во время вторичного иммунного ответа. Система комплемента : это молекулярный каскад белков сыворотки, участвующих в контроле воспаления, литической атаке на клеточные мембраны и активации фагоцитов. Система может активироваться за счет взаимодействия с IgG или IgM (классический путь) или за счет вовлечения факторов B, D, H, P, I и C3, которые тесно взаимодействуют с поверхностью активатора с образованием конвертазы C3 альтернативного пути.Анергия : это неспособность вызвать иммунный ответ после стимуляции потенциальным иммуногеном. Процессинг антигена : преобразование антигена в форму, распознаваемую лимфоцитами. Это начальный стимул для выработки иммунного ответа. Презентация антигена : это процесс, при котором определенные клетки иммунной системы экспрессируют антигенные пептиды в своей клеточной мембране вместе с аллелями главного комплекса гистосовместимости (MHC), который распознается лимфоцитами. Апоптоз : запрограммированная гибель клеток, включающая фрагментацию ядра и образование апоптотических тел. Хемотаксис : миграция клеток в ответ на градиенты концентрации хемотаксических факторов.
Реакция гиперчувствительности : устойчивый иммунный ответ, который вызывает более значительное повреждение тканей, чем вызванное антигеном или патогеном, вызвавшим ответ. Например, аллергическая бронхиальная астма и системная красная волчанка являются примерами реакций гиперчувствительности типа I и типа III соответственно.
Реакции гиперчувствительности 2 типа (антителозависимая цитотоксическая гиперчувствительность): иммунный ответ против антигенов, присутствующих на поверхности клетки. Антитела, связывающиеся с поверхностью клетки, активируют систему комплемента и вызывают дегрануляцию нейтрофилов и разрушение клетки. Такие реакции могут быть нацелены на собственные или чужие антигены. Несовместимость групп крови по системе ABO, приводящая к острым гемолитическим трансфузионным реакциям, является примером гиперчувствительности 2 типа.
Реакции гиперчувствительности 3 типа также опосредуются циркулирующим комплексом антиген-антитело, который может откладываться в тканях и повредить их. Антигены в отношениях типа 3 являются растворимыми, в отличие от связанных с клетками антигенов в типе 2.
Реакции гиперчувствительности 4 типа (реакции гиперчувствительности замедленного типа): они опосредуются антиген-специфическими активированными Т-клетками . Когда антиген попадает в организм, он обрабатывается антигенпрезентирующими клетками и вместе с MHC II передается в клетку Th1. Если Т-хелперная клетка уже была сенсибилизирована к этому конкретному антигену, она будет стимулирована к высвобождению хемокинов для рекрутирования макрофагов и цитокинов, таких как интерферон-γ, для их активации. Это вызывает локальное повреждение тканей. Реакция занимает больше времени, чем все другие типы, от 24 до 72 часов.
Воспаление : определенные реакции, которые привлекают клетки и молекулы иммунной системы к месту инфекции или повреждения. Он отличался повышенным кровоснабжением, проницаемостью сосудов и повышенной трансэндотелиальной миграцией клеток крови (лейкоцитов). Опсонизация : процесс облегчения фагоцитоза за счет отложения опсонинов (IgG и C3b) на антигене. Фагоцитоз : процесс, при котором клетки (например, макрофаги и дендритные клетки) захватывают или поглощают антигенный материал или микроб и заключают его в фагосому в цитоплазме. Иммунологическая толерантность : состояние специфической иммунологической невосприимчивости.
Отторжение трансплантата
Ксенотрансплантаты - это трансплантаты между представителями разных видов, вызывающие максимальный иммунный ответ. Быстрый отказ.
Аллотрансплантаты - это трансплантаты между представителями одного вида.
Аутотрансплантаты - это трансплантаты от одной части тела к другой. Никакого отказа.
Изотрансплантаты - это трансплантаты между генетически идентичными людьми. Никакого отказа.
Сверхострое отторжение: при сверхостром отторжении пересаженная ткань отторгается в течение нескольких минут или часов, потому что васкуляризация быстро разрушается. Сверхострое отторжение опосредовано антителами и происходит потому, что у реципиента уже есть антитела против трансплантата, что может быть связано с предыдущими переливаниями крови, многоплодной беременностью, предшествующей трансплантацией или ксенотрансплантатами. Активация системы комплемента приводит к тромбозу сосудов, препятствующему васкуляризации трансплантата.
Острое отторжение: развивается в течение нескольких недель или месяцев. Включает активацию Т-лимфоцитов против донорских МНС. Также может быть задействован гуморальный иммунный ответ, когда после трансплантации вырабатываются антитела. Проявляется васкулитом сосудов трансплантата с плотным интерстициальным лимфоцитарным инфильтратом.
Хроническое отторжение: хроническое отторжение развивается от месяцев до лет после того, как приступы острого отторжения утихли. Хронические отторжения опосредованы как антителами, так и клетками. Использование иммунодепрессантов и методов тканевого типирования увеличило выживаемость аллотрансплантатов в первый год, но хроническое отторжение в большинстве случаев не предотвращается. Обычно это проявляется фиброзом и рубцеванием. При пересадке сердца хроническое отторжение проявляется в виде ускоренного атеросклероза. В пересаженных легких проявляется облитерирующим бронхиолитом. При трансплантации печени это проявляется как синдром исчезающего желчного протока. У реципиентов почек это проявляется фиброзом и гломерулопатией.
Болезнь « трансплантат против хозяина»: начало заболевания варьируется. Привитые иммунокомпетентные Т-клетки пролиферируют в хозяине с ослабленным иммунитетом и отторгают хозяйские клетки, которые они считают «чужеродными», что приводит к тяжелой органной дисфункции. Это реакция гиперчувствительности 4 типа, которая проявляется макулопапулезной сыпью, желтухой, диареей, гепатоспленомегалией. Обычно возникает при трансплантации костного мозга и печени, которые богаты лимфоцитами.
Виды фагоцитоза, механизмы и стадии фагоцитоза. Причины недостаточности фагоцитоза и их значение при воспалении
Фагоцитоз - эволюционно выработанная защитно-приспособительная реакция организма, заключающаяся в узнавании, активном захвате (поглощение) и переваривании микробов, разрушенных клеток и инородных частиц специализированными клетками - фагоцитами. К ним относятся ПЯЛ (в основном нейтрофилы), клетки системы фагоцитирующих мононуклеаров (моноциты, тканевые макрофаги: клетки Купфера в печени, мезенгиальные клетки почек, глиальные клетки в ЦНС и др.)
4 стадии фагоцитоза:
1) сближение фагоцита с объектом;
2) прилипание (аттракция, адгезия);
3) захват фагоцитируемого объекта;
4) внутриклеточное положение и переваривание объекта.
Первая стадия — стадия сближения. Фагоцит сближается с объектом фагоцитоза . Главным механизмом сближения, является хемотаксис — направленное передвижение фагоцита по отношению к объекту фагоцитоза
Вторая стадия — стадия прилипания.Коснувшись объекта, фагоцит прикрепляется к нему. Лейкоциты, прилипшие в очаге воспаления к стенке сосуда, не отрываются даже при большой скорости кровотока. В механизме прилипания большую роль играет поверхностный заряд фагоцита.
Третья стадия — стадия поглощения.Объект фагоцитоза может перемещаться двумя способами. В одном случае оболочка фагоцита в месте контакта с объектом втягивается и объект, прикрепленный к этому участку оболочки, втягивается в клетку, а свободные края мембраны смыкаются над объектом.
Четвертая стадия — стадия внутриклеточного переваривания. К вакуоли, содержащей фагоцитированный объект (фагосоме), присоединяются лизосомы и содержащиеся в них неактивные ферменты, активируясь, изливаются в вакуоли. Образуется пищеварительная вакуоль.
Существует завершенный и незавершенный фагоцитоз .
В первом случае объект фагоцитоза полностью уничтожается.
При незавершенном фагоцитозе вследствие целого ряда причин фагоцитированный микроорганизм не уничтожается. Более того, в фагоците он находит хорошую среду обитания и размножается. В результате фагоцит гибнет и микроорганизмы разносятся кровью и лимфой.
Недостаточность фагоцитоза -состояние наследственной и приобретенной природы, которое характеризуется снижением неспецифической резистентности организма, уменьшением интенсивности антителообразования и проявляется постоянными рецидивирующими гнойно-септическими заболеваниями.
Причины патологии фагоцитоза
1. Уменьшение количества фагоцитов.
2. Структурно-функциональные изменения фагоцитов врожденного и приобретенного характера.
3. Изменения гормонально-гуморальной регуляции процесса фагоцитоза и др.
Уменьшение количества фагоцитов, прежде всего нейтрофильных лейкоцитов, возникает при лейкопениях врожденного и приобретенного характера, в частности при миелотоксических, выделительных, перераспределительных и иммуноаллергических лейкопениях.
Снижение фагоцитарной активности может быть обусловлено:
1) нарушением сократительных структур фагоцита;
2) изменением структуры рецепторов, чувствительных к хемотаксическим веществам и опсонинам;
3) снижением активности ферментов, осуществляющих нормальный метаболизм фагоцитов, в частности энергетический;
г) дефектами бактерицидных систем фагоцитов.
При дефиците опсонинов затрудняется узнавание чужеродного объекта, а также прикрепление фагоцита на его поверхности.
Декомпенсированные сдвиги кислотно-щелочного равновесия (ацидозы и алкалозы) приводят к снижению фагоцитарной активности.
Механизмы пролиферации и репарации в очаге воспаления. Принципы прогнозирования течения острого воспаления в челюстно-лицевой области.
Пролиферация - завершающей фазой воспаления, обеспечивающей репаративную регенерацию тканей на месте очага альтерации. Пролиферация развивается с самого начала воспаления наряду с явлениями альтерации и экссудации.
При репаративных процессах в очаге воспаления регенерация клеток и фиброплазия достигаются как активацией процессов пролиферации, так и ограничением апоптоза клеток. Размножение клеточных элементов начинается по периферии зоны воспаления. процессу пролиферации предшествует формирование нейтрофильного и моноцитарного барьеров, которые формируются по периферии зоны альтерации.
Восстановление и замещение поврежденных тканей начинается с выхода из сосудов молекул фибриногена и образования фибрина, который формирует своеобразную сетку, каркас для последующего клеточного размножения. И по нему распределяются в очаге репарации быстро образующиеся фибробласты. Деление, рост и перемещение фибробластов возможны только после их связывания ( с помощью фибронектина) с фибрином или коллагеновыми волокнами. Размножение фибробластов начинается по периферии зоны воспаления, обеспечивая формирование фибробластического барьера. Хемотаксис, активация и пролиферация фибробластов осуществляются под воздействием:
1. Факторов роста фибробластов.
2. Тромбоцитарного фактора роста.
3. Цитокинов - ФНО, ИЛ-1.
6. Трансформирующего фактора роста b.
Сначала фибробласты незрелые и не обладают достаточной синтетической активностью, только после перестройки фибробласты начинают синтезировать коллаген, эластин, коллагенассоциированные белки и протеогликаны. Коллагеногенез стимулируется следующими биологически активными веществами - ФНО, ИЛ-1, ИЛ-4, фактором роста фибробластов, тромбоцитарным фактором роста.
Интенсивно размножающиеся фибробласты продуцируют кислые мукополисахариды - основной компонент межклеточного вещества соединительной ткани (гиалуроновую кислоту, хондроитинсерную кислоту, глюкозамин, галактозамин). При этом зона воспаления не только инкапсулируется, но и начинаются постепенная миграция клеточных и бесклеточных компонентов соединительной ткани от периферии к центру, формирование соединительнотканного остова на месте первичной и вторичной альтерации.
Воспаление. Фагоцитоз. Асептическое и острое воспаление. Часть 7
Выпускник медицинского факультета УЛГУ. Интересы: современные медицинские технологии, открытия в области медицины, перспективы развития медицины в России и за рубежом.
- Запись опубликована: 25.11.2020
- Reading time: 4 минут чтения
Фагоцитоз - это способность определенных клеток (фагоцитов) удерживать и переваривать плотные частицы. Это явление было открыто И. Мечниковым.
Фагоцитоз осуществляется микрофагами (нейтрофилами) и системой мононуклеарных макрофагов.
Мононуклеарные макрофаги
Система (MMS) включает следующие элементы:
- промоноциты (костный мозг);
- моноциты (кровь);
- тканевые макрофаги;
- гистиоциты соединительной ткани;
- печеночные клетки Куппера;
- легочные альвеолярные макрофаги;
- свободные и фиксированные макрофаги лимфатической ткани;
- плевру и перитонеальные макрофаги.
Клетки мононуклеарной системы объединяет общее происхождение гемопоэтических клеток и саморегуляция.
Моноцитопоэз
Моноцитопоэз - это стимулирующий фактор колонии фибробластов и фактор роста макрофагов, но он же подавляет (отрицательная саморегуляция) интерферон фибробластов и лейкоцитов и т. д.
Процесс фагоцитоза делится на четыре стадии:
- Приближение.
- Адгезия.
- Оседание;
- Стадия пищеварения.
Фаза приближения
Фагоцит приближается к объекту - бактериям, мервому клеточному элементу, инородному объекту. При движении под действием хемотаксиса цитоплазма фагоцита образует удлинения (псевдоподии).
Адгезия
Способствует образованию аминополисахаридов на поверхности фагоцитов и перекрытию фагоцитарного объекта белками сыворотки, особенно иммуноглобулинами. Последний механизм по сути является опсонизацией - бактерии и поврежденные клетки перекрываются с IgM, IgG и компонентами комплемента (C3, C5 и др.), что облегчает адгезию к фагоциту.
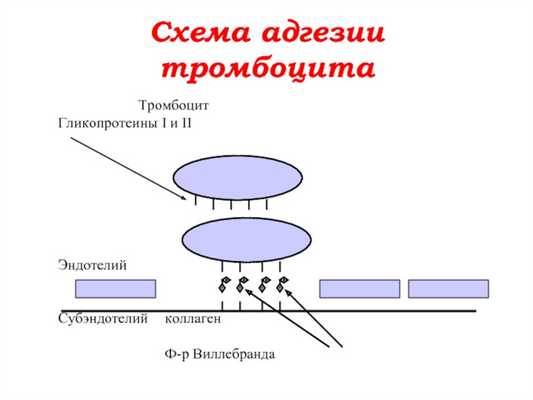
Адгезия
Поверхность фагоцита заряжена отрицательно, поэтому адгезия лучше, если объект, подлежащий фагоцитозу, заряжен положительно. Менее фагоцитарны отрицательно заряженные объекты, такие как опухолевые клетки.
Оседание
Этап фагоцитации объекта - путь инвагинации. Сначала фагоцит образует углубление, а затем фагосому - вакуоль, содержащую объект, подлежащий фагоцитозу. НАДН-зависимая оксидаза в мембране фагоцитов активируется до образования фагосом; в результате O2 превращается в O 2 ~ (супероксид-анион) и образуется H 2 O 2.
Эти продукты обладают бактерицидным действием, а также вызывают образование свободных радикалов. Под действием пероксидаз и каталаз H 2 O 2 расщепляется и высвобождается молекулярный O 2. Свободные радикалы и активный молекулярный O 2 действуют на мембрану фагоцита и объект, подлежащий фагоцитозу, активируя перекисное окисление липидов.
Липопероксиды и свободные радикалы неустойчивы к лизосомным мембранам и способствуют высвобождению лизосомальных ферментов.
Стадия пищеварения
Лизосомы присоединяются к фагосоме, содержащей фагоцитарный объект. Эти органеллы содержат все ферменты, необходимые для расщепления углеводов, белков, жиров и нуклеиновых кислот. В еще неактивной форме они попадают в вакуоль фагоцитов.
Пищеварительная вакуоль образуется при pH около 5,0, близком к оптимальному для лизосомальных ферментов. Активируются лизосомальные ферменты, и фагоцитарный объект постепенно переваривается. Во время стадии пищеварения проницаемость мембраны фагосомы увеличивается, содержимое фагосомы ускользает в цитоплазму, и микрофаг умирает (этому процессу способствует ацидоз). В этом случае фагоцитарный микроорганизм также может сохранять жизнеспособность.
Роль макрофагов в воспалительном процессе
Макрофаги начинают участвовать в фагоцитозе позже микрофагов. Макрофаги также более устойчивы к гипоксии и ацидозу, например, моноциты жизнеспособны даже при pH 5,5.
В очаге воспаления макрофаги выполняют несколько функций:
- Фагоцитируют бактериальные остатки, оставшиеся после эвакуации гноя и продуктов распада тканей - очищающая функция;
- Высвобождают лизосомальные ферменты - гиалуронидазу, аминопептидазу и др;
- Синтезируют компоненты системы комплемента и простагландины.
В то же время воспаленная тканевая среда также стимулирует образование фибробластов и фиброцитов. Постепенно появляется новая, богатая сосудами грануляционная ткань.
Фагоцитоз стимулируется продуктами повреждения тканей - внутриклеточные белки, ферменты, полипептиды, аминокислоты, электролиты и т. д., биологически активными веществами, половыми гормонами, тироксином, адреналином, лихорадкой. Но подавляется недостатком стимулирующих факторов, глюкокортикоидов, гликолортикоидов, ацетилхолина, ацетилхолина.
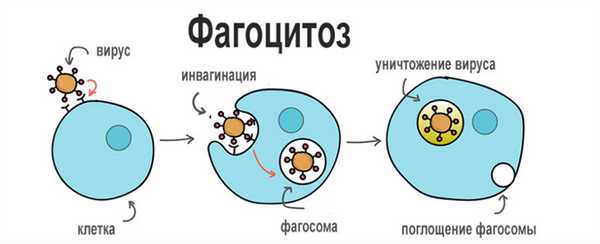
Фагоцитоз
Считается, что клетки плаценты и злокачественные опухоли способны секретировать вещество, которое подавляет функцию макрофагов, иммунологические реакции лимфоцитов и эмиграцию лейкоцитов, что приводит к значительному ослаблению или даже прекращению воспаления.
Объекты, которые фагоциты не могут переваривать, остаются в этих клетках в течение длительного времени и покрываются тонкой пленкой аминополисахаридов. После гибели фагоцитов они повторно фагоцитируются или выводятся из организма. Процесс, при котором фагоцит после переваривания высвобождает часть продуктов своего фагоцитоза в окружающую среду, называется экструзией.
Фагоцитоз - не единственный в организме механизм борьбы с воспалением. Большинство микроорганизмов погибают в условиях ацидоза, а также от ферментов, высвобождаемых во время гибели клеток и функционирования иммунокомпетентной системы.
Нейтрофилы во внеклеточном пространстве секретируют катионные белки, которые могут убивать ферменты без ферментов и фагоцитоза. Таким образом, воспалительные очаги постепенно избавляются от микроорганизмов и мертвых клеток.
Асептическое и острое воспаление
Дальнейшее течение воспаления зависит от того, является ли воспаление асептическим или бактериальным.
В асептических воспалительных условиях, например, вокруг хирургического шва, инородного тела, стенка микрофагов (нейтрофилов) начинает формироваться в течение нескольких часов, достигая максимума в течение дня.
Позже появляется следующий вал макрофагов, который достигает максимума через 2-3 раза. в день. Эмигрировавшие лейкоциты постепенно становятся неподвижными, больше не могут делиться и погибают в течение 3-5 дней. 2-3. на 5 сутки начинает формироваться стенка фибробластов, а на 5 сутки - соединительнотканная капсула.
Таким образом, в случае острого воспаления патогенный агент в организме преобразует белки, которые участвуют в реакции антиген-антитело, медиаторы и модуляторы воспаления, систему фагоцитов и миграцию клеток. В результате заканчивается острое воспаление. Однако, если инфекционные агенты попадают в участок асептического воспаления, например, в результате травмы, это воспаление становится септическим (бактериальным) воспалением.
Бактериальные воспалительные состояния бактерий и токсинов, не вызывающие гиперемии, экссудации и эмиграции лейкоцитов. Между клетками воспаленных тканей и особенно вокруг кровеносных сосудов накапливается все больше и больше микрофагов. Лизосомы микрофагов содержат множество активных ферментов, и эти клетки также начинают процесс фагоцитоза. При пальпации воспаленная ткань в это время кажется плотной, поэтому это называется стадией воспалительной инфильтрации.
По мере прогрессирования воспаления лейкоциты и те тканевые клетки, которые претерпели необратимые изменения во время воспаления, погибают. В этих клетках высвобождаются лизосомальные ферменты, которые расщепляют тканевые белки, белковые и липидные комплексы и другие структуры. Это стадия гнойного размягчения воспаления.
Эти стадии наблюдаются, например, у пациентов с гнойным воспалением перикарда (фурункул), гнойным воспалением апокринных потовых желез (гидраденит) и гнойным воспалением соединительной ткани (флегмона). При вдыхании воспаленная ткань выглядит мягкой, с характерным раскачиванием - флюктуацией. Образуется замкнутое скопление гноя - абсцесс.
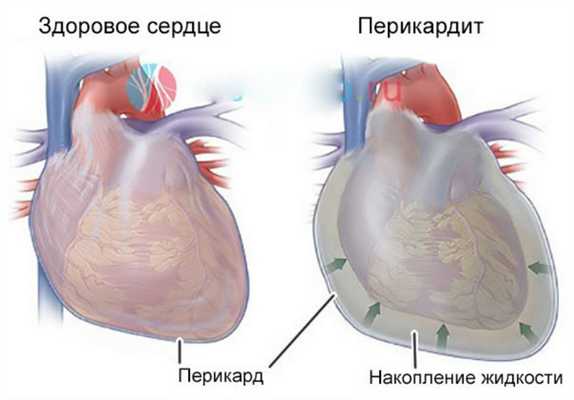
Гнойное воспаление перикарда
Гной разрывается в направлении наименьшего сопротивления (либо наружу, либо внутри тела). Если гной попадает в кровоток (пемия), в организме может развиться множество очагов гноя, но под действием микроорганизмов и токсических веществ - угрожающее общее заболевание (сепсис, септикопиемия). Поэтому важно диагностировать накопление гноя и обеспечить хирургический дренаж гноя наружу.
Воспаление. Эмиграция лейкоцитов. Хемотаксис. Часть 6
- Запись опубликована: 24.11.2020
- Reading time: 3 минут чтения
Небольшое перемещение лейкоцитов из кровеносных сосудов в ткани - диапедез или так называемая эмиграция лейкоцитов - нормальное явление. Однако при воспалительных условиях этот процесс идет интенсивно и активно - лейкоциты используют в процессе эмиграции АТФ. И этот процесс уже выходит за пределы нормы.
Почему происходит эмиграция лейкоцитов
Основной фактор, вызывающий эмиграцию лейкоцитов, - положительная гемотаксия в очаге воспаления. Эмиграции способствует повышенная проницаемость сосудистой стенки, замедление кровообращения и экссудации.
Эмиграция лейкоцитов следует за экссудацией, она начинается при артериальной гиперемии, но достигает пика при венозной гиперемии и застое . Экссудация происходит в основном из капилляров и вен, тогда как эмиграция лейкоцитов происходит из капилляров, вен и мелких вен.
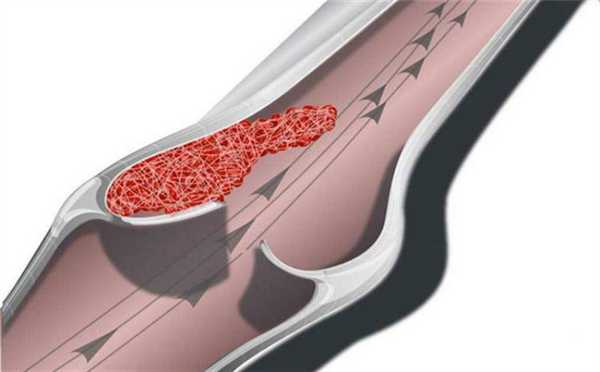
Венозный застой
Эндотелиальные клетки сосудов прикрепляются к непрерывной базальной мембране, состоящей из коллагеновых волокон и гомогенного вещества, богатого комплексами белковых полисахаридов. В нормальных условиях эндотелиальная поверхность покрыта тонким слоем фибринового вещества, примыкающего к фиксированному слою плазмы крови, который, в свою очередь, граничит с движущейся частью плазмы.
Как протекает эмиграция лейкоцитов в очаг воспаления
Эмиграцию лейкоцитов в очаг воспаления можно разделить на три периода:
- Адгезия лейкоцитов. Так называемое крайнее положение. Которая длится от нескольких минут до одного часа,
- Прохождение лейкоцитов через эндотелий сосудов - длится несколько минут.
- Лейкоциты перемещаются к очагу воспаления и в тканях очага воспаления - длится много часов и даже дней.
С адгезией лейкоцитов меняется расположение этих элементов на поверхности венозного эндотелия. В нормальных условиях лейкоциты не касаются слоя фибрина, но в случае воспаления структура фибринового цемента изменяется, и внутренняя поверхность сосуда выстлана чешуйчатым материалом, содержащим кислые мукополисахариды, мукопротеины и соляную кислоту. Нити фибрилл могут пересекать просвет даже мелких кровеносных сосудов.
Когда скорость кровообращения снижается, эти нити захватывают белые кровяные тельца, и они контактируют с измененным слоем фибринового цемента. Прежде чем прикрепиться к эндотелию сосудов, лейкоциты часто совершают очень сложные траектории движения - даже против кровотока.
Считается, что адгезия лейкоцитов к эндотелию определяется электрохимическими силами - потерей отрицательного заряда лейкоцитов и специфических химических связей между мембранами контактирующих клеток.
После адгезии к эндотелию сосудов нейтрофил развивает цитоплазматическое расширение, которое проникает между эндотелиальными клетками и образует отверстие в базальной мембране. Важную роль в изменении молекулярной структуры базальной мембраны и повышении ее проницаемости играют ферменты лейкоцитарных гранул (эластаза, коллагеназа).
Гранулы лейкоцитов также содержат катионные белки, которые также действуют на стенку кровеносных сосудов и способствуют эмиграции.
Первоначально в изгнании эмигрирующей клетки органелл нет. Затем за удлинением следует остальная масса гранулоцитов с ядром и гранулами. Эти клетки перемещаются к месту воспаления со скоростью от 6 до 12 микрон в минуту.
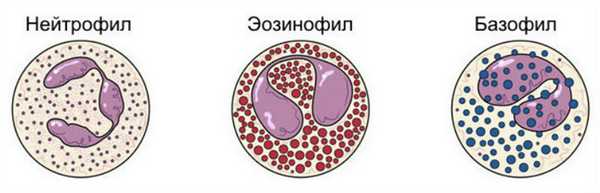
Разновидности гранулоцитов
На эмиграцию гранулоцитов влияет тип воспаления. Например, в случае бактериального воспаления эмигрируют в основном нейтрофилы, но в экссудате аллергического воспаления много лимфоцитов и эозинофилов. Гранулы этих лейкоцитов содержат вещества, инактивирующие гистамин, серотонин и, возможно, хинины, которых много в тканях в условиях гиперчувствительности.
Эмиграция моноцитов и лимфоцитов немного отличается от эмиграции нейтрофилов. Нейтрофилы мигрируют через эндотелиальную щель, а моноциты и лимфоциты мигрируют через эндотелий. После попадания в эндотелиальную клетку вокруг них образуется большая вакуоль. Попадая в него, моноцит и гимфоцит проходят через эндотелиальную клетку.
Эмиграция лимфоцитов и моноцитов - более медленный процесс, эти клетки позже появляются в воспаленных тканях и образуют второй слой или лейкоциты.
Хемотаксис
Хемотаксис - это активное движение лейкоцитов либо в направлении определенных химических раздражителей, либо от них.
В первом случае речь идет о положительной хемотаксии, а во втором - об отрицательной. Положительный хемотаксис играет роль на всех стадиях эмиграции лейкоцитов, особенно когда эти клетки уже покинули кровеносный сосуд и мигрируют во внесосудистое пространство.
И. Мечников первым наблюдал активное движение лейкоцитов к очагу воспаления и описал так называемый закон эмиграции лейкоцитов. Согласно ему, гранулоциты очень чувствительны к раздражителям хемотаксиса - так называемым гемоаттрактантам, поэтому они первыми эмигрируют к очагу воспаления. Хемотаксис моноцитов и лимфоцитов против этих раздражителей ниже. За гранулоцитами следуют моноциты и, наконец, лимфоциты.
Химические раздражители, вызывающие положительный гемотаксис, изучены достаточно подробно. Они делятся на две группы - хемотаксины и хемотаксигены.
- Хемотаксины - это вещества, которые могут привлекать лейкоциты.
- Хемотаксигены сами по себе не вызывают хемотаксии, но способствуют образованию хемотаксинов.
Примерами нейтрофильных хемотаксинов являются денатурированные белки, калихреин, компоненты комплемента (C3, C5), бактериальные токсины и гемотаксигены - трипсин, плазмин, коллагеназа, крахмал, гликоген, комплексы антиген-антитело. Хемотаксис подавляется гидрокортизоном. простагландины Ei и E2, цАМФ, колхицин.
Хемотаксины макрофагов представляют собой бактериальные культуры (Streptococcus pneumoniae, Corynebacteria) фильтрат белковых фракций, компонента С5а комплемента и др., кроме хемотаксигенов - липополисахаридов кишечных микробов, микобактерий, фракций лизосом лейкоцитов, протеиназ макрофагов.
Лейкоциты эозинофилов являются факторами хемотаксиса эозинофилов (высвобождаемых аллергеном и IgE из легких и гладких мышц), лимфокинов и других, но хемотаксигены представляют собой различные иммунные комплексы, а также продукты агрегации IgG и IgM.
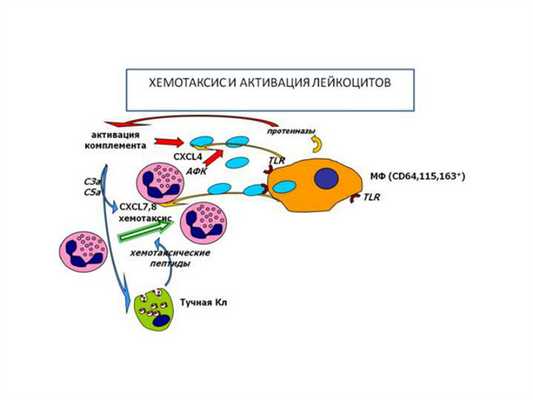
Хемотаксис и активация лейкоцитов
В настоящее время считается, что реципиенты различных хемоаттрактантов присутствуют на поверхности эмигрирующих клеток (макрофагов). Например, были изучены рецепторы на поверхности макрофагов на Fc-фрагменте иммуноглобулинов, компоненте C3 комплемента и лимфокинах. Контакт клеточной мембраны с хемоаттрактантом изменяет мембранный потенциал, увеличивает проницаемость мембраны, увеличивает транспорт ионов Ca и Mg в клетке. Эти ионы контролируют функцию сокращения актомиозина. Активация микрофибрилл и внутриклеточной канальцевой системы способствует гематокриту и эмиграции лейкоцитов.
Отток экссудата способствует прохождению лейкоцитов через эндотелиальную щель. Кроме того, движение лейкоцитов также связано с некоторыми физико-химическими факторами. Воспалительные сурфактанты (аминокислоты, полипептиды) уменьшают поверхностное натяжение поверхности лейкоцитов и образование цитоплазматического объема на их поверхности, но положительно заряженные тканевые макромолекулы снижают отрицательный заряд лейкоцитов, нарушая электростатическую стабильность лейкоцитарной мембраны. Однако основную роль играют активные движения лейкоцитов, использующие энергию мацергических соединений.
Эмигрантские лейкоциты играют важную роль в дальнейшем развитии воспаления. Эти клетки являются источником биологически активных веществ. Однако главная из них - фагоцитарная функция лейкоцитов.
Читайте также:
