Кровопотеря при эндопротезировании тазобедренного сустава
Принципы возмещения кровопотери при операциях
В настоящее время острую кровопотерю лечат с применением комплексных инфузионно-трансфузионных программ, основанных на дифференцированном поэтапном использовании инфузионных растворов и гемокомпонентов с целью стабилизации центральной гемодинамики и периферического кровотока, поддержания ОЦК, системного транспорта кислорода и устойчивого гемостаза.
Полноценное по составу и своевременное восполнение кровопотери, несомненно, представляет собой один из путей уменьшения нагрузки на организм оперируемого. Вопросы совершенствования трансфузиологического обеспечения операций не утратили своего значения и в настоящее время.
Главный принцип возмещения острой кровопотери - сначала восполнить объем, потом восстановить качественные характеристики, поэтому вначале важно оценить величины центрального венозного давления и гематокрита. Более точное представление о волемии дает измерение объема циркулирующей крови и гематокрита.
При сочетании гиповолемии и анемии отмечены значительный рост частоты осложнений, связанных с повреждением оксигенации тканей, и увеличение числа смертельных исходов. Для каждого индивидуума, вероятно, имеется собственное минимальное значение концентрации Hb, обеспечивающее адекватную оксигенацию тканей для полного сохранения сердечно-сосудистого, легочного и метаболического статуса. Однако, как только этот предел преодолен, дополнительная оксигенация тканей становится насущной потребностью.
Быстрое и адекватное восстановление нормоволемии и органной перфузии при переливании солевых и коллоидных растворов при условии адекватной доставки кислорода и объёме кровопотери менее 30% от исходного циркулирующего объёма крови позволяет, как правило, не прибегать к переливанию донорских эритроцитов, не говоря уже о цельной крови.
В современной хирургии у пациентов с исходно нормальным составом крови и отсутствием сопутствующих заболеваний трансфузии эритроцитной массы показаны при уровне гемоглобина ниже 70 г/ л и показателе гематокрита менее 0,30 - 0,33.
Улучшить доставку кислорода к тканям можно различными методами. Первым эффективным шагом по улучшению и достаточному обеспечению тотального ТO2 будет увеличение SaO2. Добавление кислорода к вдыхаемым газовым смесям до FiO2 40 - 60% может значительно увеличить общий транспорт кислорода при том же функциональном состоянии сердца и концентрации Hb.
Функциональное состояние миокарда должно обязательно учитываться при намерении осуществить трансфузию. AG. Greenburg подчеркивает, что оптимизации гемодинамики с целью улучшения транспорта кислорода необходимо достигнуть прежде, чем ставить вопрос о переливании.
Увеличение содержания гемоглобина переливанием эритроцитсодержащих сред представляет собой другой возможный путь.
К.М. Абдулкадыров и С.И. Моисеев вновь обратили внимание на то обстоятельство, что при острой кровопотере и крайне опасном уменьшении объема циркулирующей крови показатели гемоглобина и гематокрита могут длительное время оставаться на удовлетворительном уровне. В подобной ситуации быстрое ухудшение общего состояния больного, появление одышки, сердцебиения, нарастание бледности кожи и слизистых служат основанием для применения эритроцитной массы.
Определение потери крови во время конкретной операции
Объем наружной кровопотери может быть определен визуально, а также гравиметрическим, калориметрическим и электрометрическим методами. Существование многих способов определения величины кровопотери уже само по себе свидетельствует об их несовершенстве.
Визуальная оценка величины кровопотери представляет собой самый несовершенный метод и дает ошибку до 200%. Определение кровопотери одним из объективных методов (например, гравиметрическим) помогает сориентироваться в необходимости трансфузии компонентов крови.
Гравиметрический метод достаточно точно отражает величину наружной операционной кровопотери. Несмотря на критичное отношение к гравиметрическим методам, при повседневном их использовании с введением поправок на испарение жидкости и пропитывание операционного белья они правильно ориентируют оперирующую бригаду и позволяют своевременно выявить отклонение от средних значений кровопотери.
Величина наружной интраоперационной кровопотери гравиметрическим методом по Wangensteen в модификации Е. Cacers и G. Whiteeemburg была определена у 2605 больных.
Средние величины потерь крови при эндопротезировании (n = 2605)
| Вид эндопротезирования | Интраоперационно, | Потеря по дренажам, | ||
| мл | σ | мл | σ | |
| Однополюсное* | 619 | 676 | 373 | 289 |
| Тотальное | 1100 | 185 | 578 | 297 |
| Ревизионное | 1274 | 729 | 449 | 298 |
Примечание: * — не включены случаи экстренного эндопротезирования.
При сборе аутоэритроцитного концентрата использовали прямое измерение величины наружной интраоперационной кровопотери.
Наружная интраоперационная кровопотеря, даже при определении её одним из объективных методов, не отражает в полной мере утрату внутрисосудистого объема.
Для получения достаточно полного представления о размере кровопотери при ортопедических вмешательствах надлежит суммировать наружную (интраоперационную и в ближайшем послеоперационном периоде), дренажную и ориентировочно внутритканевую (имбибиция, межфасциальные гематомы) потери. Следует подчеркнуть такую особенность операций на костях и крупных суставах конечностей, как невозможность полного окончательного гемостаза.
По данным K.R. Sehat с соавторами, после тотального эндопротезирования тазобедренного сустава средняя величина полной потери крови составила 1510 мл и скрытой потери - 471 мл (26%), то есть суммарнокровопотеря была в 1,3 раза больше измеренной.
Величины дренажных потерь в первые сутки после операции эндопротезирования крупных суставов колеблются в широких пределах. При тотальном замещении эти величины составили 20 - 2600 мл при среднем объеме в 578 мл. Ревизионные эндопротезирования тазобедренного сустава сопровождались потерей по дренажам от 50 до 1300 мл (в среднем 449 мл).
Необходимо принимать во внимание и тот факт, что дефицит ОЦК усугубляется при патологическом депонировании и секвестрации эритроцитов, особенно в случае развития постгеморрагического синдрома.
При ортопедических вмешательствах, в отличие от скелетных травм, острая кровопотеря прогрессирует на фоне многочисленных медикаментозных воздействий и инфузионно-трансфузионной терапии. Поэтому клинические проявления гиповолемии возникают позднее, и их выраженность не коррелирует полностью с объемом утраченной крови.
Тактика инфузионно-трансфузионной терапии при эндопротезировании тазобедренного сустава
В процессе ортопедических вмешательств первостепенными задачами инфузионной терапии остаются обеспечение соответствия внутрисосудистого объема емкости сосудистого русла и своевременное адекватное возмещение операционной кровопотери при продолжающейся коррекции имеющихся дефицитов объема и нарушений состава крови.
Основным звеном алгоритма восполнения острой кровопотери является сочетанная инфузия синтетических коллоидных и кристаллоидных растворов. Соотношение компонентов (коллоиды : кристаллоиды) зависит от типа коллоидного препарата и, соответственно, его объемного коэффициента. Соотношение при необходимости может быть изменено в сторону увеличения кристаллоидного компонента в случае исходной гиповолемии.
В РНИИТО им P.P. Вредена при эндопротезировании крупных суставов конечностей применяли следующую тактику инфузионно-трансфузионной терапии.
При вмешательствах с ожидаемой наружной интраоперационной кровопотерей до 1000 мл (до 15 мл/кг массы тела больного или 20% ОЦК), к которым относится большинство первичных операций однополюсного эндопротезирования, установка отдельных видов эндопротезов коленного сустава и даже некоторые ревизионные вмешательства (замена вкладыша вертлужного компонента), возможно использование простейшего алгоритма инфузионно-трансфузионной терапии (ИТТ).
Если отсутствовали прямые показания к катетеризации центральных вен, ограничивались введением катетера или иглы-катетера, обеспечивающих скорость инфузии до 90 - 128 мл/мин, в одну из периферических вен локтевого сгиба или предплечья, надежно фиксировав канюлю.
Кристаллоидные растворы простой и сложной рецептуры (изотонический раствор хлористого натрия, раствор Рингера, Рингер-лактата), изотонический (5%) или гипертонический (10%) растворы глюкозы, при показаниях - с хлористым калием, инфузировали в объеме 10-12 мл/кг массы тела. При величине кровопотери, равной 6-7 мл/кг массы тела, добавляли коллоидные кровезаменители в объеме 4-5 мл/кг и контролировали показатели красной крови. При определении скорости инфузии растворов на основе декстранов, особенно у лиц пожилого возраста с ишемической болезнью сердца, учитывали реальную угрозу его перегрузки за счет гиперволемии.
В плановой хирургии производили заготовку и консервирование собственной крови больного в количестве до 500 мл путем однократного взятия за 4-5 суток до операции.
У пациентов молодого и среднего возраста при высоких исходных показателях содержания гемоглобина и эритроцитов, отсутствии сопутствующих заболеваний альтернативным методом служила острая нормоволемическая гемодилюция с изъятием до 400 - 600 мл крови на консервант ( 150 г/л].
По данным J.J. Callaghan, нормы переливания составили 2,0 ± 1,8 дозы для первичного тотального эндопротезирования тазобедренного сустава и 2,9 ± 2,3 дозы для ревизионного эндопротезирования тазобедренного сустава.
Как установлено многочисленными наблюдениями, при переливании крови от нескольких доноров одномоментно в послеоперационном периоде возможны осложнения (респираторный дистресс-синдром взрослых, почечная недостаточность и т. д.), что многократно увеличивает срок пребывания больных в палатах реанимации и интенсивной терапии, требует применения дорогостоящих препаратов.
В последние годы произошли следующие изменения в тактике трансфузиологического обеспечения: отказ от переливания цельной донорской крови, строгое следование принципам компонентной гемотерапии и (при наличии интраоперационного мониторинга витальных функций) допустимость большей, чем постулировалось ранее, степени снижения концентрации гемоглобина и содержания эритроцитов в условиях нормоволемии у больных без сопутствующей сердечно-легочной патологии.
Компонентная гемотерапия.
Основным принципом гемокомпонентной терапии являются строго дифференцированные показания к применению компонентов крови и соблюдение принципа достаточности.
Значение транспорта кислорода, равное 350 мл/ мин/м 2 , является, по мнению Ю.Н. Шанина, критическим, так как при более низких его значениях возникает устойчивая корреляционная связь между транспортом и потреблением кислорода.
Острая кровопотеря с невозможностью быстрого гемостаза требует применения больших объемов эритроцитной массы, но необходимо учитывать, что переливание свыше 2 доз (> 0,5 л) в сутки увеличивает риск проявления синдрома гомологичной крови и возникновения других посттрансфузионных осложнений. Авторы предлагают следующее соотношение трансфузионных сред при купировании острой массивной кровопотери, к которой относят утрату свыше 1 л крови. На 1 литр кровопотери превышающей 0,5 л, они считают необходимым перелить 1 - 2 дозы эритроцитной массы (200 - 500 мл), 1 - 2 дозы свежезамороженной плазмы (в среднем 200 - 400 мл) и 1 - 1,5 л солевых и коллоидных растворов.
В своей практике мы старались по возможности ограничивать трансфузии компонентов донорской крови у пациентов с нарушениями функции паренхиматозных органов. Для этого, используя дополнительные приемы при проведении общей анестезии (искусственная гипотония, острая гемодилюция) и преимущества регионарных блокад, уменьшали объем интраоперационной и общей кровопотери.
Для сокращения числа переливаний гомологичной крови или эритроцитов прибегали к допустимому снижению уровня гематокрита и содержания гемоглобина. Для некоторых клинических ситуаций показатель гематокрита 30% как предельный для назначения переливания эритроцитов неоправданно завышен.
К больным, которые нуждаются в трансфузии согласно правилу 100/30, относили пациентов с заболеваниями клапанов сердца, ишемической болезнью и лиц старше 65 лет, не имеющих возможности увеличения сердечного выброса и скорости кровотока. У молодых пациентов без сопутствующей патологии при нормоволемии и тщательном мониторном контроле допускали большую (до Ht?25%) степень разведения крови.
Уровень гемодилюции и достаточность замещения контролировали по серийно определяемым показателям гематокрита, содержанию гемоглобина.
Одним из направлений улучшения качества кровезамещения при операциях, сопровождающихся большой кровопотерей, стало внедрение в практику аутогемотрансфузии и обратных переливаний крови.
Трансфузию отмытых эритроцитов изливающейся из раны крови (аутоэритроцитного концентрата) начинали по мере её накопления в резервуаре аппарата. При дальнейшем нарастании кровопотери или снижении Ht до 32 - 30%, а Hb до 110 - 105 г/л дополняли трансфузию консервированной аутокровью. Общий объем замещения на операционном столе составлял 200 - 260%, при этом 60 - 80% объема кровопотери восполняли кровью или эритроконцентратом больного, добавляя при необходимости компоненты донорской крови (эритромасса, свежезамороженная плазма).
Поступление конгломератов клеток и жира в сосудистое русло пациента предупреждали использованием фильтра инфузионных систем с размером пор до 40 мк и исключением из инфузии конечных 30 - 40 мл аутоэритроцитарной взвеси. Соблюдение последнего условия исключало и возможность попадания воздуха в систему для переливания, а, следовательно, сводило до минимума опасность воздушной эмболии.
Ревизионные операции чреваты значительно большей кровопотерей (до 3500 мл, в среднем 1274 ±111 мл). Необходимость высоких скоростей введения разных по текучести препаратов учитывали при выполнении доступа к венозному руслу. Предпочитали катетеризацию центральных вен, что допускает высокую объемную скорость инфузии и контроль центрального венозного давления в динамике.
Анализ 2470 наблюдений показал, что, несмотря на достаточный опыт врачей, осуществляющих катетеризацию центральных вен, и использование современного оснащения, число осложнений этой манипуляции не имеет тенденции к уменьшению, хотя в процентном отношении и не превышает средних величин, приводимых в литературе.
При инфузионно-трансфузионной терапии в случаях массивной кровопотери применяли все виды трансфузионных сред:
- полифункциональные кровезаменители;
- консервированную аутокровь;
- аутоэрироцитарный концентрат, полученный как во время, так и после операции;
- свежезамороженную аутоплазму;
- компоненты донорской крови.
На этапе умеренной кровопотери тактика возмещения и состав инфузии соответствовали описанным выше.
В дальнейшем у больных с нормальными исходными показателями красной крови операционную кровопотерю восполняли растворами и аутоэритроконцентратом. Если циклы отмывания аутоэритроцитного концентрата (АЭК) следовали через 30 - 45 минут, в промежутках между переливаниями взвеси эритроцитов возникала опасность чрезмерной гемодилюции и связанного с этим снижения кислородной емкости крови. Продолжительность эпизодов гемической гипоксии сокращалась за счет более высокого темпа переливания собственных клеток крови, но иногда требовалась дополнительная гемотрансфузия. Чрезвычайно выгодно иметь для этого некоторое количество собственной крови и/или плазмы больного, заготовленной и консервированной до операции. Во избежание снижения компенсаторных резервов эритрона объем предоперационной эксфузии у этой категории больных не должен превышать 10% ОЦК. Возвращенная взвесь аутоэритроцитов составляла от 48,9 до 53,4% величины кровопотери.
При необходимости дополнительно использовали донорскую эритроцитарную массу и свежезамороженную плазму, но уже в значительно меньших количествах, чем при трансфузионном обеспечении без предоперационной заготовки аутогенной крови и интраоперационного возврата.
Описанная тактика позволила в абсолютном большинстве наблюдений обеспечить устойчивость гемодинамических показателей как во время вмешательства, так и в ближайшем послеоперационном периоде.
Р.М. Тихилов, В.М. Шаповалов
РНИИТО им. Р.Р. Вредена, СПб
Как показывают исследования, осложнения после эндопротезирования тазобедренного сустава развиваются у 1 % молодых людей и у 2,5 % пожилых пациентов. Несмотря на мизерную вероятность развития негативных последствий, они могут коснуться любого, а особенно тех, кто не соблюдал в строгости программу реабилитации.
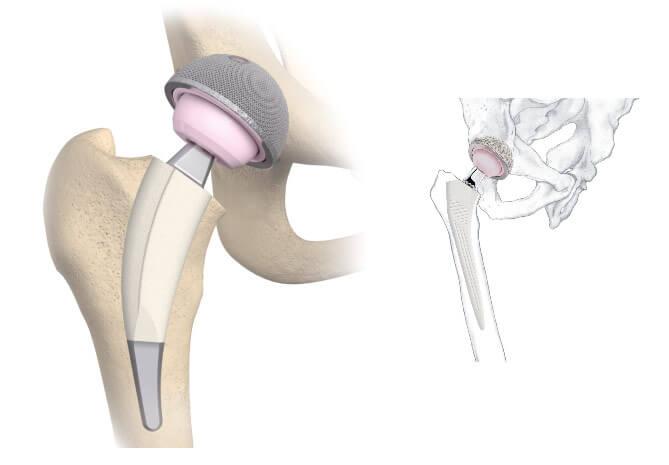
Изображение положения эндопротеза в теле человека.
К осложнениям после эндопротезирования тазобедренных суставов приводят неправильный постоперационный уход и режим физической активности после выписки из стационара. Вторая причина это ошибки врача-хирурга. И третья, это неполноценное предоперационное обследование, в результате которого не были вылечены скрытые инфекции(гланды, цистит и т.д.) На успех лечения влияет квалификация медперсонала, где пациент получал высокотехнологичную медицинскую помощь – хирургическое и реабилитационное лечение.

Статистика осложнений в процентах
- вывих головки протеза развивается примерно в 1,9 % случаев;
- септический патогенез – в 1,37 %;
- тромбоэмболия – в 0,3 %;
- перипротезный перелом возникает в 0,2 % случаев.
Они развиваются не по вине хирурга, а самого пациента, который не продолжил реабилитацию или не придерживался особенного физического режима уже по окончании восстановления. Ухудшение состояния происходит уже дома, когда нет того внимательного контроля со стороны врачей, что был в клинике.
Ни один специалист-ортопед даже с богатым и безупречным опытом работы, не может на 100 % предугадать, как поведет себя конкретный организм после таких сложных манипуляций на костно-мышечной системе, и дать пациенту полнейшую гарантию, что все пройдет гладко и без эксцессов.
Дифференцирование боли: норма или нет
Боли после эндопротезирования тазобедренного сустава будут наблюдаться в раннем периоде, ведь организм пережил серьезнейшую ортопедическую операцию. Болезненный синдром в течение первых 2-3 недель является естественной ответной реакцией организма на недавно перенесенную операционную травму, что не считается отклонением.
Пока операционная травма не заживет, мышечные структуры не придут в норму, пока кости вместе с эндопротезом не станут единым кинематическим звеном, человек будет испытывать какое-то время дискомфорт. Поэтому назначают хорошее обезболивающее средство, которое помогает и легче перенести раннюю болезненную симптоматику, и лучше сконцентрироваться на лечебно-реабилитационных занятиях.
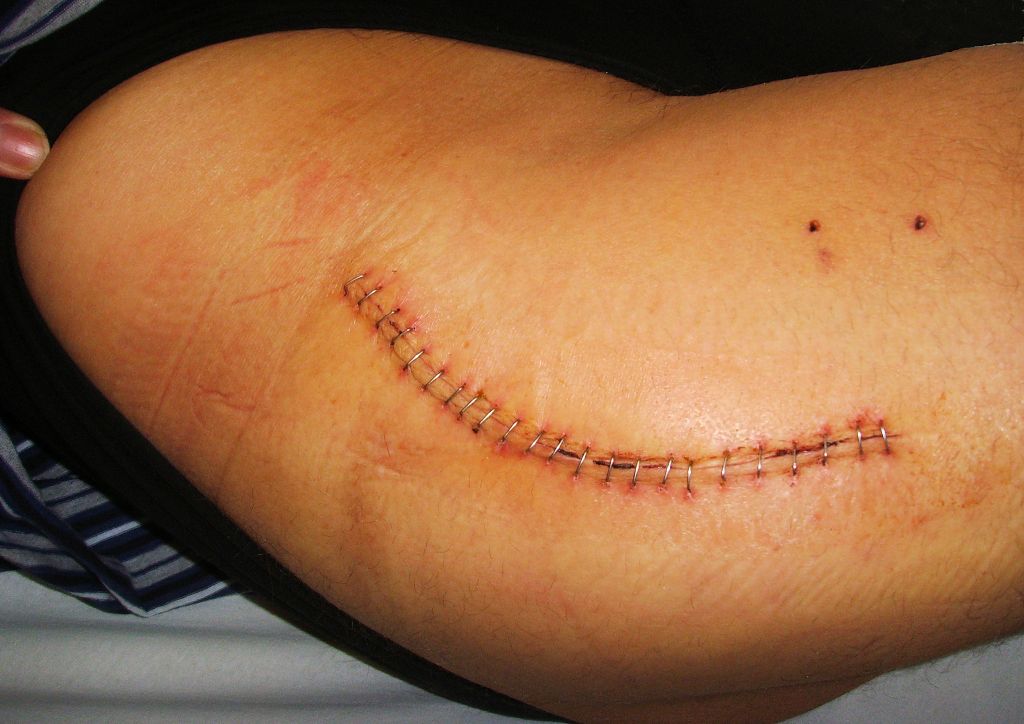
Хорошо заживающий шов после операции. Он ровный, бледный и не имеет выделений.
Болевые ощущения должны быть дифференцированы и обследованы: что из них – норма, а что – реальная угроза. Это может сделать оперировавший хирург. Задача пациента – при любых некомфортных признаках оповещать врача-ортопеда.
Главные факторы риска
Хирургическое вмешательство, не исключает осложнения, причем серьезные. Особенно если были допущены ошибки в интра- и/или постоперационный период. Даже малые погрешности в ходе операции или в течение реабилитации увеличивают вероятность неудовлетворительной артропластики ТБС. Существуют еще факторы риска, которые повышают предрасположенность организма к послеоперационным последствиям и нередко становятся их причиной:
Отметим, что после замены тазобедренных суставов осложнениям больше подвержены люди пожилых лет, а особенно те, кому за 60. У пожилых пациентов кроме основного заболевания, имеются сопутствующие патологии, которые могут усложнить течение реабилитации, например, снизить резистентность к инфекции. Имеются сниженный потенциал репаративно-восстановительных функций, слабость мышечно-связочной системы, остеопорозные признаки и лимфовенозная недостаточность нижних конечностей.

Пожилым людя сложнее восстанавливаться, но и это делается успешно.
Понятие и способы лечения последствий
Симптомы осложнения после эндопротезирования тазобедренного сустава для лучшего восприятия будут представлены ниже в таблице. Быстрое обращение к врачу при первых подозрительных признаках поможет избежать прогрессирования нежелательных явлений, а в отдельных ситуациях сохранить имплантат без ревизионной операции. Чем запущеннее станет клиническая картина, тем сложнее она будет поддаваться терапевтической коррекции.
Негативный эксцесс возникает в первый год после протезирования. Это лидирующее по распространенности патологическое состояние, при котором происходит смещение компонента бедра по отношению к вертлужному элементу, вследствие чего наблюдается разобщение головки и чашки эндопротеза. Провокационный фактор – чрезмерные нагрузки, погрешности в подборе модели и установке имплантата (дефекты угла постановки), использование заднего хирургического доступа, травматизм.
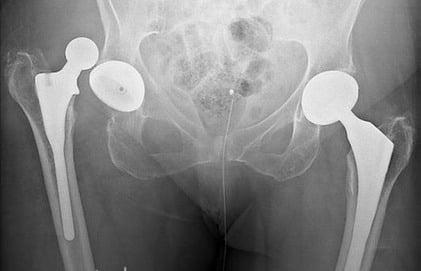
Дислокация бедренного компонента на рентгене.
В группу риска входят люди с переломами шейки бедра, дисплазией, нейромышечными патологиями, ожирением, гипермобильностью суставов, синдромом Элерса, пациенты старше 60 лет. Также особо уязвимы к вывиху лица, перенесшие в прошлом хирургию на естественном ТБС. Вывих нуждается в безоперационном вправлении или открытым способом. При своевременном обращении вправить эндопротезную головку удается закрытым способом под наркозом. Если запустить проблему, возможно, врач назначит повторную операцию с целью переустановки эндопротеза.
Второе по частоте явление, характеризующееся активизацией тяжелых гнойно-воспалительных процессов в районе установленного имплантата. Инфекционные антигены заносятся интраоперационно через недостаточно стерильные хирургические инструменты (редко) или после вмешательства по кровеносному руслу перемещаются от любого проблемного органа, имеющего болезнетворно-микробную среду (часто). Плохая обработка раневой зоны или слабое заживление (при диабете) также способствует развитию и размножению бактерий.

Выделения из операционной раны это плохой сигнал.
Гнойный очаг пагубно воздействует на прочность фиксации эндопротеза, вызывая его расшатывание и нестабильность. Гноеродная микрофлора трудно поддается лечению и, как правило, предполагает снятие имплантата и проведение повторной установки спустя продолжительное время. Основный принцип лечения – тест на установление вида инфекции, долгая антибиотикотерапия, обильный лаваж раны антисептическими растворами.
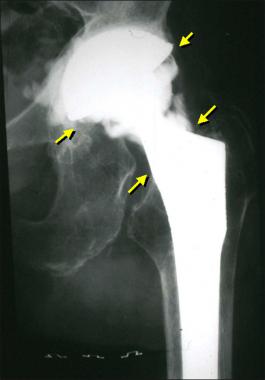
Стрелками указаны зоны инфекционного воспаления, именно так они выглядят на рентгене.
ТЭЛА – критическая закупорка ветвей или главного ствола легочной артерии оторвавшимся тромбом, который образовался после имплантации в глубоких венах нижней конечности из-за низкого кровообращения, ставшего следствием ограниченной подвижности ноги. Виновники тромбоза – отсутствие ранней реабилитации и необходимого медикаментозного лечения, длительное пребывание в обездвиженном состоянии.
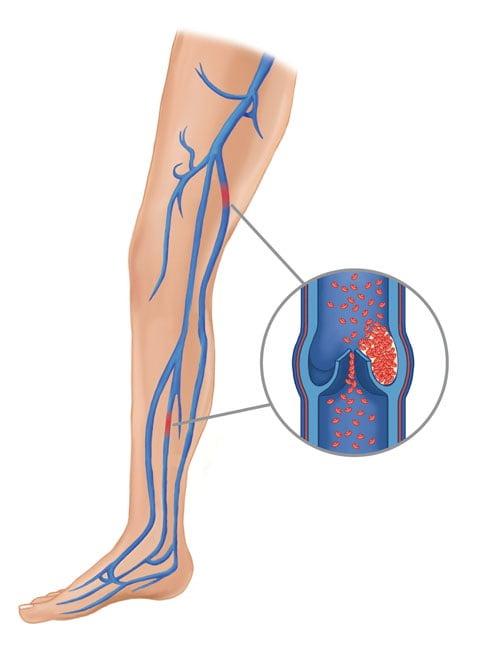
С этим осложнением достаточно успешно работают на данном этапе развития медицины.
Перекрытие просвета легких опасно летальным исходом, поэтому больного немедленно госпитализируют в реанимационное отделение, где, учитывая тяжесть тромботического синдрома: введение тромболитиков и препаратов, уменьшающих свертываемость крови, НМС и ИВЛ, эмболэктомию и пр.
Это – нарушение целостности бедренной кости в зоне ножки при нестабильном и стабильном протезе, возникающее интраоперационно или в любой момент после операции (через несколько дней, месяцев или лет). Переломы чаще происходят по причине сниженной плотности костных тканей, но могут быть следствием некомпетентно произведенной разработки костного канала перед установкой искусственного сочленения, неверно выбранного способа фиксации. Терапия в зависимости от вида и тяжести повреждения заключается в использовании одного из методов остеосинтеза. Ножку, если на то заменяют на более подходящую по конфигурации.
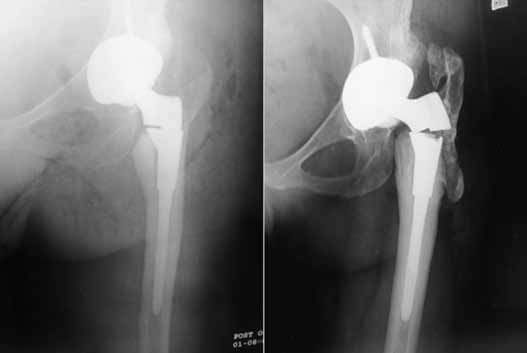
Разрушение импланта происходит очень редко.
Невропатический синдром – это поражение малоберцового нерва, входящего в структуру большого седалищного нерва, которое может быть спровоцировано удлинением ноги после протезирования, давлением образовавшейся гематомы на нервное образование, реже – интраоперационным повреждением вследствие неосторожных действий хирурга. Восстановление нерва выполняется посредством этиологического лечения оптимальным методом хирургии или при помощи физической реабилитации.
При работе неопытного хирурга есть риск травматизации бедренных нервов.
Симптоматика в таблице
Вывих (нарушение конгруэнтности) протеза
Локальный инфекционный процесс
Тромбоз и ТЭЛА (тромбоэмболия)
Перипротезный перелом кости
Невропатия малого берцового нерва
Профилактические меры
Осложнения после протезирования тазобедренного сустава гораздо легче предупредить, чем потом заниматься трудоемким и продолжительным лечением, чтобы от них избавиться. Неудовлетворительное развитие ситуации может свести к нулю все старания хирурга. Терапия не всегда дает положительный эффект и ожидаемый результат, поэтому в ведущих клиниках предусмотрена комплексная периоперативная программа профилактики всех существующих последствий.
Инфекции лечатся антибиотиками, что само по себе достаточно вредно для организма.
На предоперационном этапе выполняется диагностика на предмет инфекций в организме, заболеваний внутренних органов, аллергии и пр. При обнаружении воспалительных и инфекционных процессов, хронических болезней в стадии декомпенсации операционные мероприятия не начнутся до тех пор, пока выявленные очаги инфекций не будут вылечены, венозно-сосудистые проблемы не сократят до допустимого уровня, а другие недуги не приведут в состояние стабильной ремиссии.

В настоящее время практически все импланты изготавливаются из гипоаллергенных материалов.
Если имеется предрасположенность к аллергическим реакциям, этот факт исследуется и берется во внимание, так как от него зависит выбор медикаментов, материалов эндопротеза и вида анестезии. На оценке состояния здоровья внутренних органов и систем, возрастных критериев и веса строится весь хирургический процесс и дальнейшая реабилитация. Чтобы минимизировать до предела риски осложнений после протезирования тазобедренных суставов, профилактику проводят до и в момент процедуры, после операции, включая отдаленный период. Комплексный профилактический подход:
- медикаментозная элиминация инфекционного источника, полная компенсация хронических недугов;
- назначение за 12 часов определенных доз низкомолекулярных гепаринов для предупреждения тромботических явлений, противотромбозная терапия продолжает осуществляться еще некоторый срок после хирургии;
- применение за пару часов до предстоящей замены ТБС и на протяжении нескольких дней антибиотиков широкого спектра действия, активных в отношении обширной группы болезнетворных микроорганизмов;
- безупречное в техническом плане проведение оперативного вмешательства, при этом с минимальной травматичностью, не допуская значительных кровопотерь и появления гематом;
- подбор идеальной протезной конструкции, которая полностью совпадает с анатомическими параметрами настоящего костного соединения, в том числе корректная ее фиксация под правильным углом ориентации, что в будущем гарантирует стабильность имплантата, его целостность и отличную функциональность;
- ранняя активизация подопечного с целью недопущения застойных процессов в ноге, атрофии мышц и контрактур, включение с первых суток занятий ЛФК и процедур физиотерапии (электромиостимуляция, магнитотерапия и пр.), дыхательной гимнастики, а также качественный уход за операционной раной;
- информирование больного обо всех возможных осложнениях, разрешенных и недопустимых видах физической активности, мерах осторожности и необходимости регулярно выполнять упражнения лечебной физкультуры.

Огромную роль в успешном лечении играет коммуникация пациента с медицинским персоналом. Именно это называется сервисом, ведь когда пациента полноценно инструктируют, то он лучше воспринимает процессы происходящие с его организмом.
Пациент должен осознавать, что не только от степени профессионализма докторов зависит итог операции и успешность восстановления, но и себя самого. После протезирования тазобедренного сустава обойти стороной нежелательные осложнения реально, но исключительно при безукоризненном соблюдении рекомендаций специалистов.
Читайте также:


