Опухоль бедренной кости операция

- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
В случае онкологического заболевания в одном из парных органов, его удаление часто позволяет сохранить пациенту жизнь без ущерба для ее качества. Так, например, рак почки эффективно лечится ее удалением, при этом функциональная нагрузка перераспределяется на здоровую почку. Однако в случае с парными конечностями все не так однозначно — ампутация ноги ведет к значительной инвалидизации, депрессии и снижению качества жизни пациента. Для решения данных проблем около 60 лет назад начали применять онкологическое эндопротезирование — замена пораженных опухолью костей и суставов на искусственные конструкции. Клинический случай из моего фоторепортажа наглядно иллюстрирует тактику лечения пациента с учетом перечисленных приоритетов.

Описание клинического случая
В 2007 году у мужчины была удалена почка по поводу онкологического заболевания. Однако через 10 лет были обнаружены метастазы в легких и левой бедренной кости. С помощью иммунотерапии удалось уменьшить очаги в легких, однако опухоль бедренной кости привела к ее патологическому перелому. На снимке видно густое сосудистое сплетение опухоли, которая прорасла в кость и стала причиной патологического перелома шейки бедра:

Сложность операции обуславливалась тем, что удаление метастазов рака почки сопряжено с крупными кровопотерями. Такая опухоль активно выделяет сосудистый фактор роста и очень обильно кровоснабжается. Интраоперационную кровопотерю корректируют переливанием эритроцитарной массы, а эта процедура, в свою очередь, может осложнять клубочковую фильтрацию почек. Поэтому у возрастного пациента с одной почкой выполнять операцию подобного объема очень опасно — высок риск потерять единственную почку. Именно поэтому ему отказали в ведущих медицинских центрах Украины, РФ и Германии. Однако решительно настроенный мужчина все-таки нашел эксперта в лечении пациентов с такой сложной патологией — члена Восточно-европейской группы по изучению Сарком (EESG) — Петра Сергеева, хирурга-онколога клиники Медицина 24/7.
Этап организации доступа
Пациент уложен на правый бок, операционный доступ организуется с внешней стороны левого бедра. Длинна разреза — от проекции тазобедренного сустава до середины бедра. Вид сзади:

После рассечения кожи и жировой клетчатки хирург разрезает мышцы таким образом, чтобы минимизировать травматичность. От этого будет зависеть скорость последующей реабилитации.

Мышцы обильно кровоснабжаются, поэтому часто приходится работать электрокоагулятором:

К удаляемой части бедренной кости крепится несколько крупных мышц, а также сосуды и нервы. Их отделение занимает значительное время операции. На снимке показан момент отсечения связок ягодичных мышц, вид спереди:

Скелетипрована надкостница, бедренная кость готова к резекции.

Этап резекции части бедренной кости с опухолью
Хирургическая электрическая пила-дрель для обработки костей:

Процесс занимает меньше минуты.

В месте распила хирург берет образцы костного мозга и направляет в лабораторию, чтобы убедиться, что оставшаяся часть бедренной кости не содержит опухолевых клеток.

Резецированные связки и фрагмент бедренной кости удаляется вместе с опухолью без вскрытия оболочки кости. На фотографии показаны суставные поверхности тазобедренного сустава:

Хирург объясняет, что удаление большого объема мягких тканей вокруг опухоли снижает риск рецидива злокачественного заболевания.


Этап эндопротезирования
Первые эндопротезы изготавливались заранее под индивидуальный заказ, что не позволяло хирургам пересмотреть планируемый размер резекции кости в ходе операции. Кроме того, необходимо было ждать изготовления изделия не менее 2-х месяцев, что не всегда приемлемо в онкологии. Современные модульные эндопротезы позволяют хирургу прямо во время операции собрать конструкцию с индивидуальными размерами, учитывающими конституцию пациента и особенности клинического случая. Металлические компоненты эндопротеза состоят из сплавов титана, алюминия и никеля, что обеспечивает высокую прочность, низкий вес конструкции, а также инертность в отношении биологических тканей.

Перед установкой эндопротеза костномозговой канал высверливается для удаления костного мозга.

Затем путем многократной обработки костномозговому каналу придается форма шестиугольника — как и у ножки эндопротеза. Такая форма увеличивает площадь контакта ножки эндопротеза с твердыми тканями и обеспечивает более надежную фиксацию.

Специальной насадкой на торце кости формируется фаска для плотного прилегания эндопротеза и равномерного распределения нагрузки:

Перед установкой эндопротеза проводится примерка с использованием набора временных компонентов разных размеров:

Временные элементы конструкции установлены для проведения примерки:

Пациента укладывают на спину, хирург оценивает симметрию и длину ног:

После примерки устанавливаются компоненты эндопротеза с нужными размерами. С учетом удовлетворительного состояния кости хирург принял решение об установке ножки эндопротеза с бесцементной фиксацией. Сначала в костномозговой канал устанавливается ножка эндопротеза. Она имеет матовое напыление гидроксиапатита, чтобы окружающие ткани лучше вросли и зафиксировали эндопротез:

Ножка устанавливается при помощи молотка:

Внешняя часть ножки эндопротеза с креплением:

К ножке фиксируется основной модуль:

К периметру вертлужной впадины тазовой кости пришивается синтетическая муфта-чулок, которая будет служить основой для формирования новой суставной сумки вокруг эндопротеза.

Затем на место удаленной головки бедренной кости в вертлужную впадину тазовой кости устанавливается вкладыш с головкой эндопротеза. Золотистый цвет головке придает напыление нитрида титана — гипоаллергенный и износостойкий материал:

Весь эндопротез укрыт муфтой:

Ранее отсеченные от удаленного фрагмента бедренной кости мышцы подшиваются к муфте. В процессе реабилитации соединительные ткани прорастут в волокна муфты, тем самым образовав прочный связочный аппарат, с помощью которого мышцы смогут вновь управлять конечностью.

Устанавливается дренаж для отведения экссудата лимфы и крови, а также для промывания операционной раны антисептиками с целью профилактики инфекционных осложнений.

Края кожи ушиваются с помощью хирургического степлера за 30 секунд:

После операции выполняется контрольный снимок эндопротеза в 2-х проекциях:

А пациенту давайте все вместе пожелаем сил и терпения, которые понадобятся ему для длительной реабилитации!
Через неделю после операции:
Онкологическое эндопротезирование единственная возможность сохранить хорошее качество жизни после удаления злокачественной опухоли костей. Остеосаркомой, саркомой Юинга, хондросаркомой болеют преимущественно подростки и лица молодого возраста. Имплантация эндопротеза позволяет им вести нормальную жизнь после выздоровления.
Установка импланта никак не влияет на эффективность противоопухолевого лечения.
Органосохраняющие операции как золотой стандарт
Хирургические вмешательства в онкоортопедии начали применять еще в 80-90х годах. Тогда врачи сохраняли нижнюю конечность по строгим показаниям. Эффективность противоопухолевого лечения довольно высока (пятилетняя выживаемость составляет 75-85%).
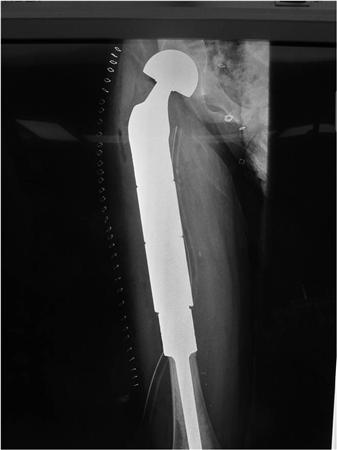
Онкологический имплант бедренной кости.
Эндопротезы устанавливают после удаления опухоли любого крупного сустава (коленного, тазобедренного, голеностопного, плечевого, локтевого). Пациентам со злокачественными новообразованиями плечевых, бедренных, большеберцовых костей выполняют их тотальное или диафизарное эндопротезирование — заменяя не сустав, а часть трубчатой кости.
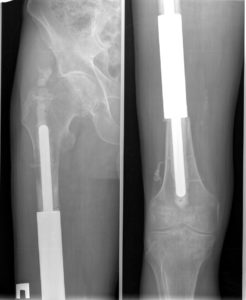
Суть онкологического эндопротезирования заключается в замене удаленных частей сустава искусственными имплантами. Это восстанавливает функции нижней конечности. Операция спасает в 85-90% случаев.
Противопоказания к хирургии
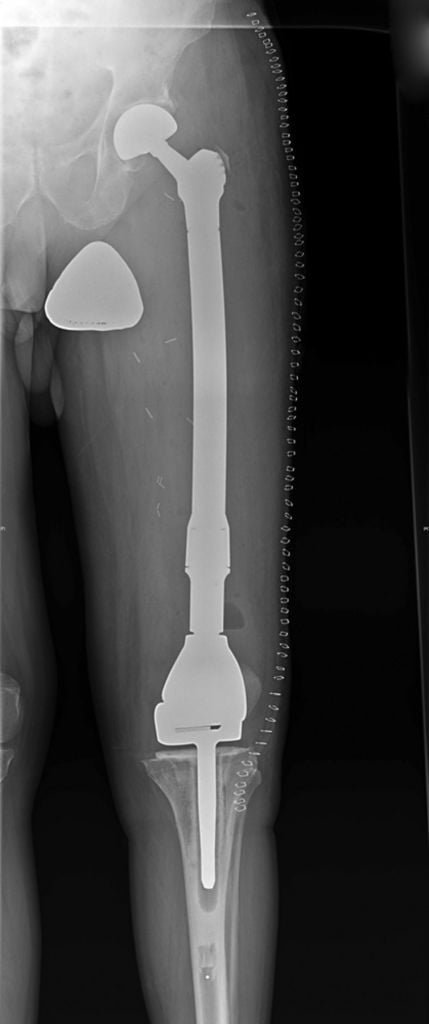
Операция по полной замене бедренной кости с имплантом коленного сустава.
Существует ряд ситуаций, когда ампутация ноги необходима. Иногда отказ от органосохраняющей операции спасает жизнь человека, а попытка сохранить нижнюю конечность приводит к его скорой гибели.
Абсолютные показания к ампутации:
- распад злокачественного новообразования;
- диссеминация (распространение) опухолевых клеток вследствие некачественно выполненной биопсии;
- поражения магистральных сосудов или нервов конечности.
Зачастую врачи рекомендуют ампутацию больным с патологическими переломами, осложнениями химиотерапии и тяжелыми поражениями жизненно важных органов, сопровождающимися декомпенсацией их функций. В этих случаях удаление нижней конечности дает человеку намного больше шансов.
Противопоказанием является невозможность сформировать мышечный футляр для импланта. Это ставит под угрозу приживление протеза и дает риск развития инфекционных осложнений.
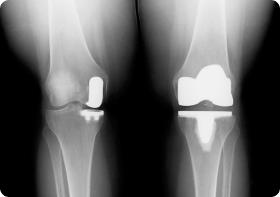
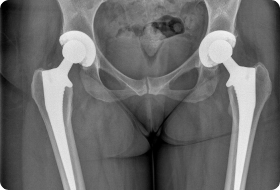
Особенности онкологического эндопротезирования
Если при обычной замене сустава врачи выполняют стандартную резекцию, то при злокачественных опухолях объем удаления костной ткани увеличивается. Врачам нужно подбирать особый имплант каждому больному. Онкологические эндопротезы имеют гораздо больший размер, чем ортопедические.
Таблица 1. Основные различия между онкологическим и обычным эндопротезированием.
| Традиционное | Онкологическое | |
| Предоперационная подготовка | Общеклинические и визуализирующие методы исследования. | Объемное обследование, включающее биопсию, ангиографию, сцинтиграфию, КТ, МРТ и другие нужные методы. |
| Особенности устанавливаемых эндопротезов | Стандартные моноблочные или модульные протезы с цементной или бесцементной фиксацией. | Модульные эндопротезы, форму и размер которых можно отрегулировать в ходе операции. Подобные мегапротезы могут полностью заместить удаленную фрагменты костей. |
| Ход операции | Больному удаляют деструктивно измененные части сустава, а на их место устанавливают эндопротез. | После полноценного обследования пациенту удаляют опухоль вместе с прилегающими тканями. Кости и сустав замещают протезом. Выполняют пластику мягких тканей нижней конечности. |
| Ожидаемые результаты | Полное восстановление функции сустава. Возможны осложнения, устранить которые можно консервативным или хирургическим путем. | Пятилетняя выживаемость после органосохраняющей операции составляет 80%. Онкологическое эндопротезирование позволяет восстановить функции сустава. Риск осложнений в этом случае выше, чем при выполнении обычной ортопедической операции. |
Обследование перед операцией
Перед началом лечения пациента тщательно обследуют. Это помогает выявить злокачественное новообразование, установить его локализацию и размеры.
- Рентгенография. Позволяет подтвердить наличие опухоли и ориентировочно оценить ее размеры. Не дает представления о состоянии магистральных сосудов, нервов, мягких тканей конечности.
- Сцинтиграфия костей скелета. Необходима для выявления метастазов злокачественного новообразования. Обнаруживает опухоли костей любой локализации.
- Биопсия. Наиболее точные результаты дает трепанационная и открытая биопсия. Пункционная и аспирационная менее информативны, поскольку в полученном в их ходе материале не всегда содержатся опухолевые клетки.
- КТ/МРТ. Детальный анализ структуры кости, оценить степень ее разрушения и состояние мягких тканей нижней конечности. Это помогает наиболее точно определить объем резекции и спрогнозировать результаты операции.
- Ангиография. Выявляет дефекты и опухолевые повреждения магистральных сосудов.
- Общеклинические исследования (общий анализ крови и мочи, биохимический анализ крови, ЭКТ, флюорография, УЗИ органов брюшной полости). Необходимы для оценки общего состояния пациента и выявления тяжелых сопутствующих заболеваний.
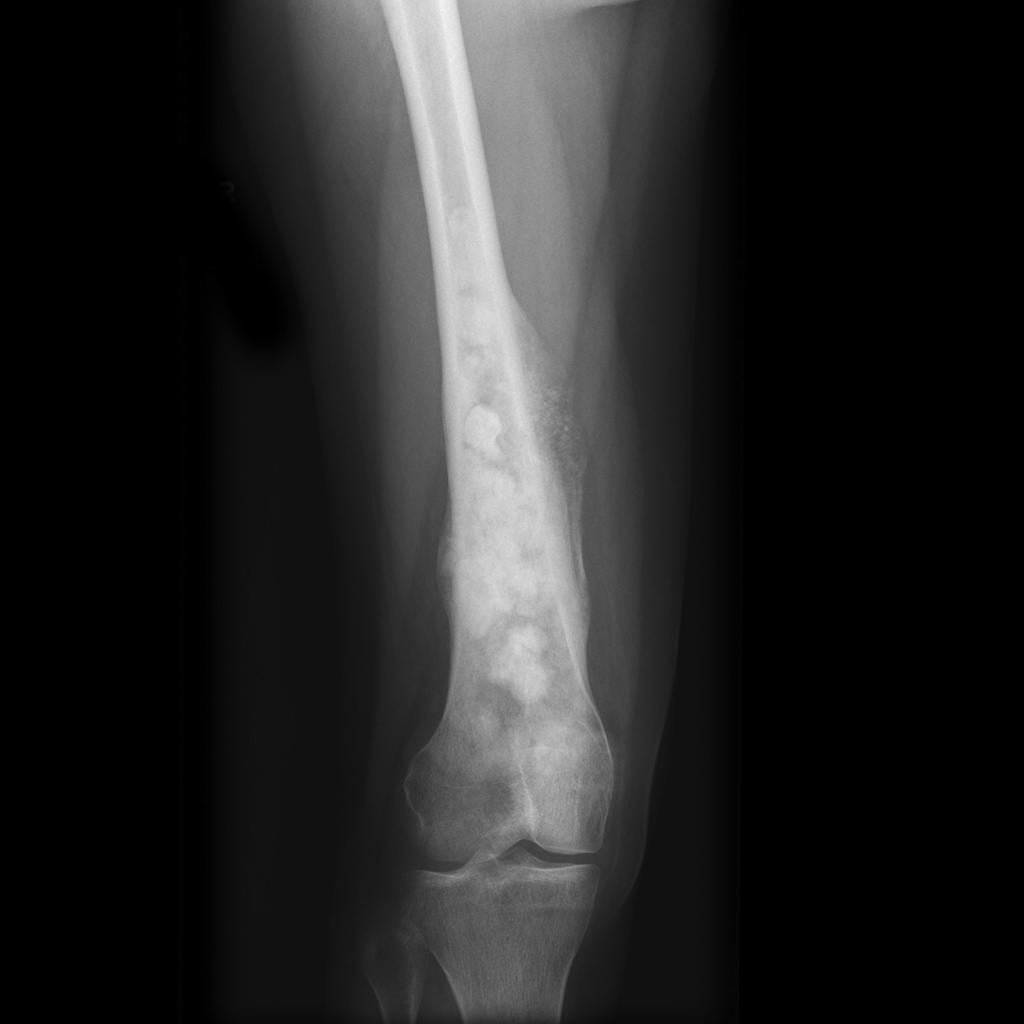
Остеосаркома на рентгене.
Комбинированное лечение опухоли
Для борьбы с опухолями костей используют химиотерапию, лучевую терапию и хирургическое лечение. Их умелое сочетание позволяет проводить органосохраняющие операции даже в тех ситуациях, в которых ранее ампутировали конечность. Химиотерапия позволяет нивелировать последствия перелома или неудачной биопсии.
Онкологические эндопротезы
Импланты, которые используются в онкоортопедии, обычно имеют гораздо больший размер. Это необходимо для замещения удаленных костных тканей. Логично, что мегапротезы нарушают биомеханику сустава, что приводит к нестабильности импланта. При опухолях нижней конечности пациентам могут замещать не только суставы, но и кости. Вид импланта зависит от локализации и размера злокачественного новообразования.
Виды онкологических протезов нижней конечности:
- заменяющие ТБС и часть бедренной кости;
- заменяющие коленный сустав и часть бедренной или большеберцовой кости;
- полностью замещающие бедренную кость;
- спейсеры – замкнутые эндопротезы коленного сустава;
- частично заменяющие и удлиняющие бедренную кость.

Основное отличие онкологических имплантов заключается в их массивности и сложности конструкции.
Производством онкологических протезов занимается несколько компаний: Stryker, ImplantCast, Biomet. Фирмы выпускают модульные эндопротезы, которые можно фиксировать цементным или бесцементным способом.
Особенностью модульных протезов является возможность собрать их во время операции. Это позволяет реконструировать дефекты костей любого размера. Применение модульных эндопротезов дает возможность избежать изготовления индивидуального импланта.
Неожиданные интраоперационные находки в онкологии нередки. Они вынуждают врачей удалять больше костной ткани, чем планировалось. Применение модульных протезов позволяет справиться с этой проблемой с минимальным ущербом для пациента. Чтобы заместить дефект, достаточно всего лишь раздвинуть эндопротез до нужного размера.
Любопытно! В онкоортопедии становятся все популярней эндопротезы с серебряным покрытием. Содержащиеся в нем ионы серебра оказывают антибактериальное действие и снижают риск развития инфекции.
Выполнение операции
Удаление костной ткани и установка протеза при злокачественных новообразованиях происходит совсем не так, как при обычном эндопротезировании. Во время хирургического вмешательства врачи придерживаются целого ряда правил.
Основные правила онкологического эндопротезирования:
- Соблюдение принципа футлярности. Злокачественную опухоль удаляют вместе с окружающими ее фрагментами здоровой костной ткани. Резекцию кости выполняют на расстоянии 5-6 см от новообразования. Вместе с опухолью удаляют зону предшествующей биопсии и все очаги возможной диссеминации.
- Соблюдение правил абластики и асептики. Во время хирургического вмешательства врачи тщательно следят за тем, чтобы опухолевые клетки не проникли в здоровые ткани. Чтобы избежать диссеминации, вначале перевязывают артерии и вены, а лишь затем иссекают опухоль. Параллельно с этим медработники проводят тщательную профилактику инфицирования операционной раны.
- Восстановление двигательной функции конечности. После установки протез прикрывают мышечными лоскутами и делают необходимую пластику. Это позволяет избежать развития инфекционных осложнений и некроза тканей в будущем.
- Адекватное послеоперационное ведение больных. Качественная реабилитация и правильное поведение пациента в послеоперационном периоде помогает восстановить функцию сустава и снизить риск возникновения непредвиденных осложнений.
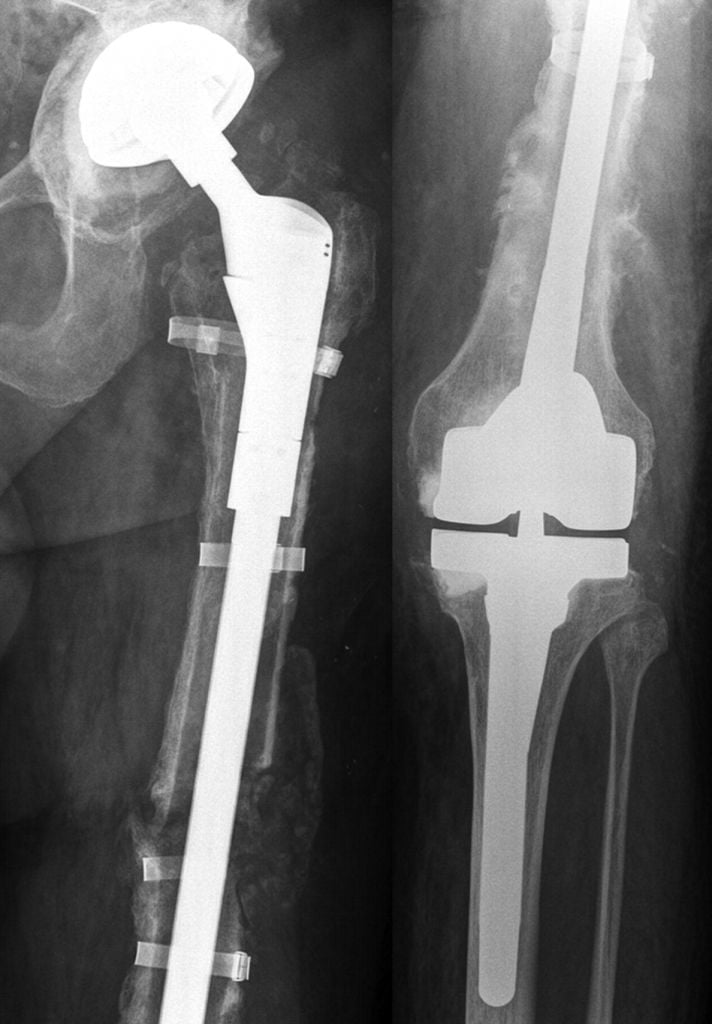
Массивный онкологический эндопротез ТБС.
Факт! Результаты органосохраняющей операции зависят от размера опухоли, степени ее злокачественности, поражения мягких тканей, сосудов и нервов конечности. Немалую роль в успехе лечения играет и внимательность, добросовестность и опытность врачей.
В Д. Сикилинда, Е.Г. Локшина, В.К. Татьянченко, А.И. Крамаров
Опухоль бедренной кости – значительное число доброкачественных опухолей скелета, а в некоторых случаях и злокачественных (в том числе и метастатическое поражение шейки бедренной кости) требуют хирургического вмешательства с резекцией патологически измененных тканей, восполнения тканевого дефекта и сохранения сегмента, а следовательно, и функции конечности. Сохранные операции находят все большее применение в современной онкоортопедии (Костандян Л.И. и соавт., 1976; Зацепин С.Т., 1984).
Распознавание опухолей костей является трудной задачей. От своевременной диагностики зависит не только характер оперативного вмешательства, но и жизнь больного. Многообразие нозологических опухолей усложняет клинико-рентгенологическую диагностику их.
Предложено несколько способов пункции тазобедренного сустава и шейки бедренной кости, которые выполняются спереди, снаружи и сзади. При пункции опухоли снаружи, как рекомендует большинство авторов, больной лежит на спине или здоровом боку с максимально разогнутыми ногами. Троакар вводится со стороны большого вертела. При передней пункции игла вводится перпендикулярно в проекции шейки бедренной кости. После анестезии кожи, подкожной клетчатки, фасции, напрягателя широкой фасции бедра или средней и малой ягодичных мышц троакаром проникают через указанные анатомические образования к опухоли. Данные способы достаточно травматичны. Если в первом случае создается канал в большом вертеле, который сохраняется при последующем эндопротезировании, то во втором случае повреждается значительный мышечный массив. Как известно, при распространении опухоли поврежденная мышечная ткань не является преградой, лишь фасция служит некоторым препятствием. Таким образом, пункция спереди и через большой вертел способствует распространению опухоли в этих направлениях, а это делает проблематичным сохранение большого вертела. При введении же троакара сзади повреждается большая ягодичная мышца.
Новая методика пункционной биопсии тазобедренного сустава (заявка N 5056924/14, решение о выдаче патента РФ от 30.07.93 г.) предусматривает доступ через ямку, расположенную в области передней поверхности бедра, которая появляется при отведении нижней конечности с наружной ротацией. Эта ямка обусловлена межмышечным промежутком портняжной мышцы и напрягателя широкой фасции бедра. В этом месте удается проникнуть к шейке бедренной кости, не повреждая указанных мышц. Резкая наружная ротация нижней конечности максимально приближает шейку бедренной кости к описанной ямке. Изучая на трупах людей особенности прохождения тканей троакаром под углом в 60° к верхней передней подвздошной ости, мы установили, что при этом не повреждается ни одной мышцы. Троакар проходит в межфасциальном пространстве и через капсулу сустава, которые являются относительным препятствием для роста опухоли. Таким образом, предложенный доступ, на наш взгляд, не травматичен, исключает контакт опухоли с мышцей. После эвакуации иглы мы выполняли коагуляцию раневого канала с целью абластики.
Результаты обследования больных определяли дальнейшую тактику дооперационного лечения, обусловливали характер анестезиологического обеспечения, вид операционного вмешательства и послеоперационное ведение пациентов.
Костно-пластический этап операции мы проводим васкуляризированным трансплантатом из крыла подвздошной кости на фиксированной сосудисто-нервной ножке (патенты РФ N 2003298, 1805925).
Отличительной особенностью разработанных нами способов от известных было следующее:
– выделение хорошо кровоснабжаемых зон крыла подвздошной кости в местах прикрепления мышц с проходящими в толще их сосудами магистрального типа и нервами;
– наличие сосудистой ножки достаточной длины необходимой для формирования сложного трансплантата и перемещения его в зону костного дефекта;
– костная часть сложного трансплантата имела достаточную величину способную заместить костный дефект образовавшийся после удаления опухоли;
– создание условий для свободного размещения трансплантата без перегиба сосудисто-нервного пучка после его разворота и ротации.
При злокачественных опухолях в показанных случаях, включая метастатическое поражение кости, осуществлялась резекция проксимального конца бедренной кости с эндопротезированием сустава.
Исходя из принципов абластичности и футлярности при метастазах опухоли в шейку бедренной кости требуется удаление всего патологического очага. Учитывая внутрисуставное расположение опухоли, мы удаляем головку и шейку бедренной кости, включая часть метафизарной области вместе с капсулой тазобедренного сустава. Удаление опухоли блоком вместе с капсулой сустава позволяет исключить возможность распространения опухолевых масс в операционной ране. В этом случае мы разработали технику оперативного вмешательства (патонт РФ N 2012269).
Разработанные способы операций позволяют решать ряд задач реабилитации больных с костными дефектами проксимального отдела бедренной кости. Эксперименты на животных показали целесообразность и высокую эффективность (96,16%) использования сложных трансплантатов, перемещенных в зону дефекта путем разворота их на сосудисто-нервной ножке. Использование в клинике иннервируемых и кровоснабжаемых трансплантатов позволило достичь приживление трансплантатов у всех больных со средними сроками консолидации 3,47±0,2 мес. Использование эндопротезов позволяет избежать ампутации и сохранить функцию конечности.
Пациентка О. 25 лет обратилась в поликлинику по месту жительства с жалобами на хромоту, боли в паховой области справа преимущественно ночью, иррадиирующие в правый коленный сустав. Во время беременности на 6- 7 месяце боли распространились на кости таза, а также возникло уплотнение в области правой половины таза. Во время родов 01.01.2014 года отмечалась слабость в правой ноге, онемение конечности. Через неделю появились боли в нижней части спины. Осмотрена гинекологом , выполнены КТ головного мозга и брюшной полости, рентген легких и таза. При обследовании выявлено образование в области правой половины таза. Выполнена биопсия: гистологическая картина может соответствовать хондросаркоме (Grade 1). Нельзя также исключить хондробластический вариант остеосаркомы, но гистологически больше данных за хрящевую опухоль.
Заключение по рентгенологическому исследованию от 10.02.2014: на рентгенограмме костей таза определяется преимущественно литическая деструкция тела и горизонтальной ветви правой лонной кости со вздутием, спикулообразным периостозом и довольно четко ограниченным, большим экстраоссальным компонентом с участками патологического остеогенеза, общими размерами 10*9см. Патологический перелом горизонтальной ветви правой лонной кости. Рентгенологическая картина может соответствовать остеосаркоме правой лонной кости, осложненной патологическим переломом. На представленных снимках таза и КТ определяется литическая деструкция костей правой половины таза.
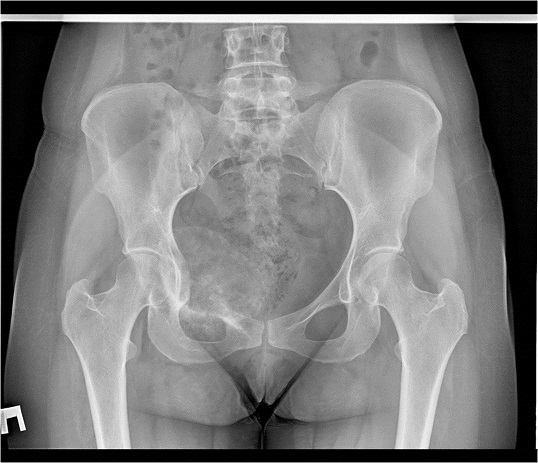
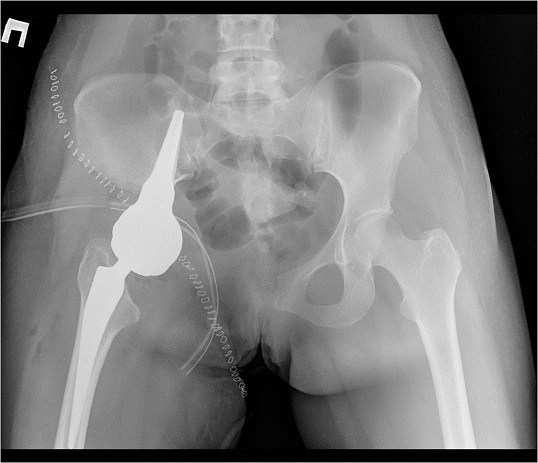
В марте 2014 года в нашей клинике пациентка оперирована. Ей выполнена резекция костей таза с удалением опухоли и эндопротезированием. Морфологический диагноз по данным исследования операционного материала - хондробластическая остеосаркома правой лонной кости, Grade 3, с инвазией мягких тканей. В краях резекции опухолевого роста не выявлено, как и во всех удаленных лимфатических узлах.
Послеоперационный период протекал без осложнений. В октябре 2014 года пациентка уже могла передвигаться самостоятельно без опоры. В настоящее время чувствует себя удовлетворительно.
Еще более интересный случай мы наблюдали 2 года назад. С хирургической точки зрения клиническая ситуация была непростой, но уникальность наблюдения заключается в том, что после операции больная смогла выносить и родить здорового ребенка.
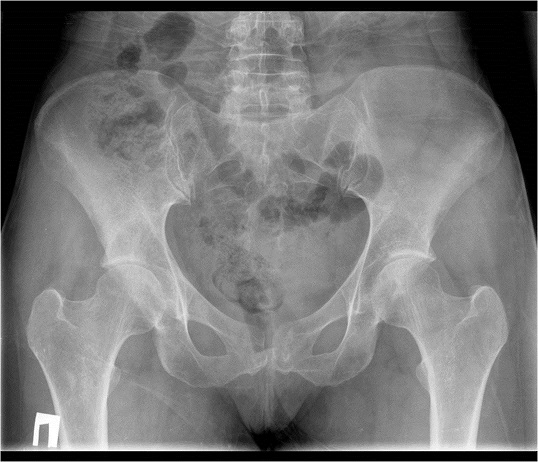
Пациентка Б. 40 лет в декабре 2011 года обратилась в поликлинику по месту жительства с жалобами на сильные боли в правом тазобедренном суставе, хромоту. Выполнены 4 блокады, в дальнейшем консультирована неврологом, проводилась терапия корешкового синдрома консервативными препаратами без выраженного эффекта.
С течением времени жалобы нарастали, в июне 2012 года при обследовании по данным серии рентгенограмм патологии не выявлялось, однако по данным МРТ и КТ в ноябре 2012 в теле правой подвздошной кости определялся очаг остеолитической деструкции без четких контуров, размерами до 4,5х3,2х1,7см, структура очага неоднородна.
Пациентка поступила в нашу клинику, была обследована, поставлен диагноз хондросаркома подвздошной кости с разрушением кортикального слоя и подрастанием к прилежащим мягким тканям, Grade 2. Мелкий участок роста хондросаркомы (диаметром 0,6 см) обнаружен в проксимальном отделе шейки бедренной кости.
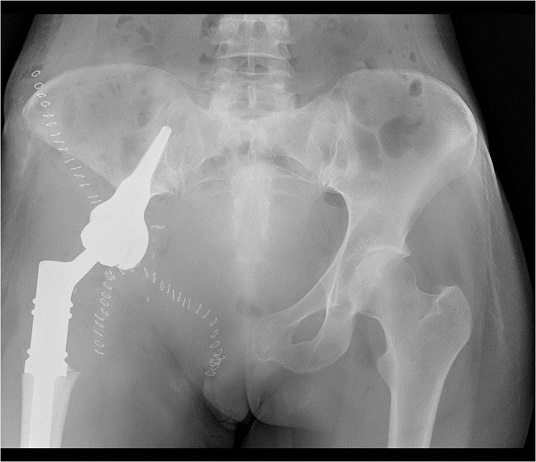
После необходимой подготовки пациентке выполнена резекция костей таза с удалением опухоли и эндопротезированием. В послеоперационном периоде осложнений не было, пациентка довольно быстро вернулась к самостоятельной двигательной активности. Реабилитация после проведенного хирургического вмешательства была настолько полной, что в 2014 году пациентка смогла выносить и родить ребенка.
Следует отметить, что выполнение одномоментного онкологического эндопротезирования в хирургии опухолей опорно-двигательного аппарата значительно сокращает время реабилитации пациентов, увеличивает качество их жизни. До начала применения эндопротезов подобные операции проводились без замещения дефекта. Пациенты, перенесшие оперативное вмешательство, передвигались с опорой, или без опоры, но значительно прихрамывая.
Читайте также:






