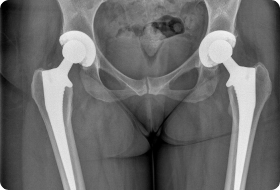
Трансплантация хряща тазобедренного сустава

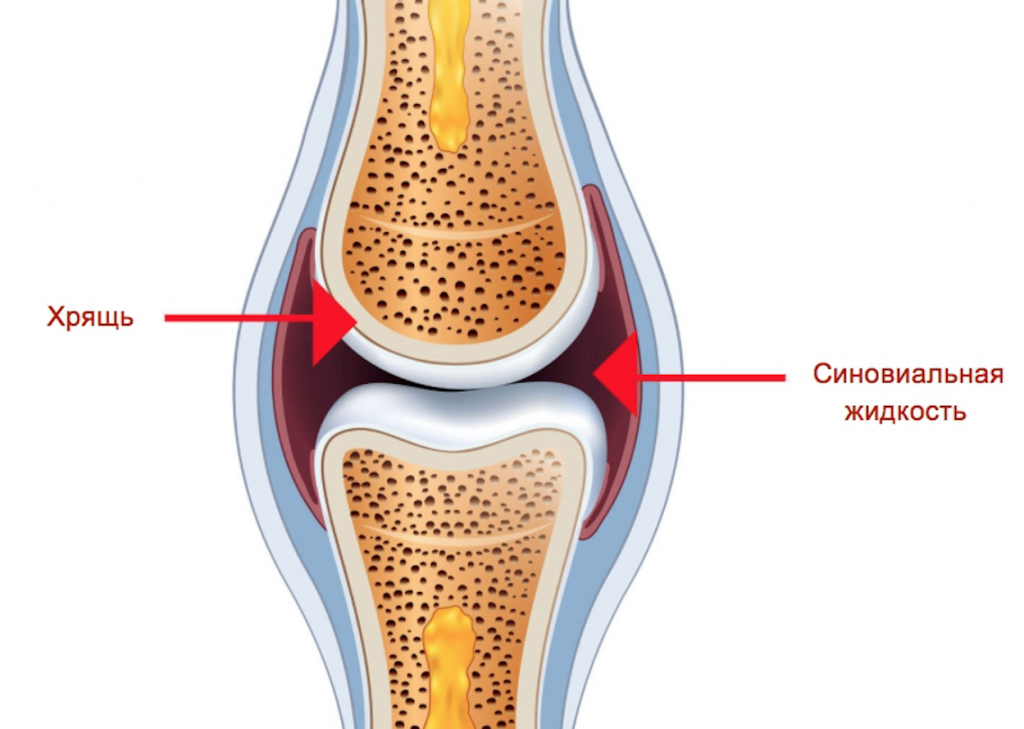
Тазобедренный сустав, как наиболее сложно устроенный подвижный костный участок организма, ежедневно претерпевает большое количество нагрузок. Чтобы опорно-двигательная система функционировала исправно, костная бедренная область устлана хрящевой тканью. Она обеспечивает амортизацию тазобедренному сочленению, защищая костный участок от повреждений.
Тем не менее, тазобедренный хрящ, как и любая область тела, на которую ежедневно влияют внешние факторы, способен изнашиваться. Повреждения хрящевой ткани могут быть вызваны механически или определенными болезнями, такими как коксартроз.

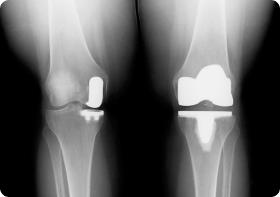
В результате, поврежденные хрящи делают костную ткань тазобедренного сустава уязвимой и более восприимчивой к внешним воздействиям. При этом в упомянутой области возникают боли, деформации, а ее движения ограничиваются. Как следствие, повреждения хрящевой ткани неизбежно ведут к эндопротезированию – операции по замене тазобедренного сустава имплантатом.
Однако современная медицина шагнула далеко вперед, и сегодня пациенты, страдающие от болезней хрящей, могут выбрать инновационный метод операции — трансплантацию хрящевой ткани тазобедренного сустава. Такая технология предполагает выращивание необходимого количества хрящевой массы из небольшой части здоровой ткани.
Эффективность
Трансплантация хрящевой ткани тазобедренного сустава способна устранить болевые ощущения, присутствующие в организме пациента, полностью или практически полностью (в зависимости от стадии повреждения тканей). К тому же, такое оперативное вмешательство может значительно оттянуть сроки установки эндопротеза, вернув пациента к привычному для него образу жизни и улучшив двигательную активность организма. Эффективность метода трансплантации хрящевой ткани тазобедренного сустава научно проверена и доказана. Оперативное вмешательство позволяет добиться таких результатов:
Еще одним преимуществом трансплантации бедренного хряща является практически полная неинвазивность хирургического вмешательства, что позволяет организму быстрее регенерировать.
Кому показана операция
Важным моментом при назначении лечащим врачом операции по хрящевой трансплантации бедренной области является возраст больного. Так, хирургическое вмешательство можно проводить у больных, достигших возраста 15 лет. Крайний порог для проведения трансплантации – 55 лет.
Однако специалист может назначать процедуру и в более раннем, а также, позднем возрасте пациентов. Решающую роль при назначении играет физическое состояние организма больного.
Трансплантацию тазобедренной зоны назначают только в том случае, если:
- Дефекты хрящевой ткани составляют не менее 2,5-10 квадратных сантиметров в диаметре;
- Диагностировано ненормальное смещение физиологических осей сустава;
- Связки и мышечные ткани бедренной области не имеют повреждений.
Как происходит

Прежде, чем назначить соответствующую операцию, лечащий врач должен провести полную диагностику организма при помощи таких действенных методик, как рентгенография, магнитно-резонансная терапия и ультразвук. Определившись, что в конкретном случае операция по трансплантации хрящевой ткани необходима, проводится практически неинвазивная хирургическая процедура по изъятию здорового хрящевого участка, на который не оказывалось серьезное внешнее воздействие.
Помимо хрящевой ткани, у пациента необходимо произвести забор крови в небольших количествах. При помощи крови в дальнейшем будет обеспечена выработка сыворотки – так хрящевая ткань сможет разрастаться в привычных условиях. После забора образцов ткани пациенту показано двухдневное пребывание в больнице. При этом нагрузки на прооперированную ногу должны быть минимальными.

Новые хрящевые клетки выращиваются в лабораторных условиях, такой процесс происходит в разы быстрее, нежели в человеческом организме. Поле того, как достаточное количество хрящевой ткани будет произведено, ее замораживают и транспортируют в больницу, где будет проходить второй этап хирургического вмешательства. Зачастую, временной отрезок между забором образцов и трансплантацией составляет не более 8 недель.
Спустя 2 суток после операции, пациента выписывают из больницы. В течение 6 недель прооперированный сустав не должен подвергаться нагрузкам, чтобы обеспечить хрящевым клеткам возможность быстро разрастаться. Уже спустя 12 месяцев после проведения трансплантации, имплантированную хрящевую ткань невозможно будет отличить от природной структуры, а пациент вернется к привычному для него образу жизни.
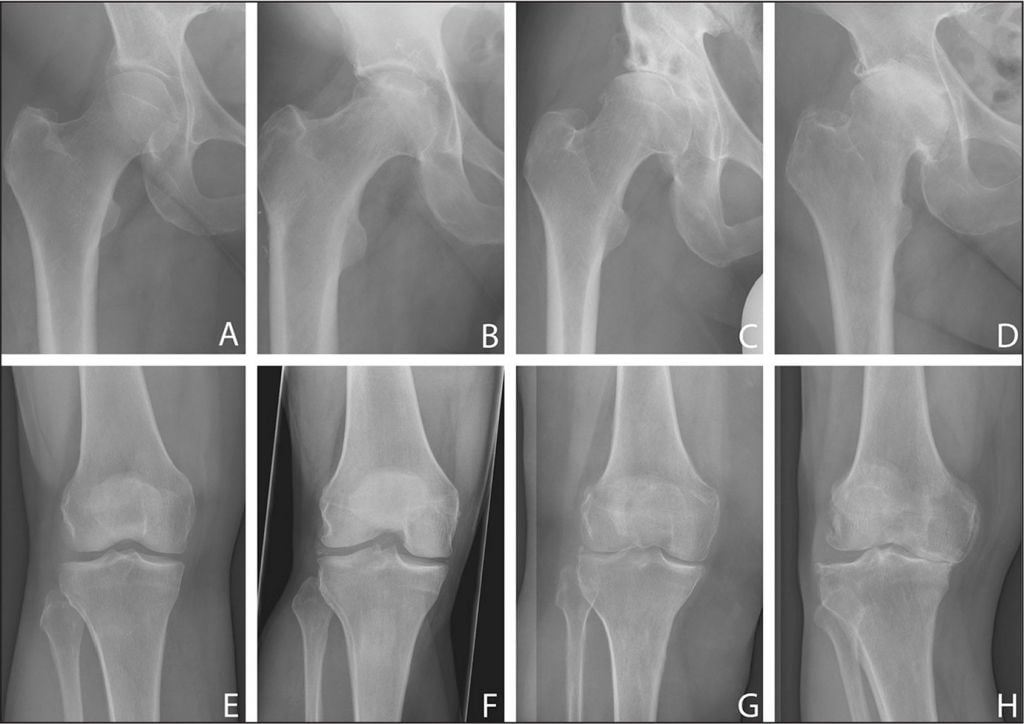
Патология поражает преимущественно лиц пожилого возраста. По статистике, артроз выявляют у 80% людей старше 75 лет. Чаще выявляют у мужчин и женщин моложе 45 лет. Такое положение вещей вынуждает ученых искать альтернативные методы лечения ОА, позволяющие побороть его без травматичного хирургического вмешательства.
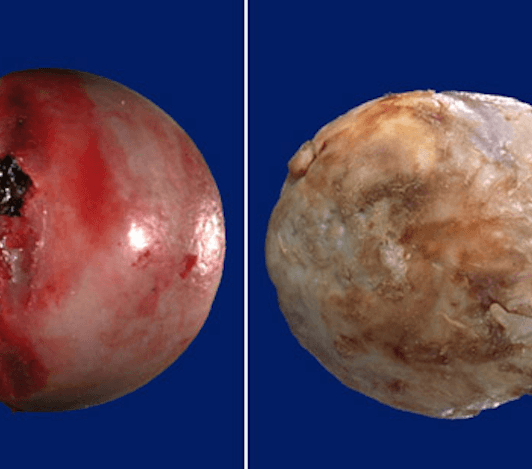
Здоровая хрящевая ткань в сравнении с дегенеративно измененной головкой бедренной кости.
Для остеоартроза характерно поражение крупных суставов, сопровождающееся разрушением внутрисуставных хрящей. Из-за нарушения кровоснабжения и обмена веществ хрящевая ткань отекает и теряет эластичность, что приводит к развитию деструктивных процессов. Со временем хрящи изнашиваются и истончаются. В дальнейшем генеративные процессы распространяются на эпифизы костей, участвующих в формировании сустава.
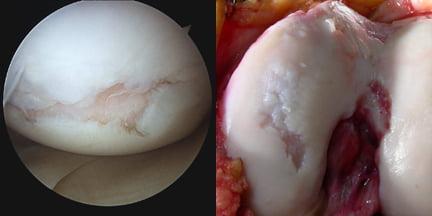
Так выглядит хрящ коленного сустава при остеоартрозе.
В настоящее время ученые из разных стран проводят исследования, главная цель которых – научиться восстанавливать нормальную структуру суставных хрящей. К сожалению, им еще не удалось разработать универсального метода, позволяющего победить ОА без операции.
Факт! На сегодня эндопротезирование является единственным радикальным методом лечения деформирующего ОА. Все остальные методики позволяют лишь замедлить развитие болезни и улучшить самочувствие пациента.
Клеточная и тканевая инженерия
Данные направления медицины занимаются изучением проблем регенерации хрящевой ткани. Суставные хрящи пробуют восстановить с помощью клеточно- и тканеинженерных конструкций (КИК и ТИК). Эти два подхода имеют одну и ту же цель – заместить разрушенные фрагменты хрящей нормальной, полноценной тканью.
Не путайте инженерию с трансплантацией. Это два совершенно разные понятия. Запомните, что аутотрансплантация собственных тканей или жидкостей не является методом клеточной или тканевой инженерии. Об этих методиках речь идет лишь в случае применения искусственно синтезированных или культивируемых биоматериалов.
Биомедицинские клеточные продукты для регенерации хрящевой ткани
В наше время в клиническую практику постепенно внедряются биомедицинские клеточные продукты, содержащие аутологичные (то есть принадлежащие самому человеку) хондроциты. Одни лекарства представляют собой чистый субстрат этих клеток, другие содержат еще и биодеградируемый носитель (матрикс, скаффолд).
Факт! Ученые считают, что для культивирования лучше всего использовать хрящевые клетки носовой перегородки. Они обладают достаточно высоким потенциалом для дифференциации, а получить их совсем несложно.
Таблица 1. Средства для восстановления хрящевой ткани.
Помимо перечисленных в таблице существует множество других продуктов клеточной инженерии (Chondrogen, MACI, ChondroCelect и т.д.), которые теоретически можно использовать для восстановления поврежденных хрящей. К сожалению, все они пока что проходят разные фазы клинических испытаний. Это значит, что в практической медицине они начнут применяться как минимум через несколько лет.
Создание искусственных хрящей
Не так давно ученые были уверены, что суставной хрящ окажется одной из первых искусственных тканей. Однако в процессе его создания разработчики столкнулись с целым рядом трудностей. Как выяснилось, скопировать структуру и биомеханические свойства хрящевой ткани крайне трудно, практически невозможно.
В наши дни все еще продолжается работа над созданием искусственных хрящей, которые в точности повторяли бы структуру естественных. Пока что данное направление инженерии считается наиболее перспективным. Вполне возможно, что создание качественных ТИК вскоре станет настоящим прорывом в лечении деформирующего артроза.
Методы клеточной и тканевой инженерии пока что находятся на стадиях разработки и внедрения в клиническую практику. Они выглядят довольно перспективно, но пока что не могут полностью заменить эндопротезирование. Однако существует высокая вероятность того, что уже через несколько десятилетий от артроза можно будет избавиться с помощью нескольких уколов.
Методы аутотрансплантации
Аутологичная трансплантация – это использование собственных тканей и жидкостей пациента для введения в суставную полость. В наши дни с этой целью применяют хондроциты, клетки-предшественницы из надкостницы и надхрящницы, обогащенную тромбоцитами плазму (ОТП), мультипотентные мезенхимальные стволовые клетки (ММСК).
На начальных стадиях болезнь не диагностируется, так как не бывает жалоб, все проходит бессимптомно.
Восстановление хрящевых тканей эффективно только на начальных стадиях остеоартроза, когда в патологический процесс еще не вовлечены кости. К сожалению, методики инженерии и аутотрансплантации пока что не позволяют устранить дефекты костной ткани. Человеку с III-IV стадией ОА может помочь только эндопротезирование.
Обогащенная тромбоцитами плазма
Известно, что тромбоциты содержат факторы роста и вещества, которые являются потенциальными хондропротекторными агентами. Следовательно, ОТП можно с успехом использовать для стимуляции регенеративных процессов в суставных хрящах. Отметим, что хорошего эффекта от лечения можно добиться лишь с помощью плазмы, содержащей не менее 1000 000 тромбоцитов в 1 мкл.
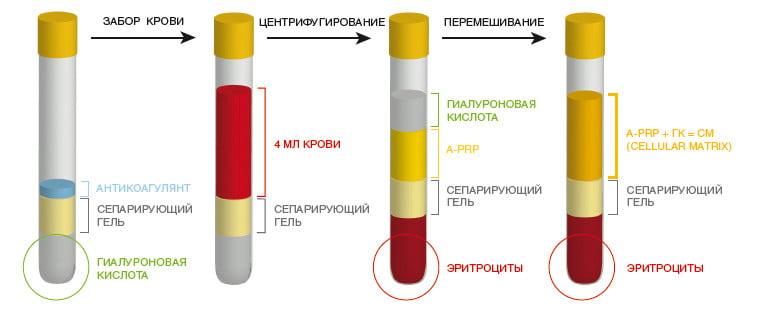
ОТП добывают путем двухступенчатого центрифугирования венозной крови. Полученный материал вводят в количестве 5 мл трижды с интервалом в 2-3 дня. Будучи абсолютно безопасной, данная методика позволяет улучшить функциональное состояние сустава и повысить качество жизни пациента. Отметим, что применение обогащенной тромбоцитами плазмы более эффективно у молодых пациентов с незначительными дегенеративными изменениями суставов.
Стромально-васкулярная фракция жировой ткани
В наше время в регенеративной медицине используются ММСК, полученные из костного мозга и жировой ткани. Причем применение последних является более оправданным ввиду их несложного получения, высокого пролиферативного потенциала и низкого коэффициента старения. Отметим, что из эквивалентного количества жировой ткани можно получить в 1000 раз больше мультипотентных мезенхимальных стволовых клеток.
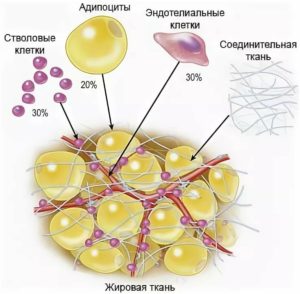
Стромаваскулярной фракцией (СВФ) называют совокупность всех ядерсодержащих клеток (в том числе и ММСК), которые можно добыть из подкожного жира путем ферментативного расщепления. Данная субстанция обладает выраженным регенерирующим, противовоспалительным, антисептическим и иммуномодулирующим действием. По мнению многих ученых, СВФ жировой ткани обладает массой преимуществ по сравнению с методами клеточной инженерии и культивированием ММСК.
Факт! Для приготовления СВФ не нужно культивирование, которое может осложниться микробной контаминацией, генетической трансформацией или спонтанной дифференцировкой. Это делает стромально-васкулярную фракцию более привлекательным продуктом для применения в клинической практике.
Синовиальное протезирование
Как известно, при остеоартрозе нарушается качественный состав, вязкость и упругость внутрисуставной жидкости, что ведет к постепенному разрушению хрящей. Исправить эту ситуацию можно путем внутрисуставного введения протеза синовиальной жидкости – очищенного гиалуроната натрия с хорошими вязкоупругими свойствами.
Доказано, что инъекции гиалуроновой кислоты позволяют замедлить развитие артроза и восстановить функции сустава. Отметим, что метод практически бесполезен на ІІІ и ІV стадиях ОА, сопровождающихся выраженными деструктивными изменениями костей. С его помощью можно лишь временно облегчить боль и улучшить самочувствие. К сожалению, вскоре неприятные симптомы возвращаются вновь.
Не так давно ученые выяснили, что эффективность синовиального протезирования можно повысить с помощью простых и доступных методов. К примеру, периартикулярные инъекции ферментных препаратов (Лидаза, Ронидаза, Лонгидаза) и мануальная терапия помогают добиться более удовлетворительных результатов, чем монотерапия препаратами гиалуроновой кислоты. Отметим, что выполнение инъекций под УЗ-контролем делает процедуры менее опасными.


Таблица 2. Наиболее популярные протезы синовиальной жидкости.
| Препарат | Производитель | Описание |
| Ферматрон | Хайэлтек, Великобритания | Выпускается в специальных шприцах для внутрисуставных инъекций. Лекарство вводится в синовиальную полость 1 раз в 7 дней. Чтобы добиться заментых результатов, требуется 2-3 укола. Стоимость разовой дозы Ферматрона – 4100 рублей. |
| Остенил | Хемедика, Германия | Препарат выпускается в готовых для использования шприцах. Вводится раз в 14 дней. Курс лечения может состоять из 2-3 инъекций. Одна упаковка лекарства стоит 3650 рублей. |
| Синокром | Крома Фарма, Германия | Вводится в синовиальную полость в асептических условиях. Курс лечения Синокромом обычно состоит из 4-5 инъекций, выполненных с интервалом в 1 неделю. Цена одного шприца – 4200 рублей. |
| Суплазин | Бионик Тео, Ирландия | Выпускается в разных дозировках. Вводится 1 раз в неделю. Продолжительность лечения зависит от тяжести заболевания. Как правило, пациента лечат 3-6 недель. Ориентировочная стоимость 1 инъекции – 3450 рублей. |
| Синвиск | Джензайм Европа Б.В,США | Протез выпускается в упаковках по 3 и 6 шт. Вводится с интервалом в 1 неделю. Чтобы получить хороший эффект, нужно сделать как минимум три инъекции. Одна упаковка Синвиска стоит 24 700 рублей. |
В 2007 году американские ученые выяснили, что некоторые группы хондропротекторов влияют на хондроциты и их предшественники – мезенхимальные стволовые клетки. Однако многие врачи и ученые ставят под сомнение эффективность хондропротекторов в лечении остеоартроза. Наиболее распространенным является мнение, что эти препараты замедляют разрушение хрящей, но НЕ восстанавливают имеющиеся дефекты.
Отделение ортопедии Клиники Фридрихсхафен получило сертификат Немецкой ассоциации травматологической медицины, принимает более 25 000 пациентов и проводит более 3 тысяч операций в год.
Его глава — профессор, доктор Ойген Винтер, является признанным специалистом в области ортопедической хирургии и не только проводит операции, но и обучает других врачей. Отделение ортопедии занимается лечением травм и заболеваний позвоночника, бедренных, коленных, плечевых и локтевых суставов, стоп, рук, хронических болей, сдавливания нерва и т.д.
Основная специализация отделения ортопедии — эндопротезирование бедренных и коленных суставов, включая полную замену сустава и восстановление хрящевой ткани путем ее трансплантации.
При повреждении или заболевании сустава могут страдать не только кости, но и покрывающие их ткани. В некоторых случаях нарушение целостности хряща предшествует разрушению кости.
Повреждение хрящевой ткани
Повреждение хрящевой ткани может быть вызвано несколькими причинами, в том числе:
- травмой,
- постоянным износом из-за чрезмерного веса или тяжелых физических нагрузок,
- нарушением обмена веществ,
- неправильным расположением элементов сустава (например коленного),
- возрастными изменениями,
- воспалением
Хрящевая ткань сама почти не восстанавливается. До недавнего времени считалось, что единственным решением при сильном повреждении была замена сустава.
Однако современная медицина предлагает иной способ: трансплантацию (пересадку) хрящевой ткани, хотя здесь имеются некоторые ограничения. Подобный способ лечения рекомендуется в основном для молодых пациентов со средним и обширным повреждением хрящевой ткани и не подходит для пожилых людей с остеоартритом.
Трансплантация хрящевой ткани проводится в случае, если размер пораженного участка не более 3-х квадратных сантиметров.
Для трансплантации может использоваться несколько видов хрящевой ткани:
- образец ткани с надкостницы (соединительной пленки, покрывающей кость там, где нет суставных хрящей)
- костно-хрящевой (трансплантация части хрящевой ткани вместе с кусочками костной, образующая своего рода мозаику на кости сустава)
- образец пасты стволовых клеток суставного хряща ( часть хрящевой ткани из углубления в центре коленного сустава извлекается и измельчается в специальном растворе, после чего им заполняют место удаленного поврежденного хряща).
- Трансплантация выращенных из собственного образца клеток хрящевой ткани
Трансплантация выращенных из собственного образца клеток хрящевой ткани - последная разработка медицины.
Во время минимально инвазивной операции у пациента берут небольшой образец здоровых клеток хряща и в лаборатории выращивают из них подходящий материал для трансплантации, а из пораженной части сустава извлекают разрушившиеся области. В некоторых случаях для компенсации нагрузки взятые здоровые клетки хряща заменяют своими же больными. Сама процедура занимает от половины до целого часа.
Для того, чтобы новая хрящевая ткань достигла необходимых размеров требуется в среднем три-четыре недели.
По истечении этого срока готовые к трансплантации клетки на специальной подложке пересаживают в место повреждения хряща.
После операции по трансплантации хрящевой ткани требуется восстановительный период длительностью от 6 до 12 недель, в некоторых случаях прописывают курс физиотерапии. Занятия спортом можно возобновлять только через 12- 16 недель. В зависимости от рода занятий, человеку, перенесшему операцию по трансплантации хрящевой ткани, может понадобиться отпуск с отрывом от производства.
Клинические испытания коллагенового геля (CaReS)
Клинические испытания модернизированного объемного коллагенового геля (CaReS) при лечении фокальных хрящевых дефектов коленного сустава.
Результаты: Пациентам вводят коллагеновый гель в область пораженного хряща. Во всех случаях гелеобразный матрикс беспрепятственно соединяется с фибрином в месте дефекта, чем укрепляет межтканевое взаимодействие. В среднем время хирургического вмешательства составляет 69 минут, а длина разреза для операционного доступа - 8,2 см. Специфические осложнения после операции не зафиксированы. В послеоперационном периоде со стороны объективных/субъективных IKDC-показателей, а также со стороны функциональных показателей и успешности процесса в целом, отмечаются значительные улучшения через 3-6 месяцев и до завершения наблюдения через 2 года. Метод очень прост в применении и демонстрирует, спустя незначительное время, превосходные клинические результаты.
Для подтверждения успешности конвенциональной АСТ по сравнению с классическими старыми методами было проведено долгосрочное исследование, в котором принимали участие множество пациентов, и в которое были включены гистологические и биомеханические методы диагностики регенеративной способности ткани.
Трансплантация хряща
Конвенциональная трансплантация хряща была разработана и введена в городе Бриттберг более 15 лет назад. Она получила признание в качестве действующего метода при лечении хондральных и остеохондральных дефектов. Успеху трансплантация хряща обязана многолетнему опыту ее использования в прошлом. Методика, которую врачи проводят в 2 этапа, по сей день считается стандартом лечения хряща сустава во всем мире и проводится после подтверждения показаний к операции.
- В первом этапе проводится артроскопия, во время которой в малонагруженном локусе медиально и латерильно надколенной поверхности бедренной кости или углубления, проводится изъятие хрящевых клеток (биологические пробы).
- После культивирования хрящевых клеток в специальной суспензии, на втором этапе оперативного вмешательства, суспензия вводится в биоактивную камеру. Последняя плотно вшивается в ткань периоста (высокая герметичность), расположенным по краям хрящевого дефекта. Защитная поверхность должна быть не только гидрофобной и устойчивой к механическим факторам, но и должна обладать хондрогенным эффектом (продуцировать рост новых дифференцированных клеток периоста).
Результаты: данного 2-хэтапного метода клинически определялись, как успешные и очень успешные (более 70%). И в сравнении с другими хирургическими методами лечения хрящевых дефектов, например таким, как классическая трансплантация (ACT) с его обширными дефектами и длительным временем курации, явно видно, на чьей стороне преимущества.
Недостатки классической трансплантации хрящя
Воодушевляющие результаты конвенциональной трансплантации хрящя не обходятся без недостатков на клеточном и техническом уровне. В результате непосредственного использования периоста появляется угроза кальцификации и расщепления. Использование жидкой клеточной суспензии может привести к потере герметичности.
При потере стабильности и целостности хрящевой основы становится сложно сшить концы ткани периоста, что негативно влияет на результат операции. Получение ткани периоста возможно при массивной артротомии или при многочисленных надрезах. Обе манипуляции требуют много времени, как и процесс фиксации трансплантата.
Кроме того, из-за обширного оперативного доступа травматизация сустава усугубляется, послеоперационный период удлиняется и появляются осложнения, например: артрофиброз. Низкое качество культивированных хондроцитов или уменьшение ширины ткани периоста может привести к плохому заполнению дефекта или к отказу от проведения операции.
Матрикссвязывающее лечение хряща, при помощи CaReS технологии
Чтобы избежать вышеописанной проблемы, были созданы разнообразные биоматериалы для матрикссвязывающей трансплантации(ATC). Некоторые варианты биоматериала находятся в лаборатории на стадии испытаний или в мультицентрическом клиническом введении. К используемому биоматериалу относится коллагеновый гель и мембраны, синтетические полимеры и структуры с гиалуроновой кислотой.
Используемая нами объемная матрикс-конструкция основана на коллагеновом геле 1 типа, который получают из крысиных хвостов. Процесс культивирования и заливка аутохондроцитов происходит после извлечения их из экстрацеллюлярного матрикса первичного хряща без каких-либо других действий.
Благодаря этому, обычно сводится к нулю возможность неверной дифференциации клеток при множественной заливке. Трансплантация возможна только при гомогенизации клеточной суспензии. Матрикс CaReS ведет к дальнейшей пролиферации клеток без возможности возникновения неверной дифференциации. Оперирующий врач может задать трансплантату желаемую консистенцию и точный размер.
Оперативная техника лечение хряща
После клинических исследований и готовности рентгенологических и МРТ-снимков, проводится артроскопия для определения размера и локализации хрящевого дефекта.
Инновационное оборудование для биопсии
Здесь важно повторно проверить консистенцию и прочность основания хряща, состояние необходимой суставной поверхности, а также менисков и связок. Биопсия выполняется по предписанию: от медиального до латерального края надколенной поверхности бедренной кости.
Для данной манипуляции мы используем специальное оснащение для изъятия хрящевой ткани. С помощью современной аппаратуры для биопсии становится возможным изъятие любого количества материала. Под визуальным контролем при помощи инструментов захватывается верхний конец от медиального до латерального края надколенной поверхности бедренной кости. С помощью инструментов проводится изъятие внутренних структур хряща, которые врач-лаборант осторожно вытягивает наружу, чтобы сделать срез ткани для биопсии. Последним этапом биопсии является перемещении образца ткани в пробирку со средой. Для культивирования клеток необходимы пробы, размером от 1 до 5 см, массой от 200 до 300 мг. Биоптат заливают веществом (не содержащим серы), добавляя 120-150 мл цельной крови и отправляют для дальнейшей обработки и культивирования, которое выполняет фирма “Ars Arthro”, город Эсслинген. Хрящевой биоптат смешивается с коллагеназой, из которого путем центрифугирования получают хондроциты. После оценки жизнеспособности к хрящевым клеткам добавляется коллаген-1 типа до образования гелеобразной суспензии.
Диаметр и плотность трансплантата может меняться в зависимости от состояния дефекта. После образования желеподобной изолированной субстанции и двухнедельной подготовки в серосодержащей среде, процесс завершается рассеиванием клеток хондроцитов в коллагеновом геле, который используется непосредственно для трансплантации.
На втором этапе оперативного вмешательства, после введения антибиотиков и наложения кровоостанавливающего жома, коленный сустав, в зависимости от локализации дефекта, медиально или латерально осуществляется парапателярный доступ. Проводится эта манипуляция, когда речь идет только о повреждении хряща, в прочих случаях при помощи кюретки проводится освобождение хряща до субхондральной зоны от омертвевшей ткани. Краевая часть срезается скальпелем таким образом, чтобы здоровая ткань слегка выступала. Следующим этапом является создание субхондральной кости. Здесь мы используем, при глубоком дефекте кости, один или несколько костных цилиндров, которые извлекаются из дистального бедренного метафиза или из головки большеберцовой кости при помощи костной дрели, после чего материал помещается в специальный вакутейнер для забора материала. Все выступающие неровности заполняются губчатым веществом. Следующие оперативные действия применяются при обоих видах повреждений. Дефект измеряется в соответствии с шаблоном, после чего заранее подготовленная конструкция клеточного матрикса вырезается строго по его размеру. Края дефекта смазываются тонким слоем фибринового клеящего вещества (Tissucol, компания Baxter), после чего в центр дефекта укладывается матрикс. Благодаря своей плотной структуре коллагеновый гель затвердевает в центре, а в остальных зонах его можно моделировать. Перед послойным заполнением повреждения проводится проверка сустава на подвижность, что позволяет максимально точно определить верную позицию для установки трансплантата.
Прочная, желатинообразная консистенция материала делает трансплантат гладким и однородным (нет разделения на отдельные волокна). Подготовленный коллагеновый гель после обработки фибрином основания трансплантата и краев, аккуратно укладывается в зону повреждения. Сразу после укладки коллагенового геля создается желаемая форма, которая полностью заполняет дефект, обволакивая рядом расположенные ткани. Средняя длина разреза для создания оперативного доступа составляет 8,2 см.
Реабилитация, после лечение хряща
Для изолированного бедренного дефекта мы накладываем временную шину на 48 часов, которая обеспечивает полное обездвиживание конечности. Также рекомендуется активная вспомогательная гимнастика, эргометрия и комплексные упражнения на мышцы после 12 недель. Спортивная нагрузка возможна через год после операции.
Результаты
Субъективное состояние пациентов в общем до проведения оперативного лечение оценивается, как плохое или очень плохое. Но уже спустя 3 месяца после проведения операции не остается ни одного негативного отзыва со стороны пациентов, касающегося состояния здоровья. Большое количество пациентов через 12 недель после хирургического вмешательства, а если быть точнее - 18,2% пациентов оценивают свое состояние, как очень хорошее, 54,5% оценивают свое состояние, как хорошее, и 27,3% чувствуют себя удовлетворительно. Через 6 месяцев повышается количество пациентов, оценивающих свое состояние, как очень хорошее и хорошее - 31,8 % и 50%, а количество пациентов, чувствующих себя удовлетворительно сокращается до до 18,2%. Через 2 года после операции 38,5% пациентов чувствуют себя очень хорошо, 46,1% - хорошо и всего 15,4% - удовлетворительно.
Послеоперационные осложнения после применения данного метода в практике не наблюдались.
Классическая трансплантация до настоящего момента является самым приемлемым методом для лечения массивных хондральных и остеохондральных дефектов в коленном суставе. Конвенциональная трансплантация показывает блестящие результаты, как в процессе многочисленных исследований, так и в клинической практике. Также показательными являются и интерпретации гистологических и биомеханических результатов. Результаты наших исследований демонстрируют значительное клиническое улучшение состояния больных после операции на бедре (повреждение хряща) с использованием объемного коллагенового геля. Через 12 месяцев после операции 86,4% пациентов (ICRS функциональный показатель) не имеют никаких ограничений. В процессе наблюдения отмечается значительное улучшение общего состояния среди пациентов: через 12 месяцев 90,9%, через 24 месяца 92,3%.
Также стоит отметить, что трансплантат прост в изготовлении, а операция по имплантации считается несложной. Продолжительность операции недолгая, разрез при операции незначительный. Послеоперационные трансплантационные осложнения, которые наблюдаются только при классической трансплантация, до сих пор не наблюдались, зато сразу дают о себе знать преимущества. Метод демонстрирует хорошие клинические результаты, что является основанием для его частого использования.
Резюме
Обобщив всю информацию, можно утверждать, что жидкие хондрофиллеры - оптимальный и надежный продукт для трансплантации. Любые дефекты хрящевой ткани можно заполнить при помощи представленных филлеров. Их надежность проявляется в отсутствии необходимости ревизии и дополнительного введения филлера, так как невозможно частичное вытекание или дислокация. При проведении МРТ (магнитно-резонансной томографии) у пациентов, зафиксированных в нашей базе, визуализируется четкое заполнение дефекта гелем, что подтверждает превосходный результат лечения суставного повреждения.
Читайте также:


