Что такое бактериоскопия туберкулеза
Начиная с открытия Коха, длительное время основным и наиболее распространенным методом выявления микобактерий туберкулеза являлась бактериоскопия.
В настоящее время метод бактериоскопии считается недостаточным для диагностики туберкулеза. В практической работе противотуберкулезных учреждений необходимо чаще применять посев исследуемого материала на питательную среду, т. е. бактериологический метод.
Кроме бактериоскопии и метода посева, необходимо в ряде случаев использовать и прививки лабораторным животным, т. е. биологический метод.
Микобактерии туберкулеза можно обнаружить в различном материале, полученном от больного. Таким материалом является прежде всего мокрота. С усовершенствованием лабораторных методов удается обнаружить микобактерии туберкулеза в мокроте при незначительных изменениях в легких, а в ряде случаев — и без видимых на рентгенограмме туберкулезных поражений в легких. При отсутствии мокроты или невозможности ее получения исследуют промывные воды желудка. Этот способ после работ Арман-Делилля [Armand-Delill, 1927] имеет широкое применение в практике противотуберкулезных учреждений. Предполагали, что микобактерии туберкулеза попадают с мокротой в желудок как у взрослых, так и особенно у детей, страдающих легочным туберкулезом. Исследования и клинические наблюдения, проведенные в СССР и за рубежом, показали, что микобактерии туберкулеза в промывных водах желудка можно обнаружить не только при легочном, но и при внелегочном туберкулезе (кожи, костей, глаз, лимфатических узлов). Эти наблюдения доказывают возможность поступления микобактерии туберкулеза в желудок лимфогематогенным путем независимо от локализации туберкулезного процесса.
При отсутствии мокроты можно исследовать, кроме промывных вод желудка, слизь из гортани, а также промывные воды бронхов. Для этого больному натощак после предварительной анестезии дыхательных путей 1 % раствором дикаина орошают гортань подогретым изотоническим раствором хлорида натрия (10—15 мл) с помощью гортанного шприца. При этом необходимо создать такое положение больного, которое способствовало бы попаданию раствора в бронхи пораженного легкого. Изотонический раствор хлорида натрия, раздражая слизистую оболочку бронха, вызывает усиленное отделение слизи. Выделяемые при откашливании больным промывные воды бронха собирают в стерильный сосуд и подвергают дальнейшему исследованию.
Можно исследовать микобактерии туберкулеза, выделенные в фекальных массах, но при обнаружении в них микобактерий туберкулеза трудно решить вопрос, из каких органов последние выделяются.
Исследовать можно также мочу, спинномозговую жидкость, другие биологические жидкости и патологический материал.
Бактериоскопические методы выявления микобактерий туберкулеза
Бактериоскопические методы выявления микобактерий включают: обычную бактериоскопию мазков, окрашенных по Цилю — Нильсену, флотацию и люминесцентную микроскопию.
Обычная бактериоскопия. В мазках, окрашенных по Цилю — Нильсену, микобактерии туберкулеза могут быть обнаружены только при наличии не менее 50 000 бактериальных клеток в 1 мл патологического материала (предел чувствительности метода), причем тогда, когда микобактерии не изменены тинкториально или морфологически под влиянием антибактериальных препаратов (при лечении больного).
Для приготовления мазков мокроту выливают в чашку Петри и заостренными деревянными палочками из 5—6 участков выбирают гнойные комочки на два предметных стекла для приготовления мазков. Один препарат используют для исследования на эластические волокна. На другом стекле комочки мокроты растирают третьим стеклом и получают таким образом два препарата, один из которых окрашивают по Цилю — Нильсену, а второй, например, флюорохромными красками, если имеется возможность произвести люминесцентную микроскопию.
При окраске по Цилю — Нильсену на препарат наливают карболовый фуксин, подогревают до появления паров, обесцвечивают 6% раствором серной кислоты или 3% солянокислым алкоголем и докрашивают 0,25% раствором метиленового синего.
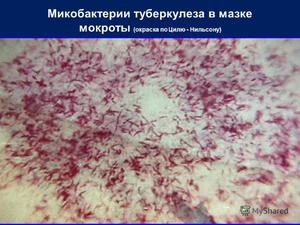
Окрашенные мазки микроскопируют с иммерсионной системой. При этом микобактерии туберкулеза выглядят красными на синем фоне. Типичные микобактерии имеют вид тонких, прямых или слегка изогнутых зернистых палочек.
Количество микобактерий туберкулеза, обнаруживаемых методом бактериоскопии в мокроте больного, зависит от многих причин и может колебаться в различных пределах. Учитывая возможные случайности и затруднения для определения количества микобактерий туберкулеза, мокроту больного рекомендуется исследовать повторно.
С введением в практику бактериостатических средств, препятствующих росту и размножению микобактерий туберкулеза в организме больного, определение количества их в мокроте в период лечения может быть относительным критерием эффективности антибактериальной терапии, учитывать который необходимо в комплексе с клиническими, рентгенологическими и другими лабораторными исследованиями. При отрицательных результатах бактериоскопии мокроты больных туберкулезом или лиц, подозрительных на туберкулез, рекомендуется производить повторные исследования мокроты 4—5 дней подряд или гомогенизировать мокроту при помощи химических веществ, т. е. превращать в однородную массу, и центрифугировать ее с целью концентрации микобактерий туберкулеза в небольшом объеме.
В мокроте могут быть различные форменные элементы: лейкоциты, эритроциты, эпителий, альвеолярные клетки, пылевые клетки, цилиндрический мерцательный эпителий, эластические волокна, известковые соли, кристаллы холестерина. Плоский эпителий может исходить из полости рта, глотки, гортани. У лиц, вдыхающих угольную пыль и дым, в мокроте обнаруживаются пылевые клетки. Цилиндрический эпителий может включаться в мокроту при прохождении последней через бронхи и трахею. Эритроциты, единичные и неизмененные, могут попадать в мокроту из поврежденных десен и носоглотки, но наличие эритроцитов в мокроте может быть и вследствие кровохарканья.
В мокроте могут быть, кроме описанных, эластические волокна Коплена — Джонса, или коралловидные. Они представляются толстыми, шероховатыми образованиями, заканчивающимися колбасообразно. Можно обнаружить и обызвествленные эластические волокна.
Наличие эластических волокон в мокроте указывает на разрушение легочной ткани. При свежем распаде пучки волокон сохраняют альвеолярное строение, при пролиферативных формах туберкулеза эластические волокна выделяются в виде пучков без сохранения альвеолярного строения. Волокна могут выделяться при всех формах туберкулеза; волокна Коппена — Джонса появляются преимущественно в случаях старого туберкулеза. Обызвествленные волокна можно видеть при распаде обызвествленных очагов во время обострения процесса.
Необходимо иметь в виду, что эластические волокна также можно обнаружить и при ряде нетуберкулезных заболеваний легких, например при абсцессе легких.
В мокроте больных туберкулезом можно обнаруживать известковые соли (карбонаты и сульфаты), имеющие под микроскопом вид темных зерен разной величины. Попадают они в мокроту чаще всего из старых, распадающихся обезвествленных очагов. Известковые соли от прибавления разведенной азотной кислоты растворяются.
Кристаллы холестерина в мокроте имеют вид нежных пластинок разной величины, большей частью с обломанными краями. Эти кристаллы обнаруживаются при наличии в легких старых каверн.
Метод флотации. Этот метод применяется в случаях скудного содержания микобактерий туберкулеза в исследуемом материале и при отрицательном результате бактериоскопии. По сравнению с обычной бактериоскопией микобактерии туберкулеза обнаруживаются методом флотации в патологическом материале примерно на 10—15% чаще. Для исследования методом флотации мокроту в количестве 12—15 мл помещают в колбу емкостью 250 мл, добавляют примерно равное количество 0,5% раствора едкого натра или кали и для лучшей гомогенизации встряхивают в течение 5—10 мин, затем до половины емкости колбы наливают дистиллированную воду с добавлением 0,5 мл ксилола или бензина. Все содержимое встряхивают 5—10 мин, после чего доливают дистиллированную воду до окончательного объема — 250 мл. Спустя 30—60 мин капельки бензина (ксилола) всплывают на поверхность, увлекая за собой микобактерии туберкулеза, концентрируя их в небольшом объеме образовавшегося на поверхности кольца. Полученное флотационное кольцо пипеткой переносят на два предметных стекла. Один препарат окрашивают по Цилю — Нильсену.
При флотации промывных вод, гноя, экссудата, спинномозговой жидкости и другого материала, не требующих гомогенизации, к ним добавляют меньшее количество раствора щелочи (от 1—2 капель до 1—2 мл в зависимости от количества материала). В дальнейшем поступают так же, как при флотации мокроты.
Люминесцентная микроскопия. Метод люминесцентной микроскопии основан на способности микобактерий туберкулеза, окрашенных флюорохромами, светиться под воздействием сине-фиолетовых лучей.
Этот метод позволяет дополнительно выявлять микобактерии туберкулеза на 17% чаще по сравнению с обычной бактериоскопией и на 8% чаще по сравнению с методом флотации. При люминесцентной микроскопии исследование производится при малом увеличении, что расширяет поле зрения и способствует обнаружению микобактерий туберкулеза, содержащихся в исследуемом материале в небольшом количестве.
Для люминесцентного исследования пользуются либо специальным микроскопом (МЛ-1 и МЛ-2), либо обычным микроскопом типа МБИ-1 с добавочным осветителем. Ко всем комплектам осветительной аппаратуры прилагаются наборы необходимых светофильтров.
Люминесцентным методом исследуют различный патологический материал. Фиксированные над пламенем препараты
окрашивают при легком подогревании в течение 15 мин специальной смесью: аурамин 00—0,5 г, радомин С — 0,05 г на 1000 мл дистиллированной воды. Затем мазок промывают водой и в течение полминуты обесцвечивают 3% солянокислым спиртом, снова промывают водой и докрашивают для гашения фона 0,25% раствором метиленового синего. При люминесцентной микроскопии микобактерии флюоресцируют золотисто-желтым цветом на темном нефлюоресцирующем фоне. Этот метод в настоящее время находит широкое применение.
Бактериологические методы
Больной туберкулезом в процессе антибактериального лечения может выделять микобактерии туберкулеза, измененные морфологически и в небольшом количестве, что не позволяет обнаружить их бактериоскопическими методами (обычная бактериоскопия, метод флотации, люминесцентная микроскопия). Поэтому в комплекс исследований, направленных на обнаружение микобактерий туберкулеза, в настоящее время обязательно включается посев патологического материала. Выделение культур микобактерий туберкулеза позволяет определить жизнеспособность возбудителя, его лекарственную чувствительность, ферментативную активность и вирулентность.
Для бактериологического исследования может быть использован любой патологический материал.
Поскольку обычно в посевном материале содержится и неспецифическая микрофлора, требуется его так обработать, чтобы уничтожить сопутствующую микрофлору и сохранить при этом жизнеспособность микобактерий туберкулеза.
В последние годы в связи с широким применением противотуберкулезных препаратов в 19—20% случаев наблюдается диссоциация между обнаружением микобактерий туберкулеза при бактериоскопическом исследовании и ростом их при посеве патологического материала. Это явление заключается в том, что видимые под микроскопом, они не растут на питательных средах. Такая диссоциация обусловлена воздействием на микобактерии туберкулеза лекарственных препаратов.
Биологическая проба. Наиболее чувствительным методом обнаружения микобактерий туберкулеза является заражение морских свинок. Однако не всегда удается получить развитие генерализованного туберкулеза в тех случаях, когда в патологическом материале содержатся микобактерии туберкулеза, устойчивые к препаратам гидразида изоникотиновой кислоты. В таких случаях микобактерии оказываются невирулентными для этих животных, и тогда при положительном результате посева патологического материала имеет место отрицательный исход заражения.
При развитии туберкулезного процесса после подкожного заражения в области введения материала к концу месяца прощупываются увеличенные лимфатические узлы. Аллергические реакции определяются при внутрикожном введении 0,1 мл ATK 1 : 10. При положительной биологической пробе у морских свинок развивается генерализованный туберкулез.

Бактериоскопический метод диагностики туберкулеза

Д.В. Шевчук, О.Е.Кузнецов
Бактериоскопический метод диагностики туберкулеза – исследование мазка после обработки и окраски по методу Циля-Нильсена. Микобактерии туберкулеза окрашиваются в красный цвет. Преимущество этого метода заключается в быстроте получения результата, однако возможности его ограничены, в частности, известно, что положительный результат – обнаружение МБТ в мазке – может быть получен только при значительном содержании микробных тел в мокроте: от 50 тыс. микробных клеток в 1 мл.
Бактериоскопическому исследованию подлежат обратившиеся в медицинские учреждения лица:
- с явными симптомами туберкулеза органов дыхания
- с наличием продолжительного (более 3 недель) кашля, сопровождающегося выделением мокроты, особенно с кровью, и жалобами на боли в груди
- контактировавшие с больными, имеющими положительный результат бактериоскопического исследования и соответствующие симптомы заболевания
- имеющие рентгенологические изменения в легких, подозрительные в отношении туберкулеза.
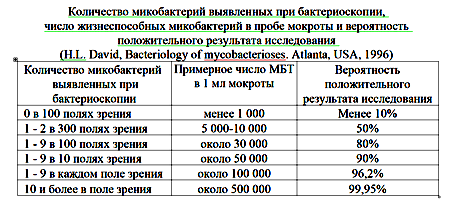
Бактериоскопическому исследованию подвергается самый разнообразный материал: мокрота, промывные воды бронхов, желудка, экссудат, отделяемое ран, свищей, моча, ликвор, менструальная кровь и др. Наиболее часто исследуется мокрота. Бактериоскопический метод диагностики туберкулеза легких – простой и экономичный, быстрый, выполнимый в любом медицинском учреждении, позволяющий при положительном результате мазка мокроты подтвердить диагноз туберкулеза. Недостатком метода можно считать его низкую чувствительность. Для повышения чувствительности метода используют методики обогащения материала (флотация, седиментация) и окраску люминесцентными красителями.
Препарат готовят из гнойных частиц мокроты, которые выбирают из нескольких мест. Отобранные частицы тщательно растирают между двумя предметными стеклами до гомогенной массы. Высушивают на воздухе, фиксируют над пламенем. Мазки из жидкого содержимого (БАС, промывные воды, моча, экссудаты и т.д.) готовят из осадка материала, обработанного кислотой, после центрифугирования.
При этом избегают следующих ошибок:
- Изготовление слишком толстых препаратов (трудно искать МБТ)
- Фиксирование плохо высушенных мазков (получается плохая окраска)
- Недостаточная фиксация (наблюдается сползание препарата)
- Длительная фиксация над пламенем (обугливание мокроты, что сильно отражается на качестве мазка).
Препарат после окраски микроскопируют с иммерсионной системой при 1000- кратном увеличении.
Методика окраски:
Микобактерии обнаруживаются в препарате в виде тонких, прямых или слегка изогнутых палочек, красного или малинового цвета на синем фоне. Иногда они располагаются в препарате в виде римской цифры V, часто скоплениями. Иногда в их структуре определяются более интенсивные зерна (зернистые формы). В связи с приемом противотуберкулезных препаратов, изменяющих морфологию микобактерий, могут обнаруживаться их ветвистые формы, бледно окрашенные палочки (частично утратившие кислотоустойчивость), осколки. Считают не менее 100 полей зрения, если не нашли КУБ то считают еще 100 полей зрения.

Рекомендуется еще один препарат докрасить пикриновой кислотой (0,25-0,5%). Просмотр двух препаратов (одного докрашенного метиленовым синим, а другого пикриновой кислотой) увеличивает процент нахождения МТ. При докрашивании препарата пикриновой кислотой фон препарата изменяется на желтый, тем самым облегчается процедура микроскопии микобактерий, окрашивающихся в красный или малиновый цвет.
Исследования бактериоскопическим методом может выполняться в следующих учреждениях:
- НИИ медицинского профиля
- Областная, городская и районная больница
- Взрослая и детская поликлиника
- Участковая больница
- Сельская врачебная амбулатория
- Психиатрическая и наркологическая больница и диспансер
- Санаторий
- ИТ учреждения
Основана на различии свечения микроскопируемого объекта в ультрафиолетовом или коротковолновом спектре света. Окраска производится флюорохромами – органическими красителями (аурамин, родамин). МБТ под действием УФ-лучей в темном поле люминесцентного микроскопа светятся в виде золотистого цвета палочек. Высокая контрастность микроскопической картины позволяет проводить исследование под меньшим увеличением (400-крат), увеличивая площадь одномоментно просматриваемого поля зрения, сокращая время, затрачиваемое на поиск единичных микобактерий, просмотр всего мазка. Этот метод особенно подходит для исследования олигобациллярного материала.
Информативность бактериоскопии с применением флюорохромов по данным различных авторов может повышаться на 15 – 30%. Данный метод не применим для бактериоскопии мочи, в связи с наличием в ней большого количества микобактерий – сапрофитов.
Метод основан на том, что после встряхивания водной суспензии легких углеводородов (ксилол, толуол, бензин и т.д.) и МБТ, а затем ее отстаивании, последние, адсорбируясь на поверхности пузырьков углеводорода, всплывают. Образовавшееся на поверхности раствора флотационное кольцо содержит МБТ в большем количестве, чем остальная часть раствора и служит материалом для приготовления мазка. Информативность бактериоскопии с применением флотационного метода может повышаться на 10%.
Методика (метод Поттенджера):
- свежевыделенную мокроту (не более 10-15 мл) помещают в узкогорлую бутылку
- приливают двойное количество 0,5% раствора едкой щелочи, смесь энергично встряхивают 10-15 мин.
- приливают 1 мл ксилола (можно бензина, толуола) и около 10 мл дистиллированной воды для разжижения мокроты, снова встряхивают 10-15 мин.
- доливают дистиллированную воду в таком количестве, чтобы уровень жидкости поднялся до горлышка бутылки.
- оставляют стоять на 40-50 мин
- образовавшийся верхний беловатый слой снимают по каплям пипеткой и наносят на предметные стекла, предварительно подогретые до 60 градусов (стекла для подогревания можно положить на металлический поднос и покрыть им водяную баню). Каждую последующую каплю наносят на предыдущую, подсушенную.
- препарат фиксируют, красят по Цилю-Нельсену и микроскопируют.
Основан на осаждении МБТ из раствора при добавлении хлороформа и центрифугировании. Из полученного осадка готовят мазок, окрашивают по Цилю- Нельсену и микроскопируют.
Одним из самых опасных и распространённых во всём мире инфекционных заболеваний не только человека, но и животных является туберкулёз. Возбудителем туберкулёза более чем в 90% случаев выступает mycobacterium tuberculosis (микобактерия туберкулёза).
Что такое микобактерия туберкулёза
На протяжении долгих столетий человечество страдало и умирало от туберкулёза, называемого ранее чахоткой. Медикам из многих стран мира никак не удавалось обнаружить и выделить коварного возбудителя туберкулёза, даже с появлением микроскопа. И только в 1882 году доктор Генрих Герман Роберт Кох из Германии сумел в результате многочисленных лабораторных опытов, проводимых на протяжении 17 лет, обнаружить продолговатую бактерию и позднее идентифицировать её. Эта бактерия также получила в медицине название по имени своего первооткрывателя: микобактерию туберкулёза называют палочкой Коха. В 1905 году Роберт Кох получил за своё открытие Нобелевскую премию.
Именно Роберт Кох предложил алгоритм для идентификации вызывающих туберкулёз бацилл, получивший также его имя (триада Коха) и применяемый до сих пор. Суть алгоритма состоит в следующем:
- Из тканей больного пациента извлекаются бактерии.
- Из них выращивается чистая культура – колонии бактерий.
- Далее, для получения клинической картины болезни, происходит заражение здорового организма (лабораторные мыши).
По своей форме микобактерия туберкулёза представляет собой продолговатую прямую или изогнутую палочку со слегка закруглёнными концами, размер бактерии обычно составляет 1 – 10 мкм в длину и 0,2 – 0,6 мкм в ширину.
Клетка МБТ состоит из:
- микрокапсулы, защищающей микобактерию от внешних воздействий и связанной с клеточной стенкой;
- клеточной стенки, которая обеспечивает клетке стабильность её формы и размера;
- гомогенной цитоплазмы и цитоплазматической мембраны;
- ядерной субстанции (собственно набор хромосом и плазмиды).
Размножение микобактерий происходит путём простого деления на две клетки. Цикл деления клетки составляет от 14 до 24 часов. Реже встречаются случаи размножения МБТ почкованием или ветвлением. На скорость размножения влияют многие факторы окружающей среды.
За свою тысячелетнюю историю бактерии приобрели различные механизмы защиты и приспособления к неблагоприятным для них внешним условиям.
Оптимальная для роста МБТ температура – 37 – 38°С. Размножаются они при температурном режиме от 29°С до 42°С. Однако, туберкулёзные палочки в состоянии сохранить свою жизнеспособность в условиях как очень низких, так и довольно высоких температур (н.п., при температуре в 80°С палочка является жизнеспособной ещё на протяжении 5 минут, при кипячении гибнет через 15 минут).
Наиболее комфортно бактерии чувствуют себя в сырых и тёмных условиях, на ярком солнце и при высокой температуре окружающей среды они прекращают интенсивное размножение и гибнут через полтора-два часа. Ультрафиолетовые лучи в состоянии уничтожить микобактерии за 2 – 3 минуты.
На протяжении многих месяцев МТБ в состоянии выжить, находясь вне живого организма. В водной среде они сохраняются около 150 дней, в пыли на улицах – до 10 дней, на книжных страницах до 3 месяцев. В высушенной форме микобактерии могут выживать в периоде до 3-х лет, а в замороженном состоянии их жизнеспособность может достигать и 30 лет.
В неблагоприятных для бактерии условиях, при лечении туберкулёза с помощью химиотерапии или при мощном иммунитете, палочка Коха быстро вырабатывает устойчивость к препаратам, может принять L -форму, способна сохраняться в таком состоянии целые десятилетия и вызывать противотуберкулёзный иммунитет. У пациентов, длительное время принимавших противотуберкулёзные препараты, бактерии могут принимать мелкие фильтрующиеся формы.
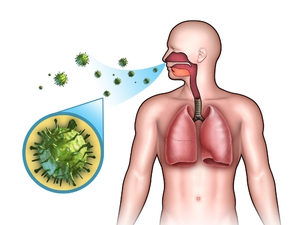
Основной путь передачи mycobacterium tuberculosis – воздушно-капельный. Этим путём передаётся до 95% из всех случаев заболевания туберкулёзом. Заражение происходит при кашле, чихании и даже во время разговора с инфицированным активной формой туберкулёза больным. Достаточно редко (в пределах 3 – 5 % от общего числа заболеваний) встречается передача МТБ через инфицированные продукты питания или от заражённых животных. Наиболее часто подвержен этому заболеванию крупный рогатый скот и свиньи. Гораздо реже им страдают собаки и кошки.
Практически любой орган или ткань человеческого организма, включая костные ткани, может быть подвержен заболеванию туберкулёзом. Более 90% всех случаев заболевания поражает органы дыхания. Наиболее часто из других внелегочных форм происходит поражение микобактериями мочеполовой системы, суставов, печени и почек.
Лабораторная диагностика и методы исследования материала на содержание микобактерий

При подозрении на туберкулёз органов дыхания материалом для лабораторного исследования является мокрота. При этом лучшие результаты даёт анализ мокроты, собранной на протяжении от 12 часов до суток. При локализации заболевания в других органах в качестве материала для анализа могут выступать разнообразные виды жидкостной среды человеческого организма: жидкость из брюшной полости или из полости суставов, спинномозговая жидкость, промывные воды бронхов кровь и гнойные выделения из ран.
При подозрении на туберкулёз внелегочных форм в качестве материала для лабораторного анализа также используют кусочки тканей органов, взятые при биопсии, пункциях и соскобах.
Если речь идёт о возможном заражении половой или мочевыделительной системы, на анализ берут мочу, собранную после ночного сна утром, как правило, это средняя порция мочи. У женщин для обследования на туберкулёз женских половых органов используют менструальную кровь, которую собирают с помощью колпачка Кафки.
В исследовании материала современная медицина применяет следующие методы:
- бактериологические;
- микроскопические;
- аллергологические;
- биологические;
- молекулярно – генетические и серологические методы (применяются достаточно редко).
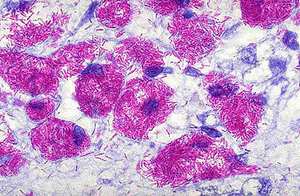
Этот метод является наиболее распространённым и заключается в исследовании мазков, выделенных из собранного материала (мокроты, мочи, спинномозговой жидкости и др.). Суть заключается в окрашивании материала по методу Циля-Нильсена или флуорохромом (как правило, аурамин-родомином или другим), и в дальнейшей обработке спиртом и промывании водой. После чего материал исследуется под люминесцентным микроскопом. Mycobacterium tuberculosis , обработанные флуорохромами, излучают золотистый цвет на тёмно-зелёном фоне. Обработанные по методу Циля - Нильсена туберкулёзные палочки имеют рубиново-красный цвет.
Для обнаружения L -форм используется в большинстве случаев фазово-контрастная микроскопия.
Необходимо просмотреть не менее 100 полей зрения для вынесения положительного ответа при обнаружении mycobacterium tuberculosis , при этом следует указать число бактерий в каждом поле. Однако следует отметить, что наличие отрицательного результата при микроскопии не даёт гарантии полностью исключить диагноз туберкулёза.
Микроскопический метод анализа имеет определённые недостатки, к которым в первую очередь относится низкая чувствительность: mycobacterium tuberculosis обнаруживается только при присутствии не менее 50 – 100 тысяч микробов на 1 мл исследуемого материала. Этот метод не позволяет отличить mycobacterium tuberculosis от других видов mycobacterium , он также не в состоянии определить чувствительность микобактерий к определённым химиотерапевтическим препаратам.
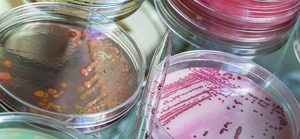
Этот метод представляет собой посев штаммов бактерий на специальные питательные среды и в состоянии определить наличие туберкулёзных палочек при концентрации 200 – 300 микробов на 1 мл. Посев помещается в термостат и на протяжении трёх месяцев при температуре 37 °С еженедельно наблюдается рост микобактерий.
Главный недостаток этого метода состоит в том, что получение конечных результатов требует определённых затрат времени (от 3 до 12 недель). На искусственных средах рост микобактерий наступает через 3 – 6 недель. У пациентов, проходящих курс химиотерапии, выделенные штаммы вырастают на ещё более поздних сроках (от 50 до 80 дней). На сегодня современной медициной испытаны и ускоренные методы выращивания культур mycobacterium tuberculosis по методу Прайса (на препаратах – мазках) и по методу посева на кровяной среде.
С помощью бактериологического метода можно определить не только вирулентность культуры, но и её чувствительность к различным медицинским препаратам.
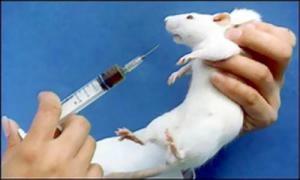
Этот метод относится, пожалуй, к самым рациональным методам исследования. Он позволяет определять микобактерии туберкулёза при малых количествах их содержания в материале (до 10 бактерий на 1 мл).
При этом методе материал вводиться морским свинкам подкожно или в брюшную полость. Если в материале присутствуют вирулентные mycobacterium tuberculosis , то обычно через 10 – 12 дней на месте инъекции образуется уплотнение, которое переходит в незаживающую язву. На протяжении 2 – 4 месяцев развивается генерализованный туберкулёз и свинки погибают.
Ускоренный биологический метод заключается во введении материала в региональный лимфоузел морской свинки. Увеличенный узел вырезается на 8 – 10 день и исследуется на присутствие микобактерий туберкулёза в препаратах-отпечатках.
В связи, с распространением в последние годы изменённых и устойчивых микобактерий чувствительность этого метода заметно снизилась. На сегодняшний день метод применяется в крупных специализированных лабораториях и требует строгого соблюдения режима проведения.
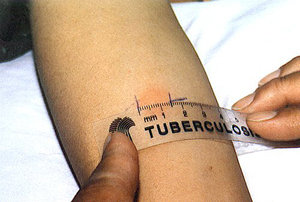
К этому методу относятся широко применяемые кожные туберкулиновые пробы. Проба Манту предусматривает введение туберкулина в предплечье, даёт положительные, отрицательные и резко положительные реакции. У детей и взрослых вводится различная концентрация вещества.
При помощи пробы Манту определяется круг лиц для проведения ревакцинации. Положительная проба Манту не является обязательным признаком наличия заболевания.
Профилактика

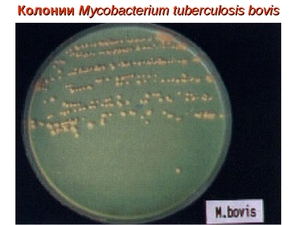
Основной профилактикой распространения микобактерий и предотвращение заболевания туберкулёзом является вакцина БЦЖ (Бацилла Кальметта-Герена). Вакцину изготовляют из штамма ослабленной живой mycobacterium bovis (бычий вид туберкулёзной палочки). При отсутствии противопоказаний вакцинацию проводят новорождённым в роддоме на 5 – 7 день жизни. Ревакцинация проводится в возрасте 7, 12, 17 и 22 лет при отрицательном результате пробы Манту и при отсутствии противопоказаний.
Взрослым с целью выявления туберкулёза на ранних стадиях не реже 1 раза в год необходимо проходить флюорографию лёгких в поликлинике. При резких изменениях реакции Манту за год или в случаях контакта с инфицированным больным фтизиатр может предложить проведение курса профилактической химиотерапии.
Читайте также:


