Чувствительность методов при исследовании на туберкулез
1. Расспрос и физикальные методы исследования позволяют:
1) заподозрить туберкулез;
2) исключить туберкулез;
3) верифицировать диагноз туберкулеза;
4) установить массивность бактериовыделения;
5) исключить возможность сочетания туберкулеза с ВИЧ-инфекцией.
2. Более ранним признаком туберкулеза является:
2) кашель с мокротой;
4) боль в грудной клетке при дыхании;
5) повышение температуры тела до 37-37,4 °С 2-3 раза в неделю.
3. Пальпацию грудной клетки проводят для определения:
1) ритма дыхания;
2) нижних границ легких;
3) подвижности нижних краев легких;
4) характера дыхания;
5) голосового дрожания.
4. У больных с начальными проявлениями туберкулеза легких при осмотре обычно отмечают:
1) дистрофические изменения кожи;
2) расширенные межреберные промежутки;
3) крыловидные лопатки;
4) отсутствие каких-либо видимых патологических изменений;
5) дефицит массы тела.
5. Перкуссию легких проводят для определения:
1) ритма дыхания;
2) побочных дыхательных шумов;
3) подвижности нижних краев легких;
4) характера дыхания;
5) голосового дрожания.
6. Аускультацию легких проводят для определения:
1) глубины дыхания;
2) подвижности нижних краев легких;
3) характера дыхания;
4) голосового дрожания;
5) патологического ритма дыхания.
7. Туберкулин содержит:
1) L-формы возбудителя туберкулеза;
2) все антигенные компоненты МБТ;
3) отдельные антигенные компоненты возбудителя туберкулеза;
4) убитые М. bovis;
5) антитела к МБТ.
8. Ответная реакция на PPD-S и PPD-L более специфична, поскольку эти препараты не содержат:
1) липидных фракций и нуклеиновых кислот МБТ;
3) полисахаридов МБТ;
4) стабилизаторов и антисептиков;
9. Выявить специфическую аллергию к МБТ позволяет:
1) общий анализ крови;
2) рентгенография легких;
3) микроскопическое исследование бронхиального содержимого;
10. Внутрикожное введение туберкулина:
1) у неинфицированного МБТ человека может привести к заболеванию туберкулезом;
2) у инфицированного МБТ человека вызывает формирование в месте введения папулы;
3) у неинфицированного МБТ человека вызывает формирование в месте введения папулы;
4) у неинфицированного МБТ человека позволяет выявить отрицательную анергию;
5) у инфицированного МБТ человека позволяет выявить положительную анергию.
11. У инфицированного МБТ человека в месте внутрикожного введения 2 ТЕ обычно формируется:
3) участок депигментации;
5) участок гиперпигментации.
12. Пробу Манту обычно применяют с целью:
1) уточнения локализации туберкулезного поражения;
2) проведения массовой туберкулинодиагностики;
3) подтверждения наличия деструкции в зоне туберкулезного поражения;
4) определения биологического вида туберкулезного возбудителя;
5) подтверждения биологической трансформации МБТ в L-формы.
13. При пробе Манту с 2 ТЕ гиперергическая реакция на туберкулин у взрослых проявляется папулой размером не менее:
14. При пробе Манту с 2 ТЕ гиперергическая реакция на туберкулин у детей проявляется папулой размером не менее:
15. Результат внутрикожной туберкулиновой пробы Манту с 2 ТЕ оценивают, когда с момента введения туберкулина пройдет:
16. У впервые инфицированного МБТ ребенка после пробы Манту на месте папулы в дальнейшем нередко формируется:
1) звездчатый белесоватый рубчик;
2) линейный белесоватый рубчик;
3) участок депигментации;
5) участок гиперпигментации.
17. У вакцинированного БЦЖ ребенка отмечают переход поствакцинальной аллергии в инфекционную, если размеры папулы в месте введения 2 ТЕ, по сравнению с данными ранее проводимой пробы Манту:
1) увеличились на 2-3 мм;
2) увеличились на 6 мм и более;
3) увеличились не менее чем на 10 мм;
4) уменьшились на 2-3 мм;
5) остались без изменений.
18. Поствакцинальная аллергия маловероятна, если размеры папулы при пробе Манту с 2 ТЕ:
19. Наличие гиперергической реакции подтверждает появление в месте введения 2 ТЕ:
1) папулы размером 12-15 мм;
20. Отрицательная реакция на туберкулин у больного туберкулезом обусловлена:
1) положительной анергией;
2) приемом противотуберкулезных препаратов;
3) прекращением бактериовыделения;
4) отрицательной анергией;
5) закрытием полостей распада в легких.
21. Для решения вопроса о сохранении активности туберкулезного процесса более информативна проба:
1) Пирке со 100% туберкулином;
3) Манту с 10 ТЕ;
4) Манту с 100 ТЕ;
22. Противопоказанием для проведения пробы Манту с 2 ТЕ являются:
1) положительная реакция на пробу Манту в анамнезе;
2) кожные проявления экссудативного диатеза;
3) большие остаточные изменения после перенесенного туберкулеза;
4) пищевая аллергия;
5) туберкулез у других членов семьи.
23. Пробу Коха используют с целью:
1) диагностики первичного инфицирования МБТ;
2) выявления поствакцинальной аллергии;
3) определения резистентности к туберкулезной инфекции;
4) дифференциальной диагностики туберкулеза и других заболеваний;
5) выявления положительной анергии к МБТ.
24. Снижение чувствительности к туберкулину бывает при развитии:
3) хронического тонзиллита;
4) сахарного диабета;
25. Повышение чувствительности к туберкулину бывает при развитии:
3) хронического тонзиллита;
4) злокачественного новообразования;
26. В отличие от пробы Манту, тесты, основанные на определении гаммаинтерферона в крови:
1) позволяют установить повышенную чувствительность замедленного типа к МБТ;
2) позволяют диагностировать первичное инфицирование МБТ;
3) не приводят к усилению специфической сенсибилизации у инфицированных МБТ лиц;
4) не позволяют исключить устойчивость МБТ к лекарствам;
5) не позволяют обнаружить L-формы МБТ.
27. Микробиологическое исследование диагностического материала на МБТ имеет большое значение для подтверждения:
1) поствакцинальной аллергии;
2) природы патологического процесса;
3) виража чувствительности к туберкулину;
4) отрицательной анергии;
5) положительной анергии.
28. Для обнаружения МБТ в диагностическом материале его нужно окрасить методом:
29. Биологический вид микобактерий позволяет установить:
1) прямая микроскопия после окраски по Цилю-Нельсону;
2) прямая микроскопия после окраски по Шпенглеру;
3) прямая микроскопия после флотации;
4) люминесцентная микроскопия;
5) культуральное исследование.
30. Для исследования чувствительности МБТ к противотуберкулезным препаратам необходимо получить чистую культуру микобактерий методом:
1) прямой микроскопии с окраской по Цилю-Нельсону;
2) прямой микроскопии с окраской по Шпенглеру;
3) прямой микроскопии после флотации;
4) люминесцентной микроскопии;
31. Быстрым способом определения чувствительности МБТ к лекарствам является:
1) люминесцентная микроскопия;
2) исследование с использованием биологических микрочипов;
3) иммуноферментный анализ;
4) градуированная проба Пирке;
32. Наиболее информативный метод выявления фазы распада при туберкулезе легких:
2) магнитно-резонансная томография (МРТ);
3) боковая рентгенография;
5) компьютерная томография (КТ).
33. При туберкулезе органов дыхания из эндоскопических методов чаще используют:
34. Классическим местом для удаления жидкости из плевральной полости является:
1) первый-второй межреберный промежуток;
2) третий-четвертый межреберный промежуток;
3) пятый-шестой межреберный промежуток;
4) седьмой-восьмой межреберный промежуток;
5) нижний край IX ребра.
35. Для получения диагностического материала из стенки долевого бронха обычно проводят биопсию:
4) трансторакальную игловую;
36. При активном туберкулезе легких в общем анализе крови часто выявляют:
1) анемию и тромбоцитопению;
2) лейкопению и лимфоцитоз;
3) олигохромазию и анизоцитоз;
4) лейкоцитоз и лимфопению;
5) лейкоцитоз и моноцитопению.
37. Интегральным показателем для оценки функции внешнего дыхания являются:
1) показатели газового состава и кислотно-щелочного состояния крови;
2) данные спирографии;
3) результаты общей плетизмографии;
4) результаты капилляроскопии;
5) показатели остаточного объема легких.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Воздушно-капельное поражение возбудителем, известным как палочка Коха или микобактерия, органов дыхательной системы и является причиной легочной формы туберкулеза. Заражению ежегодно подвергаются более 1 млн. детей и около 9 млн. взрослого населения планеты, а по данным Всемирной организации здравоохранения из 10 человек 3 уже являются его носителями. Именно поэтому так важно проходить ежегодное тщательное обследование на туберкулез каждому, независимо от возраста, социального положения и половой принадлежности. Современные методы диагностики туберкулеза легких позволяют вовремя определить форму, степень тяжести и спрогнозировать последствия заболевания, назначить полноценное интенсивное лечение. И не стоит думать, что поставленный диагноз туберкулез — это приговор. Ранее выявление туберкулеза и возможности, которыми обладает на сегодняшний день медицина, способствуют выздоровлению более 70% всех обратившихся пациентов.
Когда назначают обследование на туберкулез легких
Современная палочка Коха и ее многочисленные штаммы, которых насчитывается более 74, очень отличается от ранее открытой микобактерии. Способность вирулентной бациллы проникать в здоровые клетки носителя и оставаться в организме человека незамеченной, жизнеспособность и устойчивость к кислым средам и дезинфицирующим средствам очень усложняют задачу врачам и сотрудникам лаборатории.
Диагностика туберкулеза легких требует все новых возможностей, чтобы провести полноценное исследование. Это касается и людей, которые входят в особую группу риска и имеют предрасположенность к возникновению туберкулеза: ВИЧ-инфицированные пациенты или с поставленным диагнозом СПИД, с зависимостью от алкогольной, наркотической и никотиновой продукции, при наличии сахарного диабета, бронхиальной астмы и наследственного фактора. Нуждаются в медицинском контроле и новорожденные дети от инфицированной матери, несовершеннолетние и подростки до 17 лет, люди пенсионного и преклонного возраста.
Как проявляется туберкулез легких
Опасность, которую представляет собой латентная форма туберкулеза, состоит в том, что на ранней стадии выявление заболевания не всегда возможно по причине отсутствия выраженных симптомов. В остальных случаях, болезнь активно прогрессирует. Как диагностировать туберкулез, и на какие признаки стоит обратить внимание:
- сухой продолжительный кашель или с выделением мокроты, хрипы;
- постоянная температура тела 37°C;
- бледный цвет лица и уставший вид;
- снижение аппетита и потеря веса;
- одышка и боль в боку;
- обильное выделение пота.
У женщин способами определения туберкулеза легких являются нарушения менструального цикла и частые головные боли, со стороны мочевыделительной системы возможен цистит или кровянистые выделения в моче.
Ранняя диагностика туберкулеза у детей и подростков

Люди старшего поколения способны объективно оценивать свое состояние здоровья и следить за ним, обращаться за помощью к специалистам. Несовершеннолетние дети еще не понимают всю опасность инфекционных болезней, поэтому в дошкольных и образовательных учреждениях постоянно проводятся мероприятия по профилактике и предупреждению туберкулеза.
Клинический осмотр — основной первичный вид обследования. Врач педиатр или фтизиатр обязан выслушать жалобы маленького пациента и внимательно ознакомиться с его медицинской картой для определения врожденных патологий дыхательной системы, хронических болезней щитовидной железы. Важную роль играет целостность и цвет кожных покровов, нормальный показатель температуры — 36,6°C — 36,7°C и отсутствие хрипов, одышки при прослушивании стетоскопом.
Если общее состояние оценивается врачом, как удовлетворительное, дальнейшие методы ранней диагностики туберкулеза у ребенка предусматривают обязательное проведение пробы Манту и вакцинация БЦЖ один раз в год. Родители не доверяют составу прививки и отказываются от введения ребенку туберкулина. В этом случае они обязаны предоставить в ближайшее время результаты анализа на туберкулез, который был сделан вместо Манту.
Выявление туберкулеза легких у взрослых

Частые простуды или обострения хронических заболеваний, инфекции и воспалительные процессы, которые спровоцированы переохлаждением, тяжелой физической работой или низким иммунитетом, могут стать причиной туберкулеза у старшего поколения. Реакция Манту — недостаточно эффективное исследование для взрослых. Используется вакцинация уже после лечения туберкулезной инфекции или при наличии ярко выраженных признаков заболевания. Существуют диагностические методы обследования, как распознать туберкулез у взрослых.
Чаще всего на ежегодном медицинском осмотре врачи назначают флюорографию или рентгенографию легких. Обзорный метод визуализации грудной клетки, дает представление о состоянии органов дыхания в виде черно-белого снимка, на основании которого может быть обнаружен очаг туберкулеза. Подозрение рентгенолога или выявленные патологии дыхательной системы потребует дополнительного обследования.
Туберкулинодиагностика

С целью предупреждения распространения заболеваемости среди младшего поколения применяется подкожная инъекция или проба Манту, которая проводится каждый год. Ребёнок получает вещество туберкулин или штамм возбудителя туберкулеза, созданный в искусственных лабораторных условиях. Ослабленная микобактерия должна вызвать реакцию со стороны иммунной системы на месте укола. Оценивают результат проведенной пробы Манту через 72 часа:
- отрицательный — до 1 мм
- сомнительный — 2-5 мм;
- положительный — более 6 мм;
- слабоположительный — 5-9 мм;
- средний уровень интенсивности — 10-14 мм;
- выраженный — до 16 мм;
- гиперергические. У детей и подростков — более 17 мм, у взрослых — более 21 мм.
Кроме этого существуют и ложные показатели. Учитывают и предыдущие данные. Даже отрицательный результат не является гарантией отсутствия палочки Коха в организме. Но даже при таких недостатках, проба Манту — самая распространенная профилактика и диагностика туберкулеза у детей и подростков на ранних стадиях. Недопустима вакцинация при аллергии и бронхиальной астме, воспалительном процессе и заболеваниях органов пищеварения, сахарном диабете.
Тесты на туберкулез

Заменить традиционные методы профилактики и раннего выявления туберкулеза можно с помощью иммуноферментного анализа крови, который часто используется вместо пробы Манту. Принцип проведения данного исследования состоит в иммунной реакции организма, антител, к антигенам IgG и IgM возбудителя, микобактерии. В процессе анализа в среду с предполагаемыми туберкулезными палочками M. Tuberculosis помещают содержащие окрашивающее вещество защитные клетки, которые взаимодействуют с источником инфекции и передают вирусу часть фермента.
Метод диагностики ПЦР. Для лабораторного изучения лучше использовать мокроту. Под воздействие высокой температуры выделяют чужеродное ДНК. Для того, чтобы определить микобактерии или их штаммы, сравнивают образец с уже полученными ранее. Диагностированный туберкулез можно получить уже через 5 часов после сдачи исходного материала. Процедуру часто применяют для детей с противопоказаниями для проведения туберкулинодиагностики или для подтверждения диагноза.
Рентгеноскопическое исследование

Назначается на ежегодном медицинском обследовании у представителей старшего поколения. Не допускаются к процедуре дети из-за высокой дозы радиации для еще недостаточно окрепшего иммунитета. Лучевая диагностика предназначена для скрининга органов грудной клетки, поиска очагов туберкулеза и профилактики других патологий.
Рентгенография и флюорография органов грудной клетки. С помощью специального экрана рентгеновские лучи проходят через тело обследуемого человека, обрабатывается теневое изображение и переносится на пленку. Проявление занимает несколько минут. Цифровая флюорография выводит на монитор уже готовую картинку, которая распечатывается в черно-белом формате на принтере или сохраняется в электронном виде. На снимке флюорографии виден очаговый, инфильтративный и хронический запущенный туберкулез в виде очагов поражения.
Компьютерная и магнитно-резонансная томография легких. Методы более информативного характера для точного выявления туберкулеза, которые дают возможность с точностью определить размеры очагов поражения и жидкостные скопления, патологии. Чувствительность в 100 раз превышает флюорографию и рентген.
Общий анализ крови при туберкулезе
Изучение состава и количественных показателей жидкой соединительной ткани, которая, так или иначе, сталкивается с бациллой M. Tuberculosis, важно для ранней диагностики заболевания. При туберкулезе у пациента наблюдается умеренная анемия, уровень гемоглобина у мужчин ниже 130, у женщин менее 120. В период обострения легочной формы изменяется зернистость лейкоцитов и их количество увеличивается от 20% до 50%, число эозинофилов, молодых иммунных клеток, уменьшается.
Но основной показатель активности туберкулеза — это скорость оседания эритроцитов или СОЭ. Эта проба показывает способность эритроцитов, плотность которых больше плазмы, оседать под действием гравитации. В здоровом организме норма у женщин не должна превышать 15 мм/час, у мужчин — 10 мм/час. Повышение СОЭ от 20 мм/ч и до 80 мм/ч указывает на большое количество иммуноглобулинов и низкий уровень альбумина в крови, что означает активизацию защитных сил организма под действием чужеродных клеток.
Используют часто и лейкограмму, которая основана на изменении белкового состава крови во время острого воспалительного процесса. Учитываются показатели таких лейкоцитов, как нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты. Обследование на заболевание туберкулез легких выделяет три фазы поражения иммунной системы организма:
- нейтрофильная. Активная защитная реакция. Количество нейтрофилов увеличивается, уровень моноцитов и лимфоцитов снижается, эозинофилы отсутствуют;
- моноцитарная. Попытка преодолеть туберкулезную инфекцию. Число нейтрофилов низкое, прослеживаются единичные эозинофилы, лимфоциты увеличиваются;
- восстановления. Наблюдается после выздоровления пациента. Количество лимфоцитов и эозинофилов увеличено, но их показатели приходят в норму.
В сравнении с ИФА и ПЦР анализами, обнаружен сам возбудитель туберкулеза не будет, но изменения состава крови будет достаточно, чтобы заподозрить наличие в организме воспалительного процесса и продолжить обследование, направленное на поиски источника.
Метод выявления кислотоустойчивых микобактерий
Особенностью клеточной стенки туберкулезной палочки является отсутствие реакции на хлорсодержащие средства и кислые среды. Поэтому проведение диагностических мер в лабораторных условиях часто выполнить невозможно. Заменяет микроскопические методы исследования мазка в таких случаях бактериоскопия или окрашивание мокроты.
Микроскопия мазка или материала, содержащего КУБ, осуществляется по Граму и способом окрашивания, известного, как метод Циля-Нильсена. Вирус Коха сначала подвергается воздействию красного вещества карбол-фуксина, который проникает в мембрану клетки, а потом сверху обрабатывается раствором метиленовым синим. Положительным результатом наличия туберкулезной палочки станет присутствие в мазке на синем фоне красных микобактерий. В современной медицине чаще используется аурамин-родамин. После ультрафиолетового спектра бациллы приобретают желтый оттенок.
Бактериологическое исследование промывных вод бронхов
Используется, как дополнительный способ забора мокроты и метод выявления в ней возбудителя туберкулеза, когда у больного не получается собрать материал самостоятельно или количество выделений недостаточно для проведения обследования. Запрещено назначать людям пенсионного возраста, при заболеваниях сердечно-сосудистой системы и бронхиальной астме, детям до 15 лет.
Процедура предусматривает местную анестезию дыхательных путей и введение в гортань с помощью специального шприца подогретого физиологического раствора для повышения уровня секреции. После проведенных манипуляций мокрота у пациента интенсивно выделяется естественным путем и собирается медицинскими работниками в пробирку для последующего посева и выращивания микобактерий.
Пункционная биопсия легкого
Для определения патологического процесса, протекающего в легких, и получения исходного образца, назначается инвазивная диагностика туберкулеза у взрослых. Она направлена на изучение причин кашля с кровью, внутреннего легочного кровотечения, явной дыхательной недостаточности, взятие материала слизистых, бронхиального секрета или мокроты, получения образца пораженного участка.
Обязательным условием пункционной биопсии является четкий контроль над выполняемыми действиями через ультразвуковой аппарат или с помощью рентгеновских лучей. Суть процедуры состоит в местном обезболивании области грудной клетки и введения иглы Сильвермена для захвата и отделения фрагмента легочной ткани. После проведения биопсии определяется степень и форма поражения дыхательной системы. В запущенных случаях прибегают к открытому хирургическому вмешательству под общим наркозом.
Бронхоскопия
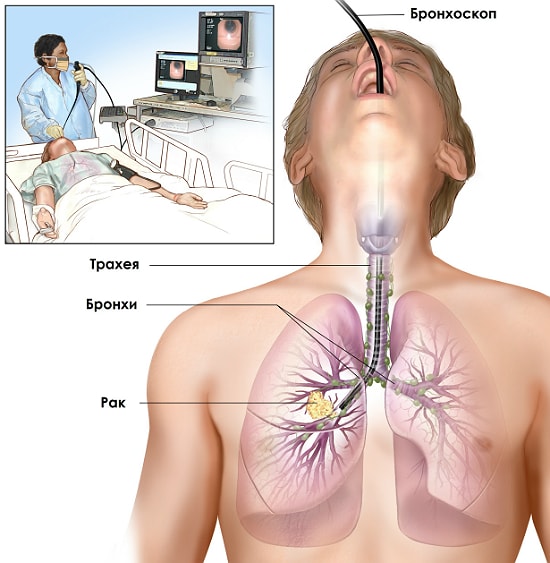
Чтобы изучить и оценить степень поражения легочной системы, включая трахеи, бронхи и слизистые оболочки, в медицинской практике все чаще отдают предпочтение эндоскопической диагностике туберкулеза. К показаниям для проведения процедуры относится длительный кашель, который наблюдается у человека более 1 месяца, выделения мокроты с кровью, выявленные ранее патологии в легких.
Во время обследования необходима местная анестезия и мышечные релаксанты, чтобы обеспечить свободный вход в дыхательные пути гибкого тубуса со светопроводным устройством. Взятие материала слизистой или секрета из трахеи и бронхов способствует изучению цитологического состава мокроты на наличие инородных клеток туберкулезной палочки.
При лабораторной диагностике туберкулеза недостаточно дать ответ, констатирующий, обнаружены или нет тем или иным методом микобактерий туберкулеза. Для клиники туберкулеза, детального представления о характере микобактериальной популяции и определения прогноза заболевания необходимо изучение различных свойств культур, выделенных от больного: лекарственной чувствительности, ферментативной активности, вирулентности, видовой принадлежности. В некоторых случаях необходимо дифференцировать выделенные культуры и установить характер атипичных культур. Все это обусловливает то разнообразие исследований, которые необходимо проводить при лабораторной диагностике туберкулеза.
Определение лекарственной чувствительности выделенных штаммов микобактерий является необходимым и весьма важным этапом микробиологических исследований. Развитие лекарственной устойчивости обусловлено многими факторами: селекцией устойчивых вариантов в микобактериальной популяции, вегетирующей в организме больного; индукцией противотуберкулезными препаратами или антибиотиками, применяемыми в процессе химиотерапии; передачей эписомного R-фактора чувствительным особям (нехромосомная устойчивость) и др. Следует отметить, что снижение чувствительности микобактерий туберкулеза отмечается ко всем противотуберкулезным препаратам, однако оно может отличаться по степени, характеру, частоте и скорости появления. Известно, что из патологического материала от больных туберкулезом выделяются неоднородные по лекарственной чувствительности микобактерий: устойчивые к одному лекарственному препарату, или моноустойчивые, варианты с истинной двойной или полиустойчивостью, а также смесь вариантов, устойчивых к различным препаратам.
Определение спектра и степени чувствительности микобактерий туберкулеза к противотуберкулезным препаратам имеет важное значение для тактики химиотерапии больных, контроля за эффективностью лечения и определения прогноза заболевания. Степень лекарственной чувствительности микобактерий туберкулеза определяется в соответствии с установленными критериями, которые зависят как от противотуберкулезной активности лекарственного препарата, так и его концентрации в очаге поражения, величины максимальной терапевтической дозы, фармакокинетики препарата и др.
Определение лекарственной чувствительности в настоящее время проводится бактериологическими методами — методом разведений на плотной питательной среде и методом разведений (или абсолютных концентраций) на жидких питательных средах. Имеется много модификаций обоих методов. В качестве унифицированного в России применяют рекомендованный Комитетом по химиотерапии ВОЗ метод определения лекарственной чувствительности микобактерий на плотной среде Левенштейна — Йенсена (без крахмала), в которую перед свертыванием добавляют различные концентрации препаратов. Минимальный набор состоит из 2—3 пробирок с разными концентрациями каждого из используемых в данной клинике препаратов, одной контрольной пробирки со средой без препарата.
Этот метод достаточно точен. Он позволяет применять патологический материал, содержащий любое количество микобактерий, поскольку для определения лекарственной чувствительности используются микобактерий, предварительно выделенные из патологического материала. Поскольку сроки выделения возбудителя на питательных средах составляют не менее 1—1,5 мес, результаты определения лекарственной чувствительности указанным методом можно получить не ранее чем через 2—2,5 мес после забора материала. В этом заключается один из основных недостатков метода. Описанный метод определения лекарственной чувствительности микобактерий после выделения их чистой культуры получил название непрямого метода.
При массивном бактериовыделении (не менее 1—5 микобактерий в каждом поле зрения) применяют прямое определение лекарственной чувствительности при выделении возбудителя непосредственно из патологического материала. Для этого используют метод глубинного посева и метод культивирования на стеклах в жидких питательных средах. Эти методы более трудоемки, требуют дополнительного приготовления мазков, окраски и микроскопирования последних и, кроме того, менее точны, так как невозможно дозировать засев микобактерий. Однако результаты можно получить в более короткие сроки (через 12 дней). Практикуется также прямое определение лекарственной устойчивости на плотных средах, в этом случае результаты можно получить через 3 нед.
Лекарственно-чувствительные штаммы дают рост на средах с препаратами в пределах определенной концентрации, различной для каждого препарата. Штаммы, которые растут при соответственно более высоком содержании этих препаратов в питательной среде, относят к лекарственно-устойчивым. Устойчивость определяют по наличию макроскопически видимого роста на плотных и микроскопического роста — на жидких средах.
Устойчивость данного штамма в целом выражается той максимальной концентрацией препарата (количество микрограмм в 1 мл питательной среды), при которой еще наблюдается размножение микобактерий (по числу макроколоний при посеве на плотные среды и микроколоний при посеве на жидкие среды). Лекарственно устойчивые микроорганизмы способны размножаться при таком содержании препарата в среде, которое оказывает на чувствительные особи бактериостатическое или бактерицидное воздействие. При определении лекарственной устойчивости микобактерий на плотных средах культура считается чувствительной к той концентрации препарата, которая содержится в среде, если число колоний микобактерий, выросших на одной пробирке с препаратом, не превышает 20. Только при наличии более 20 колоний культура расценивается как устойчивая.
Для различных препаратов установлена определенная предельная концентрация, при которой еще наблюдается размножение чувствительных к этому препарату микобактерий. Границей, или критерием устойчивости, называют те первые концентрации препарата в питательной среде, выраженные в микрограммах на 1 мл, при которых начинают размножаться устойчивые особи. Для плотной среды Левенштейна—Йенсена установлены следующие концентрации (мкг/мл):
- стрептомицин — 5;
- изониазид — 1;
- этионамид — 30;
- протионамид — 30;
- циклосерин — 50;
- канамицин — 30;
- флоримицин (виомицин) — 30;
- тиоацетазон (тибон) — 2;
- этамбутол — 2;
- рифампицин — 20.
Наряду с анализом лекарственной чувствительности все выделенные при посеве медленно растущие штаммы микобактерий подлежат первичной идентификации для определения их видовой принадлежности (М. tuberculosis, М. bovis, М. africanum, М. microti), так как принадлежность возбудителя к тому или иному виду существенно влияет на тактику химиотерапии, прогноз заболевания и др. Одним из основных лабораторных тестов, позволяющих дифференцировать М. tuberculosis и М. bovis и микобактерии всех других видов, служит ниациновый тест. Он основан на уникальной способности микобактерии человеческого типа синтезировать ниацин (никотиновую кислоту) в значительно больших количествах, чем микобактерии бычьего типа и нетуберкулезные микобактерии.
Биологическая проба. При отрицательных результатах бактериоскопии и посева материала, исследуемого на микобактерии туберкулеза, если все же подозревается туберкулез, ставят опыты на животных (так называемая биологическая проба). Это наиболее чувствительный метод выявления возбудителя туберкулеза. Самым чувствительным к туберкулезной инфекции лабораторным животным является морская свинка. Считается, что заражение морской свинки позволяет диагностировать туберкулез даже при наличии в материале, использованном для заражения, 1—5 микробных клеток.
Биологический метод широко применяется в диагностике туберкулеза со времени открытия возбудителя этой инфекции. Он не потерял своей ценности и в настоящее время. Более того, сейчас этот метод с успехом применяется для выявления не только типичных неизмененных, но и разнообразных биологически измененных форм возбудителя, в частности L-трансформированных и фильтрующихся форм. Кроме того, этот метод является основным при определении видовой принадлежности микобактерии, их вирулентности, изучении патогенности атипичных культур. Он широко используется для воспроизведения туберкулеза отдельных органов, исследования аллергических реакций, иммунитета и эффективности химиотерапии при туберкулезе. В последние годы метод применяется при проведении биологических пассажей в процессе изучения биологически измененных форм возбудителя в целях получения биологической реверсии.
При любом методе заражения морских свинок микобактериями туберкулеза у животных развивается генерализованный туберкулезный процесс, заканчивающийся гибелью. Однако следует иметь в виду, что возбудители туберкулеза, устойчивые к препаратам изоникотиновой кислоты, вследствие снижения или потери вирулентности могут не вызывать заболевание у морских свинок и дать отрицательные результаты биологической пробы при одновременном наличии роста на питательных средах при посеве. Это обстоятельство диктует необходимость дифференцированного подхода к результатам биологической пробы и одновременного использования метода посева при проведении заражения животного в диагностических целях.
Для повышения частоты обнаружения микобактерий туберкулеза в патологическом материале многие авторы используют, помимо подкожного, интратестикулярное заражение. При этом в патологическом материале удается чаще выявлять изониазидоустойчивые слабовирулентные микобактерий. Кроме того, для повышения чувствительности биологического метода рекомендуется искусственно снижать естественную резистентность морских свинок ежедневным введением больших доз кортизона (12,5 мг), что позволяет повысить результативность биологической пробы на 15—29% (по данным разных исследователей). Наконец, результативность биологической пробы можно повысить, применяя метод последовательных биологических пассажей. Для этого заражение каждой последующей морской свинки производится гомогенатом органов от предыдущего животного, использованного в биологической пробе. По мере увеличения числа пассажей нарастает выраженность специфических изменений в органах.
Следует подчеркнуть, что особую ценность биологическая проба представляет для диагностического исследования олигобациллярного материала.
Перед заражением морским свинкам с массой 200—250 г ставят реакцию Манту, вводя 0,02 мл альттуберкулина Коха внутрикожно в наружную поверхность бедра, освобожденную от волосяного покрова; контроль — введение такого же количества бульона в другую лапку. При отрицательной реакции через 48 ч свинку можно брать в опыт. Для заражения в диагностических целях можно использовать различный патологический материал: мокроту, мочу, промывные воды, отделяемое ран и др. Исследуемый материал обычно обрабатывают 3% раствором серной кислоты так же, как и для посева. Затем осадок 2 или (лучше) 3 раза отмывают стерильным изотоническим раствором NaCl и центрифугируют. Такое отмывание является обязательной процедурой, поскольку при попадании кислоты животному под кожу может развиться некроз. К отмытому осадку добавляют изотонический раствор NaCl и вводят эту смесь под кожу правой паховой области. За свинками проводят систематическое наблюдение, проверяя появление местного инфильтрата в месте введения материала, изъязвление этого инфильтрата, состояние регионарных лимфатических узлов и места введения материала; повторно ставят реакцию Манту. То же повторяют через 6 нед и далее. При положительных туберкулиновых пробах и наличии местных изменений свинок забивают через 1—1,5 мес, при отсутствии признаков развивающегося туберкулеза — через 3 мес.
Туберкулиновые пробы при наличии туберкулезного процесса становятся положительными через 2 нед — 1 мес после заражения.
На вскрытии свинок, погибших от туберкулеза, наблюдается картина генерализованного туберкулеза. Если при заражении в материале были слабовирулентные микобактерии туберкулеза, то развитие процесса может ограничиться увеличением лимфатических узлов и единичными очажками в органах. Во время вскрытия делают мазки-отпечатки из органов для бактериоскопических исследований. Кроме того, кусочки лимфатических узлов, селезенки, печени и легких вырезают стерильным инструментом, помещают в стерильную ступку, гомогенизируют и засевают на плотные питательные среды. Посевы производят обязательно при отсутствии в органах макроскопически видимых изменений туберкулезного характера. Кроме того, в сомнительных случаях проводят гистологическое исследование тканей.
Для оценки распространенности и характера туберкулезного поражения у морских свинок предложено несколько схем учета макроскопических изменений в органах. Наибольшее распространение в нашей стране получили схемы, разработанные М.В. Триус и Ю.К. Вейсфейлером. По этим схемам специфические изменения в органах и лимфатических узлах оцениваются в зависимости от степени их выраженности плюсами, которые затем переводятся в цифровые показатели.
Микробиологическая диагностика b-трансформированных и фильтрующихся вариантов микобактерии. Все изложенное выше касается разнообразных методов выявления и идентификации классических бактериальных форм возбудителя туберкулеза, не учитывая многообразные формы, возникшие в результате морфологической, тинкториальной и биологической изменчивости микобактерии.
В настоящее время традиционные методы выделения микобактерии туберкулеза все меньше удовлетворяют нужды клиники, так как информативность микробиологических исследований явно недостаточна. Применяемые методы малоэффективны и не позволяют составить представление об истинном состоянии микобактериальной популяции, вегетирующей в организме больного. Это объясняется, с одной стороны, недостаточной чувствительностью ряда методов, а с другой (в значительно большей степени), тем, что большинство таких методов не позволяет выявить возбудитель, находящийся в b-трансформированном состоянии.
b-трансформация
b-трансформация — закономерный этап жизненного цикла микобактерии.
b-формы — это варианты бактерий с дефектом клеточной стенки. Им придают особое значение в патологии человека и животных в связи с их способностью длительно существовать в макроорганизме и реверсировать в исходный вид с восстановлением свойственной ему вирулентности. Возможность попеременного или одновременного существования возбудителя в бактериальной и b-форме не только значительно затрудняет диагностику, но и влияет на развитие эпидемического процесса, создавая ложное впечатление об абациллировании источников и стерилизации очагов инфекции.
Таким образом, результаты бактериологических исследований, рассчитанных на выделение только бактериальных форм возбудителя, не могут служить основанием для исключения туберкулезной инфекции и должны дополняться данными, полученными специальными методами, которые направлены на выявление b-форм микобактерий. Последние, как известно, являются закономерно существующей формой возбудителя при разных клинических проявлениях туберкулезного процесса, а также основной формой персистирования микобактерий.
Установлено, что b-трансформация микобактерий закономерна и при использовании специальных методов исследования она может быть выявлена. Из-за биологических особенностей b-форм, для которых характерны резко измененная морфология бактериальных клеток и сниженный метаболизм, выделение их требует специальных методов культивирования и идентификации. b-формы могут обнаруживаться в виде гигантских зернистых тел, скоплений различных по размеру, гомогенности и оптической плотности шаров, гранул, сферопластоподобных образований, светопреломляющих тел и др, b-фюрмы и близкие к ним варианты возбудителя туберкулеза характеризуются повышенной хрупкостью и требуют применения особых методов выделения и условий культивирования: щадящих методов обработки материала, элективных питательных сред, наличия нативных белков и осмотических стабилизаторов.
b-формы выделяются преимущественно у больных, недавно прекративших выделять бактериальные формы. У данного контингента больных с сохранившимися полостями деструкции и воспалительными изменениями в легочной ткани выделение b-форм продолжается еще в течение 3—4 мес и более после прекращения выделения бактериальных форм. Таким образом, целенаправленные поиски b-форм микобактерий показаны у больных, не выделявших или прекративших выделять бактериальные формы, но имеющих явные клинические признаки активного туберкулезного процесса. К таким признакам относится наличие участков деструкции легочной ткани, каверн с неравномерно широкими стенками и с эволютивными воспалительными изменениями в окружающей легочной ткани.
Поиски b-форм микобактерий туберкулеза должны проводиться повторно, многократно, так как выделение их носит периодический характер. В настоящее время разработаны и применяются разнообразные методы микробиологической диагностики b-трансформированных вариантов: бактериоскопические, культуральные, биологические, серологические, иммунофлюоресцентные, гистологические. Разработаны методические основы культурального выделения b-форм, сконструированы элективные питательные среды, предложены методы обработки материала, подобраны адекватные детергенты и осмотические стабилизаторы, разработана схема посева и контролей. Предложены методы окраски b-форм в чистой культуре и патологическом материале; разработаны стандартные и ускоренные методы реверсии и др. Все это позволяет выделять b-формы из разнообразного патологического материала и устанавливать их видовую специфичность.
Исследованиями последних лет (А.Г. Хоменко, В. И. Голышевская) установлено, что при многих клинических проявлениях туберкулеза (особенно на фоне длительной комбинированной химиотерапии) в организме больных и экспериментальных животных обнаруживаются и ультрамелкие формы возбудителя, проходящие через бактериальные фильтры. Частота обнаружения этих микроорганизмов варьирует в зависимости от формы процесса и особенно от лекарственного режима.
Для выделения ультрамелких форм разработаны культуральный и биологический методы. Основной принцип этих методов заключается в том, что исследованию подвергается материал, последовательно профильтрованный через мембранные фильтры с размером пор 0,65; 0,45 и 0,22 мкм. При этом исследуемый субстрат полностью очищается от бактериальных форм возбудителя, осколков микобактерий и других вариантов изменчивости, в материале остаются только фильтрующиеся формы. Полученный фильтрат засевают на специальные питательные среды или вводят морской свинке. Результаты оценивают по данным бактериоскопии мазков, приготовленных из культивированного фильтрата или в результате реверсии возбудителя в бактериальную форму.
Читайте также:


