Патологический процесс при туберкулезе
Морфологические изменения при туберкулезе многообразны. Они обусловлены особенностями микобактерий туберкулеза, иммунологическим состоянием организма, факторами внешней среды, влиянием на течение патологического процесса различного рода лекарственных препаратов. Патологоанатомическая картина при туберкулезе определяется специфическими и параспецифическими тканевыми изменениями.
Специфическое туберкулезное воспаление, как и всякое другое, складывается из явлений альтерации, экссудации и пролиферации.
Альтерация представляет собой повреждение ткани вплоть до развития некроза. Туберкулезная природа воспаления при альтерации определяется наличием в участках поражения микобактерий туберкулеза.
Экссудация характеризуется появлением в зоне воспаления серозного пропитывания, выпадения фибрина, клеточных скоплений с преобладанием мононуклеаров. Альтеративно-экссудативный компонент обычно преобладает при массивности и вирулентности инфекций, повышенной чувствительности к возбудителю туберкулеза, снижении защитных сил организма.
Пролиферация, или продуктивный характер воспаления, наиболее типична для туберкулеза. При ней наблюдаются усиленное размножение клеточных элементов, трансформация их в очаге воспаления, образование бугорков (гранулем).
Туберкулезный бугорок имеет следующее строение: в центре бугорка аморфный тканевый детрит (следствие альтерации и некроза), по периферии расположен вал из нескольких слоев эпителиоидных клеток; во внешных слоях бугорка в небольшом количестве обнаруживаются лимфоидные клетки. Среди эпителиоидных клеток располагаются крупные многоядерные клетки Пирогова — Лангханса (рис. 3). По преобладанию того или иного типа клеточных элементов различают эпителиоидноклеточные, лимфоидные и гигантоклеточные бугорки. При высокой резистентности организма эпителиоидные клетки вытягиваются, превращаются в фибробласты и бугорок рубцуется. При снижении резистентности организма развивается экссудативная тканевая реакция с появлением творожистого некроза (казеоза), который может развиваться и в бугорке, и в окружающей его ткани, пропитанной серозно-фибринозным экссудатом. В дальнейшем очаг некроза может рассосаться, подвергнуться соединительнотканному замещению, обызвествлению и даже окостенению (оссификации).
Проявления туберкулеза в тканях и органах отличаются большим разнообразием: из бугорков возникают различной величины очаги. Очаги туберкулезного воспаления в легком могут ограничиваться ацинусом, долькой, сегментом, занимать долю легкого. Очаги творожистого некроза могут расплавляться, и на их месте появляются полости распада — каверны, а на слизистых оболочках дыхательных путей при расплавлении казеоза возникают язвы. Для туберкулеза типичен волнообразный характер течения, проявляющийся клиническими фазами обострения (инфильтрация, распад, обсеменение) и затихания (уплотнение, рубцевание, обызвествление, рассасывание). Основные фазы туберкулезного процесса характеризуются сменой экссудативной и продуктивной тканевых реакций, порой с преобладанием неспецифического компонента. Так называемые параспецифические реакции (А. И. Струков) расцениваются как токсико-аллергические. Заболевание туберкулезом (первичным) развивается после контакта микроорганизма с микобактериями туберкулеза.
Фокус специфического воспаления в месте внедрения и оседания микобактерий получил название первичного аффекта, но локализация первичного аффекта не всегда определяется воротами внедрения инфекции. Вокруг первичного очага в легком, представляющего собой фокус казеозной пневмонии, образуется зона неспецифической перифокальной пневмонии. Следующим этапом развития процесса является поражение лимфатических путей (лимфангит) и затем лимфатических узлов (лимфаденит) также с явлениями перифо-кального воспаления. Так происходит формирование первичного туберкулезного комплекса. При отсутствии тенденции к прогрессированию первичный туберкулезный комплекс подвергается анатомо-биологическому заживлению; зона перифокального воспаления исчезает, вокруг творожистого фокуса формируется состоящая из внутреннего специфического и внешнего неспецифического слоев капсула. Творожистое содержимое очага уплотняется, обызвествляется и т. д. Сроки заживления могут растягиваться на годы и определяются размерами очага и состоянием организма. Капсула первичного очага не представляет собой герметического барьера, а скорее является биологической мембраной, через которую очаг влияет на организм в целом. При полном анатомическом заживлении первичного комплекса возможно повторное заражение с возникновением повторного (реинфекционного) первичного комплекса.
Прогрессирование первичного туберкулезного комплекса ведет к заболеванию хроническим первичным туберкулезом и многообразным последующим проявлением туберкулеза органов.
Вторичный туберкулез, т. е. заболевание туберкулезом лиц, перенесших в прошлом первичный туберкулез, может возникать как эндогенным путем, так и вследствие повторного (экзогенного) инфицирования организма. Более подробно сведения о патоморфологических изменениях приведены при описании различных форм легочного и внелегочного туберкулеза.
В настоящее время установлено, что один бактериовыделитель может заразить в год до 10-12 человек.
Первичное инфицирование проходит через несколько стадий:
1. Внедрение возбудителя через слизистые оболочки дыхательных путей, желудочно-кишечного тракта или плаценту.
2. Бактериемия (распространение возбудителя по лимфатическим и кровеносным сосудам).
3. Поражение регионарных (чаще внутригрудных) и периферических лимфатических узлов с развитием в них специфического туберкулезного воспаления.
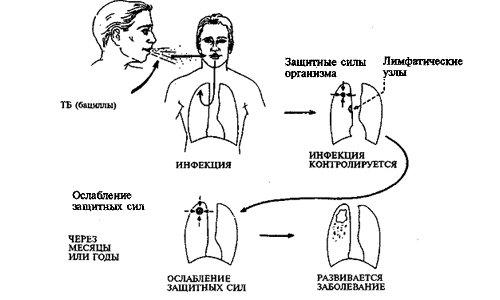
После внедрения возбудителя в организм развивается первичная бактериемия. Этот период - первичной туберкулезной инфекции обычно не имеет клинических проявлений, может продолжаться до 6-8 недель в зависимости от массивности, вирулентности микобактерий и уровня иммунитета. Циркулируя в крови, микобактерии вызывают иммунологическую перестройку организма ребенка. В это время у ребенка обнаруживается вираж туберкулиновых проб, то есть впервые выявленная положительная туберкулиновая проба. Если защитные функции организма оказались достаточными и предотвратили дальнейшее размножение микобактерий, то развитие патологического процесса не происходит и ребенок остается практически здоровым, хотя и инфицированным с виражом туберкулиновых проб. Чем раньше выявлено первичное инфицирование и назначен комплекс профилактических мероприятий, тем больше вероятность предупредить у ребенка переход инфицирования в заболевание.
Позднее, при неблагоприятных условиях может возникнуть воспаление, которое характеризуется появлением специфических для туберкулеза изменений в пораженных органах.
Выделяют следующие стадии туберкулезного воспаления: инфильтрация (формирование туберкулезного очага различного диаметра), творожистый некроз (казеоз), рассасывание (полное, неполное), кальцинация. Кальцинация не является полным заживлением, т.к. в кальцинатах, как правило, находятся микобактерий, которые спустя даже много лет, могут активизироваться, проникнуть в кровь, вызвать вторичный туберкулезный процесс и стать источником самозаражения при неблагоприятных условиях.
Клинико-патологические изменения, возникающие при первичном заражении микобактериями, принято называть первичным туберкулезом.
Основные клинические формы первичного туберкулеза у детей и подростков:
1. Первичная туберкулезная интоксикация.
2. Первичный туберкулезный комплекс.
3. Туберкулез внутригрудных лимфатических узлов.
Предрасполагающие факторы развития первичного туберкулеза у детей:
• иммунодефицитное состояние ребенка;
• отсутствие вакцинации против туберкулеза.
Способность детского организма, особенно раннего возраста, на сравнительно небольшой очаг туберкулезной инфекции отвечать общими функциональными расстройствами, создает условия для возникновения такой детской формы туберкулеза, как туберкулезная интоксикация.
ПЕРВИЧНАЯ ТУБЕРКУЛЕЗНАЯ ИНТОКСИКАЦИЯ
Первичная туберкулезная интоксикация развивается часто у детей первых лет жизни в начальном периоде заболевания туберкулезом, вскоре после заражения микобактериями.
Основные клинические проявления первичной туберкулезной интоксикации:
§ нарастают симптомы туберкулезной интоксикации: снижение аппетита, слабость, утомляемость, раздражительность, ухудшение сна;
§ выражены нейровегетативные расстройства: потливость, головная боль, тахикардия;
§ выявляется микрополиаденит (умеренное диффузное увеличение периферических лимфатических узлов);
§ появляется вираж туберкулиновых проб (папула 6 и более мм);
§ иногда отмечается узловатая эритема: на коже голеней по ходу сосудов появляются красные болезненные узелки (размерами от горошины до вишни);
§ происходит остановка физиологической прибавки или определяется дефицит массы тела;
§ возникает наклонность к интеркуррентным заболеваниям;
§ наблюдается изменение показателей периферической крови: эозинофилия, нейтрофилез, лейкопения, небольшое увеличение СОЭ и иммунологического статуса: снижение уровня Т-лимфоцитов и их активности.
Продолжительность указанных клинических симптомов - от 1 до 4 месяцев. При своевременной диагностике и адекватной специфической терапии возможно выздоровление. При неблагоприятном течении происходит развитие локальных форм туберкулеза.
ПЕРВИЧНЫЙ ТУБЕРКУЛЕЗНЫЙ КОМПЛЕКС
Первичный туберкулезный комплекс наблюдается чаще у детей дошкольного и школьного возраста, что связано с возросшими контактами, периодами наиболее интенсивного роста и развития всех органов и систем, гормональной и иммунологической перестройкой организма.
Частота заболеваемости девочек и мальчиков одинакова. В последние годы первичный туберкулезный комплекс встречается реже по сравнению с прошлыми годами и составляет от 9 до 18%.
1. Внедрение возбудителя через верхние дыхательные пути в периферические отделы легкого (чаще в правое) с последующим развитием очага воспаления (первичный очаг специфического воспаления в легочной ткани).
3. Вовлечение в процесс регионарных лимфатических узлов и как следствие - развитие регионального лимфаденита.
В последующем, в центре очага воспаления в легком, а также в соответствующем лимфатическом узле образуется творожистый некроз (казеоз) ткани, по окружности обнаруживается перифокальное неспецифическое воспаление (как следствие аллергической реакции).
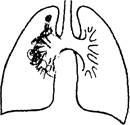
Первичный туберкулезный комплекс
Основные клинические проявления первичного туберкулезного комплекса.
• выражены симптомы интоксикации: повышенная утомляемость, потливость, слабость, недомогание, фебрильная лихорадка в течение 1-2 недель, которая сменяется длительным высоким субфебрилитетом;
• пальпируются от 7 до 10 групп периферических лимфатических узлов, мягко-эластической консистенции, диаметром от 2 до 10 мм (от просяного зерна до боба) с явлениями свежего воспаления в подмышечной группе лимфатических узлов, которые более выражены на стороне легочно-железистого воспаления;
• наблюдаются симптомы поражения легких: небольшая одышка, сухой кашель, локальное укорочение перкуторного звука над очагом специфического воспаления, здесь же выслушивается ослабленное дыхание, скудные влажные хрипы;
• изменяются показатели периферической крови: анемия, умеренный лейкоцитоз, эозинофилия, увеличение СОЭ до 35 - 40 мм/ч;
• туберкулиновые пробы всегда положительные.
Комплексная специфическая терапия приводит, как правило, к клиническому и рентгенологическому выздоровлению с образованием мелких петрификатов в легком и лимфатических узлах. Обызвествленные очаги, особенно в лимфатических узлах, содержат микобактерии, сохраняющие вирулентность, которые при неблагоприятных условиях могут стать источником реинфекции с развитием вторичного туберкулеза.
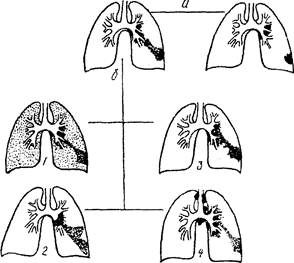
Исходы первичного туберкулезного комплекса:
а- неосложненное течение: образование очага Гона и кальцинатов в лимфоузлах;
б - осложненное течение:
1 - гематогенная диссеминация;
4 - лимфогенная диссеминация.
ТУБЕРКУЛЕЗ ВНУТРИГРУДНЫХ ЛИМФАТИЧЕСКИХ УЗЛОВ (БРОНХОАДЕНИТ)
Туберкулез внутригрудных лимфатических узлов (бронхоаденит) занимает самый большой удельный вес - от 70 до 80%, среди всех вновь заболевших туберкулезом органов дыхания детей.
Бронхоаденит характеризуется тем, что первичный очаг формируется во внутригрудных лимфатических узлах: паратрахеальных, трахеобронхиальных, бронхопульмональных. При этой форме туберкулеза могут поражаться как отдельные группы, так и все лимфатические узлы корня легкого и средостения.
У детей раннего возраста заболевание протекает, как правило, тяжело. Клинические проявления зависят от степени преобладания инфильтративно-воспалительных или казеозных изменений в лимфоидной ткани.
Не нашли то, что искали? Воспользуйтесь поиском:

Патологическая анатомия туберкулеза при прогрессировании, затихании и заживлении
Изложение основ патологической анатомии туберкулеза на современном уровне знаний нельзя рассматривать только как описание прогрессирующих деструктивных форм.
Патоморфологическое изучение процессов восстановления при различных формах этого заболевания и в различных органах значительно дополнило клиническое, рентгенологическое и патофизиологические исследование проблемы заживления. Развитие туберкулеза как специфического воспаления или инфекционного воспалительного процесса нельзя в настоящее время представлять только как проявление местно возникающих изменений в связи с локализацией туберкулезных микобактерий в том или ином органе.
Наши представления о патогенезе туберкулеза обогатились в настоящее время знаниями тех процессов, которые возникают в центральной и периферической нервной системе при различных фазах заболевания. Установлено, что в центральной нервной системе при туберкулезе у человека и в эксперименте наблюдаются различные дистрофические изменения и ограниченные воспалительные процессы (В. И. Пузик, Л. Е. Иванова, О. Д. Сенюшкина, В. П. Грязнова, И. А. Шройт).
В патоморфологической лаборатории Института туберкулеза установлено, что в связи с наступлением очень ранних изменений в коре больших полушарий и на периферии — в легких — задолго до развития в ней туберкулезного воспаления могут наблюдаться реактивные изменения; нервных волокон, оказывающиеся в дальнейшем вполне обратимыми.
Таким образом, если сопротивление организма велико и инфекционный агент количественно или качественно недостаточен, то развиваются лишь небольшие реактивные изменения в ганглиозных клетках больших полушарий и периферических нервах, и воспаления как такового не возникает. Если же реактивность организма понижена и вирулентность возбудителя высока или количество микобактерий туберкулеза чрезмерно, то на периферии развивается воспаление, усугубляясь в дальнейшем импульсами, исходящими из коры и подкорковых областей вследствие вовлечения их в общий патологический процесс организма. Роль фазовых состояний центральной нервной системы в развитии воспаления была показана работами Института туберкулеза.
Давая морским свинкам до заражения малые дозы брома, Л. Е. Иванова снимала первую волну острых процессов набухания в ганглиозных клетках коры. В результате этого туберкулезный процесс у данной группы животных протекал значительно благоприятнее и был количественно значительно меньше, чем в контрольной группе, где бром не применялся.
Итак, мы располагаем в настоящее время данными, позволяющими подойти к пониманию туберкулезного воспаления с позиций нервизма. Слагающие воспаление компоненты — альтерация ткани органов токсинами туберкулезных микобактерий, вызванная далее экссудация различных клеточных элементов и пролиферация могут по разному комбинироваться в воспалительном очаге в связи с тем или иным функциональным состоянием нервной системы, с той или иной сопротивляемостью организма. Не всегда пролиферация является обязательно третьей стадией туберкулезного воспаления: при достаточной резистентности организма можно наблюдать первично пролиферативные процессы.
Преобладание в картине воспаления обширных экссудативных и особенно некротических реакций свидетельствует о пониженной сопротивляемости как организма в целом, так особенно его центральной нервной системы. Развитие всего цикла воспалительных процессов зависит и от местной сопротивляемости органов. Так, как правило, в печени, селезенке, щитовидной железе очень редко развиваются экссудативные реакции. Чаще всего в них отмечаются ограниченные эпителиоидно-клеточные бугорки со значительной примесью гигантских туберкулезных клеток.
Бугорок (туберкул) является основным элементом воспалительного процеcca при туберкулезе. В нем может наблюдаться преобладание как экссудативных, так и продуктивных реакций. Обычно развитию характерных бугорков предшествуют небольшие процессы альтерации местной ткани органов.
Бугорок по своему строению представляется зональным, с наиболее измененными участками в центре. В зрелом туберкулезном бугорке различают казеозный центр, зону эпителиоидных клеток, лежащую кнаружи от казеозного центра, гигантские клетки и окружающий весь бугорок вал из лимфоцитов. Бугорки могут фиброзироваться, причем инкапсуляция в них начинается снаружи. Бугорки могут также сливаться и подвергаться казеозному некрозу. Туберкулезные бугорки под влиянием лечения стрептомицином изменяют свою типичную форму, уменьшаются, прорастают соединительной тканью. Казеоз в них не определяется.
Наряду с воспалением, характеризующимся развитием бугорков, могут развиваться альтернативные и экссудативные формы воспаления, где элементы бугоркового характера почти не выражены. При этих формах, наряду с возникающим острым экссудативным процессом, к которому очень рано могут примешиваться и полинуклеары, образуется характерный для туберкулезного воспаления творожистый распад, или казеоз. Казеоз имеет характер сухого коагуляционного некроза и обычно лишен сосудов.
При прогрессирующем характере воспаления казеоз может подвергаться разжижению и распаду, вследствие чего образуются дефекты. Полости распада при прогрессирующем течении заболевания могут формироваться в любом органе: в легких, костях, почках, половых органах. Полости в легких (каверны) изучены наиболее подробно. Участки более или менее крупных фокусов казеозного распада могут, напротив, при затихании воспаления инкапсулироваться и превращаться в очаги. В ходе туберкулезного заболевания подобные инкапсулированные очаги отмечаются во всех органах.
Не следует противопоставлять продуктивные процессы при туберкулезе экссудативным. Они часто представляют собой фазы одного и того же туберкулезного воспаления и редко бывают представлены в чистом виде; при продуктивном воспалении всегда имеются элементы экссудативного и наоборот.
Пролиферативный, или продуктивный, процесс при туберкулезе не всегда носит выраженный бугорковый характер. Часто пролиферативные изменения имеют тяжистый вид и отмечаются в окружности инкапсулированных очагов. Со временем в подобных участках черты специфического воспаления (наличия казеоза, гигантских клеток, эпителиоидов) утрачиваются и на их месте разрастается рубцовая ткань. Рубец как исход воспалительного процесса оказывается более устойчивым репаративным образованием, чем казеозный инкапсулированный очаг. О. А. Уварова установила, что в рубцах содержатся менее вирулентные туберкулезные микобактерии, чем в инкапсулированных очагах казеоза.
Исследованиями в Институте туберкулеза Академии медицинских наук СССР установлено, что процессы заживления при туберкулезе не ограничиваются только инкапсуляцией и развитием рубцов. Работами В. И. Пузик и А. И. Яковлевой доказано рассасывание ограниченных очагов экссудативного воспаления с полным восстановлением легочной ткани. Доказано, кроме того, что в самом начале формирования очага воспаления, наряду с участками некробиоза, всегда можно отметить также и наличие восстановительных реакций. При этом наблюдаются клетки гистиоцитарного типа, расположенные в различных зонах очага.
Помимо специфической туберкулезной гранулемы, характеризующейся наличием эпителиоидных и гигантских клеток, участками казеозного некроза, развитием более или менее характерных бугорков, привлекают внимание параспецифические реакции, когда в ответ на наличие в органе туберкулезных микобактерий развивается пролиферативная реакция активной соединительной ткани организма. Такие реакции описаны В. И. Пузик в органах детей в ответ на вакцинацию их палочками БЦЖ.
При этом отмечены гиперпластические процессы в эндотелии синусов лимфатических узлов с выраженной пролиферацией эндотелиальных элементов; те же процессы отмечаются и в ретикулярных клетках. Все клеточные элементы оказываются набухшими, гипертрофированными, заполняющими значительную часть узла. Аналогичные процессы гиперплазии клеток активной соединительной ткани отмечены при вакцинации и в межуточной ткани легких, в селезенке, печени, миндалинах.
На фоне параспецифических изменений могут позднее развиваться и специфические гранулемы, чаще всего имеющие выраженный продуктивный характер. В большинстве же случаев наблюдается уменьшение гиперпластических процессов с развитием впоследствии нежных соединительнотканных прослоек по ходу стромы органов. Подобные же параспецифические реакции были обнаружены 3. А. Лебедевой в костном мозгу экспериментальных животных на ранних стадиях заражения и на протяжении всего заболевания у детей и взрослых.
Патоморфологические изменения в органах и тканях при туберкулезе многообразны и зависят от формы, стадии, локализации и распространенности патологического процесса.
Общими для большинства форм туберкулеза являются специфические изменения в сочетании с неспецифическими или параспецифическими реакциями. К специфическим изменениям относится туберкулезное воспаление, течение которого сопровождается формированием туберкулезного бугорка, или гранулемы, и более крупного очага. Неспецифическими изменениями являются различные реакции, обусловливающие так называемые маски туберкулеза.
Морфология туберкулезного воспаления зависит от реактивности организма и вирулентности возбудителя. В туберкулезном очаге могут преобладать явления экссудации, некроза или пролиферации, и очаг в соответствии с этим может быть преимущественно экссудативным, некротическим или продуктивным. В развитии туберкулезного воспаления большая роль принадлежит иммунологическим процессам. В участке воспаления сначала развивается реакция, не имеющая признаков, типичных для туберкулеза. В ней в разной степени выражены явления альтерации и экссудации. На первое место выступают нарушения в микроциркуляторном русле. Они затрагивают тонкую структуру стенки альвеолы, и механизмы их развития можно проследить на ультраструктурном уровне [Ерохин В.В. 1987]. На ранних стадиях воспаления изменения в субмикроскопической организации составных элементов стенки альвеолы связаны с повышением капиллярной проницаемости, развитием внутриклеточного интерстициального и внутриальвеолярного отека с вымыванием отечной жидкостью альвеолярного сурфактанта.
В дальнейшем дистрофические изменения в альвеолярной ткани нарастают, однако наряду с ними возникают и компенсаторно-восстановительные процессы, направленные на развитие внутриклеточной организации, повышение функциональной активности сохраняющихся клеток межальвеолярной перегородки.

В следующей фазе воспаления — пролиферативной — появляются специфические для туберкулеза элементы (эпителиоидные и гигантские клетки Пирогова—Лангханса), формируются участки своеобразного гомогенного казеозного (творожистого) некроза в центре туберкулезного очага. На основании данных электронной микроскопии и авторадиографии о динамике клеточной трансформации установлена генетическая связь клеток гранулемы по линии моноцит — гигантская клетка [Серов В.В., Шехтер А.Б., 1981; Ерохин В.В., 1978, 1987; ОаппеЬе А.М., 1982; БресЛо С., 1982]. Макрофаги активно синтезируют и накапливают лизосомные ферменты, выполняют фагоцитарную функцию. Поглощенный материал, среди которого находятся и микобактерии туберкулеза, находится и переваривается в фагосомах и фаголизосомах.
Эпителиоидные клетки образуются из мононуклеаров и макрофагов, скапливающихся в очаге туберкулезного воспаления в первые фазы воспалительной реакции. Они имеют крупное ядро овальной формы, обычно с 1—2 ядрышками Цитоплазма этих клеток содержит митохондрии, гранулы, аппарат Гольджи, хорошо развитую систему канальцев и цистерны зернистой и незернистой цитоплазматической сети, единичные фагосомы небольших размеров. Число митохондрий, элементов ретикулума, лизосомных включений широко варьирует и определяется функциональным состоянием клетки.
Гигантские клетки Пирогова—Лангханса могут образовываться из эпителиоидных клеток или макрофагов при их пролиферации, а также в результате слияния эпителиоидных клеток. Цитоплазма гигантских клеток содержит большое число ядер, обычно располагающихся в виде кольца или подковы по периферии клеток, множество митохондрий, лизосом, элементов зернистой цитоплазматической сети, хорошо развитый комплекс Гольджи. Гигантские клетки способны к фагоцитозу, в их цитоплазме обнаруживаются различные остаточные включения Они характеризуются высокой активностью гидролитических и дыхательных ферментов.
Помимо эпителиоидных и гигантских клеток, туберкулезная грануляционная ткань обычно содержит значительное число лимфоидных и плазматических клеток, а также нейтрофильный лейкоцитов. В периферических отделах грануляционного слоя выявляются фибробласты. Вокруг очага воспаления нередко имеется перифокальная зона неспецифической воспалительной реакции. При прогрессировании процесса наблюдаются увеличение казеозного некроза, усиление инфильтрации грануляционной ткани мононуклеарами и лимфоидными клетками, а также нейтрофилами, расширение зоны перифокального воспаления. Специфический процесс распространяется контактным и лимфатическим путем.
При заживлении очага туберкулезного воспаления массы казеозного некроза уплотняются, в последних отмечается отложение мелких зерен солей кальция. В грануляционной ткани увеличивается количество фибробластов и фибрилл коллагена, объединяющихся в коллагеновые волокна, которые вокруг туберкулезного очага формируют соединительнотканную капсулу. В последующем специфическая грануляционная ткань все больше замещается фиброзной тканью. Число клеточных элементов между коллагеновыми волокнами уменьшается, иногда коллагеновые волокна подвергаются гиалинозу. В подобных очагах и посттуберкулезных очагах обнаружены измененные формы микобактерий туберкулеза, в частности L-формы, что позволяет лучше понять роль старых туберкулезных очагов в патогенезе вторичных форм туберкулеза [Пузик В.И., Земскова 3.С, Дорожкова И.Р., 1981, 1984]. В основе реактивации туберкулеза и формирования различных форм вторичного туберкулеза легких лежат реверсия и размножение бактериальной популяции на фоне развития недостаточности специфической и неспецифической защиты микроорганизма.
Неспецифические или параспецифические реакции могут формироваться в различных органах и тканях: нервной и сердечно-сосудистой системе, кроветворных органах, суставах, серозных оболочках и др. В сердечно-сосудистой системе и паренхиматозных органах указанные реакции проявляются очаговой или диффузной гистиоцитарной и лимфоцитарной инфильтрацией, в лимфатических узлах — пролиферацией ретикулярных и эндотелиальных клеток, в легких — образованием лимфоидных узелков. А.И. Струков (1959) считает, что эти реакции имеют токсико-аллергическую природу. В.И. Пузик (1946) расценивает их как результат действия микобактерий туберкулеза в ранние периоды развития инфекционного процесса. Показана связь данных реакций с клеточным и гуморальным иммунитетом [Авербах М.М. 1976]
Благодаря профилактическим противотуберкулезным мероприятиям и специфическому лечению наблюдается значительный патоморфоз туберкулеза. К истинному патоморфозу относят уменьшение числа казеозных пневмоний (что свидетельствует о повышении иммунитета), более частое образование туберкулем. Реже стали встречаться формы мил парного туберкулеза и туберкулезного менингита (особенно у детей). Проявлениями индуцированного патоморфоза, обусловленного специфическим лечением, являются изолированные каверны, вокруг которых быстро рассасывается перифокальное воспаление, полное рассасывание или развитие мелких звездчатых рубчиков при гематогенно-диссеминированном туберкулезе, отторжение казеозно-некротических масс с формированием на месте каверны кистолодобной полости при фиброзно-кавернозном туберкулезе.
Применение наиболее эффективных химиопрепаратов приводит к полному излечению от туберкулеза. Чаще наблюдается разное течение туберкулезного воспаления: стабилизация и обратное развитие, приобретение хронического характера с периодами затихания и обострения специфического процесса. Решающее значение принадлежит макроорганизму, состоянию его защитных механизмов, способности противостоять действию антигенного раздражителя, а также развитию полноценных репаративных процессов.
- Этиология туберкулеза
- Первичный патогенез
- Патогенез клинического туберкулеза
- Патологическая анатомия туберкулеза
- Патогенетическое лечение
Туберкулез — это опаснейшее инфекционное заболевание, с которым борются на протяжении многих столетий с переменным успехом. Патогенез туберкулеза основан на специфических воспалительных процессах, разрушающих ткани органов человека, в основном легких.

Многие выдающиеся ученые изучали туберкулез, этиологию, патогенез, и значительно продвинули вперед возможности медицины в борьбе с этим недугом. Но и в наше время, несмотря на то что его этиология и патогенез достаточно исследованы, туберкулез остается серьезным заболеванием, грозящим эпидемиями.
Этиология туберкулеза
Возбудителем туберкулеза становятся микобактерии специфичного туберкулезного комплекса. Источником появления бактерий являются люди, больные туберкулезом легких. Очень редко инфекция может передаваться от животных. Болезнетворные бактерии могут выделиться в виде мокроты, только через рот больного человека (при кашле, чихании, разговоре). Затем ее мельчайшие частицы (размером до 5 мкм) формируют аэрозольные облачка, которые много часов могут распространяться в воздухе.
Вдыхая воздух, здоровый человек получает порцию инфекции, которая и становится возбудителем болезни при благоприятных условиях. Такой аэрогенный путь проникновения бактерий в организм человека является основным в этиологии туберкулеза. Обычно заражение происходит в помещениях, где опасные аэрозоли сохраняются длительное время. Проветривание и вентиляция значительно уменьшают риск инфекции; кроме того, бактерии погибают под действием прямых солнечных лучей.
Помимо воздушно-дыхательного пути, инфекция может передаваться алиментарным, контактным и внутриутробным способами. Однако алиментарный (через загрязненные продукты и вещи) путь инфицирования встречается в 10000 раз реже, чем аэрогенный способ. Контактный путь проникновения бактерий может наблюдаться в основном при попадании зараженной крови. В целом туберкулез принято относить к социальным заболеваниям, связанным с низким уровнем жизни. К группе риска относятся лица без определенного места жительства, обитатели трущоб, люди, находящиеся в исправительных организациях.
Первичный патогенез
В общем случае патогенез туберкулеза можно охарактеризовать как воспалительный процесс гранулематозного типа, который вызывает появление многочисленных бугорков, склонных к разложению. Первичный патогенез заключается в локальном инфицировании входных ворот и регионарном лимфадените.
В абсолютном большинстве случаев (до 98%) легкие человека становятся входными воротами для инфекции. Несмотря на то что большинство возбудителей болезни погибает, небольшая их часть попадает в макрофаги, которые переносят бактерии в регионарные лимфатические узлы. В течение 10-80 дней в паренхиме легких и в лимфатических узлах активизируется воспалительный процесс. В паренхиме легких возникает казеозный некроз и инкапсуляция, которые заживляются при фиброзе. Очаг разрушения паренхимы может расшириться, что приводит к пневмонии или плевриту. При значительном размере некроза ядро очага разжижается и выделяет мокроту в бронхи, образуя каверну.

Очаги в лимфатических узлах также подвергаются фиброзу, и заживление их более затруднительно. Бактерии могут сохраняться в них несколько десятков лет. При первичном патогенезе лимфатические узлы могут не увеличиваться. В то же время прикорневые узлы могут значительно расшириться и сдавить бронх, что ведет к ателектазу. Возникает опасность разрушения стенки бронха с образованием свища. В результате всех процессов возникает очаг уплотнения.
Первичный патогенез туберкулеза протекает с проникновением бактерий практически во все ткани органа. Активное их размножение происходит в верхней части легких, почках и костях. При недостаточном клеточном иммунитете начинает проявляться диссеминированный туберкулез.
Патогенез клинического туберкулеза
При недостаточном функционировании макрофагов процесс размножения бактерий начинает развиваться в геометрической прогрессии. В пространство между клетками ткани проникает значительное число медиаторов и ферментов, приводящее к разрушению ткани путем ее разжижения. Воспалительный процесс распространяется на весь орган. Увеличивается проницаемость стенок сосудов, а в ткань проникают лейкоциты и моноциты. Появляются туберкулезные гранулемы с преобладанием некроза. Таким образом, первичная форма заболевания перерастает в клиническую форму.
Продолжительность периода до проявления клинических симптомов зависит от многих факторов. К первым таким признакам можно отнести возникновение диссеминированного туберкулеза и туберкулезного менингита. Время до их проявления составляет 2-6 месяцев. Туберкулезный бронхит может появиться через 3-9 месяцев. Развитие туберкулеза до клинической формы в костях может продолжаться несколько лет, а в почках — до 10 лет.
Патологическая анатомия туберкулеза

Патологическая анатомия туберкулеза характеризуется рядом специфических повреждений тканей. При диссеминированном туберкулезе наиболее характерны единичные бугорки в легких. В других органах они практически не встречаются. Генерализованный гематогенный туберкулез может проявиться в виде казеозных очагов, в основном в легких, но иногда встречается в других органах человека. В редких случаях диссеминированная форма заболевания ведет к сепсису.
Патологическая анатомия острой формы болезни указывает на многочисленные небольшие очаги, характерные при милиарном туберкулезе. Возникают благоприятные условия для миграции бактерий и возникновения лимфангитов. Вокруг капилляров возникают желтоватые выпуклости с размером до 2 мм. Процессы в легких ведут к поражению сосудов — вен и ветвей легочной артерии. В самом легком развиваются очаги размером до 10 мм.
В целом патологическая анатомия туберкулеза описывается такой картиной: специфические гранулемы, васкулиты и альвеолиты явственно проступают в тканях легких.
На следующей стадии преобладает интерстициальный сетчатый склероз.
Патогенетическое лечение
Обычное терапевтическое лечение туберкулеза ведет борьбу с общим воспалительным процессом. Патогенетическая терапия направлена воздействовать на определенные зоны, ответственные за патогенез туберкулеза.
Патогенетическое лечение основывается на выделении двух основных типов протекания туберкулеза. К первому типу относят резкое начало болезни через туберкулезную интоксикацию и разрушение тканей, заметное на рентгенограмме уже на первичной стадии. В легких главенствуют экссудативные реакции. Инфильтрационный процесс проходит с появлением очагов некроза. Ко второму типу причисляется слабовыраженный процесс (без явных симптомов). В этом случае в ткани легких имеют преимущество продуктивные реакции, а патологических отклонений не наблюдается. Вокруг очагов некроза образуются оболочки. Признаки туберкулеза диагностируются только при томографических исследованиях.

Номенклатура препаратов, используемых при патогенетическом лечении, достаточно широка. Для снижения воспалительных реакций вводятся глюкокортикоиды и гепарин натрия. Если возникает риск проявления фиброзных аномалий, то назначается гиалуронидаза, пирогенал, пеницилламин. Важное значение имеет устранение побочных воздействий антибиотиков, для чего рекомендуются антигистаминные средства, пиридоксин, глутаминовая кислота, пирацетам. Для укрепления защитных функций внутреннего органа используются иммуномодуляторы и иммунокорректоры. Особо выделяется применение поливалентных патогенетических препаратов, которые могут предотвращать и устранять некоторые патологические изменения.
Патогенетическое лечение назначается с учетом переносимости человеком лекарственных средств и степени устойчивости бактерий к ним. Вид терапии зависит от этапа развития болезни и применяемого противотуберкулезного лечения. В первой фазе патогенетическая терапия туберкулеза использует противовоспалительные и антигипоксические препараты, направленные на устранение побочных воздействий и выведение токсико-аллергических веществ. На втором этапе лечения патогенетическая терапия применяет методы активизации репаративных процессов.
Важными препаратами, используемыми в патогенетической терапии, являются глюкокортикоиды. Они уменьшают миграцию клеток из сосудов, оказывают противовоспалительное действие, обладают иммунодепрессивным и антигистаминным свойствами, участвуют в подавлении биологического синтеза коллагена. К наиболее эффективным препаратам этого ряда можно отнести преднизолон, триамианолон, дексаметазон. Они достаточно надежно помогают бороться с туберкулезом первого типа течения.
Туберкулез характеризуется специфичным патогенезом и этиологией. При лечении туберкулеза важно учитывать патогенетические процессы.
Использование методов патогенетической терапии позволяет повысить эффективность медикаментозного лечения.
Читайте также:


