Пцр диагностика туберкулеза m tuberculosis m bovis
Цена: 240 руб.
Материал: УГ соскоб, моча, эякулят
Время забора: 7:00-18:30сб. 7:00-13:00вс. 8:00-11:00
Выдача результатов: В день сдачи биоматериала через 6 часов, кроме субботы и воскресенья
Условия подготовки к анализам:
Не мочиться 2 часа
Mycobacterium tuberculosis-bovis - кач.
Определение ДНК возбудителей туберкулеза: комплекса микобактерий: M. tuberculosis, M. bovis, в соскобе эпителиальных клеток урогенитального тракта методом полимеразной цепной реакции (ПЦР).
Туберкулёз (от лат. tuberculum — бугорок) – распространённое, социально зависимое заболевание человека. Болеют им и животные. Возбудитель туберкулёза открыт Р. Кохом в 1882 г. Это кислотоустойчивые аэробные бактерии (74 вида) рода mycobacterium, широко распространённые в почве, воде и у животных. У человека чаще всего возбудителем является Mycobacterium tuberculosis. Второй по частоте является Mycobacterium bovis. Оба вида очень очень устойчивы ко многим факторам внешней среды, а в организме очень долго остаются жизнеспособными и могут вызвать заболевание через многие годы после заражения. Очень важно, что микобактерии туберкулёза могут образовывать так называемые L-формы. Сохраняясь в организме, они создают противотуберкулёзный иммунитет. Длительное время туберкулёз может протекать скрыто и обнаруживаться случайно, хотя нередко уже проявляются такие симптомы, как слабость, быстрая утомляемость, субфебрильная температура, ночная потливость, а в крови – анемия и лейкопения. В настоящее время, несмотря на все достижения антимикробной терапии, туберкулёз угрожает будущему нации. Поэтому все методы диагностики, особенно его латентных форм являются крайне важными.
Существует много методов лабораторной диагностики туберкулёза: микроскопия мазка (чаще всего для этого используют мокроту), классический культуральный метод, ИФА. Всем им присущи достоинства, но и определённые недостатки, в частности, обнаружение микобактерий только в случае их достаточного количества.
В последние годы для диагностики используют полимеразную цепную реакцию (ПЦР). Её высокая чувствительность позволяет обнаружить в исследуемом материале единичные клетки и даже их фрагменты ДНК. Метод исключает перекрёстные реакции и специфичность достигает 100%. ПЦР позволяет дифференцировать ограниченные и диссеминированные формы туберкулёза, особенно у детей даже при отрицательных результатах микробиологических исследований.
- определяемый фрагмент - специфичные участки ДНК микобактерий;
- специфичность определения - 100%;
- чувствительность определения-100 копий ДНК микобактерии в образце.
Обследование женщин целесообразно проводить в первую половину менструального цикла, не ранее 5 –ого дня. Допустимо обследование во второй половине цикла, не позднее, чем за 5 дней до предполагаемого начала менструации. При наличии выраженных симптомов воспаления, взятие материала проводится в день обращения. Накануне и в день обследования пациентке не рекомендуется выполнять спринцевание влагалища. Не рекомендуется взятие биоматериала на фоне проведения антибактериальной терапии (общей / местной) и во время menses, ранее 24- 48 часов после полового контакта, интравагинального УЗИ и кольпоскопии. Рекомендуется брать материал не ранее, чем через 14 дней после применения антибактериальных препаратов и местных антисептиков, и не ранее, чем через 1 месяц после применения антибиотиков перорально. Если для исследования берут соскоб из уретры, сбор материала проводят до или не ранее 2 - 3 часов после мочеиспускания. Если для исследования берут мочу, следует собирать первую утреннюю порцию мочи в количестве 20-30 мл в стерильный флакон. Не рекомендуется взятие биоматериала на фоне проведения антибактериальной терапии.
- Воспаления эндометрия.
- Наличие перенесённого туберкулёза в анамнезе.
- Бесплодие при исключении гинекологической патологии у женщин.
- Ненормальная реакция на туберкулиновую пробу (гиперчувствительность или анергия) на фоне обострения какого-либо системного заболевания.
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Читайте также:
|
Морфология.Микобактерии туберкулеза — тонкие прямые пли слегка изогнутые палочки длиной 1—4 мкм, шириной 0,3— 0,6 мкм (М. bovis несколько короче и толще), неподвижны, не образуют спор и капсул. В культурах встречаются зернистые формы, нитевидные, ветвящиеся.
Тинкториальные свойства.В связи с высоким содержанием липидов (до 50%) микобактерии туберкулеза кислото- и щелочеустойчивы и окрашиваются по методу Циля-Нильсена в ярко-красный цвет. Грамположительны.
Культуральные свойства.Возбудители туберкулеза культивируются в аэробных условиях на элективных питательных средах, содержащих растертое содержимое куриных яиц, картофель, глицерин, аминокислоты, различные соли. Наибольшее признание получили среды Левенштейна-Иенсена (яичная среда с добавлением картофельной муки, глицерина, солей и малахитовой зелени для подавления роста других микроорганизмов), среда Петраньяни (яичная среда с добавлением молока, картофельной муки, кусочков картофеля и глицерина), картофельно-глицериновая среда, состоящая из кусочков картофеля и глицерина, глицериновый бульон. Можно использовать синтетическую среду Сотона, содер-кащую аспарагин, глицерин, цитрат железа, фосфат калия, сульфат магния. Для подавления посторонней микрофлоры в яичные среды добавляют малахитовую зелень. М. bovis для роста не нуждается в глицерине.
На плотных питательных средах микобактерии туберкулеза образуют морщинистые, суховатые, с неровными краями колонии-(R-формы). Некоторые виды атипичных микобактерии на свету или в темноте образуют каротиноидные пигменты, в связи с чем колонии приобретают желтую или оранжевую окраску. На жидких средах появляется нежная пленка, которая постепенно утолщается и приобретает бугристо-морщинистый вид и желтоватый цвет. Бульон остается прозрачным.
Возбудители туберкулеза характеризуются медленным ростом, что связано с длительным периодом генерации клеток, и для выделения М. tuberculosis требуется 12—25 дней, а М. bovis — 24— 40 дней.
Ферментативные свойства.Микобактерии туберкулеза являются биохимически активными микроорганизмами. Ферментируют алкоголь, глицерин, многие углеводы до кислоты, продуцируют лецитиназу, уреазу, каталазу. Некоторые биохимические свойства (продукция уреазы, термостабильной каталазы, пероксидазы, ни-котинаминазы, восстановление нитратов, накопление в среде ниацина), а также культуральные, используются для дифференциации микобактерий.
Токсинообразование.Туберкулезные микобактерииэкзотоксин не образуют, токсическими свойствами обладают многие химические компоненты клетки: фосфатиды, жирные кислоты, миколовая кислота, гликолипид (так называемый корд-фактор). Механизм действия корд-фактора заключается в предохранении бактерий отразрушения фагоцитами хозяина и подавлении миграции лейкоцитов.
Антигенная структура.Антигены микобактерий туберкулеза представлены белковыми, полисахаридными и липоидными компонентами клеток. М. tuberculosis и, М. bovis в антигенном отношении сходны. Серовары не установлены.
Всего известно около 70 видов микобактерий, но только 5 из них вызывают заболевание туберкулезом, которые объединяются в туберкулезный комплекс - M.tuberculosis complex:
1. M.tuberculosis humanus (M.tuberculosis) - человеческий тип, вызывающий до 85% случаев туберкулеза (по другим данным до 92 %).
2. M.tuberculosis bovinus (M.bovis) - бычий тип, вызывающий 10-15% случаев туберкулеза (по другим данным до 5%).
3. M.tuberculosis africanus (M.africanus) - африканский тип, вызывающий до 90% случаев туберкулеза в Южной Африке.
4. M.tuberculosis microti (M. microti) - мышиный тип, редко вызывает заболевание.
5. M.tuberculosis bovinus (M. bovis BCG) - вакцинный штамм, применяющийся для специфической профилактики от туберкулеза.
Патогенность для животных.Туберкулез распространен среди крупного рогатого скота, свиней, лошадей, кошек, собак, кур, индеек. Из лабораторных животных к М. tuberculosis высокочувствительна морская свинка, менее чувствительны кролики, М. bоvis и атипичные микобактерий непатогенны для морских свинок и кроликов.
7. Эпидемиология и патогенез туберкулеза.
Патогенез.Источник возбудителя в природе — человек с актив— ной формой туберкулеза (главным образом, легочного), реже животные иптицы, больные туберкулезом.
Пути передачи возбудителей — воздушно-капельный, алиментарный, контактный, внутриутробное инфицирование плода через плаценту.
Входные ворота инфекции — слизистые оболочки и кожа. Заражение чаще всего происходит воздушно-капельным путем, и поэтому первичный очаг возникает в легких. Образуется так называемый первичный туберкулезный комплекс (продуктивный тип поражения), который характеризуется наличием воспалительного процесса в легком (инфекционная гранулема, в центре которой находятся микобактерий) и регионарного лимфаденита. Туберкулезная гранулема рассматривается как область реакции антиген-антитело. В ее формировании принимает участие корд-фактор. При доброкачественном течении первичного туберкулезного комплекса происходит рубцевание очага, его кальцинация и затихание воспалительного процесса. При этом освобождения организма от возбудителей, как правило, не происходит. Такие инфицированные люди обладают, с одной стороны, относительным иммунитетом (нестерильный иммунитет), а с другой — потенциально скрытой формой туберкулеза, которая может активироваться при снижении резистентности организма.
Другой исход первичного туберкулезного комплекса — некроз элементов гранулемы, казеозный распад ее, прорыв в окружающие ткани и их обсеменение бактериями. Процесс может распространиться на весь орган (например, на все легкое), микобактерий уберкулеза лимфогенно и гематогенно из места первичной лока-лизации распространяются по организму, вызывая различные клинические формы: туберкулез органов дыхания, мочеполовой системы, кишечника, костей, суставов, мозговых оболочек, кожи, глаз. Генерализация туберкулезного процесса зависит от количества микобактерий, их вирулентности, резистентности и гиперчувтвительности макроорганизма.
Воспалительная реакция при туберкулезе, особенно легких, может развиваться и по экссудативному типу в виде пневмонии. Этот тип поражения характеризуется развитием отека, скоплением вокруг микобактерий полиморфноядерных лейкоцитов, а позже — моноцитов. Процесс может заканчиваться полной абсорбцией экссудата,некрозом ткани или трансформацией в продуктивный тип поражения.
Человек обладает естественной резистентностью к туберкулезной палочке, и из всех инфицированных (около 80% всего взрослогонаселения старше 20 лет) заболевает не более 10%. Отмечено существование генетической предрасположенности к заболеванию туберкулезом.
Пути выделения возбудителя из организма зависят от клинической формы туберкулеза: с мокротой, с испражнениями, с мочой.
Исход инфекции.У больных со сниженной резистентностью организма возможен переход в хронический процесс. Первичный туберкулез протекает довольно тяжело и дает сравнительно высокую летальность у ранее неинфицированных и непривитых людей. При экзогенной суперинфекции болезнь протекает тяжелее, чем при обострении первичного туберкулеза. Наиболее уязвимы люди в пожилом и старческом возрасте.
8.Особенности иммунитета при туберкулезе.
Иммунитет при туберкулезе относительный, инфекционный, носит, в основном, клеточный характер. По данным Н. А. Хониной с соавт. (2000), синдром вторичного иммунодефицита выявляется у 98% больных туберкулезом. Имеются указания на угнетение иммунитета при пассивной и длительной полихимиотерапии. Показано, что изониазид неблагоприятно влияет на клеточный иммунитет, являясь при этом основным противотуберкулезным препаратом. Согласно современным представлениям, ключевым звеном в формировании иммунного ответа на туберкулезную инфекцию, как отмечалось ранее, являются альвеолярные макрофаги и различные субпопуляции лимфоцитов. Накопленные к настоящему времени факты позволяют отнести туберкулез к интерлейкинным заболеваниям.
9.Методы микробиологической диагностики туберкулеза.
Микробиологическая диагностика.Материалом для исследования в зависимости от клинической формы заболевания являются мокрота, моча, спинномозговая жидкость, испражнения, гной, экссудат, промывные воды желудка и бронхов, которые собирают в стерильную посуду.
Микроскопический этапявляется наиболее распространенным. Мокроту выливают в чашку Петри, ставят на черную поверхность стола, выбирают комочки гноя, наносят их на предметное стекло ирастирают между двумя стеклами. Спинномозговую жидкость оставляют в холоде на 18—24 часа. На поверхности жидкости образуется нежная пленка фибрина, в которой находятся микобактерий туберкулеза. Эту пленку осторожно распределяют на предметном стекле. Мочу, промывные воды желудка и бронхов и др. материал центрифугируют и из осадка делают мазки.
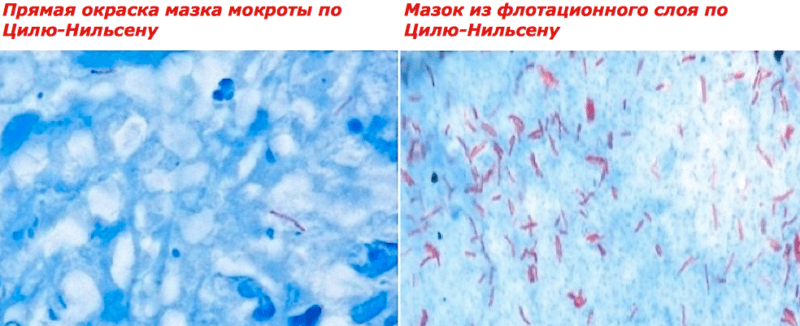
Метод гомогенизации.Суточную порцию мокроты выливают во флакон, добавляют равный объем 1 % водного раствора едкого натра, плотно закрывают резиновой пробкой и энергично встряхивают 10—15 мин. Мокроту, утратившую вязкость, центрифугируют, жидкость сливают, осадок нейтрализуют добавлением 2—3 капель 10% соляной кислоты или 30% уксусной кислоты. Из осадка готовят мазки и окрашивают по Цилю-Нильсену.
Метод флотации.Мокроту гомогенизируют описанным выше способом и прогревают при 55° С в течение 30 мин на водяной бане. Затем добавляют 1—2 мл ксилола (бензола, бензина), встряхивают в течение 10 мин и отстаивают 20 мин при комнатной температуре. На поверхности образуется сливкообразная пленка, состоящая из всплывших капелек ксилола с адсорбированными микробами. Из нее пипеткой готовят мазок, несколько раз наслаивая материал на предметное стекло по мере его высыхания. Препарат фиксируют и окрашивают по Цилю-Нильсену.
Используется также люминесцентная микроскопия. Препарат окрашивают аурамином, микобактерии туберкулеза светятся ярким золотисто-зеленым светом.
Результаты бактериоскопического метода рассматривают как ориентировочные, т. к. при микроскопии микобактерии туберкулеза могут быть не обнаружены, кроме того, не представляется возможным их дифференцировать от других микобактерии.
10.Аллергологическая диагностика туберкулеза. Туберкулин: состав, способ получения и применение. Внутрикожная проба Манту: техника проведения и интерпретация.
Аллергологическийэтап. Кожно-аллергическая проба Манту ставится с туберкулином с целью выявления инфицированных I микобактериями туберкулеза лиц, при отборе контингентов для I ревакцинации, для оценки активности туберкулезного процесса, I определения эффективности вакцинации БЦЖ.
Туберкулин представляет собой протеин, полученный из I фильтрата бульонной культуры микобактерии осаждением и очисткой химическими и физическими методами. Туберкулин вводят внутрикожно в дозе 0,1 мл в среднюю, треть передней поверхности предплечья в строго определенной дозировке. Результаты учитывают через 48 часов. Если диаметр инфильтрата на месте введения туберкулина не превышает 1 мм, пробу считают отрицательной, при диаметр инфильтрата 2—4 мм — проба сомнительная, более 5 мм — по ложительная.
11. Профилактика туберкулёза.
Профилактика. Специфическая профилактика осуществляется путем активной иммунизации живой противотуберкулезной вакциной БЦЖ- Аттенуированный вакцинный штамм получен французскими учеными Кальметтом и Гереном путем длительного, в течение 13 лет, культивирования М. bovis на глицериново-картофельной среде с добавлением желчи. Вакцину вводят внутрикожно. Первичная вакцинация осуществляется всем здоровым новорож денным при отсутствии противопоказаний на 5—7-й день жизни, Ревакцинацию проводят через каждые 5—7 лет до 30-летнего возраста лицам с отрицательной туберкулиновой пробой.
1. Предмет и задачи клинической микробиологии.
Клиническая микробиология - наука, изучающая взаимоотношения,складывающиеся методу макро- и микроорганизмами в норме, при патологии) в динамике патологического процесса с учетом проводимой терапии до констатации клиницистом состояния клинического или полного выздоровления.
Из определения следует, что основой клинической микробиологии является тесная, неразрывная связь между сотрудниками лаборатории и лечащими врачами. Те. как научная дисциплина клиническая микробиология опирается на клинико-диагностическую лабораторию ЛПУ в целом и на отделение бактериологии в частности. В задачи клинической микробиологии должны быть поставлены: изучение системы антиинфекционной резистентности в ее микробиологическом и иммунологическом аспектах; определение возбудителей заболевания с особым вниманием к госпитальным штаммам; расшифровка механизмов патогенеза заболеваний различной локализации; объективизация диагностики и результатов терапии таких пациентов. Существенная роль отводится также участию в разработке рациональных методов химио- и иммунотерапии больных.
2. Понятие об условно-патогенных микроорганизмах, их роль в патологии человека.
Условно-патогенные микроорганизмы часто являются естественными обитателями организма человека, вызывают заболевания только при снижении иммунитета и достаточно большой инфицирующей дозе. Заражение может происходить экзогенным путем (контактным, воздушно-капельным, алиментарным), в результате аутоинфекции, а также при использовании инструментальных методов лечения и обследования больных, когда микробы попадают непосредственно во внутреннюю среду организма, минуя естественные барьеры. Инфекционный процесс развивается на фоне снижения естественного или приобретенного иммунитета, чему способствуют тяжелые соматические заболевания, большая кровопотеря, переохлаждение и другие факторы. Условно-патогенные микроорганизмы способны вызывать инфекционный процесс в любых тканях организма. Особенности клинической картины вызываемых ими заболеваний определяются локализацией возбудителя в организме.
Наиболее часто условно-патогенные микрорганизмы являются возбудителями внутрибольничной инфекции (напр., стафилококковой), т. к. именно в стационарных лечебных учреждениях создаются условия, благоприятные для их распространения, и имеется ослабленный контингент людей, восприимчивых к заражению. Возрастанию их роли в инфекционной патологии способствовало широкое внедрение в лечебную практику антибиотиков, вызвавшее нарушение экологического баланса - взаимоотношений между представителями нормальной микрофлоры организма и развитие устойчивости к антибиотикам у микроорганизмов. Основные возбудители внутрибольничной инфекции - антибиотикорезистентные штаммы (т. н. госпитальные штаммы).
3. Понятие о внутрибольничных (ятрогенных, госпитальных, нозокомиальных) и оппортунистических инфекциях, условия их возникновения и этиология.
Госпитальные (нозокомиальные) инфекции - инфекции, которые возникают у больного через 48 ч и более после поступления в лечебное учреждение при условии отсутствия клинических проявлений этих инфекций в момент поступления и исключения вероятности инкубационного периода.
Ятрогенные инфекции - инфекции, вызванные диагностическими или терапевтическими процедурами.
Оппортунистические инфекции - инфекции, развивающиеся у больных с поврежденными механизмами иммунной защиты.
Предрасположенность пациента или риск развития у него госпитальной инфекции связаны с наличием факторов риска, которые можно разделить на две категории - внутренние и внешние.
Внутренние факторы обусловлены самим течением болезни пациента. Строгие профилактические меры проводятся в отношении так называемой группы высокого риска развития инфекционных осложнений - иммунокомпрометированных пациентов и пациентов с периферическими венозными катетерами.
Среди факторов внешнего воздействия наиболее значительными являются хирургические вмешательства и использование инвазивных методик в тактике лечения. Широкое использование в медицинской практике различных приспособлений для проведения инвазивных процедур существенно увеличивает риск развития инфекционных осложнений. Такие медицинские приспособления, как внутривенные катетеры, облегчают проникновение микроорганизмов из внешней среды в организм пациента. Катетеры служат своеобразным резервуаром для размножения микрофлоры при отсутствии влияния на нее иммунной системы организма.
Окружающая пациента внешняя среда (вода, воздух, пища) относится к числу традиционных внешних факторов, оцениваемых эпидемиологами. Но они играют меньшую роль в современных больницах, чем прежде. Главной целью лечебных учреждений должно быть прежде всего строгое соблюдение гигиенических и технических стандартов. Практика проведения микробиологического мониторинга за объектами внешней среды (посевы воздуха, смывы с различных предметов) в большинстве стран мира в настоящее время считается убыточной с финансовой точки зрения и неэффективной в плане профилактики нозокомиальных инфекций. Несмотря на это, в условиях остаточного финансирования отечественного здравоохранения во многих стационарах существует угроза возникновения эпидемических вспышек госпитальных инфекций из-за неудовлетворительных условий внешней больничной среды.
4. Основные возбудители внутрибольничных инфекций: стафилококк, стрептококк, клебсиелла, протей, синегнойная палочка и кишечная палочка, грибки рода Candida. Таксономическое положение, основные биологические свойства.
Молекулярно-генетическое исследование, позволяющее определить в исследуемом биоматериале наличие ДНК возбудителей туберкулеза – M. tuberculosis и M. bovis.
Возбудители туберкулеза, ДНК [реал-тайм ПЦР] (моча, клетки эндометрия матки, эякулят, секрет простаты).
Mycobacterium tuberculosis complex, DNA.
Полимеразная цепная реакция в режиме реального времени.
Для чего используется этот анализ?
Для диагностики туберкулеза мочеполовой системы и контроля за его лечением.
Когда назначается анализ?
При подозрении на туберкулез.
Какой биоматериал можно использовать для исследования?
Клетки эндометрия матки, первую порцию утренней мочи, мазок урогенитальный (с секретом предстательной железы), эякулят.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Туберкулез по сей день является наиболее частой причиной смерти от инфекционных заболеваний у взрослых. Он вызывается человеческим (M. tuberculosis) и бычьим (M. bovis) типом микобактерий. Отличительной особенностью этих бактерий является устойчивость их клеточной стенки к действию кислот, отчего их называют кислотоустойчивыми. Заражение Mycobacterium tuberculosis происходит, как правило, воздушно-капельным путем, а Mycobacterium bovis – алиментарным (через пищевые продукты, в том числе и молоко), возможно заражение контактным путем (через раневую поверхность) и внутриутробно (от больной туберкулезом матери к плоду).
При первичном инфицировании клинические симптомы, как правило, отсутствуют. По мере прогрессирования заболевания появляются усталость, ночная потливость и лихорадка, кашель с мокротой, теряется масса тела. Примерно в 10 % случаев наблюдается активная форма туберкулеза, риск развития которой наиболее высок при ослабленном иммунитете, в том числе при ВИЧ-инфекции, сахарном диабете, терминальной почечной недостаточности, злокачественных опухолях и т. д.
Наиболее быстрым и высокочувствительным методом (чувствительность – 95 %) выявления туберкулеза является полимеразная цепная реакция. Ее принцип основан на амплификации (многократном увеличении числа копий) специфичных для возбудителей туберкулеза участков ДНК.
Для чего используется исследование?
- Для диагностики туберкулеза – мочеполовой системы, а также легочных форм.
- Для оценки эффективности проводимой противотуберкулезной терапии.
- Для раннего выявления рецидивов туберкулеза.
Когда назначается исследование?
- При симптомах или рентгенологических изменениях, характерных для туберкулеза.
- При бесплодии.
Что означают результаты?
Референсные значения: отрицательно.
Причины положительного результата
- Инфицирование возбудителями туберкулеза.
- Выявление фрагментов ДНК нежизнеспособных микобактерий туберкулёза после эффективной терапии (ложноположительный результат).
Причины отрицательного результата
- Отсутствие инфицированности возбудителями туберкулеза (отсутствие туберкулеза).
- Недостаточное количество возбудителя.
Что может влиять на результат исследования?
- Предшествующая антибактериальная терапия.
- Загрязнение пробы посторонними молекулами ДНК способствует ложноположительному результату, ингибирование полимеразной цепной реакции компонентами биопроб (гемоглобином, гепарином и т. д.) – ложноотрицательному.
Кто назначает исследование?
Фтизиатр, терапевт, педиатр, врач общей практики, уролог, гинеколог.
Литература
- Кишкун А. А. Руководство по лабораторным методам диагностики / А. А. Кишкун. – М. : ГЭОТАР-Медиа, 2007. – 822 с.
- Fitzgerald D., Haas D. W. Mycobacterium tuberculosis. In: Principles and practice of infectious disease / G.L. Mandell, Bennett J.E., Dolin R (Eds) ; 6th ed. – Churchill Livingstone, Philadelphia, PA 2005. – 2701 p.
- Slaven E. M. Infectious diseases. Emergency department, diagnosis & management / E.M. Slaven, S.C. Stone, F.A. Lopez. – McGraw-Hill’s,
Оставьте ваш E-mail и получайте новости, а также эксклюзивные предложения от лаборатории KDLmed
Микобактериозы – группа инфекционных заболеваний человека и животных, включая все виды птиц, вызываемая бактериями рода Mycobacterium.
Большинство видов микобактерий
птиц вызывают хроническую (зачастую без проявления внешней симптоматики в течение длительного периода времени) полиорганную инфекцию с поражением печени, селезенки, легких, кишечника, суставной и костной ткани.
Также процесс может протекать локально, с поражением отдельных участков кожи и прилежащих тканей (чаще в области головы либо конечностей).
Некоторые виды возбудителя являются зооантропонозными, т.е.заразны для животных и человека. К ним относятся в том числе Mycobacterium tuberculosis, M.bovis и M.avium, вызывающие у людей туберкулёз. Передача возбудителя может происходить от птицы человеку и наоборот – в равной степени и люди, болеющие туберкулёзом, несут опасность заражения для домашних птиц, проживающих с ними.
Помимо трех вышеобозначенных видов, есть и другие микобактерии (M.fortuitum, M. scrofulaceum, M. intracellulare и др.), встречающиеся у птиц и потенциально опасные для людей. Чаще они не вызывают системных поражений (тубёркулеза), однако могут провоцировать очаговые хронические дерматиты с образованием абсцессов; главным образом, к группе риска по подобным атипичным микобактериозам относятся дети младшего возраста, пожилые люди, ВИЧ-положительные, онко-больные, а также люди, проходящие химиотерапию или иммуносупрессивную терапию.
Проблема постановки диагноза на микобактериоз и лабораторной диагностики данного заболевания у птиц стоит весьма остро, и на то есть несколько причин:
1. неравномерное выделение возбудителя из организма больного животного – не каждая проба помета может нести в себе микобактерии или содержать достаточное их количество для диагностики. Отсюда вытекает две сопутствующие проблемы:
1.1 необходимость проведения серий анализов – окраска по Цилю-Нильсену, ПЦР, посевы на питательные среды– для постановки окончательного диагноза;
1.2 зачастую требуется концентрация микобактерий в материале (методом флотации) перед проведением анализа, что в разы повышает эффективность обнаружения возбудителя при любом методе диагностики (окраске, ПЦР, посевах).
2. необходимость концентрации материала приводит к последующей сложности: соответствующее оснащение лабораторий для безопасной работы с концентрированным зооантропонозным возбудителем в материале для проведения анализов. Именно за счёт повышенного риска для сотрудников при работе с концентрированными пробами единицы лабораторий (как правило, это государственные лаборатории на базе НИИ) ведут данную деятельность.
[немаловажно: риск заражения владельца прямо пропорционален длительности его проживания с зараженной птицей, т.к.птица-бактериовыделитель способствует поддержанию высокой, нарастающей концентрации микобактерий в помещении, особенно при отсутствии регулярной уборки со специфическими дез.средствами, т.к.микобактерии являются кислото-, спирто-, щёлоче-устойчивыми микроорганизмами, длительно сохраняющимися в окружающей среде]
Для диагностики микобактериозов у содержащихся в неволе птиц в России доступны следующие методы:
Окраска по методу Циля-Нильсена:
Материал: помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, мазки-отпечатки органов при посмертной диагностике.
Принцип метода основан на обнаружении микобактерий при микроскопии материала – в готовом мазке они окрашены в красный цвет красителем фуксином Циля, т.к.являются кислотоустойчивыми, большинство же других микроорганизмов обесцвечивается (на этапе промывания мазка серной кислотой после фуксина) и затем окрашивается в синий (на этапе завершающей окраски метиленовой синью).
| Преимущества: | Недостатки: | ||||||||||||
|
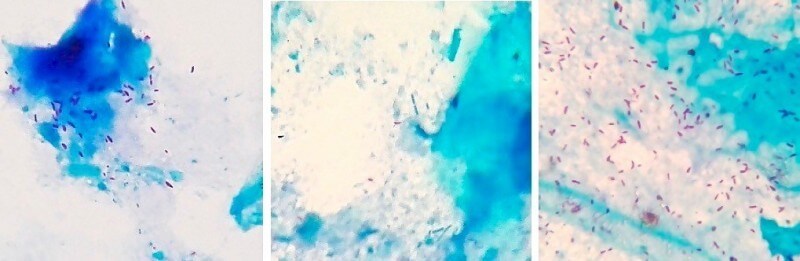
Окрашенные по методу Циля-Нильсена помёт жако – слева (более 40 микобактерий в поле зрения микроскопа), помёт сизого голубя – по центру (единичные микобактерии в поле зрения), помёт кореллы – справа (более 100 микобактерий в поле зрения). Фото автора. При последующей сдаче помёта от данных пациентов на ПЦР-диагностику только от жако с первого же раза была получена положительная ПЦР и подтвержден возбудитель M.bovis. Две другие птицы прореагировали ложно-отрицательно. Корелла прореагировала положительно при повторной ПЦР по помёту. Голубь прореагировал ложно-отрицательно при повторной ПЦР по помёту, но диагноз был подтвержден по ПЦР крови. ПЦР (полимеразная цепная реакция):Материал: кровь, помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, кусочки органов при посмертной диагностике.
Посевы на питательные среды:Материал: помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, кусочки органов при посмертной диагностике. Метод основан на культивировании (высевании) бактерий из материала на специальных питательных средах (наиболее часто используемой является среда Левенштейна-Йенсена), с целью обнаружения роста возбудителя и дальнейшего получения чистой культуры микобактерий для проведения последующей типизации.
|