Сд4 клетки при туберкулезе
При ВИЧ-инфекции назначают исследование крови на CD4-клетки. По показателям этой пробы можно судить о состоянии иммунной системы человека. Результаты теста также указывают на стадию болезни и степень поражения организма вирусом. Каковы нормы этого анализа? Всегда ли низкий уровень таких клеток свидетельствует о синдроме приобретенного иммунодефицита? Эти вопросы мы рассмотрим в статье.
Что это такое
Самыми важными клетками иммунной системы человека являются лимфоциты. Они подразделяются на 3 группы:
- B-лимфоциты. Способны запоминать и распознавать возбудителей болезни, которые ранее уже проникали в организм. При повторном попадании опасных микроорганизмов этот вид лимфоцитов вырабатывает антитела - иммуноглобулины. Благодаря этим клеткам, у человека формируется иммунитет против некоторых инфекционных патологий.
- NK-лимфоциты. Уничтожают собственные клетки организма, подвергшиеся инфицированию и злокачественному перерождению.
- T-лимфоциты. Это наиболее многочисленная группа защитных клеток. Они обнаруживают и уничтожают болезнетворные микроорганизмы.
Клетки CD4 представяляют собой разновидность Т-лимфоцитов. Далее мы рассмотрим более подробно их функции.
Функции клеток
В свою очередь T-лимфоциты подразделяются на несколько типов, которые выполняют разные функции в организме:
- T-киллеры. Убивают болезнетворные микроорганизмы.
- T-хелперы. Это клетки-помощники. Они усиливают ответ иммунной системы на вторжение инфекционных агентов.
- T-супрессоры. Этот вид лимфоцитов регулирует силу реакции иммунной системы на проникновение микробов.
На поверхности T-хелперов находятся молекулы гликопротеина CD4. Они работают как рецепторы, которые распознают антигены болезнетворных микроорганизмов. Т-хелперы иначе называют клетками CD4 или CD4 T. Они передают информацию о вторжении инфекционных агентов в B-лимфоциты. Далее запускается процесс выработки антител против чужеродных антигенов.
Так функционируют клетки CD4 у здорового человека. Они служат для защиты организма от возбудителей болезней. Однако при ВИЧ-инфекции происходят серьезные сбои в работе T-хелперов. Мы рассмотрим их далее.
Приобретенный иммунодефицит
При ВИЧ клетки CD4 поражаются в первую очередь. Именно T-хелперы становятся главной мишенью для вируса.
Возбудитель ВИЧ проникает в CD4 и подменяет нормальный генетический код этих клеток на патологический. В процессе размножения Т-хелперов создаются все новые и новые копии вируса. Так происходит распространение инфекции в организме.
На начальных стадиях болезни наблюдается повышенная выработка T-хелперов. Это является ответом организма на вторжение вируса. Неслучайно люди с ВИЧ-положительным статусом отмечают, что на ранних этапах инфицирования они редко болели простудными патологиями.
Однако длительное пребывание вируса в организме и его распространение истощает иммунную систему. В дальнейшем у ВИЧ-инфицированных отмечается резкое падение уровня клеток CD4. Это свидетельствует о том, что человек заражен вирусом иммунодефицита уже довольно давно. При низком показателе этих клеток у больного практически отсутствует сопротивляемость организма опасным микробам. Пациент становится чрезвычайно подвержен любым инфекционным болезням, которые протекают у него в тяжелой форме.
Какой анализ нужно сдать
Чтобы узнать состояние своей иммунной системы, необходимо сдать анализ на СД4 Т-клетки. На пробу берут венозную кровь. Тест проводят в утренние часы натощак. Перед исследованием нужно исключить физические и психоэмоциональные нагрузки, употребление алкоголя и курение.
Показания к пробе
Исследование крови на клетки CD4 T назначают пациентам с ВИЧ-положительным статусом. Этот тест проводят в следующих целях:
- для наблюдения за динамикой развития ВИЧ-инфекции;
- для определения стадии патологии;
- для выявления необходимости медикаментозной терапии.
Как уже упоминалось, присутствие и распространение в организме вируса ВИЧ всегда сопровождается резким снижением сопротивляемости организма болезнетворным микроорганизмам. Анализ помогает оценить вероятность развития у пациента инфекционных патологий и вовремя провести противовирусное и профилактическое лечение.
Нормальные результаты
Рассмотрим допустимые показатели клеток CD4. Нормы зависят от возраста человека, а также от единицы измерения. Чаще всего эти клетки исчисляют в процентах от общего количества лимфоцитов. В некоторых лабораториях определяют концентрацию T-хелперов в 1 л крови.

Какой процент от всех видов лимфоцитов составляют CD4-клетки у здорового человека? Нормой считаются показатели от 30 до 60 %. Это референсные значения для взрослых пациентов.
Если же в лаборатории оценивается концентрация T-хелперов в 1 литре крови , то для взрослых людей допускаются значения от 540 х 10 6 до 1460 х 10 6 клеток/л.
В норме клетки CD4 у здорового ребенка продуцируются в более высоких количествах, чем у взрослых. Референсные значения T-хелперов для детей приведены в таблице ниже:
| Возраст | Показатели в % от общего числа лимфоцитов | Количество клеток х 10 6 в 1 л крови |
| 1 - 3 месяца | 41 - 64 | 1460 - 5116 |
| 3 месяца - 1 год | 36 - 61 | 1690- 4600 |
| 2 - 6 лет | 35 - 51 | 900 - 2860 |
| 7 -16 лет | 33 -41 | 700 - 1100 |
Причины повышения
Обычно при проведении анализа оцениваются не только показатели T-хелперов, но и численность T-супрессоров (клеток CD8). Их соотношение имеет важное диагностическое значение. Очень часто повышение концентрации T-хелперов сопровождается снижением активности супрессоров. Это приводит к чрезмерной и неадекватной иммунной реакции. В этом случае лимфоциты могут атаковать здоровые ткани организма. Это является признаком следующих аутоиммунных патологий:
- системной красной волчанки;
- склеродермии;
- ревматоидного артрита;
- аутоиммунного тиреоидита;
- дерматомиозита.
Повышение концентрации CD4 также отмечается у больных циррозом печени и гепатитом.
Причины снижения
Наиболее частой причиной падения уровня CD4 является ВИЧ-инфекция. Это говорит о прогрессировании заболевания и высоком риске заражения бактериальными, вирусными и грибковыми патологиями. При низких показателях этих клеток врачи назначают курс профилактической терапии.
Пр этом всегда обращают внимание на численность T-супрессоров. Их увеличение и падение уровня лимфоцитов-хелперов отмечается при саркоме Капоши. Это тяжелое осложнение нередко возникает у больных на поздних стадиях СПИДа.
Однако ВИЧ является не единственной причиной снижения концентрации T-хелперов. Численность этих клеток уменьшается также при следующих заболеваниях и состояниях:
- хронических затяжных инфекционных патологиях (например, при туберкулезе или лепре);
- врожденных нарушениях иммунной системы;
- дефиците питания;
- раковых опухолях;
- лучевой болезни;
- после ожогов и травм;
- в старческом возрасте;
- при систематических стрессах.
Повлиять на показатели CD4 может также прием некоторых лекарств. К препаратам, снижающим уровень T-хелперов, относятся кортикостероидные гормоны, цитостатики, иммуносупрессоры. Поэтому перед сдачей анализа рекомендуется исключить прием таких медикаментов.
Рекомендации врачей
Что делать, если у человека с ВИЧ-положительным статусом анализ показал резкое снижение CD4? Такие результаты пробы указывают на распространение вируса и серьезное повреждение иммунной системы. Пациенту необходим прием профилактических препаратов.
При этом результаты теста на T-хелперы учитываются вместе с данными анализа на вирусную нагрузку. Это исследование показывает количество копий возбудителя ВИЧ на единицу крови.
Опасными считаются показатели CD4 менее 350 х 10 6 клеток/л (не более 14% от общих лимфоцитов). Такие результаты говорят о том, что ВИЧ-инфекция может перейти в стадию активных проявлений СПИДа. Если при этом у пациента отмечается высокая вирусная нагрузка, то необходимо специальное лечение. Оно называется антиретровирусной терапией. Больным назначают три или четыре вида препаратов, которые подавляют размножение возбудителя на разных стадиях его развития. Такое лечение позволяет ВИЧ-инфицированным людям оставаться в стадии ремиссии.
Существует также понятие - оппортунистические инфекции. Это заболевания, которые крайне редко возникают у людей с нормальной иммунной системой. Однако такие патологии довольно часто встречаются при ВИЧ. Тест показывает вероятность возникновения подобных болезней:
- При показателях клеток менее 200 х 10 6 у пациента повышается риск появления пневмонии грибковой этиологии (пневмоцистоза).
- Если CD4 падает ниже уровня 100 х 10 6 , то это чревато возникновением токсоплазмоза и менингита, вызываемого грибками (криптококкоза).
- Если показатели T-хелперов опускаются ниже 75 х 10 6 , то у больного возрастает риск микобактериоза. Это тяжелая форма туберкулеза, которая встречается только при СПИДе.

При таких данных анализа пациент нуждается в профилактике оппортунистических инфекций. Больному назначают превентивный курс противогрибковых и антибактериальных лекарств.
ВИЧ-инфицированным людям рекомендуется сдавать тест на CD4 не менее, чем 1 раз в 3-4 месяца. Это позволяет вовремя отследить распространение вируса и предотвратить опасные осложнения.
Вирусная нагрузка – важный показатель состояния организма ВИЧ-положительного пациента. Она рассчитывается путем подсчета количества копий РНК ВИЧ (вирусных частиц) в 1 миллилитре плазмы крови. Полученные показатели указывают на степень тяжести вирусной инфекции. Благодаря им можно оценить эффективность проводимой ВААРТ, и прогнозировать дальнейшее развитие заболевания. Для создания более полной картины болезни, анализ на вирусную нагрузку проводится вместе с тестом на уровень CD4-лимфоцитов – антигены иммунной системы, отображающие ее состояние.
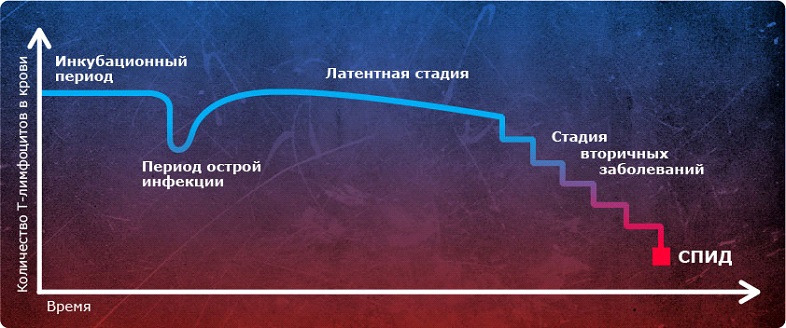
Без приёма терапии со временем снижается уровень СД4 клеток.
Как можно узнать уровень вирусной нагрузки на организм?
По сути, вирусная нагрузка отображает количество ВИЧ в крови. В то время как количество CD4 клеток демонстрирует состояние иммунной системы. Регулярный мониторинг этих двух показателей позволяет своевременно принимать решения – назначать ВААРТ и корректировать лечение, тем самым сдерживая прогрессирование ВИЧ-инфекции.
Анализ на вирусную нагрузку необходимо делать в следующих случаях.
- При подозрении на ВИЧ-инфекцию.
- При постановке диагноза ВИЧ.
- До начала антиретровирусной терапии – каждые 3-6-12 месяцев.
- Через 1 и 3 месяца после начала ВААРТ и далее каждые 3-4 месяца в ходе ее проведения.
Именно оценивая динамику вирусной нагрузки, лечащий инфекционист может сделать заключение об эффективности лечения и при необходимости корректировать ВААРТ.
Для определения вирусной нагрузки проводятся лабораторные исследования, с применением одного из нижеследующих методов.
- ПЦР (полимеразная цепная реакция) – обнаруживает вирус, начиная с 20 - 40 копий в 1 мл крови.
- Метод разветвленной ДНК – менее чувствительный и обнаруживает большое количество копий.
- NASBA (метод транскрипционной амплификации) – очень чувствительная методика, способная увеличивать белки вируса, для того чтобы определить его количество. Однако в России NASBA пока не получил широкое распространение.
Принципиальное различие методов и степень их чувствительности могут стать причиной недостоверного результата. Поэтому специалисты рекомендуют для определения вирусной нагрузки выбрать какой-нибудь один метод и использовать его на постоянной основе.
Расшифровка результатов исследований на ВИЧ
Полученные в ходе исследования вирусной нагрузки результаты расшифровываются следующим образом.
- До 10 000 копий вируса – низкая вирусная нагрузка.
- Свыше 100 000 копий – высокая вирусная нагрузка.
- 0 копий – вируса в организме нет, что считается нормой для здорового человека и указывает на необходимость повторного исследования для ВИЧ-инфицированных пациентов.
Неопределяемая вирусная нагрузка – минимальное количество копий, наличие которых невозможно зафиксировать с помощью выбранного метода исследования.
Таким образом, неопределяемая вирусная нагрузка – это показатель, к которому стремятся все ВИЧ-инфицированные пациенты. Такой результат указывает на то, что вирус в организме есть, но его количество ничтожно мало и на данный момент человеку ничего не угрожает. Одна при этом обязательно необходимо оценить общее состояние иммунной системы. Для этого нужно определить количество CD4+антигенов Т-лимфоцитов. Норма клеток и возможные отклонения приведены в нижеследующей таблице.
| Количество CD4 | Возможные действия пациента |
|---|---|
| 1500 – 500 кл/мл | норма |
| 500 - 350 кл/мл | необходимо начать ВААРТ |
| 200 кл/мл и ниже | проводят ВААРТ |
| Менее 100 кл/мл | проводят ВААРТ и симптоматическую терапию |
Оценивая показатели вирусной нагрузки и CD4 можно сделать достоверное заключение о состоянии здоровья пациента. Если зафиксирована низкая вирусная нагрузка, например, 4000 копий и показатели CD4 в норме, то ВААРТ эффективна. И наоборот – высокая вирусная нагрузка при снижении показателей CD4 свидетельствуют о низкой эффективности лечения.
Как уменьшить вирусную нагрузку?
Тест на вирусную нагрузку отражает степень тяжести ВИЧ-инфекции и состояние организма. Естественно, что столкнувшись с высокими показателями нагрузки, пациенты стремятся ее снизить. Нередко для этой цели они прибегают к альтернативным методам лечения. Но проблема в том, что единственный способ снизить вирусную нагрузку – это эффективная ВААРТ. Иммуностимуляторы, иммуномодуляторы, витаминные комплексы, отвары трав и прочие средства, не оказывают никакого влияния на развитие ВИЧ-инфекции. Снизить нагрузку можно только с помощью антиретровирусной терапии.
Преимущества неопределяемой низкой нагрузки
Низкая или неопределяемая вирусная нагрузка желательна по нескольким причинам.
- Минимальный риск прогрессирования инфекции.
- Минимальный риск развития резистентности к препаратам ВААРТ.
- Минимальный риск передачи инфекции во время незащищенного полового контакта.
- Максимальный шанс родить здорового ребенка (для женщин).
Врачи сталкиваются со сложностью выявления туберкулеза (чахотка, палочка Коха) у ВИЧ-положительных пациентов: из-за ослабленного иммунитета и изменения патогенеза болезни стандартные методы диагностики (флюорография и туберкулиновые пробы) становятся не информативными. Течение заболевания отличается тяжестью, злокачественностью, склонностью к осложнениям и генерализацией процесса – поражая сначала, например, легкие. Постепенно туберкулез распространяется на другие органы и системы.
Туберкулез среди ВИЧ инфицированных
Сочетание двух диагнозов – туберкулез и ВИЧ – явление достаточно частое. В современной медицинской литературе их даже называют инфекциями-спутниками, что обусловлено рядом факторов:
- схожий контингент для каждого заболевания: наркоманы, заключенные, лица с низкой социальной ответственностью;
- высокая инфицированность населения палочкой Коха, которая может годами латентно существовать в организме человека и никогда не спровоцировать болезнь при условии стойкого иммунитета; так как при ВИЧ иммунитет снижен и не может бороться с инфекциями, микобактерии начинают активно размножаться, что приводит к развитию туберкулеза;
- зависимость ВИЧ и туберкулеза от одних и тех же клеток – ВИЧ поражает в первую очередь Т-лимфоциты, которые так же в первую очередь отвечают за клеточный ответ при заражении микобактериями.
Статистика по комбинации двух болезней не утешительна:
- вероятность заболеть туберкулезом у ВИЧ-больного в несколько десятков раз выше, чем у здорового человека;
- чахотка занимает первое место по смертности при ВИЧ от вторичных инфекций;
- до половины больных СПИДом имеют открытую форму туберкулеза.
Сколько проживет человек, если у него диагностированы чахотка и ВИЧ, зависит напрямую от его образа жизни. Если следовать предписаниям врачей, принимать все необходимые лекарства, отказаться от вредных привычек (в первую очередь это касается наркоманов), то возможно добиться стабилизации состояния и прожить с двумя диагнозами 15-20 лет. Но при игнорировании лечения и отказе от должного поведения продолжительность жизни сокращается до 1 года.
ВИЧ-инфекция и туберкулез вместе
Генерализация очагов туберкулеза при ВИЧ зависит от стадии иммунодефицита и уровня CD4-лимфоцитов:
- высокий уровень (более 500 клеток на 1 мкл) – типичная клиническая картина туберкулеза с преимущественным поражением органов грудной клетки;
- средний уровень (350-500 клеток на 1 мкл) – помимо тяжелых легочных форм с плевритом – лимфогенная генерализация туберкулеза с поражением внутригрудных, периферических, брюшных и забрюшинных лимфоузлов;
- низкий уровень (менее 350 клеток на 1 мкл) – атипичные формы туберкулеза, гематогенная генерализация процесса с поражением костей, суставов, органов ЖКТ, кожи, головного мозга, сердца; самая тяжелая стадия – туберкулезный сепсис.
ВИЧ ассоциированный туберкулез может протекать в двух формах:
- латентная (или скрытая) – клиническая картина не ярко выражена, но в организме идет процесс распространения микобактерий и поражения лимфатической ткани и других органов;
- активная – ярко-выраженные проявления болезни в зависимости от генерализации процесса.
Туберкулез при ВИЧ еще больше усугубляет иммунодефицит, что способствует присоединению оппортунистических инфекций, вызванных условно-патогенными вирусами или бактериями, которые не опасны для здорового человека: пневмоцистная пневмония, грибковые поражения органов брюшной полости, бактериальный или грибковый менингит. Совокупность таких диагнозов практически не поддается лечению и чаще всего приводит к летальному исходу.
Существует три варианта развития чахотки при ВИЧ-инфекции:
- пациент заболел туберкулезом, уже имея ВИЧ-положительный статус;
- пациент изначально болел чахоткой и потом заразился ВИЧ;
- пациент одновременно инфицировался ВИЧ и палочкой Коха.
Третий вариант является самым тяжелым по клинике и исходу заболевания, чаще всего наблюдается у лиц с алкогольной или наркотической зависимостью.
Туберкулез при ВИЧ протекает тем сложнее, чем сильнее выражен иммунодефицит. Но существуют признаки, которые проявляются вне зависимости от формы, стадии и сопутствующих заболеваний:
- интоксикация организма – повышение температуры тела, ночная потливость, слабость, утомляемость, потеря массы тела больше 15%, истощение. Такое состояние может длиться от нескольких недель до полугода;
- бронхолегочные проявления (при генерализации процесса в органах грудной клетки) – кашель (сухой или с выделением мокроты), одышка, кровохарканье;
- увеличение лимфоузлов (шейные, надключичные, паховые); при пальпации узлы плотные, болезненные, без смещения. При прогрессировании заболевания возможно образование свищей и язв над лимфоузлами и прилежащими тканями;
- снижение уровня гемоглобина меньше 100 г/л;
- нарушения пищеварения: тошнота, рвота, запор или диарея, потеря аппетита;
- боль в костях и суставах.
Такая клиническая картина может встречаться и при других заболеваниях, но если пациент ВИЧ-положительный, то наличие хотя бы одного из перечисленных признаков может указывать на чахотку. В таком случае необходимо провести комплекс диагностических мероприятий для подтверждения диагноза:
- стандартные процедуры:
- осмотр фтизиатра,
- общие клинические анализы крови и мочи,
- рентгенография органов грудной клетки в двух проекциях,
- бактериологическое исследование мокроты,
- оценка кожной реакции на туберкулиновую пробу;
- специальные процедуры:
- иммуноферментный анализ крови, ПЦР или анализ плазмы крови на наличие микобактерий,
- бронхоскопия с биопсией по необходимости,
- УЗИ органов брюшной полости,
- МРТ внутренних органов, суставов, позвоночника или головного мозга,
- МСКТ органов грудной клетки,
- биопсия лимфатических узлов, костного мозга, селезенки.
Опасность кроется в сложности диагностики, нетипичности клинической картины, молниеносном течении и тяжести осложнений. Если у изначально здорового человека переход от одной стадии и формы туберкулеза к другой может занимать несколько лет, то у ВИЧ-инфицированного пациента манифестация чахотки может возникнуть сразу на последних неизлечимых стадиях.
Самым критичным для пациента является сочетание двух диагнозов – туберкулез и СПИД. Обычно при заражении палочкой Коха на стадии СПИД поражаются не легкие, а лимфоузлы, кости, сердце и другие органы. Вылечить такой комплекс болезней практически невозможно, становится сложным даже поддержание физической активности и нормальной жизнедеятельности пациента. Продолжительности жизни в таком случае сокращается до нескольких месяцев.
Туберкулез и ВИЧ у детей
В сочетании друг с другом туберкулез и ВИЧ в 6 раз чаще приводят к смертельному исходу у детей, чем у взрослых. Как правило, дети приобретают ВИЧ внутриутробно или во время родов от ВИЧ-инфицированной матери. Если мать вела асоциальный образ жизни или являлась наркозависимой, то велика вероятность рождения недоношенного ребенка с сопутствующей инфекцией (помимо ВИЧ) – вирусный гепатит, токсоплазмоз, грибковые заболевания, сифилис. С таким набором диагнозов не может справиться несформированная иммунная система новорожденного, и если к этому списку присоединяется туберкулез, то шансов на выживание у ребенка практически нет.
Обычно здоровым новорожденным на 3-5 день жизни делают прививку БЦЖ – вакцина против чахотки, приготовленная из ослабленных микобактерий. Но если ребенок рожден от ВИЧ-инфицированной матери, то такую прививку делать нельзя: иммунодефицитное состояние спровоцирует развитие туберкулеза даже от ослабленных возбудителей болезни.
Особенности назначаемого лечения
Высокий процент смертности при туберкулезе и ВИЧ обычно связан не с малоэффективностью противотуберкулезной или антиретровирусной терапии, а с тяжелым течением всех сопутствующих диагнозов при ВИЧ.
Профилактика туберкулеза среди ВИЧ-инфицированных больных имеет огромное значение. Можно выделить несколько ключевых направлений:
- Самым лучшим и результативным методом профилактики является своевременное и грамотное лечение ВИЧ: при поддержании CD4-лимфоцитов на высоком уровне снижается риск заражения туберкулезом, так как иммунная система еще в силах противостоять заболеванию.
- Исключение контакта с больными туберкулезом, что подразумевает изменение образа жизни – отказ от наркотиков, смена круга общения, соблюдение назначений врача и режима.
- Профилактические осмотры и обследования.
- Если у ВИЧ-инфицированных больных выявлена неактивная стадия болезни (латентное инфицирование палочкой Коха), то обязательна химиопрофилактика туберкулеза.
Соблюдение несложных мер и своевременное обращение к врачу может избавить пациента от тяжелых последствий ВИЧ-ассоциированного туберкулеза и значительно увеличить продолжительность и качество жизни.
Конкурирующие интересы: авторы заявили, что конкурирующих интересов не существует.
Задуманные и разработанные эксперименты: IVL. Провели эксперименты: ИЙН ГАК ИВЛ. Проанализированы данные: IYN NAK IAV RBA VVG IVL. Написал статью: IVL VVG IYN GAK.
Эффекторные CD4 Т-клетки представляют собой ключевой компонент иммунной защиты против туберкулеза у хозяина. Успешная дифференциация и функционирование эффекторных лимфоцитов защищает хозяина от тяжелой инфекции M. tuberculosis (Mtb). С другой стороны, дифференциация эффекторных Т-клеток зависит от тяжести заболевания / активности, поскольку ответы Т-клеток управляются антигенными и воспалительными стимулами, выделяющимися во время инфекции. Таким образом, прогрессирование туберкулеза (ТБ) и степень дифференцировки дифференцированных клеток CD4 связаны между собой, но отношения сложны и недостаточно понятны. Мы проанализировали связь между степенью дифференцировки T4-лимфоцитов CD4 и тяжести / активности легочной ТБ-инфекции.
Степень дифференцировки CD4 T-клеток оценивали путем измерения процента высокодифференцированных CD27-клеток в популяции Mtb-специфических CD4-T-лимфоцитов (клетки CD27lowIFN-γ +). Процентное содержание CD27lowIFN-γ + клеток было низким у здоровых доноров (медиана, 33,1%) и контактов с ТБ (21,8%), но у пациентов с ТБ (47,3%, р 76%), но варьировался в крови (12-92%). Основным коррелятом для накопления CD27lowIFN-γ + клеток в крови было разрушение легких (r = 0,65, p = 2,7 × 10-7). Обрезание 47% CD27lowIFN-γ + клеток различало пациентов с высокой и низкой степенью разрушения легких (чувствительность 89%, специфичность 74%); снижение CD27lowIFN-γ + клеток после терапии ТБ коррелировало с восстановлением и / или уменьшением разрушения легких (p 1 год) туберкулез и он получил несколько курсов терапии.
NA, не применимо.
Все зарегистрированные пациенты были серонегативными. Все анализы проводились в течение 2008-2011 годов. Подробные клинические характеристики зарегистрированных пациентов представлены в таблице S1.
Проявления заболевания оценивались и оценивались независимыми врачами и радиологами, которые не знали результатов иммунологических анализов. Тяжесть клинических заболеваний оценивалась от 0 до 3 в зависимости от степени симптомов системной интоксикации (усталость, потоотделение, лихорадка, потеря веса): 0 — никаких симптомов; 1 — от одного до двух симптомов без лихорадки; 2 — несколько симптомов плюс субфебрильная температура тела; 3 — несколько симптомов плюс температура лихорадки. Гематологические аномалии были оценены на основе изменений скорости седиментации эритроцитов, лейкоцитоза, лимфопении, левого нейтрофильного сдвига (0 — никаких аномалий, 1 — одна аномалия, 2 — две аномалии, 3 — по крайней мере три серьезных аномалии).
Степень туберкулеза, форма патологии легких и степень разрушения тканей легкого оценивались на основе рентгенографических исследований. ТБ (область, пораженная поражениями ТБ) оценивалась как: 1 — от одного до трех сегментов в разных долях; 2 — четыре или более сегментов в разных долях или одна-две цельные лепестки; 3 — три доли в разных легких; 4 — одно целое легкое или оба легких. Степень разрушения легочной ткани оценивали по количеству и размеру деструктивных (люкентных) очагов: 0 — без фокусов; 1 — один небольшой ( 2 см) разрушение; D, оценка 3, множественные разрушения легких. Стрелы, разрушения легких. Звездочка, инфильтративный фокус без разрушения.
A-C, Стратегии определения процентного содержания CD27low (A), IFN-γ + (B) и CD27lowIFN-γ + (C) CD4-T-клеток. A, CD27low клетки были включены в общую популяцию CD4 + Т-клеток. B, Чтобы идентифицировать Т-клетки IFN-γ + CD4, аликвоту крови стимулировали ультразвуком Mtb; другая аликвота оставалась не стимулированной. Во время анализа ворота для IFN-γ + клеток в Mtb-стимулированных образцах были построены на основе не стимулированных образцов Mtb (рис. B, пунктирная линия). Для идентификации CD27lowIFN-γ + клеток экспрессия CD27 была впервые проанализирована в популяции IFN-γ. Поскольку эта популяция всегда была многочисленной, CD27low и CD27hi-клетки могли быть легко разделены. Ворота для клеток CD27low затем применяли к популяции IFN-γ + (C, пунктирная линия). D-F, проценты клеток CD27low (D), IFN-γ + (E) и CD27lowIFN-γ + (F) у пациентов с ТБ (n = 50), контакты ТБ (n = 21) и Mtb-неэкспонированные индивидуумы п = 15). G, Отсутствие корреляции между процентами клеток IFN-γ + и CD27lowIFN-γ + у пациентов с ТБ, контактов с ТБ и Mtb-неэкспонированных лиц (n = 86). H, ROC-кривая CD27lowIFN- + клеток в процентах для выявления больных ТБ у здоровых людей (контакты ТБ и Mtb-неэкспонированные). I, Процент клеток CD27lowIFN-γ + в контактах ТБ с положительными и отрицательными результатами анализа QFT * p 0,5, фиг.2D). Аналогично, процентное соотношение ИФН-γ + клеток было выше у пациентов с ТБ по сравнению с неконтролируемыми Mtb (0,3 [0,2-0,5] против 0,1 [0,1-0,3]), но были одинаковыми у пациентов с ТБ и контактов ТБ (0,3 [ 0,2-0,5] против 0,3 [0,1-0,4], p> 0,5, фиг.2E). Более поздний вывод согласуется с другими исследованиями, в которых показано, что анализ IFN-γ не был полезен для выявления активного заболевания туберкулезом и латентной инфекции Mtb [11]. Таким образом, ни экспрессия CD27 на объемных CD4-Т-лимфоцитах, ни частота Mtb-специфических IFN-γ, продуцирующих CD4-T-клетки, не различали активный ТБ от латентной инфекции.
Напротив, процентная доля CD27lowIFN-γ + клеток была значительно выше у пациентов с ТБ (47,3 [33,2-63,6]) по сравнению с участниками Mtb-неэкспонированных (33,1 [16,8-39,5], p 0,2, фиг.2I), но значительно отличались от пациентов с ТБ (p 47%) процентами CD27lowIFN-γ + CD4 T-клеток (n = 12, валидационный анализ). I, J, Отсутствие корреляции между процентами (I) и числами (J) CD27lowIFN-γ + клеток в легких и в крови больных ТБ (n = 8). Показаны числа CD27lowIFN-γ + клеток на 1 миллион приобретенных клеток.
Затем мы рассмотрели корреляции между процентами CD27lowIFN-γ + клеток и величиной данного фактора. В этом анализе наиболее значимыми факторами, которые наиболее сильно коррелировали с процентами CD27lowIFN-γ + клеток, были: разрушение тканей легкого (r = 0,65, p = 2,7 × 10-7), тяжести клинических заболеваний (r = 0,63, p = 7,7 × 10 -7), гематологические аномалии (r = 0,49, p = 3 × 10-4). Наличие Mtb в области мокроты и туберкулеза коррелировалось менее сильно (r = 0,41, p = 0,003 и r = 0,42, p = 0,003, соответственно, таблица 3). Корреляции между процентами CD27lowIFN-γ + клеток и резистентностью лекарственного средства Mtb или длительностью ТБ были незначительными (p = 0,01 и p = 0,04 соответственно, незначительные, если они были скорректированы для множественных сравнений). Корреляция между процентами CD27lowIFN-γ + клеток и формой легочной патологии была очень значительной (r = 0,63, p = 8,7 × 10-7), но она, вероятно, была вторичной по отношению к разрушению легких: она появилась только тогда, когда более высокие оценки были (т. е. туберкулез — оценка 1, инфильтрат туберкулеза — оценка 2, полостной туберкулез — оценка 3, казеозная пневмония — оценка 4); в группе пациентов с той же формой патологии легких (например, инфильтрата ТБ) процент CD27lowIFN-γ + клеток коррелирует с разрушением легких (r = 0,45, p 0,007 (незначительно для множественного (семи) тестирования параметров); эти факторы не были включены в анализ с множественной линейной регрессией. rho, коэффициент Спирмена, p, значение значимости теста.
Множественная линейная регрессия выявила разрушение тканей легких и клиническую тяжесть туберкулеза в качестве основных коррелятов для накопления CD27lowIFN-γ + клеток в крови больных туберкулезом (выделено жирным шрифтом).
NA, не включенной в несколько линейных регрессионных анализов.
В то время как процент клеток CD27lowIFN-γ + сильно коррелировал с несколькими характеристиками ТБ (например, тяжесть ТБ, разрушение легких), количество CD27lowIFN-γ + клеток (на мл крови) не коррелировало значительно с любым из проанализированных факторов ( Таблица S3). Этот результат можно объяснить тем, что проценты CD27lowIFN-γ + клеток представляют собой простой параметр, который отражает только степень дифференцировки T27 CD2 + CD27-CD4 T-клеток. Напротив, количество CD27lowIFN-γ + клеток представляет собой комплексный параметр, который, помимо процентов CD27lowIFN-γ + клеток, зависит от общего количества лимфоцитов, CD4-T-клеток и клеток, продуцирующих IFN-γ. Курс заболевания туберкулезом может влиять на эти параметры по-разному (например, стимулировать CD27 + → CD27-дифференцировку и увеличивать частоту клеток CD27lowIFN-γ +, но индуцировать лимфопению и уменьшать общее количество лимфоцитов и их подмножеств).
Поскольку процент CD27lowIFN-γ + клеток достоверно коррелировал с несколькими различными проявлениями заболевания ТБ, мы в дальнейшем рассмотрели, какой из идентифицированных коррелятов был наиболее важен для определения процента CD27lowIFN-γ + клеток в крови пациентов с ТБ. При множественном регрессионном анализе высокий процент CD27lowIFN-γ + клеток достоверно коррелировал с разрушением легких и клинической ТБ (таблица 3). В нескольких дополнительных анализах (F-тест для вложенных моделей и выбор модели с использованием критерия информации Akaike), разрушение легких, тяжести клинических заболеваний и гематологические аномалии, или разрушение легких и тяжести клинических заболеваний только предсказали процентное содержание CD27lowIFN-γ + клеток (таблица 4 ). Любой из этих факторов, взятых отдельно, не предсказывал значительных количеств CD27lowIFN-γ + клеток, предполагая, что повреждение тканей легкого и тяжесть ТБ важны, и оба необходимы для объяснения увеличения процента CD27lowIFN-γ + клеток у пациентов с ТБ. Когда использовался метод повторной дискретизации случайных данных [28], разрушение легких и клиническая тяжесть туберкулеза чаще всего проявлялись как факторы, определяющие высокие проценты CD27lowIFN-γ + клеток у больных ТБ (13% и 15% случаев соответственно).
Наилучшие минимальные модели — это те, которые незначительно отличаются от полной модели (выделены жирным шрифтом).
Анализ был первоначально выполнен у 50 пациентов. Впоследствии было добавлено 12 пациентов из когорты валидации (n = 62), главным образом для проверки согласованности результатов. В обеих когортах, разрушение легких и тяжесть клинических заболеваний лучше всего предсказали накопление CD27lowIFN-γ + клеток.
В информационном критерии Акаики эта комбинация была лучшей минимальной моделью для предсказания накопления CD27lowIFN-γ + клеток в крови (Δn = 50 = 4,7, Δn = 62 = 4,8).
Поскольку степень разрушения легочной ткани оказалась хорошим коррелятом процентных соотношений CD27lowIFN-γ + клеток и потому, что разрушение легочной матрицы является важным патогенным фактором, который вызывает развитие, заболеваемость туберкулезом и бациллярное распространение, мы в дальнейшем задали вопрос о том, оценивается ли оценка CD27lowIFN -γ + могут быть использованы в качестве средства оценки поражения легких.
На кривой эксплуатационной характеристики приемника (ROC) обрезание 47% клеток CD27lowIFN-γ + показало себя как хороший разделитель больных туберкулезом с тяжелой деградацией легких (оценка 3) и другими пациентами (оценки 0-2) (AUC = 0,89 , p 76% всех клеток IFN-γ +), что указывает на то, что большинство специфичных к Mtb CD4-клеток легкого CD4 были сильно дифференцированы (таблица S4). Процент крови CD27lowIFN-γ + клеток различался среди пациентов (30-74%). Наблюдалась значительная корреляция между процентами CD27lowIFN-γ + клеток, находящихся в легких, и циркулирующих в крови (таблица S4, рис.3, I, J), что указывает на то, что изменчивость в процентах CD27lowIFN-γ + клеток в крови больных туберкулезом не было связано с различиями в генерации (накоплении) этих клеток в легких. Аналогичная недостаточная корреляция была обнаружена для клеток IFN-γ + (таблица S4). Более того, процент CD27lowIFN-γ + или IFN-γ + клеток в легких не коррелировал достоверно с какими-либо критериями, используемыми для категоризации заболевания ТБ (то есть, тяжести заболевания, разрушения легких и др., Таблица S4). Напротив, процент CD27lowIFN- + клеток в крови хорошо коррелировал с разрушением легких (r = 0,88, p = 0,01, таблица S4), что соответствовало нашим результатам, полученным в основной группе.
У двух пациентов региональные лимфатические узлы были подвергнуты резекции во время операции. Проценты и числа клеток CD27lowIFN-γ + были ниже в LN по сравнению с легкими (на 1 миллион приобретенных клеток, таблица S4). Это соответствует нашим предыдущим выводам у мышей, где мы обнаружили низкие проценты CD27low и IFN-γ + CD4 T-клеток в лимфатических узлах и их преимущественное накопление в ткани легких [24], [25].
Таким образом, мы наблюдали (i) преимущественное накопление CD27low
Mtb-специфические CD4-Т-клетки в легких; (ii) плохая корреляция между величиной CD27low
Mtb-специфический ответ CD4 Т-клеток в легких и в крови; (iii) что разрушение легочной ткани коррелирует с процентами CD27lowIFN-γ + клеток, присутствующих в крови, но не в легких. Эти наблюдения показали, что оценка CD27low
Mtb-специфичные CD4-T-клетки, циркулирующие в крови, могут служить средством для оценки разрушения легких во время ТБ.
У 3 пациентов процент CD27lowIFN-γ + клеток снижался для достижения нормальных значений к концу терапии с 2 молями ( 76%) были CD27low. Эти результаты были получены у всех анализируемых пациентов и поддерживали склонность CD27low клеток к расположению легочной ткани, зарегистрированным ранее в различных патологических состояниях у мышей и людей [25], [31] — [34].
В отличие от легких, процентное содержание CD27lowIFN-γ + клеток в крови варьировалось среди пациентов. Не было существенной корреляции между процентами этих клеток в крови и в легких, но была обнаружена значительная корреляция между процентами CD27lowIFN-γ + клеток в крови и разрушением тканей легких и ТБ. Процентное содержание CD27lowIFN-γ + клеток в легком не коррелировало с разрушением легких или тяжести ТБ. Причины несогласованности между легкими и кровью CD27lowIFN-γ + клетки и механизмы, связывающие кровь CD27lowIFN-γ + клетки, разрушение легких и тяжесть ТБ, неясны.
Считается, что Т-клетки-эффекторы генерируются в LN и мигрируют в периферийные сайты посредством циркуляции. Ранее мы показали, что CD27low CD4-эффекторы могут генерироваться непосредственно в легких с их эффекторных предшественников CD27hi [25]. Поэтому высокие проценты CD27lowIFN-γ + клеток в крови пациентов с тяжелым ТБ могут быть результатом их высокоэффективной генерации в LN (например, из-за обширной антигенной / воспалительной стимуляции) и / или преимущественного удержания в кровообращении (например, из-за сильно воспалительной среды). Равномерно высокие проценты CD27lowIFN-γ + клеток в месте заражения Mtb легкого могут быть связаны с их эффективным локальным образованием. Эти сценарии объясняют связь между CD27lowIFN-γ + клетками и серьезностью ТБ, но не объясняют, почему процентные содержания CD27lowIFN-γ + клеток в крови не зависели от степени ТБ или почему они были тесно связаны с разрушением легких. Существует несколько возможных объяснений поздней ассоциации.
Во-первых, разрушение легких и накопление CD27lowIFN-γ + клеток в кровообращении могут представлять собой независимые проявления тяжелого ТБ. Во-вторых, CD27lowIFN-γ + клетки, генерируемые в больших количествах во время тяжелого ТБ, могут непосредственно способствовать разрушению тканей, например, путем продуцирования провоспалительных факторов или стимулирования воспалительных реакций в фагоцитарных клетках. Действительно, у мышей CD27low CD4 T-клетки опосредуют эти функции более эффективно, чем эффекторы CD27hi (наши неопубликованные наблюдения); непосредственно продемонстрирована роль металлопротеиназ и провоспалительных цитокинов в разрушении матриц легкого [35], [36]; в других патологических состояниях CD27low Т-клетки были связаны с плохим исходом заболевания [34]. Однако эти сценарии не отвечают на вопрос, почему кровь, а не легкие CD27lowIFN-γ + клетки были связаны с повреждением легочной ткани. Они также не объясняют, почему проценты, но не количество клеток, были связаны с тяжести ТБ и разрушением легких.
В третьей гипотезе накопление CD27lowIFN-γ + клеток в крови является результатом разрушения легких. В этой гипотезе CD27low CD4 T-клетки представляют собой резидентную популяцию легочной ткани и обычно имеют низкую емкость для выхода ткани, напоминающую недавно описанные клетки памяти с ретентивным хранением [37]. После разрушения структуры легочной ткани и / или сосудов легких CD27LL лимфоциты приобретают способность проникать в кровоток. Это может стать возможным из-за механических причин или высокого местного производства факторов (например, протеаз), изменяющих клеточную адгезию к паренхиме легких. Несомненно, все описанные механизмы могут взаимодействовать для содействия накоплению CD27lowIFN-γ + клеток в кровообращении. Точные механизмы, связывающие высокую степень дифференциации CD4 T4 крови и разрушение тканей легких, еще предстоит определить.
В заключение, это исследование свидетельствует о том, что нет недостатка в дифференцировке эффекторных CD4-T-клеток во время тяжелого туберкулеза легких. Исследование впервые выявило связь между CD27low
Mtb-специфические CD4-T-клетки и разрушение тканей легких и предлагает иммунологический анализ для оценки разрушения легких и его восстановления после терапии ТБ (процессы, которые до сих пор могли контролироваться только рентгенологическим исследованием). Наконец, исследование поднимает фундаментальные вопросы о механизмах, связывающих разрушение периферической ткани и дифференциацию циркулирующих эффекторных лимфоцитов.
Читайте также:


