Устойчивый штамм при туберкулезе
Лекарственно устойчивые штаммы туберкулёза возникают естественным путём в ходе спонтанного мутагенеза как ответная реакция на введение антибиотиков. Они, как правило, обладают слабым фитнесом, т.е. они медленнее растут, слабее размножаются, у них нет других преимуществ, за исключением устойчивости к антибиотикам. И, соответственно, первоначальная стратегия при столкновении с лекарственно устойчивыми штаммами заключалась в том, чтобы, во-первых, антибиотики, направленные на лечение туберкулёза, были изъяты из широкой сети обращения и использовались только в специализированных учреждениях и, во-вторых, курс лечения проводился особым образом: сначала больного лечили антибиотиками, потом делали перерыв, за это время оставшиеся лекарственно чувствительные штаммы начинали доминировать, соответственно вытесняя лекарственно устойчивые варианты, затем опять проводили химиотерапию, достигали хороших результатов, что снова приводило к появлению лекарственно устойчивых штаммов, снова делали перерыв и так до полного излечения. Но потом оказалось, и обнаружили это, прежде всего в Африке, что такие проблемы как СПИД, который поражает иммунную систему, приводят к значительному росту числа лекарственно устойчивых штаммов. Причём если раньше эти штаммы были в основном в лечебных учреждениях, то теперь они стали обнаруживаться во всей популяции. И наиболее распространённая на сегодняшний день теория, для которой находится всё больше и больше подтверждений, заключается в том, что для того, чтобы лекарственно устойчивые штаммы вырвались в популяцию, они должны пройти несколько циклов размножения в организме со слабой иммунной системой, а именно такими объектами являются, прежде всего, больные СПИДом. Далее обнаружилось, что в странах, где происходят колоссальные социальные пертурбации, где всё рушится, возникает большая прослойка бедных, социально дезориентированных людей, у которых доходы ниже прожиточного реального минимума и иммунная система ослаблена, и такие люди тоже становятся тем резервуаром, в котором лекарственно устойчивые штаммы могут адаптироваться и приобрести такие преимущества, которые позволяют им конкурировать с лекарственно чувствительными штаммами. Таким образом с появлением и распространением СПИДа в мире, а также с началом таких крупных социальных потрясений, как в бывших странах СНГ, появились две большие зоны, включающие Африку, Азию, страны СНГ, где лекарственно устойчивые штаммы стали стремительно распространяться.
И тогда первыми забеспокоились международные организации, потому что эпидемия любого заболевания, в том числе и туберкулёза, в одной стране, является проблемой многих. В данном случае это было связано и усугублялось миграцией, поскольку открылись все ворота, люди стали эмигрировать из бывшего Советского Союза, и в Западной Европе вдруг стали обнаруживать те генотипы туберкулёза, которые раньше там не регистрировались.
Несмотря на то, что со дня открытия туберкулёза прошло уже больше ста лет, микобактерия хорошо изучена, известен и расшифрован её геном, но, тем не менее, мы пока не имеем надёжных средств вакцинации от туберкулёза. Спектр имеющихся лекарственных препаратов из-за проблемы лекарственной устойчивости приходится постоянно расширять и модифицировать, и ещё одна большая проблема – это проблема ранней диагностики туберкулёза.
Кох, открыватель туберкулёза, получивший за это Нобелевскую премию, был уверен, что можно быстро справиться с этой инфекцией. Но оказалось, что вакцина Коха защиты не даёт. Тогда появилась другая вакцина, БЦЖ, но она защищает только детей, а после 14 лет – что её вводи, что ни вводи – защиты нет. Кроме того, эффективность использования этой вакцины значительно меняется в зависимости от географического региона. В некоторых странах она обеспечивает высокую защиту детей – до 80%, а в других – 0%. К этому могли привести очень многие факторы. БЦЖ отличается от диких штаммов туберкулёза, у неё отсутствует фрагмент генома, и соответственно, несколько десятков генов у БЦЖ нет. В каждой стране штаммы для производства вакцины свои, единого мирового стандарта нет. По утверждениям специалистов-фтизиатров, наблюдается неуклонный рост осложнений при вакцинации БЦЖ. В чём причины? Они могут быть разнообразными. Может быть, сам ребёнок и его состояние, потому что в последнее время возросло число патологий среди новорождённых. Может быть, вакцинный штамм. Вакцинные штаммы строго контролируют по всем стандартным микробиологическим параметрам, но эти параметры не позволяют учитывать генотипические варианты. Так, во Франции на сегодняшний день идентифицировано не менее четырех штаммов БЦЖ, которые используют для вакцинации, в России – около двадцати. Поскольку при производстве штамм контролируется не на генетическом уровне, то не исключено, что на генетическом уровне могут происходить изменения и некоторые из них могут привести к не очень хорошим свойствам, которые, в свою очередь, и приводят к осложнениям. Возможно. Этого никто не проверял. Мы готовы принять участие в таких исследованиях, и мы могли бы найти те нуклеотидные замены, которые не должны присутствовать в исходном штамме, и создать устройство, с помощью которого можно было бы контролировать штаммы в ходе производства. Это позволяло бы проводить более глубокий независимый внутренний производственный контроль. Это в любом случае необходимо делать и, безусловно, это будет сделано, потому что любые живые вакцины требуют такого контроля. Всё в этом мире меняется, хотим мы или нет, это естественный, неизбежный процесс, возникают мутации, приобретаются какие-то селективные преимущества, иногда эти селективные преимущества срабатывают в организме, и это может привести к осложнениям. Такие работы – составление генетических портретов вакцинных штаммов - необходимы для практического здравоохранения и весьма интересны с научной точки зрения.
Следующая проблема – диагностика. Для детей это – реакция Манту, для взрослых – флюорография или томография. В ходе наших исследований и в ходе общения с коллегами, мы поняли, что реакция Манту имеет весьма условное диагностическое значение. Во-первых, реакция Манту не однозначна и существенно зависит от иммунного статуса человека. Во-вторых, она не всегда обладает высокой специфичностью и чувствительностью и не может отличить иммунитет, полученный при вакцинации БЦЖ, от дикой бактерии. Ведь реакция Манту – это суммарные белки от БЦЖ, и если вы вакцинированы БЦЖ, то они пересекаются с белками, полученными при прививке, появляется папула, на основании чего возникает подозрение, и надо проводить исследования дальше, тщательно проверять, что же происходит в организме. Чувствительность реакции Манту очень высока, а специфичность очень низкая, по оценкам некоторых специалистов она составляет всего 8-20%. Если же ещё накладывается коассоциированная инфекция – ВИЧ, или гепатит, или респираторные заболевания, то это вносит ещё большую путаницу. Поэтому в случае положительной реакции Манту необходимо провести подтверждающие диагностические анализы с помощью более совершенных методов. Если же говорить о флюорографии или результатах томографических исследований, то они выдают уже патологию. Т.е. это, безусловно, очень нужная, но уже не ранняя диагностика.
В России Т-клеточные технологии пока не внедрены. А в мире эти технологии уже внедрены в Германии и США, в специализированных крупных центрах, что надо делать и нам. Там не только есть центры, но действует система иммунологического мониторинга и система мониторинга генотипов микобактерии туберкулёза. Это позволяет реально оценивать эффективность всех противотуберкулёзных мероприятий, позволяет изучать процессы, которые реально происходят с микобактерией туберкулёза, вовремя выявлять эпидемические очаги, а не работать, как это делали раньше, по территориям в целом.
Аннотация научной статьи по клинической медицине, автор научной работы — Аксютина Л. П.
В статье представлены данные о заболеваемости контактных в семейных очагах с чувствительными и устойчивыми к противотуберкулезным препаратам микобактериями туберкулеза.
Похожие темы научных работ по клинической медицине , автор научной работы — Аксютина Л. П.
Tuberculosis sickness rate in family with drag stable strains of tuberculosis micro bacteria
This article represents the data on tuberculosis sickness rate in families with tuberculosis micro bacteria sensible and resistant to anti tuberculosis drugs.
3. Mierdl S., Meininger D., Dogan S. et al. Abdominal complications after cardiac surgery. Ann. Acad, Med. Singapore. 2001; 3(3): 245-249.
4. Fennerty M.B. Pathophysiology of the upper gastrointestinal tract in the critically ill patients: rationale lor the therapeutic benefits of acid suppression. Crit. Care Med. 2002; 30(6): 351-355.
5. Flannery J., Tuker D A. Pharmacologic prophylaxis and treatment of stress ulcers in critically ill patients Cril. Care Nurs Clin. North Am. 2002; 14(1): 39-51.
СОРОКИНА Елена Альбертовна, кандидат медицинских наук, врач кардиологического отделения восстановительного лечения.
МОРОВА Наталия Александровна, доктор медицинских наук, профессор кафедры внутренних болезней № 1, заведующая кардиологическим отделением восста-
САФЕЧУК Виктор Васильевич, врач отделения эндоскопии.
МИЛЬЧЕНКО Марина Валерьевна, врач отделения кардиохирургии.
ЧЕРКАЩЕНКО Денис Владимирович, врач отделения кардиохирургии.
УДК «16,002.5-058 л.П. АКСЮТИНА
Омская государственная медицинская академия
ЗАБОЛЕВАЕМОСТЬ ТУБЕРКУЛЕЗОМ В СЕМЕЙНЫХ ОЧАГАХ С ЛЕКАРСТВЕННО-УСТОЙЧИВЫМИ ШТАММАМИ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА
В статье представлены данные о заболеваемости контактных в семейных очагах с чувствительными и устойчивыми к противотуберкулезным препаратам микобактериями туберкулеза.
Туберкулез на протяжении многих десятилетий остается актуальной проблемой здравоохранения Омской области. За последние сорок лет (1960-2005гг.) эпидемический процесс туберкулезной инфекции имел различные тенденции. После почти двадцати лет планомерного снижения основных показателей, отражающих распространение туберкулезной инфекции, в последнее десятилетие произошло резкое ухудшение эпидемиологической ситуации.
Наличие значительного резервуара инфекции в области привело к высокому уровню инфицированно-сти и заболеваемости туберкулезом населения области. Длительно применяемая в связи с этим непрерывная химиотерапия послужила причиной выраженной изменчивости биологических, морфологических и тин-кториальных свойств микобактерий туберкулеза. Одной из значимых форм изменчивости возбудителя туберкулеза явилось нарушение чувствительности к противотуберкулезным препаратам [1,2].
На сегодняшний день принято различать следующие типы устойчивости микобактерий туберкулеза к специфическим антибактериальным препаратам:
1. Множественная лекарственная устойчивость микобактерий туберкулеза представляет собой одновременную устойчивость к действию изониазида и рифампицина с наличием или отсутствием устойчивости к любым другим противотуберкулезным препаратам. Изониазид — гидразидизоникотиновой кислоты (ГИНК)- обладает высокой бактерицидной активностью против размножающихся микобактерий. Препараты ГИНК являются обязательным компонентом во всех схемах противотуберкулезной терапии, рекомендуемых в настоящее время для лечения, а также для профилактики передачи МБТ лицам, имеющим тесный бытовой контакт с бакте-риовыделителем. Рифампицин отличается бактерицидной активностью и выраженным стерилизующим эффектом по отношению к микобактериям туберкулеза, располагающимся как внутриклеточно, так и внеклеточно, благодаря способности легко растворять липиды клеточной стенки МБТ. Как и изониазид, рифампицин включен во все схемы лечения туберкулеза. Данный тип устойчивости имеет наибольшее клиническое значение. Микобактерии
туберкулеза, обладающие множественной лекарственной устойчивостью, являются резистентными к действию основных антибактериальных препаратов, применяемых для лечения туберкулеза. Этот фактор препятствует эффективной терапии, значительно удлиняет сроки излечения больных.
2. Полирезистентность — это устойчивость ми-кобактерий туберкулеза к двум и более специфических антибактериальных препаратов, без одновременной устойчивости к изониазиду и рифампицину.
3. Монорезистентность штаммов микобактерий туберкулеза — это устойчивость к действию одного из специфических антибактериальных препаратов, применяемых мя лечения туберкулеза.
Целью нашего исследования явилось изучить качественную характеристику бактериовыделения в контингенте больных туберкулезом органов дыхания, состоящих на диспансерном учете. В соответствии с полученными данными из 2423 культур, полученных от больных-бактериовыделителей, у которых проводилось определение спектра лекарственной чувствительности, 877 (36,1 ±0,97%) были чувствительны ко всем противотуберкулезным препаратам. Устойчивость хоты бы к одному противотуберкулезному препарату определенау 1546 больных 163,9±0,^7%, р 2, р 2, р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
У заболевших лиц из окружения больных, выделяющих устойчивые к ГИНК микобактерии, чаще были диагностированы распространенные формы туберкулеза (фиброзно-кавернозный туберкулез у взрослых, первичный туберкулезный комплекс у детей). У детей из второй группы очагов достоверно чаще выявлялись локальные формы - туберкулез внут-ригрудныхлимфоузлов (28,8±6,27%, р 2, р
Способность бактерий туберкулеза быстро развивать устойчивость к лекарственным препаратам – одна из причин широкого распространения инфекции, снижения эффективности и удорожания лечения.

Когда у пациента диагностируется лекарственно-устойчивый туберкулез, то это означает, что лечение предстоит долгое, затратное и без гарантий эффективности. Чаще эта форма выявляется у пациентов с длительным анамнезом заболевания. Но иногда туберкулез, устойчивый к препаратам, диагностируется у здоровых, ранее не лечившихся людей.
Почему туберкулезная палочка приобретает устойчивость?
Лекарственно-устойчивый туберкулез формируется тогда, когда из-за спонтанных мутаций появляются бактерии, нечувствительные к лекарству, или когда не удается поддерживать необходимую концентрацию препарата в крови. В результате гибнут не все возбудители, менее чувствительные выживают. Если применяется несколько антибиотиков, то устойчивые бактерии могут быть уничтожены ими.
При монотерапии или при неправильно подобранной схеме выжившие палочки размножаются, и их потомки наследуют свойство резистентности к данному лекарству. Невосприимчивость туберкулезной палочки закрепляется генетически. Так формируется лекарственная устойчивость микобактерий туберкулеза.
Формированию устойчивости способствуют некоторые клинические ситуации. Знание этих условий необходимо для предотвращения перехода заболевания в устойчивую форму:
- недостаточная продолжительность курса лечения,
- пропуски в приеме препаратов,

использование дозы лекарства, ниже рекомендованной,- использование некачественных лекарственных средств,
- назначение сочетаний химиопрепаратов без проверки чувствительности к ним (если один из препаратов неэффективен, вероятность формирования резистентности к другому велика),
- назначение нерациональных схем,
- использование противотуберкулезных антибиотиков с широким спектром антимикробной активности (фторхинолонов) для лечения других бактериальных инфекций (например, пневмонии) с нераспознанным туберкулезом,
- перекрестная резистентность – если появляется резистентность к одному химиопрепарату может возникнуть резистентность и к другому из того же класса.
Стоит помнить, что одна из основных причин развития лекарственно-устойчивого туберкулеза – недостаточная приверженность терапии.
Больные, достигая положительных результатов терапии, часто перестают адекватно оценивать серьезность ситуации и начинают пропускать прием лекарств, а то и вовсе бросают лечение. Если к этому моменту не наступило выздоровление, через некоторое время заболевание снова начинает прогрессировать, но уже в виде устойчивой формы туберкулеза. Есть и другие причины формирования устойчивости (врачебные ошибки, недочеты в организации лечебного процесса, отсутствие лекарств).
Особую значимость в появлении лекарственно устойчивого туберкулеза имеет заболеваемость в местах лишения свободы. В появлении и распространении форм туберкулеза, устойчивого к лечению, среди лиц из МЛС участвуют следующие факторы:

высокая скученность зараженных людей,- пребывание социально неадаптированных лиц с высоким уровнем заболеваемости совместно с относительно благополучными заключенными,
- недостаточное обеспечение медикаментами,
- отсутствие преемственности в лечении (некоторая часть туберкулезных больных не обращаются в диспансеры после освобождения и не лечится).
Эта группа людей служит постоянным источником устойчивых штаммов возбудителя. В результате, излечение вновь заразившихся больных становится все более проблематичным, растет уровень заболеваемости, количество тяжелых форм и летальных исходов.
Важно! Заражение человека микобактерией, устойчивой к препаратам, ведет к заболеванию первично резистентным туберкулезом, который даже при выявлении на ранних стадиях очень плохо поддается лечению.
Виды лекарственно устойчивого туберкулеза и их терапия
Туберкулезная палочка может приобретать резистентность к нескольким химиопрепаратам. Чем более устойчива палочка, тем сложнее подобрать схему лечения. В зависимости от того, к каким препаратам возбудитель нечувствителен, выделяется 3 формы лекарственно-устойчивого туберкулеза:

Туберкулез с множественной лекарственной устойчивостью (МЛУ-ТБ). Эта форма диагностируется при устойчивости микобактерии к двум самым сильным противотуберкулезным химиопрепаратам первой линии – Изониазиду и Рифампицину, независимо от наличия или отсутствия устойчивости к другим препаратам этой группы.- Туберкулез с широкой лекарственной устойчивостью (ШЛУ-ТБ). Она диагностируется при устойчивости к Изониазиду, Рифампицину и другим препаратам – любому из фторхинолонов и любому из инъекционных антибиотиков третьей линии (Канамицину, Амикацину или Капреомицину).
- Абсолютно устойчивый туберкулез. Этот термин не является официально признанным медицинским сообществом, но он хорошо отражает ситуацию – микобактерия резистентна ко всем химиопрепаратам, тестирование на лекарственную чувствительность (ТЛЧ) к которым проводилось.
Кроме этого, различают первичную, когда больной изначально инфицирован устойчивой бактерией, и приобретенную устойчивость, появившуюся минимум после месяца лечения, монорезистентность (к одному из препаратов) и полирезистентность (к нескольким лекарственным средствам). Выделение туберкулеза МЛУ производится для стандартизации стратегий лечения этих больных.
Клинически эта форма болезни в момент постановки диагноза ничем не отличается, разница – в ответе на лечение. Заподозрить лекарственно-устойчивый туберкулез можно при отсутствии эффекта от терапии в течение 4–6 месяцев, при прогрессировании процесса на фоне приема лекарств, при продолжающемся бактериовыделении свыше 4 месяцев.
В идеале, тестирование на лекарственную чувствительность должно проводиться всем больным при установлении диагноза, по крайней мере, к основным химиопрепаратам. Организационно это не всегда возможно, поэтому определение чувствительности должно проводиться как минимум больным из групп риска:

больным, ранее получавшим лечение по поводу туберкулеза,- ВИЧ-инфицированным,
- работникам медицинских учреждений,
- пациентам, бывшим в контакте с больными устойчивыми формами или с умершим от МЛУ-ТБ,
- больным, продолжающим выделять микобактерию после 4 месяцев лечения,
- освободившиеся из МЛС.
Лечение больных с МЛУ–ТБ проводится в соответствии со стандартными схемами. В разработке стратегии лечения должны учитываться не только аспекты подбора препаратов и режима дозирования.
Важно! Для успешного лечения необходимо уделять внимание мотивации больных к соблюдению режима приема лекарств и выдерживанию необходимой продолжительности курса.
Основные принципы терапии лекарственно устойчивого туберкулеза:
- назначается одновременно 5 химиопрепаратов с доказанной чувствительностью к выделенному штамму, а при эмпирическом лечении или при тяжелых формах поражения – и более пяти препаратов,
- применяют максимальные дозы,
инъекционные антибиотики продолжают вводить еще 6 месяцев после прекращения бактериовыделения,- после получения отрицательного посева мокроты лечение продолжается еще 18 месяцев, общая продолжительность составляет около 2 лет,
- прием лекарств производится под контролем медицинского персонала 6 дней в неделю 2–3 раза (в зависимости от схемы) в день,
- обязательно получение информированного согласия на лечение,
- учет этих больных в единой базе данных.
Количество больных туберкулезом во всем мире постоянно увеличивается, в том числе и из-за роста числа больных, инфицированных устойчивыми штаммами. Кроме того, заболеваемость туберкулезом имеет довольно выраженный социальный характер. Ему подвержены в большей степени как раз именно те люди, лечение которых сложнее контролировать. Знание этих фактов, понимание механизмов развития устойчивости и строгое следование рекомендациям, разработанным научным сообществом – инструменты, дающие надежду на обретение контроля над этой болезнью.
Туберкулез (от лат. tuberculum – бугорок) – это инфекционное антропозоонозное заболевание, вызываемое микобактериями и характеризующееся развитием специфического гранулематозного воспаления, чаще хроническим течением, многообразием клинических проявлений и поражением различных органов, главным образом дыхательной системы.
1. Туберкулез – это самая распространенная инфекция.
3. В России один из самых высоких уровень заболеваемости туберкулезом.
4. Туберкулез – это инфекция, которая чаще всего является причиной смерти и инвалидности.
5. Туберкулез может поражать любой орган и систему организма, поэтому врач любой специальности должен знать и уметь распознать туберкулез.
Причины распространенности туберкулеза:
Проблема туберкулеза – на 80% социальная проблема и лишь на 15% зависит от состояния здравоохранения.
1. Снижение социально-экономического уровня жизни граждан.
2. Сокращение объемов финансирования противотуберкулезных программ, дефицит противотуберкулезных препаратов, дорогостоящее лечение.
3. Распространение лекарственно устойчивых штаммов микобактерий туберкулеза.
4. Распространение ВИЧ-ассоциированного туберкулеза (на сегодняшний день в РФ зарегистрировано более 13 тыс. случаев ВИЧ-ассоциированного туберкулеза).
5. Недостатки в работе первичного звена по диагностике и раннему выявлению туберкулеза.
Семейство – Mycobacteriaceae (от греч. myces – гриб, bacteria – палочка).
Виды – M. tuberculosis (92%), M. bovis (5%), M. africanum (3%).
Морфология и тинкториальные свойства.
Характерен полиморфизм и склонность к ветвлению:
· в свежих культурах – прямые или слегка изогнутые палочки размером 0,3-0,6×1-4 мкм;
- зернистые формы (зерна Муха – от 2 до 12 зерен разной величины, не являются КУБ);
Из зерен, фильтрующихся и L-форм могут восстанавливаться в обычные формы, что способствует поддержанию хронического воспаления, возникновению рецидивов.
Жгутики отсутствуют, спор не образуют, имеют микрокапсулу, кислото-спирто-щелочеустойчивые (клеточная стенка на 46% состоит из липидов в 3-х фракциях: фосфатиды, воски и жирные кислоты – туберкулостеариновая, фтионовая, миколовая и др.).
Грамположительны. Окрашиваются по методу Циля-Нильсена в красный цвет, зернистые формы – в фиолетовый. При окраске ауромином приобретают желтый цвет.
Строгие аэробы (M. bovis – микроаэрофилы), оптимальная температура 370С, рН 6,4-7,2, большое содержание липидов замедляет обмен веществ, поэтому видимый рост M. tuberculosis появляется через 12-25 дней, M. bovis – через 21-60 дней, M. africanum – через 31-42 дня (это обусловлено длительным периодом генерации клеток – 14-15, даже до 24 часов, тогда как у большинства бактерий – 20-30 минут). Рост стимулируется 5-10% СО2, 0,5% глицерина и лецитином. Культивируются только на сложных питательных средах с глицерином, витаминами группы В, аминокислотами и глюкозой, а для подавления токсического действия жирных кислот добавляют активированный уголь, сыворотку животных и альбумин, а для подавления роста сопутствующей флоры – красители (малахитовый зеленый).
* среда Левенштайна-Йенсена (яично-картофельная среда с добавлением глицерина и малахитовой зелени для подавления сопутствующей флоры);
* среда Петраньяни (яично-картофельная среда с добавлением глицерина, кусочков картофеля и молока);
* среды Финна 2 (яичная среда), Миддлбрука и др.
* среда Сотона (аспарагин, глицерин, цитрат Fe и фосфат К);
* Миддлбрука, Дюбо, Школьниковой и др.
В жидких средах видимый рост появляется на 5-7 день в виде тонкой нежной желтоватой пленки, которая постепенно утолщается, становится морщинистой, ломкой, раствор остается прозрачным.
Относительно активны. M. tuberculosis обладает каталазной активностью (в отличие от каталазы условно-патогенных микобактерий термолабильна), уреазой, никотинаминидазой, восстанавливает нитраты, накапливает в среде ниацин (ниациновый тест Конно – среда желтеет под действием никотиновой кислоты).
M. bovis и M. africanum обладают только уреазой, не восстанавливает нитраты, не продуцирует никотинаминидазу и не накапливает в среде ниацин, т.к. превращает его в ниацинрибонуклеотид.
Антигены туберкулезной палочки – это полисахаридные (родоспецифические антигены), белковые (туберкулопротеины), липидные компоненты клетки, фосфатиды. Туберкулопротеиды
являются полными антигенами, полисахариды только в соединении с γ-глобулинами. Антигены стимулируют образование антиполисахаридных, антифосфатидных, антипротеиновых и иных антител различной специфичности (но протективной роли не играют). Также антигены индуцируют развитие ГНТ и ГЗТ.
Экзотоксины не вырабатывают.
Токсическими свойствами обладают химические компоненты клетки:
- Корд-фактор (высокотоксичен) – оказывает токсическое действие на ткани, блокирует окислительное фосфорилирование на митохондриях, тем самым нарушая функцию дыхания, защищает от фагоцитоза, подавляет миграцию лейкоцитов.
- Липиды (миколовая, фтионовая и туберкулостеариновая кислоты, фосфатидный фактор, мураминдипептид, воск Д) и полисахариды – стимулируют развитие специфического гранулематозного воспаления в тканях (образование эпителиоидных клеток, гигантских многоядерных клеток Пирогова-Лангханса).
- Туберкулопротеин – индуцирует развитие ГЗТ.
Ферменты патогенности: лецитиназа, каталаза, пероксидаза.
Среди неспорообразующих бактерий самые устойчивые к действию неблагоприятных факторов окружающей среды. Устойчивы к кислотам, щелочам, спиртам, высушиванию (в высохшей мокроте до 2 месяцев). Рассеянный солнечный свет инактивирует микобактерий в течение 1-1,5 месяцев, прямой – 1,5 часа. На белье, книгах – свыше 3 месяцев; в воде – более 1 года; в почве – до 2 лет; в уличной грязи – до 4 месяцев; в желудочном соке – 6 месяцев; в масле – 10 месяцев. Выдерживают температуру жидкого азота (-1900С), при кипячении погибает через 5-7 минут, 500С – 12 часов, в молоке при 90-950С – 5 минут. 5% карболовая кислота, 1:1000 сулема – 1 сутки, 10% формалин – 12 часов, 5% фенол – 6 часов, 0,05% бензилхлорфенол – 15 минут. Чувствительны к УФО (погибают через 2-3 минуты) и хлорсодержащим дезсредствам (3-5 часов). Губительно действуют стрептомицин, рифампицин, тубазид, фтивазид, ПАСК.
Источник инфекции – больной человек и животные.
- Аэрогенный (пути – воздушно-капельный, воздушно-пылевой);
- Фекально-оральный (путь – алиментарный);
- Контактный (путь – непрямой контактный);
- Вертикальный (путь – трансплацентарный, реализуется редко, т.к. микобактерии вызывают развитие тромбоза кровеносных сосудов плаценты).
Инкубационный период – 3-8 недель – 1 год (до 40 лет).
Патогенез и клинические особенности.
К 40 годам 70-90% людей инфицированы, но только у 10% развивается первичный туберкулез.
В 85-95% случаях заболевание начинается в легких и во внутригрудных лимфатических узлах. Остальные случаи – это туберкулез костей, суставов, кишечника, мочеполовой системы и т.д.
При попадании в альвеолы M. tuberculosis вызывает образование первичного аффекта – специфической гранулемы (бугорка, от лат. granulum – зернышко, греч. oma – окончание опухолей): в центре его располагается зона казеозного некроза с M. tuberculosis, окруженная зоной эпителиоидных и гигантских многоядерных клеток Пирогова-Лангханса, далее расположен вал из лимфоцитов и мононуклеарных фагоцитов.
Из гранулемы M. tuberculosis, поглощенные макрофагами (незавершенный фагоцитоз), по лимфотическим сосудам (лимфангоит) проникает в регионарные лимфоузлы (лимфаденит). Т.о. формируется первичный туберкулезный комплекс, состоящий из:
- лимфаденит.
При высокой естественной резистентности первичный очаг окружается соединительнотканной капсулой и обызвестляется – формируется очаг Гона (петрификат). Микобактерии в виде L-форм могут сохранять жизнеспособность в первичном очаге многие годы.
При снижении невосприимчивости развивается прогрессия, которая может осуществляться 4 путями – развивается диссеминированный туберкулез:
2. Гематогенный путь.
3. Рост первичного аффекта вплоть до казеозной пневмонии.
4. Смешанный путь.
В ряде случаев первичный туберкулез может принимать хроническое течение в виде туберкулезной интоксикации, лихорадки и т.д.
Вторичный туберкулез развивается при повторном массивном инфицировании микобактериями, либо эндогенным путем из очага Гона и других локализаций первичного туберкулеза.
Симптомов, характерных только для туберкулеза, нет.
Значительный естественный иммунитет.
Приобретенный иммунитет – ведущее место клеточный нестерильный (устойчивость к суперинфекции). Формируется ГЗТ.
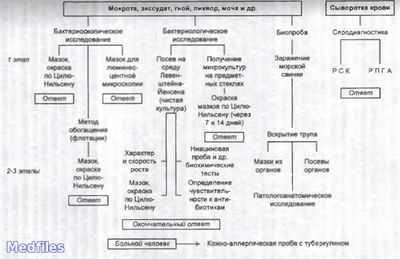
Исследуемый материал – мокрота, гной, моча, СМЖ, плевральная жидкость, промывные воды желудка, кусочки органов, кровь.
1. Бактериоскопический метод.
2. Бактериологичекий метод (основной).
3. Ускоренный метод Прайса на обнаружение корд-фактора.
4. Биологический метод.
5. Серологический метод – РИФ, РСК, РПГА, РДП в геле, ИФА, РИА, иммуноблотинг.
6. Молекулярно-биологический метод – ПЦР, ДНК-гибридизация.
7. Аллергологический метод – проба Манту с 2 ТЕ PPD-L.
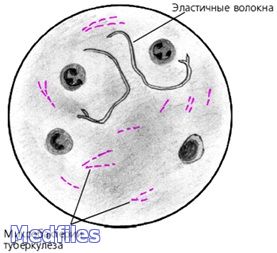
Обнаружение микобактерий туберкулёза при бактериоскопическом методе диагностики (схематично).
В исследуемом материале обнаруживают микобактерии туберкулеза путем микроскопии мазков, окрашенных по Цилю-Нильсену и с применением люминесцентных красителей (чаще всего аурамина). Бактериоскопию рассматривают как ориентировочный метод. Бактериологический метод является основным в лабораторной диагностике туберкулеза.
Посевы делают на среду Левенштейна-Йенсена и инкубируют при 37°С в термостате в течение 3 мес. Выделенные культуры идентифицируют и определяют их чувствительность к химиотерапевтическим препаратам. Для ускоренного обнаружения микобактерий делают посевы по методу Прайса, позволяющего получить микрокультуры туберкулезных бактерий и определить наличие корд-фактора, когда микобактерии располагаются в форме кос и жгутов.
В некоторых случаях, например, при туберкулезе почек, прибегают к биологической пробе -заражению морских свинок с последующим выделением чистой культуры. Кожно-аллергические туберкулиновые пробы (реакция Манту) ставят с целью выявления лиц, инфицированных туберкулезными микобактериями, для оценки течения туберкулезного процесса у больных, а также для контроля эффективности вакцинации и отбора лиц для ревакцинации BCG .
В последние годы большое внимание уделяется новым методам диагностики туберкулеза — цепной полимеразной реакции (ЦПР) и др
Оценка пробы Манту с 2 ТЕ (через 48-72 часа).
- Отрицательная – уколочная реакция (несостоятельность поствакцинального иммунитета, иммунодифицитные состояния).
- Сомнительная – инфильтрат 2-4 мм/только гиперемия любого размера.
- Положительная – инфильтрат 5 мм и более.
- Гиперэргическая – инфильтрат 21 мм и более/везикуло-некротическая реакция независимо от размера инфильтрата.
У здорового вакцинированного человека проба Манту в норме должна быть слабоположительной (папула – 5-12 мм).
Плановая вакцинация в соответствии с национальным календарем прививок в возрасте 3-7 дней жизни живой аттенуированной туберкулезной вакциной БЦЖ (BCG – Bacille Calmette Guerin) – авирулентный штамм M. bovis (длительно культивируют на картофильно-глицериновом агаре с бычьей желчью).
Первая ревакцинация – в 7 лет при отрицательной пробе Манту.
Вторая ревакцинация – в 14 лет при отрицательной пробе Манту и не получившим прививку в 7 лет.
Специфическое лечение – не разработано.
Неспецифическое лечение – АБ, ХТП: изониазид (тубазид), ПАСК, рифампицин, стрептомицин, этамбутол и др.
Читайте также:


