Аденоассоциированный вирус типа 2
24.06.2005

Сразу две команды ученых объявили, что нашли новые способы борьбы с раком. В первом случае, как сообщает корейское новостное агентство Yonhap News, группа под руководством профессора Данкукского университета Шин Дег Юна обнаружила и исследовала новое вещество, способствующее апоптозу (самоуничтожению) клеток, больных раком. При этом, как утверждают онкологи, здоровые клетки не повреждаются.
Дело в том, что многие виды злокачественных опухолей вызываются нарушением работы протеина-супрессора (от английского supress – сдерживать, подавлять) p53, который участвует в восстановлении или уничтожении ДНК поврежденной клетки. Таким образом p53 включает реакции, которые прерывают процесс деления клеток с летальными генными дефектами. Если ген протеина p53 работает нормально, он защищает человека от онкологических заболеваний, если же он мутирует, то, наоборот, способствует их возникновению. Примерно в 60% случаев злокачественные опухоли связаны именно с мутацией гена p53.
Как выяснили ученые, вещество под названием PTX-2, которое можно выделить из морских губок Poecillastra, ослабляет действие белка актина. При этом в раковых клетках с неправильной работой p53-генов начинает активно выделяться Bim-протеин, который и вызывает их самоуничтожение.
Результат опытов на мышах показал, что при введении PTX-2 в течение 72 часов уничтожаются 70% раковых клеток.
При этом ослабление актина происходит также и в нормальных клетках, однако вскоре полностью восстанавливается их нормальная работа. Эксперименты, проведенные учеными в 2004 году на мышах, подтвердили, что РТХ-2 убивает только раковые клетки, а в обычных клетках никаких побочных эффектов не вызывает. По словам Шин Дег Юна, в течение ближайших трех лет благодаря этому открытию должно появиться новое лекарство от рака.
Вторая команда ученых – из Медицинского колледжа Пенсильванского университета в США – нашла другой способ уничтожать раковые клетки – с помощью безвредного для человека вируса. Аденоассоциированный вирус типа 2 (AAV-2) присутствует в организме примерно 80% людей, но не вызывает никаких заболеваний. Исследования этого вируса ведутся уже давно, но обычно его использовали для доставки медикаментов к зараженным клеткам. Американские исследователи выяснили, что этот вирус и сам способен уничтожать клетки, зараженные вирусом папилломы человека (HPV), который влияет на работу гена p53 и тем самым способен вызвать раковую опухоль. В ходе исследования ученые заразили группу человеческих клеток вирусом HPV. Затем они заразили эти клетки, а также чистые клетки вирусом AAV-2. Спустя шесть дней все клетки, зараженные HPV, погибли.
Особенность новых методик состоит в том, что они безвредны для здоровых клеток, в то время как многие виды терапии онкологических больных вредят как раковым, так и обычным клеткам.
Впрочем, как рассказала заведующая отделом экспериментальной химиотерапии Российского онкологического научного центра Галина Герасимова, о каком-то прорыве в области онкологических исследований говорить пока рано. По ее словам, в настоящее время уже существуют препараты для так называемой таргетной терапии, то есть терапии, направленной непосредственно на опухолевые клетки или ее компоненты. Таргетная терапия применяется и в России. Но универсального препарата, который действует на все виды опухолей, в настоящее время нет, сообщила Герасимова. В зависимости от вида опухоли по рекомендации врача рак можно лечить только с помощью медикаментов или в совокупности с другими терапевтическими методами.
Кроме того, хорошие результаты на лабораторных мышах еще ничего не означают. Клинические исследования, по словам Герасимовой, обычно показывают гораздо меньший процент излечимости. Пока не пройдут мультицентровые исследования (исследования сразу в нескольких онкологических центрах) и не покажут, что эффект есть, трудно сказать, насколько лекарство эффективно.
По материалам Газета.Ru.
Центр России. Другие новости 24.06.05
АДЕНОАССОЦИИРОВАННЫЕ ВИРУСЫ (греческое aden — железа и латинское associare — соединять; синоним: аденосателлитные, аденоассоциированные сателлитные вирусы) — мелкие ДНК-содержащие вирусы, размножающиеся только в присутствии аденовирусов; входят в состав группы парвовирусов.
Впервые описаны итальянскими вирусологами Аркетти и Боччарелли (1963).
Аденоассоциированные вирусы обнаруживаются в культурах аденовирусов (см.), изолированных от людей и животных.
Размер частиц аденоассоциированных вирусов 22—24 нм, они обладают кубической симметрией икосаэдрального типа. Их вес 7,5 * 10 6 дальтон. Плавучая плотность большинства частиц в изопикническом градиенте хлористого цезия составляет от 1,38 (типы 1—3 и Х7) до 1,43 г/см 3 (тип 4). Кроме того, имеются более плотные частицы, диаметр которых на 12% меньше, их плавучая плотность составляет от 1,43 (вирус Х7) до 1,47 г/см 3 (А. в. тип 3). В культурах также обнаруживаются пустые капсиды с плотностью 1,33—1,36 г/см 3 .
Предполагают, что капсид аденоассоциированных вирусов состоит из 12 капсомеров. В состав вириона входят три структурных белка с молекулярным весом около 66 тыс., 80 тыс. и 92 тыс. дальтон. Аденоассоциированные вирусы типа 4 и вирус Х7 имеют гемагглютинин. Первый из них наиболее интенсивно склеивает эритроциты человека группы 0 при t° 4°, а второй — эритроциты человека, морской свинки и мыши. При t° 37° наблюдается элюция вируса без разрушения рецепторов эритроцита.
Аденоассоциированные вирусы содержат однонитчатую ДНК с молекулярным весом 1,5—1,7 * 10 6 дальтон. На нее приходится от 18,9 (тип 1) до 26,5% (тип 4) веса вириона, причем гуанин-цитозин составляет от 53% (аденоассоциированных вирусов типа 2) до 58—62% (тип 4) веса ДНК.
аденоассоциированный вирус весьма устойчивы к нагреванию: при t° 80° они инактивируются за 30 мин., а при t° 60° — лишь через 4 часа. Они не изменяются в течение 30 дней при t° 25° и 6 мес.— при t° 2—4°. Устойчивы к действию эфира. Инактивируются ультрафиолетовыми лучами.
Известно несколько серологических типов аденоассоциированного вируса. У приматов встречаются аденоассоциированный вирус четырех типов: у людей типы 1, 2, 3, у обезьян — типы 1, 2, 3, 4. У типов 2 и 3 имеется некоторая антигенная общность. Обнаружены аденоассоциированные вирусы также у крупного рогатого скота (вирус Х7), свиней, собак и кур. Клинически выраженных заболеваний аденоассоциированного вируса, по-видимому, не вызывают. Они нередко выделяются вместе с аденовирусами из глоточных и ректальных смывов у людей при аденовирусных болезнях (см.). Антитела к аденоассоциированных вирусов типов 1—3 обнаруживаются в сыворотках 20—50% людей; инфицирование происходит обычно в раннем детстве. Еще шире данные вирусы распространены среди обезьян (макаки-резусы и зеленые африканские мартышки). Вирус Х7, помимо крупного рогатого скота, может, очевидно, инфицировать людей, поскольку у них найдены соответствующие антитела.
Наличие аденоассоциированных вирусов определяется чаще всего с помощью электронной микроскопии, используется также РСК, преципитация в геле и обработка зараженных клеток флуоресцирующими иммунными сыворотками. Аденоассоциированные вирусы типа 4 и Х7 можно выявить по их способности агглютинировать эритроциты.
Библиография: Blacklow N. R., Hoggan М. D. а. МсСLanahan М. S. Adenovirus-associated viruses, Proc. Soc. exp. Biol. (N. Y.), v. 134, p. 952, 1070; Blacklow N. R. a. o. A seroepidemio-logic study of adenovirus-associated virus infection in infants and children, Amer. J. Epidemiol., r. 94, p. 359, 1971; В о u-cher D. W., Mel nick J. L. a. Mayor H. D. Nonencapsi dated infectious DNA of adeno-satelllte virus in cells coinfected with herpesvirus, Science, v. 173, p. 1243, 1971; Hogg an M. D. Adenovirus associated viruses, в кн.: Progr. med. Virol., ed. by J. L. Melnick, p. 211, MQn-chen — N. Y., 1970; Johnson F. B., Ozer H. L. a. H о g g a n M. D. Structural proteins of adenovirus-associated virus type 3, J. Virol., v. 8, p. 860, 1971; T orpl er G., D’ H a 1 1 ui n J.-C. a. Boulanger P. Electron microscopic observations of KB cells infected with adeno-associated satellite virus, J. Microec. (Paris) , v. 11, p. 259, 1971.
06 февраля 2015
- 1328
- 1,1
- 0
- 2
Калифорнийские ученые разработали беспромоторную и безнуклеазную стратегию компенсации мутаций гена свертывающего фактора IX, тем самым избавив от повышенной кровоточивости разновозрастных мышей. Остроумный способ конструирования и введения терапевтического вектора предполагает наименьшее количество возможных побочных эффектов этиологического лечения не только гемофилии B, но и других наследственных заболеваний.
Спектр дефектов генов F8 и F9 чрезвычайно широк: потери целых генов или делеции их фрагментов, инверсии интронов, инсерции, дупликации, сплайсинг-, нонсенс- и миссенс-мутации. В зависимости от типа мутации развивается заболевание определенной тяжести.
Для гемофилий A и B характерен отсроченный геморрагический синдром, обусловленный нарушением первой фазы свертывания крови — образования активного плазменного тромбопластина. При минимальных травмах или даже спонтанно возникают болезненные кровоизлеяния: в мягкие ткани (подкожные, внутримышечные, в забрюшинное пространство, стенки кишечника и др.), в кости и суставы (инвалидизирующие гемартрозы), мозг [5]. Носовые или связанные с удалением зубов кровотечения иногда не удаётся остановить несколько часов.
Профилактика травм и заместительная терапия — все, чем на сегодняшний день располагает больной гемофилией. Замещение недостающего фактора свертывания производится в целях профилактики и купирования кровотечений свежезамороженной плазмой и концентратами человеческих (или полученных из животных) факторов VIII и IX. Но: факторы быстро выводятся из организма, существует риск переноса хронических вирусных инфекций, как и риск выработки ингибиторов — антител, нейтрализующих вводимый антигемофильный фактор. Тогда назначаются антиингибиторные комплексы, плазмаферез и даже иммунодепрессанты.
Недавно начаты клинические испытания некоторых генотерапевтических подходов, однако ни один из них пока не признан безоговорочно безопасным даже теоретически.
Как перенести терапевтический ген в нужные клетки и обеспечить его поддержание?
Аденоассоциированные вирусы (AAV), содержащие одноцепочечную ДНК, почти всем хороши: не вызывают болезней у человека (потому и иммунная система их почти игнорирует), обладают тропизмом к разным тканям, могут производить терапевтические продукты как в виде эписом, так и очень быстро и даже специфично рекомбинировав с хромосомной ДНК. Одно плохо: клонировать в такие векторы можно до 4,5 тыс. нуклеотидов — капсиды миниатюрные. И на некоторые серотипы иммунная система таки реагирует, что выяснилось уже в клинических испытаниях.
Анализ накопленного опыта применения описанных генотерапевтических подходов побудил группу Ади Барцеля, работающую с мутантными по гену F9 мышами-гемофиликами, сделать ставку на аденоассоциированные вирусы (rAAV) и специфичную интеграцию. Только ещё и беспромоторную, и осуществляемую посредством гомологичной рекомбинации без всяких нуклеаз [1].
Мы свой, мы новый ген построим.
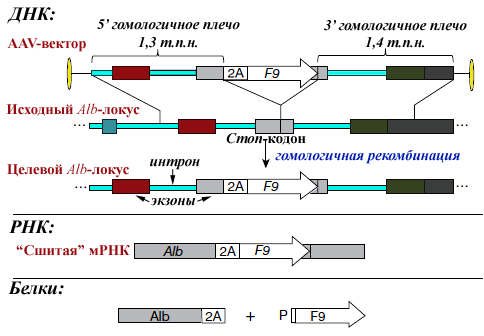
Прежде всего ученые амплифицировали 2,7-т.п.н. участок мышиного гена альбумина, содержащий примерно в середине стоп-кодон (рис. 2), клонировали его между вирусными инвертированными концевыми повторами. А вот дальше авторы использовали новомодный трюк — непосредственно перед альбуминовым стоп-сигналом ввели оптимизированный по кодонам человеческий ген F9, а прямо перед ним — ДНК-фрагмент, кодирующий 2А-пептид (см. справку по 2А-пептидам). В целевой конструкции гены Alb и F9 должны ко-транскрибироваться с единственного Alb-промотора, а трансляция F9 следовать сразу за трансляцией Alb, но полипептиды не будут связаны физически. Специфичность интеграции в геном гепатоцитов должны обеспечивать два (5′ и 3′) плеча гомологии.
И стар и млад мышиный рад — их гемостаз пошёл на лад
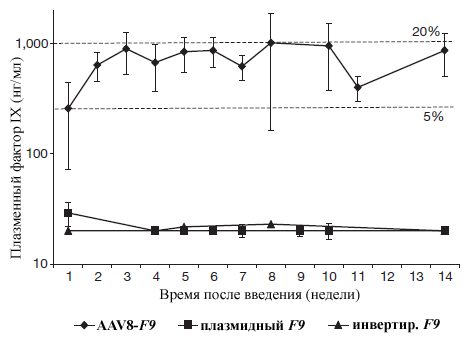
Рисунок 3. Экспрессия человеческого фактора IX (уровень FIX в плазме по данным ELISA) у взрослых мышей, которым в возрасте ввели либо терапевтическую конструкцию (AAV8-F9 получили 7 особей), либо инвертированную (получили 3 особи), либо плазмидную (получили 3 особи). Пунктирными линиями ограничен диапазон от нормального уровня FIX. Рисунок из [1].
Первым делом терапевтический вектор внутрибрюшинно ввели шести двухдневным мышатам в количестве 2,5×10 11 молекул на особь, а контрольный — трем. Начиная с четвертой недели, иммуноферментным анализом (ELISA) еженедельно определяли уровни фактора IX в плазме мышат. У экспериментальной группы уже во время первого измерения они вышли на плато ( от нормы). Известно, что достижение даже может улучшить качество жизни людей, страдающих гемофилией, а радикально снизить кровоточивость. В контрольной группе плазменные уровни фактора IX оставались за пределом детекции, что указывает на отсутствие нецелевого встраивания (или его неуловимо редкие случаи). Эписомную экспрессию исключило быстрое восстановление терапевтического уровня фактора IX после удаления 2/3 печени.
Доказательств много не бывает
Да, хоть и сложно продумывать все нюансы эксперимента и доказывать его успешность, чтобы потом ни один рецензент не подкопался, но в случае генотерапии на кону стоит не только публикация в Nature, а чье-то здоровье. Потому группа А. Барцеля потрудилась на славу.
Вроде бы стройно все получается.
Сомнения и перспективы
Настоящий учёный не перестаёт сомневаться, даже если теория железобетонная и результаты экспериментов проверены и перепроверены. А. Барцеля и соавторов статьи [1], в частности, беспокоит следующее:
Несмотря на понятную осторожность, Ади Барцель и коллеги считают, что их беспромоторная и безнуклеазная интегративная rAAV-стратегия — идеальный кандидат для проведения клинических испытаний не только с целью терапии гемофилии и иных генетических дефектов, но и для компенсации каких-то состояний секрецией нужных белков. Конечно, этот подход не слишком напоминает идеал — замену бракованной детали, но сулит, возможно, самое маленькое кладбище (как у хорошего врача) по сравнению с ранними и даже зреющими методиками генной терапии.
Аннотация научной статьи по биотехнологиям в медицине, автор научной работы — Епифанова Е.А., Борисова Е.В., Салина В.А., Бабаев А.А.
Вирусные векторы современный инструмент для доставки генетического материала в клетку. Рассмотрены различные типы вирусных векторов , таких как ретровирусные, аденоассоциированные и лентивирусные векторные системы, векторные системы на основе аденовирусов, вируса герпеса простого и поксвирусов. Более подробно представлены аденоассоциированные векторные системы. Их основные преимущества (способность интегрировать целевой ген в нужное место генома хозяина, что предотвращает нежелательные мутации; встраивание как в делящиеся, так и в покоящиеся клетки; широкий профиль трансдукции; низкий иммунный ответ; сильная и устойчивая экспрессия трансгена) сделали эти векторы популярным и универсальным инструментом для доставки генов in vitro и in vivo. Показаны возможности применения вирусных векторов в нейробиологии .
Похожие темы научных работ по биотехнологиям в медицине , автор научной работы — Епифанова Е.А., Борисова Е.В., Салина В.А., Бабаев А.А.
Viral Vectors for Delivering Gene Material into Cells and Their Application in Neurobiology (Review)
Viral vectors are modern tools for delivering genetic material into cells. Various types of viral vectors based on retroviruses, adeno-associated and lentiviral viruses, adenoviruses, herpes simplex and poxviruses are considered in this work. Adeno-associated vector systems are presented in more detail. Their main advantages (ability to integrate a target gene into the proper site of the host genome, preventing undesirable mutations; entering both dividing and nondividing cells; a wide transduction profile; low immune response; strong and stable transgene expression) have made these vectors a widely used and universal tool for transferring genes in vitro and in vivo. Possible applications of viral vectors in neurobiology are also shown.
1я доставки ериалав клетку 1ание в нейробиологии (обзор)
Е.А. Епифанова, магистрант, лаборант лаборатории генно-инженерных технологий Института биологии и биомедицины;
Е.В. Борисова, аспирант, младший научный сотрудник лаборатории генно-инженерных технологий Института биологии и биомедицины;
В.А. Салина, аспирант, младший научный сотрудник лаборатории генно-инженерных технологий Института биологии и биомедицины;
А.А. Бабаев, к.б.н., доцент кафедры молекулярной биологии и иммунологии; старший научный сотрудник лаборатории генно-инженерных технологий Института биологии и биомедицины
Нижегородский государственный университет им. Н.И. Лобачевского, Н. Новгород, 603950, проспект Гагарина, 23
Вирусные векторы — современный инструмент для доставки генетического материала в клетку. Рассмотрены различные типы вирусных векторов, таких как ретровирусные, аденоассоциированные и лентивирусные векторные системы, векторные системы на основе аденовирусов, вируса герпеса простого и поксвирусов. Более подробно представлены аденоассоциированные векторные системы. Их основные преимущества (способность интегрировать целевой ген в нужное место генома хозяина, что предотвращает нежелательные мутации; встраивание как в делящиеся, так и в покоящиеся клетки; широкий профиль трансдукции; низкий иммунный ответ; сильная и устойчивая экспрессия трансгена) сделали эти векторы популярным и универсальным инструментом для доставки генов in vitro и in vivo. Показаны возможности применения вирусных векторов в нейробиологии.
Ключевые слова: вирусные векторы; аденоассоциированные вирусные векторы; хелперные плазмиды; трансфекция; нейро-биология.
Viral Vectors for Delivering Gene Material into Cells and Their Application in Neurobiology (Review)
E.A. Еpifanova, Master's degree Student, Laboratory Assistant, Laboratory of Genetic Engineering Technologies of the Institute of Biology and Biomedicine;
Е.V. Borisova, PhD Student, Junior Researcher, Laboratory of Genetic Engineering Technologies of the Institute of Biology and Biomedicine;
V.A. Salina, PhD Student, Junior Researcher, Laboratory of Genetic Engineering Technologies of the Institute of Biology and Biomedicine;
Для контактов: Епифанова Екатерина Алексеевна, e-mail: epifa888@mail.ru
А.А. Babaev, PhD, Associate Professor, Department of Molecular Biology and Immunology; Senior Researcher, Laboratory of Genetic Engineering Technologies of the Institute of Biology and Biomedicine
Lobachevsky State University of Nizhni Novgorod, 23 Prospect Gagarina, Nizhny Novgorod, 603950, Russian Federation
Viral vectors are modern tools for delivering genetic material into cells. Various types of viral vectors based on retroviruses, adeno-associated and lentiviral viruses, adenoviruses, herpes simplex and poxviruses are considered in this work. Adeno-associated vector systems are presented in more detail. Their main advantages (ability to integrate a target gene into the proper site of the host genome, preventing undesirable mutations; entering both dividing and nondividing cells; a wide transduction profile; low immune response; strong and stable transgene expression) have made these vectors a widely used and universal tool for transferring genes in vitro and in vivo. Possible applications of viral vectors in neurobiology are also shown.
Key words: viral vectors; adeno-associated viral vectors; helper plasmids; transfection; neurobiology.
В настоящее время вирусные векторы — распространенный инструмент для доставки генетического материала в клетку. Именно благодаря особенностям жизненного цикла вирусов первые векторы (носители трансгенов) стали разрабатывать на их основе [1]. Вирусы переносят чужеродные гены, которые способны экспрессироваться в зараженных клетках [2]. Сейчас вирусы эволюционировали в специализированные молекулярные механизмы, способные эффективно транспортировать их геномы внутрь клеток, которые они заражают [3].
Разнообразие вирусных векторов велико, и каждый имеет свои преимущества и недостатки. Сейчас значительные усилия направляются на разработку вирусных векторов с улучшенными характеристиками безопасности и большей эффективностью доставки нуклеиновой кислоты в клетки, а также на обеспечение длительной и тканеспецифичной экспрессии введенного генетического материала. Потенциально вирусные векторы могут применяться как один из способов доставки генов в генной терапии новообразований и наследственных заболеваний.
Рекомбинантные аденоассоциированные вирусы (рААВ) являются одними из наиболее перспективных векторов доставки для генной терапии благодаря своим непатогенным свойствам, отсутствию иммуноген-ности со стороны хозяина и тропности к большинству клеток и тканей [4]. Аденоассоциированные вирусные векторы по своим характеристикам приближаются к идеальному вектору [5].
Вирусные векторы нашли свое применение и в ней-робиологии в качестве систем эффективной доставки генов в нейроны и другие нейрональные клетки in vitro и in vivo. Вирусные векторы позволяют вести наблюдение за нейробиологическими функциями, изменять экспрессию целевых генов, метить клетки для определения их судьбы и менять физиологическое состояние специфических клеточных популяций. Использование вирусных векторов для доставки генов в нервную систему имеет большие перспективы как для фундаментальных исследований, так и для терапевтического применения.
Типы вирусных векторов, используемых в нейробиологии
навать клетки-мишени. Поэтому для доставки генов в эукариотические клетки с начала 1980-х гг. разрабатываются векторные генетические конструкции [11].
Ретровирусные векторные системы
Ретровирусы относятся к группе вирусов, РНК-геном которых в инфицированных клетках конвертируется в ДНК. Геном ретровирусов образован плюс-цепью РНК и включает три структурных гена (gag, pol и env), фланкированных длинными терминальными повторами (LTR, long terminal repeat) [12]. В LTR содержатся регуляторные элементы, которые играют роль во встраивании ретровируса и необходимы для интеграции ДНК-копии генома вируса с геномом хозяина, а также определяют начало и конец вирусного генома. LTR также контролируют экспрессию вирусных генов [13]. Оболочка ретровирусов состоит из цитоплазма-тической мембраны зараженной клетки и вирусных белков [14]. Особенностью жизненного цикла ретро-вирусов является обратная транскрипция в зараженной клетке на матрице вирусной РНК с образованием двухцепочечной ДНК (провирус), которая затем встраивается в клеточный геном. Вирус встраивается в клеточный геном случайным образом, поэтому возрастает риск инсерционного мутагенеза. Так как эти вирусы заражают только делящиеся клетки (для проникновения в ядро необходимо разрушение ядерной оболочки клетки, происходящее в ходе митоза), ретровирусные векторы используют в основном для трансфекции клеток ex vivo или для лечения злокачественных опухолей [15]. Сами ретровирусные векторы получают на основе провируса, из которого удаляются гены gag, pol и env для предотвращения репродукции вируса и освобождения места для желаемого генетического материала. В вектор на основе ретровируса может быть включено до 8 тыс. пар оснований ДНК-вставки. Для репродукции вируса удаленные вирусные гены (gag, pol, env), которые кодируют вирусные белки и обеспечивают репродукцию вируса, встраивают в геном упаковывающей клеточной линии на разные хромосомы так, чтобы снизить вероятность обратной рекомбинации вирусных генов в исходный вирусный геном и образования вирусов, которые могут репродуцироваться [16].
Лентивирусные векторные системы
Лентивирусы относятся к семейству ретровирусов и в отличие от других ретровирусов инфицируют не только делящиеся, но и неделящиеся клетки. Наиболее исследованным лентивирусом является вирус иммунодефицита человека (ВИЧ). В связи со способностью лентивирусов включать большое количество генетического материала (до 8 тыс. пар оснований) и инфицировать делящиеся и неделящиеся клетки, эти вирусы являются перспективным вектором для доставки генов в условиях in vivo [17]. Геном ВИЧ
включает три гена структурных белков (gag, pol и env) и б генов регуляторных белков (tat, rev, vpr, vpu, nef и vif) [18, 19]. Некоторые гены могут быть исключены из генома вируса и при этом не вызвать снижения вирусной способности к размножению и инфицированию клеток. Лентивирусный жизненный цикл похож на жизненные циклы других ретровирусов, за исключением способности заражать и неделящиеся клетки. Эта способность обеспечивается взаимодействием вирусного преинтеграционного комплекса с ядерной оболочкой и транспортом через нее [2O]. Сборка лентивирусного вектора происходит в упаковывающих клетках — это перевиваемые клетки, осуществляющие синтез виру-соспецифических белков [21]. Упаковывающие клетки включают в себя пакующую, векторную и оболочечную кассеты, которые вместе позволяют собрать функциональную вирусную частицу [22, 23]. При этом их одновременная экспрессия не вызывает образования ретровирусных частиц, способных инициировать инфекционный процесс у человека [24].
Лентивирусы имеют сравнительно небольшой объем вставки целевого гена (до 8 тыс. пар оснований), могут обеспечить длительную экспрессию трансгена и индуцируют минимальный иммунный ответ организма-хозяина [25]. Некоторые авторы считают эти векторы малоподходящими для доставки in vivo, так как они увеличивают риск инсерционного мутагенеза. Однако при использовании лентивирусов для трансдукции дифференцированных клеток риск инсерционного мутагенеза меньше, чем при использовании других ре-тровирусов [2б].
Векторные системы на основе аденовирусов
Аденовирусы — семейство ДНК-вирусов, несущих в своем составе одну двуцепочечную молекулу ДНК и лишенных липидной оболочки. Аденовирусы разделены на основе связывания со специфическими сыворотками на 51 серотип [27], а по способности агглютинировать эритроциты у людей, кроликов и мышей и по онкогенности для грызунов — еще на б субгрупп (от A до F) [28]. Аденовирусы разных субгрупп поражают различные органы и ткани человека [29].
Создание рекомбинантных аденовирусных векторов во многом схоже с созданием лентивирусных векторов. Аденовирусы, дефектные по репликации, получали за счет замены гена Е1, необходимого для репликации, на ген интереса, промотор и энхансер [3O]. При этом такие рекомбинантные векторы эффективно размножаются в пакующих клетках, экспресси-рующих продукт гена Е1. Неспособные к репликации вне пакующих клеток аденовирусные векторы используют для введения трансгенов в условиях in vivo [31]. Рекомбинантные аденовирусные векторы обеспечивают очень высокую экспрессию клонированных генов, но на короткое время (5-1O сут) — из-за иммунного ответа организма-реципиента [32]. Для решения этой проблемы было создано второе поколение аденови-
русных векторов, у которых дополнительно к гену Е1 удалили гены, отвечающие за репликацию вируса, и оставили только элементы, определяющие начало и конец генома и вирусную пакующую последовательность [33]. Такие векторы способны к более длительной экспрессии генов [14].
Аденовирусы способны инфицировать большинство типов клеток (делящиеся и неделящиеся). Объем для вставки целевого гена составляет 20 тыс. пар оснований, что является достаточно большой емкостью ре-комбинантных аденовирусных векторов. Аденовирусы реплицируются в ядре инфицированной клетки как эписомные элементы и обладают высокой эффективностью трансдукции. Так, например, после прямой внутричерепной инъекции рекомбинантного аденовируса была обнаружена его способность заражать нейроны, астроциты, олигодендроглию, эпендимоциты, хориои-дальный эпителий и микроглию [34, 35].
Векторные системы на основе вируса простого герпеса
Вирусные векторы на основе вируса простого герпеса (herpes simplex virus, HSV) имеют конструкцию проще, чем векторы на основе аденовирусов. Сам вирус включает около 80 генов, один из которых (IE3) чаще всего замещается при создании вектора [36]. Исключены могут быть и другие гены, что позволяет увеличить объем вектора или заклонировать несколько генов интереса. Недостатками векторов на основе вирусов простого герпеса являются кратковременная экспрессия клонированных генов, токсичность для клеток-мишеней, низкая эффективность трансдукции и способность заражать только неделящиеся клетки [37].
Для создания вирусных векторов сейчас активно используются ампликоны — многократно повторяющиеся последовательности вируса простого герпеса, которые включают мономерные последовательности, организованные как конкатемеры [38]. Каждый мономер включает хотя бы один участок начала репликации вирусной ДНК (oriS или oriL) и последовательность для упаковки ДНК в вирусную частицу (pac) [39]. Молекулярное клонирование этих последовательностей в бактериальную плазмиду позволяет получить вектор, который упаковывает ДНК в вирион HSV. Такие векторные системы способны включать до 150 тыс. пар оснований чужеродной ДНК, что предоставляет возможность одним вектором доставлять в клетку-мишень несколько транскрипционных единиц, не вызывая при этом иммунного ответа и цитопатического эффекта [40]. Особенность жизненного цикла вирусов простого герпеса — наличие двух стадий инфицирования: активной (проникновение и репродукция в клетках эпителия, приводящие к лизису клеток) и латентной (внедрение и репродукция в нервных клетках) [41]. Лизис клеток происходит за счет того, что при репликации вируса сформировавшиеся вирионы покидают клетку путем почкования ядерной мембраны.
Вирусы простого герпеса — нейротрофичны и высокоэффективны при изучении ретроградного и анте-роградного транспорта в ЦНС, могут быть введены в неопасном латентном состоянии. HSV-векторы имеют большую генетическую емкость и могут обеспечить долгосрочную экспрессию трансгена, однако, как отмечалось выше, основным недостатком их являются токсичность для клеток и низкая эффективность тран-сдукции [24].
Векторные системы на основе поксвирусов
Поксвирусы — крупные вирусы, которые содержат двунитевую ДНК. Поксвирусный вектор позволяет включить до 25 тыс. пар нуклеотидов ДНК интереса без исключения генов самого вируса. Векторные системы на основе поксвирусов не имеют такого широкого применения, поскольку эукариотические промоторы неэффективно распознаются транскрипционными механизмами поксвирусов и для эффективной экспрессии рекомбинантных генов в клетке-реципиенте нужно использовать поксвирусные промоторы [42]. Поксвирусные транскрипты не подвергаются сплайсингу, из-за чего ДНК интереса обязательно должна быть представлена в форме комплементарной ДНК. Особенностью жизненного цикла поксвирусов является наличие собственной ДНК-зависимой РНК-полимеразы, которая обеспечивает считывание более половины вирусного генома в течение начальной и ранней стадий репродуктивного цикла. Вследствие большого размера и неинфекционной природы поксвирусной ДНК чужеродные гены клонируются в поксвирусах путем рекомбинации в условиях in vivo. Поксвирусы обладают природным тропизмом к опухолевой ткани [43].
Главными недостатками поксвирусов являются высокая иммуногенность, кратковременная продолжительность экспрессии и сложности репликации в эукариотических клетках. При этом положительными сторонами поксвирусов служат высокая эффективность трансдукции, емкость и способность заражать большинство типов клеток [44].
Аденоассоциированные вирусные системы и их преимущества
Рекомбинантные аденоассоциированные вирусы (ААВ) являются одними из наиболее перспективных векторов доставки для генной терапии и нейробиоло-гии благодаря своим непатогенным свойствам, низкой иммуногенности со стороны хозяина, тропности к большинству клеток и тканей, высокой эффективности трансдукции и продолжительной экспрессии [45]. Основной их недостаток — небольшая емкость вектора (до 5 тыс. пар оснований).
Всего у ААВ известно 8 различных серотипов. ААВ2, ААВ3 и ААВ5 первоначально были выделены у обезьян [46]. Полагают, что ААВ6 был сформиро-
ван путем рекомбинирования ААВ2 и ААВ1, а именно 5'-конец ААВ2 слился с З'-концом ААВ1 (включая две открытые рамки считывания) [47, 48]. ААВ7 и ААВ8 были выделены от макаки-резуса при ПЦР-амплификации с использованием праймеров, полученных из консервативных областей серотипов ААВ1-ААВ6 [49]. Среди всех восьми серотипов ААВ2 является наиболее изученным и широко используется в качестве вектора доставки генов [5].
ААВ принадлежит к семейству РагуоуШав. Это группа безоболочечных вирусов, содержащих одноце-почечную ДНК. Вирусная частица имеет икосаэдриче-скую (20 граней) симметрию с диаметром 18-26 нм и молекулярную массу 5,5-6,2 МДа [50].
Наиболее характерными особенностями ядерной структуры являются группы тройных выступов и
Читайте также:


