Антиген ротавирусов группы а
Описание и строение ротавируса
Ротавирусная инфекция представляет собой инфекционное заболевание, вызванное вирусами из семейства реовирусов (Reoviridae). Впервые вирус был обнаружен в 1973 г. в эпителиальных клетках слизистой оболочки двенадцатиперстной кишки детей с острым гастроэнтеритом (рис. 1.).
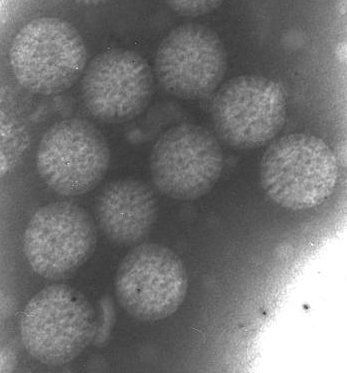
Рис. 1. Фотография вирионов ротавируса с электронного микроскопа.
Острый гастроэнтерит является одним из самых распространенных заболеваний человека и характеризуется наиболее высоким уровнем заболеваемости и смертности среди детей и пожилых людей. В развивающихся странах гастроэнтерит является распространенной причиной смертности детей в возрасте до 5 лет и может быть вызван широким спектром возбудителей. Несмотря на то, что в развитых странах смертность от диареи встречается реже, указанное заболевание зачастую приводит к госпитализации или к вызову врача. Значительная доля заболеваний гастроэнтеритом среди детей приходится на долю вирусов, принадлежащих к четырем различным семьям: ротавирусы, калицивирусы, астровирусы и аденовирусы. Другие вирусы, такие как торовирусы, пикобирнавирусы, пикорнавирусы (вирус Айчи) и энтеровирус 22, также могут приводить к развитию заболевания. Вирусный гастроэнтерит имеет две эпидемиологические модели: диарея (эндемическое заболевание у детей) и вспышки заболеваний среди людей всех возрастов. Возбудителями вирусной диареи у детей являются ротавирусы группы А, кишечные аденовирусы, астровирусы и калицивирусы; при этом заболевание возникает у всех детей в первые несколько лет жизни по всему миру, независимо от уровня гигиены, качества воды или пищи, а также типа поведения. Все указанные инфекционные заболевания за исключением, пожалуй, калицивирусных инфекций, приводят к формированию у пациента иммунитета от повторного заражения тяжелой болезнью.
В геноме ротавируса, основу которого составляет двухцепочечная фрагментированная РНК, 11 фрагментов, кодирующие 13 белков: 7 структурных (VP — вирусные протеины) и 6 неструктурных белков (NSP).
Вирион имеет четыре основных структурных белка (VP2, VP4, VP6 и VP7), образующих трехслойный капсид (рис.2). VP2 формирует ядро вируса и связывает вирусный геном. VP4 располагается на поверхности вирусной частицы в виде шипа, связывается с рецепторами на поверхности клеток и управляет внедрением вируса в клетку, определяет вирулентность вируса. Данных полипептид модифицируется в кишечнике трипсином до VP5 и VP8. VP6 формирует толщу капсида и используется для определения вида ротавируса. Структурный гликопротеин VP7 участвует вместе с VP4 в формировании иммунитета к инфекции.
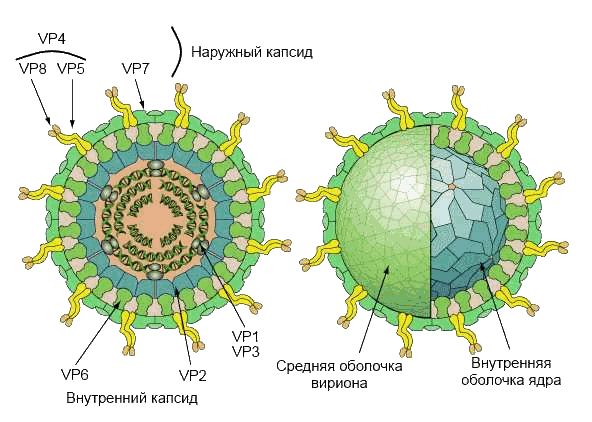
Рис. 2. Структура вириона. Полипептиды VP4 и VP7 формируют наружный капсид вириона; VP2 формирует оболочку ядра, VP6 — среднюю оболочку, вместе образуют внутренний капсид. VP1 и VP3 располагаются в вершинах ядра вирусной частицы.
Диагностика ротавируса
Инкубационный период ротавирусной инфекции составляет около 2 суток. Симптомы заболевания проявляются в течение 3-8 дней в виде рвоты и водянистой диареи, часто сопровождающейся лихорадкой и болями в животе. Как и все вирусы, некоторые разновидности ротавирусной инфекции, в особенности поражающие взрослых, протекают бессимптомно либо проявляются незначительными симптомами. Для ротавирусной инфекции характерен фекально-оральный механизм передачи.
Антитела к ротавирусу компании Биалекса
В качестве иммуногена компания Биалекса использует очищенный бычий ротавирус, при этом моноклональное антитело RV3 специфично к группе А ротавирусов млекопитающих. Антитело кросс-реактивно к ротавирусу обезьяны (SA-11), ротавирусу свиньи (РР), ротавирусу мышей и ротавирусу человека. В рамках Вестерн-блоттинга антитела реагируют с основным антигеном внутреннего капсида VP6, а также могут использоваться при проведении иммуноферментного анализа и иммуногистохимии.
11 геномных сегментов ротавирусов кодируют 13 белков, 2 из которых образуются в результате посттрансляционного расщепления.
Данные по характеристике белковой композиции ротавирусов основном получены на модели ротавирусов животных, в частности обезьян, крупного рогатого скота и свиней, которые адаптированы к культуре клеток и накапливаются в высоких титрах.
В вирионах ротавирусов обнаружено шесть полипептидов (VP1, VP2, VP3, VP4, VP6 и VP7) с молекулярной массой от 37 до 125 кД, один из которых (VP7) гликозилирован.
Два белка VP4 (90 кД) и VP7 (36-38 кД) являются компонентами наружного капсида и не обнаруживаются в однокапсидных частицах. Другие белки образуют внутренний капсид или ассоциированы с сердцевиной вируса. Мажорным белком вириона является полипептид внутреннего капсида VP6 (42 кД). Три белка VP1, VP2 и VP3 входят в состав сердцевины.
Полипептиды наружного капсида ротавирусов представляют особый интерес, поскольку играют основную роль в возникновении инфекционного процесса и развитии иммунитета. Они ответственны за осуществление ранних этапов взаимодействия вирионов с чувствительными клетками - адсорбцию и проникновение, с ними связывают вирулентность ротавирусов. Эти же белки (VP7 и VP4) вызывают образование специфических вируснейтрализующих антител. Они ответственны за иммуногенность ротавирусов. Вирусоподобные частицы ротавирусов, содержащие основные иммуногенные белки, могут служить своеобразными компонентными вакцинами.
Белок VP7 является основным протективным антигеном ротавирусов, ответственным за образование ВН-антител. С помощью моноклональных антител (МАТ) в его составе обнаружен большой домен нейтрализации, включающий несколько перекрывающихся эпитопов. Гликозилирование VP7 - необходимое условие для взаимодействия с клетками-мишенями и проявления инфекционности.
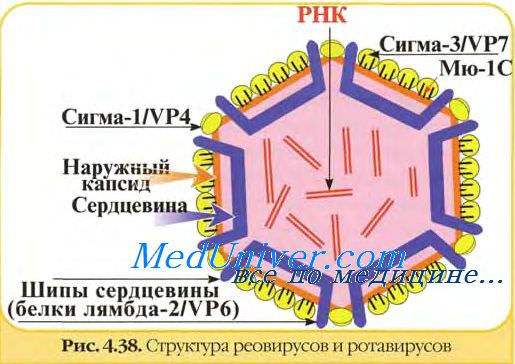
Другим важным белком наружного капсида является VP4. Он ответственен за адаптацию ротавирусов к росту in vitro, контролирует их вирулентность на уровне организма, к тому же является вирусным гемагглютинином и, по-видимому, осуществляет некоторые функции, что и гемагглютинин вируса гриппа, то есть является вирусным белком, обеспечивающим проникновение вируса в клетку. Гемагглютинирующий и нейтрализующий домены находятся в N-концевой половине VP4 ротавируса.
В отличие от гемагглютинина орто- и парамиксовирусов, гемагглютинин ротавирусов не является гликопротеином, хотя в первичной структуре этого белка обнаружены потенциальные сайты гликозирования. В результате протеолиза от полипептида VP4 отщепляется фрагмент — VP8, в котором обнаружено пять нейтрализующих эпитопов.
Нейтрализующие моноклональные антитела к VP7 и VP4 сообщали протективный иммунитет против гомологичного и некоторых гетерологичных серотипов ротавируса. Способность VP4 и VP7 к независимой и гетеротипической индукции синтеза протективных антител может иметь важное значение при конструировании современных ротавирусных вакцин.
Сравнительное изучение антигенных свойств ротавирусов различными методами показало наличие у них общих групповых антигенов. Групповое сходство определяется антигенной общностью внутреннего капсида, а антигенная специфичность связана с белками наружного капсида. Ротавирусы разделяют на группы, субгруппы и серотипы. Белки наружного капсида содержат типоспецифические антигенные детерминанты, а внутреннего — группоспецифические и субгруппоспецифические антигенные детерминанты. Групповая принадлежность определяется антигенной общностью белка VP6, субгрупповая — его антигенными различиями. Гликопротеин VP7 (главный белок нейтрализации) является типоспецифическим антигеном ротавирусов и определяет их серотиповую принадлежность. Серотиповая специфичность отличается высокой консервативностью. Критерием антигенного различия вирусов принята 20-кратная или большая разность титров вируса в РН с гомологичными и гетерологичными антителами.
Исходя из наличия общего группоспецифического антигена (VP6), все ротавирусы, независимо от вида естественного хозяина, разделены на шесть антигенных групп: А, В, С, D, Е и F. Наиболее многочисленна группа А, представители которой играют существенную роль в патологии человека и животных.
Большинство ротавирусов человека и животных относят к группе А, включающей так называемые типичные ротавирусы. Ротавирусы других групп называют атипичными, или параротавирусами. Они изучены недостаточно, поскольку, за небольшим исключением, их пока не удалось размножить in vitro. Каждая группа ротавирусов на основании типоспецифических антигенов делится на серотипы. Так, ротавирусы группы А разделены на 11 серотипов, получивших название G-серотипы.
В другие антигенные группы также входят ротавирусы, поражающие различных хозяев. Вирусы, имеющие одного хозяина, могут настолько сильно различаться между собой в антигенном отношении, что представляют различные антигенные группы. Штаммы ротавирусов, относящиеся к одному серотипу, но выделенные от различных видов животных, часто имеют более тесную антигенную связь, чем штаммы различных серотипов, выделенные от одного вида животных.
В группу В входят ротавирусы человека, крупного и мелкого рогатого скота, в группу С — человека и свиней, группы Е и F — свиней, группу D — птиц. В настоящее время различают не менее четырех серотипов ротавируса человека. Известно о существовании не менее трех серотипов ротавирусов группы А свиней. Кроме того, известны ротавирусы свиней, относящиеся к серогруппам В, С, Е. Серогрупповая серотиповая вариантность имеет место у ротавирусов крупного рогатого скота и других животных. В перекрестной реакции нейтрализации тесное антигенное родство выявлено между ротавирусами обезьян и свиней, а также между ними и ротавирусами крупного рогатого скота. Гомология первичной структуры VP7 различных серотипов достигает 71—85%. Различная степень антигенного родства по VP4 обнаружена между ротавирусами, выделенными от свиней, человека, обезьян и собак. Штамм (АН-1), выделенный от человека, характеризовался высокой гомологией с ротавирусом, выделенным от кошек (FRV-1). От крупного рогатого скота с диареей выделен ротавирус, геномная РНК которого была аналогична ротавирусу птиц. Ротавирусы человека и свиней имели высокую степень гомологии нуклеотидных последовательностей и, возможно, могли иметь общего предка.
Ротавирусы обезьян, свиней и кроликов легко инфицировали телят в экспериментальных условиях. Ротавирус человека вызывал летальную инфекцию у новорожденных поросят при оральном заражении. Существуют ротавирусы, обладающие двойной субгрупповой специфичностью. Такая уникальная способность обнаружена, например, у ротавируса лошадей (штамм FI-14), который взаимодействовал с антителами первой и второй субгрупп. Известен штамм ротавируса свиней с двойной серотипоспецифичностью (G3 и G5). Природа антигенного полиморфизма у ротавирусов пока не выяснена. Приведенные выше данные свидетельствуют о возможности пересечения ротавирусами видовых барьеров и их миграции между различными классами и видами млекопитающих в естественных условиях.
В последнее время у кур, свиней и человека были обнаружены атипичные ротавирусы, не имеющие группоспецифического антигена, несмотря на типичную для ротавирусов морфологию. Они были названы параротавирусами. Атипичные штаммы были обнаружены в 5% случаев при ротавирусных инфекциях у свиней и в 1% — ротавирусных диареях у крупного рогатого скота. При изучении с помощью ЭФ в ПААГ выявлены различия в профиле геномов этих штаммов и типичных ротавирусов. Параротавирусы свиней, в отличие от ротавирусов, вызывают образование синцития из энтероцитов в тонком кишечнике. Хемопротеин в тонком отделе кишечника удаляет наружный капсид ортореовирусов и ротавирусов и повышает их эффективность.
Колтивирусы и аквареовирусы по структуре и свойствам практически не отличаются от свойств, присущих семейству.
Комплексное молекулярно-генетическое исследование для выявления и дифференциации наиболее распространенных возбудителей острых кишечных инфекций (ОКИ) – ротавирусы группы А (Rotavirus), норовирусы 2 генотипа (Norovirus 2 генонотип), астровирусы (Astrovirus). Исследование позволяет выявить генетический материал (РНК) возбудителей в кале и установить этиологию заболевания. Данные патогены являются основной причиной наиболее тяжелого гастроэнтерита у детей грудного и раннего возраста, а также у взрослых.
Анализ качественный - по каждому виду инфекции выдается результат "обнаружено/не обнаружено".
Скрининг на кишечные инфекции: ротавирус, норовирус, астровирус.
Какой биоматериал можно использовать для исследования?
ПЦР в режиме реального времени.
Как правильно подготовиться к исследованию?
- Исследование рекомендуется проводить до начала приема антибиотиков и других антибактериальных химиотерапевтических препаратов.
- Исключить прием слабительных препаратов, введение ректальных свечей, масел, ограничить (по согласованию с врачом) прием медикаментов, влияющих на перистальтику кишечника (белладонна, пилокарпин и др.), и препаратов, влияющих на окраску кала (железо, висмут, сернокислый барий), в течение 72 часов до сбора кала.
Общая информация об исследовании
Острые кишечные инфекции (ОКИ) – группа заболеваний, обусловленных вирусами, бактериями или паразитами, для которых характерен фекально-оральный механизм передачи. Общими для данных инфекций являются факторы передачи: пищевые продукты, вода, инфицированные бытовые предметы и грязные руки. Первые симптомы возникают через несколько часов или дней после инфицирования, начало резкое, с появлением частого жидкого стула, рвоты, боли в животе, признаков интоксикации (лихорадки, озноба, тошноты). Заболевание может носить групповой характер и проявиться у нескольких человек, употреблявших инфицированную пищу или воду.
Согласно официальной статистике, в России до 65-67% заболеваний этой группы составляют ОКИ неуточненной этиологии. Если возбудитель инфекции неизвестен, эффективность противоэпидемических мероприятий ограничивается. Соотношение частоты выявления вирусных и бактериальных патогенов варьируется в разных возрастах: у детей до 3 лет на долю вирусных агентов приходится 80-90% заболеваний, на долю бактериальных – 10-20%; среди взрослых пациентов доля вирусных возбудителей снижается до 30%.
Ротавирусная инфекция – это острое вирусное заболевание, передающееся фекально-оральным путем. Его возбудителями являются РНК-содержащие ротавирусы (Rotavirus). Источник инфекции – больной человек.
Для ротавирусов характерна сезонность: чаще всего ими заражаются в холодное время года. Инкубационный период длится от 15 часов до нескольких суток, начало заболевания острое, с тошнотой, рвотой, диареей, иногда лихорадкой. Если болезнь не лечить, к ним могут добавиться обезвоживание и нарушение электролитного и кислотно-щелочного баланса. Хотя иногда ротавирусная инфекция протекает бессимптомно. После перенесенного заболевания иммунитет нестойкий, поэтому возможен рецидив.
В соответствии с данными зарубежной литературы, норовирус – наиболее частый возбудитель вспышек ОКИ небактериальной этиологии. Эта особенность связана с низкой инфицирующей дозой и высокой устойчивостью в окружающей среде. ПЦР является "золотым стандартом" в клинической диагностике норовирусных инфекций.
Норовирус (Norovirus) – это РНК-содержащий вирус, относящийся к семейству Caliciviridae и приводящий к возникновению желудочно-кишечной инфекции в форме острого гастроэнтерита. Норовирусы классифицируются на шесть геногрупп: GI – GVI. В соответствии со сложившейся номенклатурой, известно около 38 генотипов данных вирусов. Для человека наиболее патогенными являются норовирусы GI, GII, GIV. По современным литературным данным, самой распространенной геногруппой в инфицировании человека является геногруппа GII. Она содержит до 19 генотипов и генотипы GII.3, GII.6, GII.12 ассоциированы с передачей инфекции через продукты питания. Норовирусная инфекция является высококонтагиозным заболеванием и может протекать в виде единичных случаев, групповых случаев и вспышек. Данный возбудитель является причиной возникновения более 90% небактериальной природы и около 50 % всех случаев гастроэнтеритов. К инфекции восприимчивы люди всех возрастных групп, но чаще описываются случаи заболевания у детей школьного возраста и взрослых.
Несмотря на несколько меньшую в сравнении с рота- и норовирусами распространенность, астровирусы составляют значительный пласт кишечных инфекций, у трети пациентов протекающий с явлениями колита. Ротавирусы группы А являются наиболее частой причиной спорадических заболеваний ОКИ у детей, а ДНК-содержащий аденовирус F (серотипы 40 и 41) нередко вызывает вспышки гастроэнтеритов у детей младшего возраста.
Астровирусная инфекция – это острое вирусное заболевание с фекально-оральным путем передачи. Его возбудителями являются РНК-содержащие астровирусы (Astrovirus). Пик заболеваемости приходится на холодное время года. Инкубационный период составляет 3-4 дня. Инфекция проявляется в виде острого гастроэнтерита (общее недомогание, головная боль, тошнота, диарея, небольшое повышение температуры, иногда рвота) и чаще развивается у детей (особенно в возрасте до 2 лет), однако может встречаться и у взрослых. Она напоминает ротовирусную инфекцию, однако протекает легче. Заболевание длится, как правило, не более 5 дней, специфического лечения не требует и заканчивается выздоровлением.
Нередко астровирусная инфекция протекает бессимптомно. Выделение вируса с калом происходит в течение 3 недель с момента заражения, поэтому выявление возбудителя методом ПЦР рекомендуется проводить именно в это время.
Для выявления и дифференциальной диагностики кишечных инфекций используются культуральные и молекулярно-генетические методы исследования генетического материала возбудителя в кале и определение концентрации специфических иммуноглобулинов в крови. ПЦР обладает преимуществом перед культуральными методами благодаря высокой специфичности и чувствительности исследования. Данный анализ позволяет со 100-процентной точностью определить возбудителя кишечного заболевания, а быстрая диагностика острых кишечных инфекций помогает избежать лишних процедур и оперативных вмешательств, своевременно начать лечение и ограничить очаг распространения инфекции.
Для чего используется исследование?
- Для установления этиологического фактора острой кишечной инфекции;
- для дифференциальной диагностики причин острого гастроэнтероколита (воспаления ЖКТ).
Когда назначается исследование?
- Установление этиологического фактора острой кишечной инфекции;
- дифференциальная диагностика причин острого гастроэнтерита;
- дифференциальная диагностика причин острой диареи;
- при симптомах вирусного гастроэнтерита (боли в животе, диарея, рвота, метеоризм, лихорадка);
- одновременное или последовательное развитие ОКИ у нескольких членов семьи, у детей в детском учреждении или пациентов в стационаре;
- "обострение" симптоматики ОКИ у госпитализированного с этим диагнозом пациента (внутрибольничная инфекция);
- по эпидемиологическим показаниям.
Что означают результаты?
Референсные значения: не обнаружено.
Norovirus 2 генотип
Анализ результатов проводят с помощью программного обеспечения используемого прибора для проведения ПЦР c детекцией в режиме "реального времени".
- инфекция вызвана соответствующим патогеном.
- отсутствие РНК возбудителя в исследуемом материале;
- уровень РНК в исследуемом материале ниже пределов детекции метода.
57 Острые кишечные инфекции, скрининг (Shigellaspp., E. coli (EIEC), Salmonella spp., Campylobacter spp., Adenovirus F, Rotavirus A, Norovirus 2 генотип, Astrovirus)
31 Yersinia pseudotuberculosis, ДНК [ПЦР]
10 Посев кала на условно-патогенную флору с определением чувствительности к антибиотикам
Кто назначает исследование?
Инфекционист, педиатр, гастроэнтеролог, эпидемиолог.
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо). Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гаст
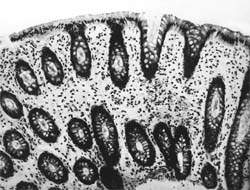 |
| Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимально выраженный катаральный колит. х 100. |
Ротавирусы представляют собой род семейства Reoviridae, который объединяет большое количество сходных по морфологии и антигенной структуре вирусов, вызывающих гастроэнтерит у человека, млекопитающих и птиц. Систематическое изучение ротавирусов человека началось с 1973 года, когда они были обнаружены при электронной микроскопии ультратонких срезов биоптатов слизистой оболочки двенадцатиперстной кишки, полученных от больных острым гастроэнтеритом детей Австралии (Р. Бишоп и соавторы). В том же году Т. Флеветт обнаружил сходный вирус в копрофильтратах больных гастроэнтеритом методом электронной микроскопии при негативном контрастировании препаратов.
Вирусные частицы имеют диаметр от 65 до 75 нм. При проникновении контрастирующего вещества в вирион выявляется электронно-плотный центр диаметром 38 — 40 нм, который представляет собой так называемую сердцевину, окруженную электронно-прозрачным слоем. Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободом, поэтому их стали называть ротавирусами (лат. rota — колесо).
Ротавирусы имеют две белковые оболочки — наружный и внутренний капсиды. Сердцевина содержит внутренние белки и генетический материал, представленный двунитчатой фрагментированной РНК. Геном ротавирусов человека и животных состоит из 11 фрагментов, которые могут быть разделены при электрофорезе в полиакриламидном геле (ПААГ) или агарозе. В составе ротавирусов обнаружено четыре антигена; основной из них — это групповой антиген, обусловленный белком внутреннего капсида. С учетом группоспецифических антигенов все ротавирусы делятся на пять групп: A, B, C, D, E. Ротавирусы одной группы имеют общий групповой антиген, который выявляется иммунологическими реакциями: иммуноферментный анализ, иммунофлюоресценция, иммунная электронная микроскопия и др. Большинство ротавирусов человека и животных относятся к группе A.
| Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями |
Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями. Вирусы в фекалиях заболевших появляются одновременно с развитием клинических симптомов, наибольшая концентрация их в кале (до 109 — 1011 вирусных частиц в 1 г) регистрируется в первые 3 — 5 дней болезни. В эти дни больные представляют наибольшую эпидемиологическую опасность для лиц, контактирующих с ними. Наиболее частым источником заболевания для детей первого года жизни являются инфицированные ротавирусом матери; для взрослых и детей более старшего возраста — дети, в основном из детских коллективов. Возможность заражения человека от животных не доказана.
Патогенез ротавирусной инфекции характеризуется проникновением вируса в эпителиоциты слизистой оболочки желудочно-кишечного тракта, преимущественно тонкой кишки, что приводит к их повреждению и отторжению от ворсинок. Вследствие этого на ворсинках тонкой кишки появляются функционально и структурно незрелые энтроциты с низкой способностью синтезировать пищеварительные ферменты. При ротавирусном гастроэнтерите это проявляется снижением уровня дисахаридаз, развивается вторичная дисахаридазная недостаточность, при которой в просвете тонкой кишки накапливаются нерасщепленные дисахариды, что создает повышенное осмотическое давление и приводит к выводу в просвет кишечника воды и электролитов из тканей организма. Это является основной причиной диареи и дегидратации и определяет основные клинические проявления болезни.
Ротавирусный гастроэнтерит как инфекционное заболевание имеет циклическое течение. Инкубационный период продолжается чаще всего от 12 — 24 часов до двух суток. Клиническая картина ротавирусного гастроэнтерита характеризуется в основном острым началом, однако в ряде случаев может иметь место продромальный период длительности от 12 до 48 — 72 часов. В этот период больные отмечают недомогание, общую слабость, повышенную утомляемость, снижение аппетита, головную боль, познабливание, урчание и неприятные ощущения в животе, умеренно выраженные катаральные явления: заложенность носа, першение в горле, легкий кашель.
В клинической картине ротавирусного гастроэнтерита в период развернутых клинических проявлений ведущими являются синдромы гастроэнтерита и интоксикации. Выраженность диареи и обусловленной ею той или иной степени дегидратации организма, а также токсикоза, продолжительность этих симптомов в значительной мере определяет тяжесть течения заболевания.
Синдром гастроэнтерита характеризуется развитием диареи, снижением аппетита, появлением урчания и болей в животе, тошноты и рвоты. Наиболее типичен для ротавирусного гастроэнтерита обильный водянистый пенистый стул желтого или желто-зеленого цвета. У больных с легким течением заболевания стул может быть кашицеобразным. Как правило, патологические примеси в стуле отсутствуют. Боль локализуется преимущественно в верхней половине живота или является диффузной, она может быть разной интенсивности. Почти всегда она сопровождается громким урчанием в животе.
Синдром интоксикации появляется в самом начале заболевания. Слабость, зачастую резкая, является наиболее частым проявлением этого синдрома; реже отмечается головная боль. При более тяжелом течении имеют место головокружение, обморочное состояние, коллапс. Обращает на себя внимание следующая особенность ротавирусного гастроэнтерита: два ведущих в клинической картине болезни синдрома развиваются в процессе заболевания не всегда однонаправленно; у некоторых больных на фоне сравнительно слабо выраженных диспепсических явлений могут наблюдаться резко выраженные симптомы общей интоксикации, особенно слабость.
Повышение температуры тела не всегда может отмечаться при ротавирусном гастроэнтерите, особенно у взрослых. У некоторых больных может быть озноб без повышения температуры. В то же время нередко в разгар заболевания выраженность лихорадочной реакции варьируется от субфебрильных цифр и выше и может достигать 38 — 39°С как у детей, так и у взрослых.
Важным в диагностическом плане для ротавирусного гастроэнтерита считается сочетание двух ведущих клинических синдромов с симптомами поражения верхних дыхательных путей. Катаральный синдром встречается приблизительно у 50% больных и проявляется в виде гиперемии и зернистости слизистых оболочек мягкого неба, небных дужек, язычка, задней стенки глотки, а также насморка, заложенности носа, кашля, болей в горле. В ряде случаев катаральные симптомы наблюдаются уже в продромальном периоде, до проявления симптомов гастроэнтерита.
В разгар болезни отмечается изменение функционального состояния сердечно-сосудистой системы, чаще у пациентов с более тяжелым течением и при наличии сопутствующих заболеваний органов кровообращения. У большинства пациентов отмечается тенденция к артериальной гипертензии, тахикардия, определяется глухость сердечных тонов при аускультации. У больных с тяжелым течением заболевания, как правило, возникают обмороки и коллапсы из-за выраженных расстройств гемоциркуляции, в генезе которых наряду с токсическими воздействиями существенное значение имеет гиповолемия. Потери жидкости и электролитов вследствие рвоты и диареи могут быть значительными и приводят к развитию дегидратации. Клинические проявления дегидратации зависят от ее степени. При легком и среднетяжелом течении ротавирусного гастроэнтерита отмечается жажда, сухость во рту, слабость, бледность (дегидратация I — II степени), при тяжелом течении наряду с этими симптомами наблюдаются также осиплость голоса, судороги мышц конечностей, акроцианоз, снижение тургора кожи, уменьшение диуреза (дегидратация III степени).
В связи с развитием при ротавирусном гастроэнтерите возможных осложнений, главным образом циркуляторных расстройств, острой сердечно-сосудистой недостаточности, нарушений гомеостаза, выделяют группы больных повышенного риска, в которые включают новорожденных, детей младшего возраста, лиц пожилого возраста, а также больных с тяжелыми сопутствующими заболеваниями. Описанные в литературе и наблюдавшиеся нами случаи ротавирусного заболевания с летальным исходом относятся именно к этим группам.
Выделяются две основные клинические формы ротавирусного заболевания — гастроэнтерическая и энтерическая. Симптомы только острого гастрита (гастритический вариант) встречаются в 3 — 10% случаев. Функциональные и морфологические нарушения со стороны желудочно-кишечного тракта, возникающие при ротавирусном гастроэнтерите в случае наличия у пациентов фоновой гастроэнтерологической патологии, нередко способствуют развитию таких осложнений основного заболевания, как обострение сопутствующих болезней: хронического гастрита, энтероколита, панкреатита, часто в сочетании с выраженными явлениями дисбактериоза кишечника, требующими коррекции при лечении.
При ротавирусном гастроэнтерите гемограмма изменяется следующим образом: в остром периоде заболевания с высокой частотой выявляются лейкоцитоз с нейтрофилезом и повышенная СОЭ. В периоде реконвалесценции картина крови обычно нормализуется полностью. Изменения урограммы у большинства больных имеют кратковременный характер и проявляются чаще всего небольшой протеин-, лейкоцит- и эритроцитурией; в редких случаях в моче появляются гиалиновые цилиндры в незначительном количестве. При тяжелом течении заболевания нарушения функции почек могут быть более выраженными, с повышением уровня мочевины крови, олигоурией или анурией, снижением клубочковой фильтрации. На фоне проводимой терапии указанные изменения быстро исчезают и при повторных обследованиях не отмечаются.
В качестве примера, иллюстрирующего особенности клинического течения ротавирусного гастроэнтерита, приводим выписку из истории болезни.
Лечение: обильное питье солевых растворов, парентеральная регидратационная и дезинтоксикационная терапия — трисоль 1000 мл внутривенное капельное введение, внутрь ферментные препараты: абомин, панкреатин, тансол, карболен. Течение заболевания без осложнений. На третий день болезни — субфебрильная температура, оставалась слабость; боли в животе прекратились. Стул кашицеобразный до пятого дня от начала заболевания. Полное выздоровление наступило на седьмой день болезни.
Дифференциальный диагноз у больных ротавирусным гастроэнтеритом проводят с другими острыми кишечными инфекциями как вирусной так и бактериальной этиологии, прежде всего в тех случаях, когда в клинической картине на первый план выступает синдром гастроэнтерита: с вирусными диареями различной этиологии (аденовирусы, коронавирусы, астровирусы, калицивирусы, вирус Норфолк, энтеровирусы Коксаки и ЕСНО); с гастроинтестинальной формой сальмонеллеза, с гастроэнтеритическим и гастроэнтероколитическим вариантами острой дизентерии, с пищевыми токсикоинфекциями, вызванными условно-патогенными бактериями; с холерой.
Обнаружение специфических антител и нарастание их титра в сыворотке крови больных и переболевших ротавирусным гастроэнтеритом при помощи серологических реакций с целью текущей диагностики на практике в настоящее время широкого распространения не получило и используется в основном для ретроспективного анализа различных эпидемиологических ситуаций.
Методы обнаружения вирусспецифической РНК, которые можно назвать высокочувствительными и специфичными, имеют, однако, ряд недостатков, ограничивающих их практическое применение (необходимость наличия специальной аппаратуры, реактивов, квалифицированного персонала и др.) Наиболее простой метод в этой группе — электрофорез ротавирусной РНК в полиакриламидном геле. Этот метод, позволяющий идентифицировать штаммы вирусов, вызвавшие заболевание, и дать характеристику штаммов, циркулирующих на данной территории, в основном применяется при эпидемиологических исследованиях.
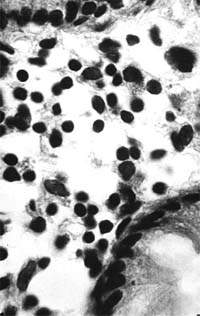 |
| Рисунок 2. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимальное содержание плазматических клеток в собственной пластинке, увеличение в ней числа макрофагов. х 400 |
В клинической практике врач нередко сталкивается с обстоятельствами (сомнительные результаты вирусологических и серологических исследований, случаи микст-инфекций), когда возникает необходимость в применении дополнительных методов для верификации диагноза. С этой целью может быть использован доступный для практического здравоохранения интрументальный метод исследования — ректороманоскопия с аспирационной биопсией слизистой оболочки толстой кишки. При гистологическом, морфометрическом и гистохимическом исследованиях биоптатов при ротавирусном гастроэнтерите выявляются характерные изменения в виде поверхностного минимально выраженного катарального колита с незначительной дистрофией эпителия (рис. 1), снижения числа серотонинсодержащих желудочно-кишечных эндокриноцитов (ЕС-клетки) в эпителиальном пласте кишечных желез, умеренной инфильтрацией собственной пластинки плазматическими клетками и увеличением в ней числа макрофагов (рис. 2). Эти особенности имеют дифференциально-диагностическое значение, поскольку отличаются указанным показателем от других острых кишечных инфекций, что может быть использовано в диагностически сложных случаях.
Здравоохранение в настоящее время не располагает препаратами, обладающими специфическим антиротавирусным действием, поэтому терапия ротавирусного гастроэнтерита является патогенетической. Основные ее цели — борьба с дегидратацией, токсикозом и связанными с ними наиболее часто встречающимися при ротавирусном гастроэнтерите нарушениями функции жизненно важных органов — сердечно-сосудистой системы и органов мочевыделения, степень выраженности которых во многом определяет тяжесть течения заболевания и его прогноз.
Для правильного выбора характера и объема проводимой регидратационной терапии в первую очередь необходимо установить степень дегидратации у того или иного пациента. При эксикозе I — II степени следует ограничиваться пероральной регидратационной терапией (препараты регидрон, глюксолан и др.). При дегидратации III степени целесообразно прибегать к комбинированной парентеральной и пероральной регидратации. Для парентеральной регидратации применяют растворы трисоль, квартасоль, ацесоль и др. С целью дезинтоксикации и улучшения гемодинамики при среднетяжелом и тяжелом течении заболевания показаны коллоидные растворы (гемодез, полиглюкин и др.).
| Для ротавирусной инфекции характерно сочетание гастроэнтерита, интоксикации и симптомов поражения верхних дыхательных путей |
Современными представлениями о патогенезе диарейного синдрома при ротавирусном гастроэнтерите обусловлено и назначение соответствующих средств, способствующих нормализации состояния пищеварительного тракта, а также диеты. Учитывая нарушения активности ряда пищеварительных ферментов, в частности лактазы, рекомендуется исключить в острый период заболевания из пищевого рациона больных молоко и молочные продукты. Кроме того, по этой же причине целесообразно ограничивать и пищу, богатую углеводами. В связи с вышеизложенным, в острый период необходимы энзимные препараты (панзинорм-форте, фестал и др). Кроме того, в остром периоде заболевания могут быть использованы адсорбирующие и вяжущие средства, способствующие ускоренному формированию стула (смекта, карболен и др.) также возможно применение хилака-форте. Высокой частотой дисбактериозов кишечника различной степени выраженности у больных ротавирусным гастроэнтеритом обусловлена необходимость применения в комплексной терапии бактерийных биологических препаратов. Лучшая терапевтическая эффективность при ротавирусном гастроэнтерите отмечена при применении лактосодержащих бактерийных биологических препаратов (ацилакт, лактобактерин и др.), что, по-видимому, связано с заместительным действием бактериальной лактазы, содержащейся в лактобактериях. В последние годы в комплексной терапии ротавирусного гастроэнтерита начал применяться комплексный иммуноглобулиновый препарат (КИП), который разработан и выпускается в МНИИЭМ им. Г. Н. Габричевского. Это первый отечественный иммуноглобулиновый препарат для энтерального применения. КИП характеризуется повышенной концентрацией антител к микроорганизмам, возбудителям острых кишечных инфекций, в том числе ротавирусам, сальмонеллам, шигеллам, эшерихиям и др. Применение КИП в комплексной терапии больных ротавирусным гастроэнтеритом оказывает отчетливый положительный терапевтический эффект, существенно сокращая продолжительность интоксикации и диареи, что открывает новые возможности в лечении этого заболевания.
Литература
1. Букринская А. Г., Грачева Н. М., Васильева В. И. Ротавирусная инфекция. М., 1989.
2. Дроздов С. Г., Покровский В. И., Шекоян Л. А., Машилов В. П. и др. Ротавирусный гастроэнтерит. М., 1982.
3. Новикова А. В. и др. Архив патологии, 1989, №6.
4. Щербаков И. Т. и др. Архив патологии, 2995, №3.
5. Юшук Н. Д., Царегородцев А. Д.. Лекции по инфекционным болезням. М., 1996.
Читайте также:


