Антигены вирусов чем являются
Совершенствование или создание новых вакцин требует знаний структурных и функциональных особенностей вирусных антигенов, различаемых иммунной системой организма.
Вирусными антигенами называются продукты вирусспецифического синтеза, несущие признаки чужеродной генетической информации и вызывающие иммунный ответ. К ним относятся структурные и неструктурные вирусные белки.
Защита от вирусной инфекции зависит от выраженности иммунного ответа на антигены, расположенные на поверхности вирионов или инфицированных клеток. Иммунный ответ на неструктурные вирусные антигены играет меньшую роль в защите от инфекции.
Однако у герпесвирусов, например, клеточный иммунный ответ индуцируется множеством вирусспецифических белков, не входящих в структуру вирионов. Белки герпесвирусов эксперссируются каскадно и большинство нестук-турных белков синтезируется на ранней стадии репликации вируса. После про-цессинга они презентируются МНС классом I (главным комплексом гистосов-местимости, класс I) на плазматической мембране инфицированных клеток и распознаются специфическими цитотоксическими Т-клетками.
Поэтому инфицированные клетки могут различаться эффекторными цитотоксическими Т-лимфоцитами до завершения цикла вирусной репликации.
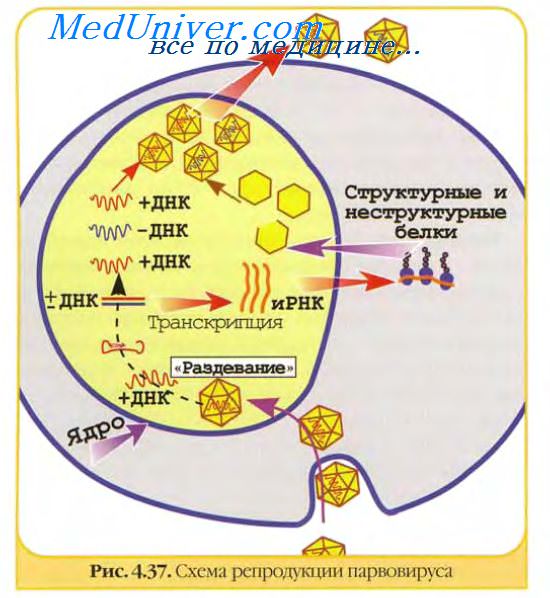
Каждый вирус представляет собой сложную смесь антигенов, определяемую в первую очередь структурными белками. Являясь сложными корпускулярными антигенами вирусы обычно вызывают выраженный иммунный ответ и большая часть их белков способна вызывать синтез специфических антител. Вирусные белки неравнозначны по своей антигенной активности. Наиболее явные и доступные мишени для иммунного ответа — белки, расположенные на поверхности вирусных частиц. Это прежде всего относится к вирусным гликопротеинам, расположенным на поверхности вирусных частиц, и экспрессированным на поверхности зараженных клеток.
Гликопротеины поверхности оболочечных вирусов и капсидные белки безоболочечных вирусов являются главными протективными антигенами.
Под специфичностью вирусного антигена подразумевают его способность избирательно реагировать с антителами или сенсибилизированными лимфоцитами, являющимися ответом на введение данного антигена. Участок антигена, который узнается специфическим лимфоцитом, и с которым впоследствии взаимодействует специфическое антитело, называется антигенной детерминантой.
Иммунологическая специфичность определяется не всей молекулой антигена, а лишь входящими в ее состав антигенными детерминантами (эпитопами). Участки вирусного белка, индуцирующие образование антител и специфически связывающиеся с ними, принято называть антигенными участками (доменами). Антитела соответствующей специфичности образуются к каждой антигенной детерминанте. Антитела к определенной детерминанте реагируют только с ней или с другой очень сходной структурой. Специфичность антигена определяется совокупностью детерминант, а его валентность — количеством однородных антигенных детерминант. Антигенность детерминант зависит от их пространственной структуры и размера молекулы антигена.
Антигенные детерминанты состоят обычно из 10—20 аминокислотных остатков и содержат гидрофильные группы. Наиболее гидрофильными аминокислотами являются лизин, аргинин, аспарагиновая кислота и глютаминовая кислота. Считается, что те участки молекулы белка, в которых их содержание относительно велико, предпочитают водное окружение и поэтому располагаются на поверхности. Различают линейные (непрерывные) и конформационные (прерывистые) детерминанты. Антитела образуются преимущественно к конформационным детерминантам, расположенным, как правило, на поверхности вирионов, и зависят от третичной структуры молекулы антигена.
Антигенная и иммуногенная активность вирусов определяется, главным образом, конформационными эпитопами. Разные антитела различают специфические антигенные участки вирусных антигенов. Например, прикрепительный гликопротеин (HN) вируса парагриппа имеет, по крайней мере, 6 антигенных сайтов, три из которых различаются нейтрализующими антителами.
Денатурация белков приводит к потере некоторых конформационных детерминант, обнажая ранее экранированные детерминанты. В результате денатурации белки частично или полностью изменяют антигенную специфичность, что может отразиться на иммунном ответе.
Вирионные белки разных вирусов различаются типоспецифичностью и вариабельностью. Одни из них обладают высокой вариабельностью, другие характеризуются консервативностью. Группоспецифические антигены являются высококонсервтивными, находятся обычно внутри вирионов и могут быть сходными у нескольких представителей рода данного семейства вирусов. Например, субвирусные частицы 12S вируса ящура содержат высококонсервативный белок, который выявляется моноклональными антителами одной специфичности у шести из семи известных типов вируса. Однако иммунизация ими не сопровождалась образованием ВН-антител.
Типоспецифические антигены связаны с вариабельными областями белков, обычно расположенными в наружных частях вирионов, и обладают узкой специфичностью, присущей одной группе вирусов.
В структуре вирусной частицы различают несколько групп антигенов: ядерные (или коровые), капсидные (или оболочечные) и суперкапсидные. На поверхности некоторых вирусных частиц встречаются особые V-антигены — гемагглютинин и фермент нейраминидаза. Антигены вирусов различаются по происхождению. Часть из них — вирусоспецифические. Информация об их строении картирована в нуклеиновой кислоте вируса. Другие антигены вирусов являются компонентами клетки хозяина (углеводы, липиды),] они захватываются во внешнюю оболочку вируса при его рождении путем почкования.
Антигенный состав вириона зависит от строения самой вирусной частицы. Антигенная специфичность простоорганизованных вирусов связана с рибо- и дезоксирибонуклеопротеинами. Эти вещества хорошо растворяются I в воде и поэтому обозначаются как S-антигены (от лат. solutio — раствор). У сложноорга- низованных вирусов часть антигена связанаснуклеокапсидом, а другая — локализуется во внешней оболочке — суперкапсиде.
Антигены многих вирусов отличаются высокой степенью изменчивости. Это связано с постоянным мутационным процессом, который претерпевает генетический аппарат вирусной частицы. Примером могут служить вирус гриппа, вирусы иммунодефицитов человека.
60. Учение об иммунитете. Определение и сущность понятия "иммунитет". Основные формы иммунного ответа.
Иммунитет – это способ защиты организма от генетически чужеродных веществ – антигенов экзогенного и эндогенного происхождения, направленный на поддержание и сохранение гомеостаза, структурной и функциональной целостности организма, биологической (антигенной) индивидуальности каждого организма и вида в целом.
Виды иммунного ответа
Иммунный ответ представляет собой реакцию организма на внедрение в него микробов или различных ядов. В целом, любое вещество, чья структура отличается от структуры тканей человека способно вызвать иммунный ответ. Исходя из механизмов, задействованных в его реализации, иммунный ответ может быть различным.
Во-первых, различаем специфический и неспецифический иммунный ответ.
Неспецифический иммунный ответ - это первый этап борьбы с инфекцией он запускается сразу же после попадания микроба в наш организм. В его реализации задействованы система комплимента, лизоцим, тканевые макрофаги. Неспецифический иммунный ответ практически одинаков для всех типов микробов и подразумевает первичное разрушение микроба и формирование очага воспаления. Воспалительная реакция это универсальный защитный процесс, который направлен на предотвращение распространения микроба. Неспецифический иммунитет определяет общую сопротивляемость организма. Люди с ослабленным иммунитетом чаще болеют различными заболеваниями.
Специфический иммунитет это вторая фаза защитной реакции организма. Основной характеристикой специфического иммунного ответа является распознавание микроба и выработка факторов защиты направленных специально против него. Процессы неспецифического и специфического иммунного ответа пересекаются и во многом дополняют друг друга. Во время неспецифического иммунного ответа часть микробов разрушается, а их части выставляются на поверхности клеток (например, макрофагов). Во второй фазе иммунного ответа клетки иммунной системы (лимфоциты) распознают части микробов, выставленные на мембране других клеток, и запускают специфический иммунный ответ как таковой.
Специфический иммунный ответ может быть двух типов: клеточный и гуморальный.
Клеточный иммунный ответ подразумевает формирование клона лимфоцитов (К-лимфоциты, цитотоксические лимфоциты), способных разрушать клетки мишени, мембраны которых содержат чужеродные материалы (например, вирусные белки).
Клеточный иммунитет задействован в ликвидации вирусной инфекции, а также таких типов бактериальных инфекций как туберкулез, проказа, риносклерома. Раковые клетки тоже разрушаются активированными лимфоцитами.
Гуморальный иммунный ответ опосредован В-лимфоцитами, которые после распознания микроба начинают активно синтезировать антитела по принципу один тип антигена – один тип антитела. На поверхности одного микроба может быть множество различных антигенов, поэтому обычно вырабатывается целая серия антител, каждое из которых при этом направлено на определенный антиген. Антитела (иммуноглобулины, Ig) – это молекулы белков, способные прилипать к определенной структуре микроорганизма, вызывая его разрушение или скорейшее выведение из организма. Теоретически возможно формирование антител против любого химического вещества, имеющего достаточно большую молекулярную массу. Существует несколько типов иммуноглобулинов, каждый из которых выполняет специфическую функцию. Иммуноглобулины типа А (IgA) синтезируются клетками иммунной системы и выводятся на поверхность кожи и слизистых оболочек. В больших количествах IgA содержатся во всех физиологических жидкостях (слюна, молоко, моча). Иммуноглобулины типа А обеспечивают местный иммунитет, препятствуя проникновению микробов через покровы тела и слизистые оболочки.
Для характеристики микроорганизмов выделяют родовую, видовую, групповую и типовую специфичность антигенов. Наиболее точная дифференциация осуществляется с использованием моноклональных антител (МКА), распознающих только одну антигенную детерминанту.
Обладая сложным химическим строением, бактериальная клетка представляет целый комплекс антигенов. Антигенными свойствами обладают жгутики, капсула, клеточная стенка, цитоплазматическая мембрана, рибосомы и другие компоненты цитоплазмы, токсины, ферменты. Основными видами бактериальных антигенов являются:
- соматические или О- антигены (у грамотрицательных бактерий специфичность определяется дезоксисахарами полисахаридов ЛПС);
- жгутиковые или Н- антигены (белковые);
- поверхностные или капсульные К- антигены.
Выделяют протективные антигены, обеспечивающие защиту (протекцию) против соответствующих инфекций, что используется для создания вакцин.
Любой микроорганизм (бактерии, грибы, вирусы) представляет собой комплекс антигенов.
По специфичности микробные антигены делятся на:
· перекрестно-реагирующие (гетероантигены) - это антигены общие с антигенами тканей и органов человека. Они имеются у многих микроорганизмов и рассматриваются как важный фактор вирулентности и пусковой механизм развития аутоиммунных процессов;
· группоспецифические - общие у микроорганизмов одного рода или семейства;
· видоспецифические - общие у разных штаммов одного вида микроорганизмов;
· вариантспецифические (типоспецифические) - встречаются у отдельных штаммов внутри вида микроорганизмов. По наличию тех или иных вариантспецифических антигенов микроорганизмы внутри вида делят на варианты по антигенному строению - серовары.
По локализации антигены бактерий делятся на:
· целлюлярные (связанные с клеткой),
· экстрацеллюлярные (не связанные с клеткой).
Среди целлюлярных антигенов основными являются: соматический - О-антиген (глюцидо-липоидо-полипепдидный комплекс), жгутиковый - Н-антиген (белок), поверхностные - капсульные - К-антиген, Vi-антиген. Экстрацеллюлярные антигены - это продукты, секретируемые бактериями во внешнюю среду, в том числе антигены экзотоксинов, ферментов агрессии и защиты, и другие.
Антигены вирусов
В структуре вирусной частицы различают несколько групп антигенов:
· ядерные (или коровые)
· капсидные (или оболочечные)
На поверхности некоторых вирусных частиц встречаются особые V-антигены- гемагглютинин и фермент нейраминидаза.
Антигены вирусов различаются по происхождению. Часть из них – вирусоспецифические. Информация об их строении картирована в нуклеиновой кислоте вируса. Другие антигены вирусов являются компонентами клетки хозяина (углеводы, липиды), они захватываются во внешнюю оболочку вируса при его рождении путем почкования.
Антигенный состав вириона зависит от строения самой вирусной частицы. Антигенная специфичность простоорганизованныхвирусов связана с рибо- и дезоксирибонуклеопротеинами. Эти вещества хорошо растворяются в воде и поэтому обозначаются как S-антигены ( от лат. Solution- раствор). У сложноорганизованных вирусов часть антигена связана с нуклеокапсидом, а другая – локализуется во внешней оболочке – суперкапсиде. Антигены многих вирусов отличаются высокой степенью изменчивости. Это связано с постоянным мутационным процессом, который претерпевает генетический аппарат вирусной частицы. Примером могут служить вирус гриппа, вирысы иммунодефицитов человека.
14. Антигены гистосовместимости. На цитоплазматических мембранах практически всех клеток макроорганизма обнаруживаются антигены гистосовместимости. Большая часть из них относится к системе главного комплекса гистосовместимости, или МНС (аббр. от англ. Major histocompatibility complex).
По химической природе антигены гистосовместимости представляют собой гликопротеиды, прочно связанные с цитоплазматической мембраной клеток. Их отдельные фрагменты имеют структурную гомологию с молекулами иммуноглобулинов и поэтому относятся к единому суперсемейству.
Различают два основных класса молекул МНС. Условно принято, что МНС I класса индуцирует преимущественно клеточный иммунный ответ, а МНС II класса – гуморальный.
МНС I класса состоит из двух нековалентно связанных полипептидных цепей с разной молекулярной массой: тяжелой альфа-цепи и легкой бета-цепи. Альфа-цепь имеет внеклеточный участок с доменным строением (альфа1,альфа2,альфа3-домены), трансмембранный и цитоплазматический.
Для МНС I класса характерна высокая скорость биосинтеза – процесс завершается за 6 часов. Этот комплекс экспрессируется на поверхности практически всех клеток, кроме эритроцитов и клеток ворсинчатого трофобласта. Плотность МНС I класса достигает 7000 молекул на клетку, и они покрывают около 1% ее поверхности.
У человека МНС обозначили как HLA(аббр. от англ. Human Leukocyte Antigen), так как он ассоциирован с лейкоцитами.
В настоящее время у человека различают более 200 различных вариантов HLA I класса. Они кодируются генами, картированными в трех основных сублокусах 6-й хромосомы и наследуются и проявляются независимо: HLA-A, HLA-B, HLA-C. Локус А объединяет более 60 вариантов, В-130, а С- около 40.
АГ-это любые генетич.чужеродные для данного орг-ма в-ва, которые, попав во внутр. среду, выаывают ответную специфическую иммунологическую реакцию: синтез антител, появление сенсибилизированных лимфоцитов или возникновение толерантности к этому веществу, гиперчувствительности немедленного и замедленного типов иммунологической памяти. Антитела, вырабатываемые в ответ на введение антигена, специфически взаимодействуют с этим антигеном, образуя комплекс антиген антитело.
Антигены, вызывающие полноценный иммунный ответ, называются полными антигенами. Эго органические вещества микробного, растительного и животного происхождения. Химические элементы, простые и сложные неорганические соединения антигенностью не обладают.
Антигенами являются также бактерии, грибы, простейшие, вирусы, клетки и ткани животных, попавшие во внутреннюю среду макроорганизма, а также клеточные стенки, цитоплазма` тические мембраны, рибосомы, митохондрии, микробные токсины, экстракты гельминтов, яды многих змей и пчел, природные белковые вещества, некоторые полисахаридные вещества микробного происхождения, растительные токсины и т.д.
Некоторые вещества самостоятельно не вызывают иммунного ответа, но приобретают эту способность при конъюгации с вьгсокомолекулярными белковыми носителями или в смеси с ними. Такие вещества называют неполными антигенами, или гаптенами. Гаптенами могут быть химические вещества с малой молекулярной массой или более сложные химические вещества, не обладающие свойствами полного антигена: некоторые бактериальные полисахариды, полипептид туберкулезной палочки (РРД), ДНК, РНК, липиды, пептиды. Гаптен является частью полного или конъюгированного антигена. Гаптены иммунного ответа не ВЫзывают, но они вступают в реакцию с сыворотками, содержащими специфические к ним антитела.
Характерными свойствами антигенов являются антигенность, иммуногенность и специфичность.
Антигенность — это потенциальная способность молекулы антигена активировать компоненты иммунной системы и специфически взаимодействовать с факторами иммунитета (антитела, клонэффекторных лимфоцитов). При этом компоненты иммунной системы взаимодействуют не со всей молекулой антигена, а только с ее небольшим участком, который получил название антигенной детерминанты, или эпитопа. Иммуногеннос/пь — потенциальная способность антигена вызывать по отношению к себе в макроорганизме специфический продуктивный ответ. Специфичностью называют способность антигена индуцировать
иммунный ответ к строго определенному эпитопу. Специфичность
антигена во многом определяется свойствами составляющих его эпитопов.
В структуре бактериальной клетки различают жгутиковые, соматические, капсульные и некоторые другие антигены (рис. 10.2).
Жгутиковые, или Н-антигены, локализуются в их жгутиках и пред-
ставляют собой эпитопы сократительного белка флагеллина. При
нагревании флагеллин денатурирует и Н-антиген теряет свою
специфичность. Фенол не действует на этот антиген.
Соматический, или О-антиген, связан с клеточной стенкой бактерий. Его основу составляют липополисахариды. О-антиген термостабилен и не разрушается при длительном кипячении.
Капсульные, или К-антигены, встречаются у бактерий, образующих капсулу. Как правило, К-антигены состоят из кислых полисахаридов (уроновые кислоты).

В структуре вирусной частицы различают ядерные (или коро-
вые), капсидные (или оболочечные) и суперкапсидные антигены.
На поверхности некоторых вирусных частиц встречаются особые
V-антигены — гемагглютинин и фермент нейраминидаза. Часть из них вирусоспецифические, кодируются в нуклеиновой кислоте вируса.
Другие, являющиеся компонентами клетки хозяина (углеводы, ли-
пиды), формируют суперкапсид вируса при его рождении путем
Антигенный состав вириона зависит от строения самой вирус-
ной частицы. В просто организованных вирусах антигены ассоци-
ированы с нуклеопротеидами. Эти вещества хорошо растворяются
в воде и поэтому обозначаются как S-антигены (от лат. solutio —
раствор). У сложноорганизованных вирусов часть антигенов свя-
зана с нуклеокапсидом, а другая находится во внешней оболочке,
Антигены многих вирусов отличаются высокой степенью из-
менчивости, что связано с постоянными мутациями в генетиче-
ском материале вирусов. Примером могут служить вирус гриппа,
Антигены групп крови человека
Антигены групп крови человека располагаются на цитоплаз-
матической мембране клеток, но наиболее легко определяются
на поверхности эритроцитов. Поэтому они получили название
≪эришроцитарные антигены≫. На сегодняшний день известно бо-
лее 250 различных эритроцитарных антигенов. Однако наиболее
важное клиническое значение имеют антигены системы АВО и Rh
(резус-фактор): их необходимо учитывать при проведении пере-
ливания крови, пересадке органов и тканей, предупреждении и
лечении иммуноконфликтных осложнений беременности и т.д.
На цитоплазматических мембранах практически всех клеток
макроорганизма обнаруживаются антигены гистосовместимости.
Большая часть из них относится к системе главного комплекса
гистосовместимости, или МНС (от англ. Main Hystocompatibility
Complex). Установлено, что антигены гистосовместимости играют
ключевую роль в осуществлении специфического распознавания
≪свой—чужой≫ и индукции приобретенного иммунного ответа,
определяют совместимость органов и тканей при транспланта-
ции в пределах одного вида и другие эффекты.
В 1948—1949 гг. видный отечественный микробиолог и имму-
нолог Л.А. Зильбер при разработке вирусной теории рака доказал
наличие антигена, специфичного для опухолевой ткани. Позже в
60-х годах XX века Г.И. Абелев (в опытах на мышах) и Ю.С. Тата-
ринов (при обследовании людей) обнаружили в сыворотке крови
больных первичным раком печени эмбриональный вариант сыво-
роточного альбумина — а-фетопротеин. К настоящему моменту
обнаружено и охарактеризовано множество опухольассоциирован-
ных антигенов. Однако не все опухоли содержат специфические
маркерные антигены, равно как и не все маркеры обладают стро-
гой тканевой специфичностью.
Опухольассоциированные антигены классифицируют по лока-
лизации и генезу. Различают сывороточные, секретируемые опухо-
левыми клетками в межклеточную среду, и мембранные. Последние
получили название опухолеспецифических трансплантационных ан-
тигенов, или TSTA (от англ. Tumor-Specific Transplantation Antigen).
Выделяют также вирусные, эмбриональные, нормальные гипер-
экспрессируемые и мутантные опухольассоциированные антиге-
ны. Вирусные — являются продуктами онковирусов, эмбриональные
в норме синтезируются в зародышевом периоде. Хорошо известен
а-фетопротеин (эмбриональный альбумин), нормальный протеин
тестикул
железы и др. Хорионичсский гонадотропин, в норме синтезируе-
мый в плаценте, обнаруживается при хориокарциноме и других
опухолях. В меланоме в большом количестве синтезируется нор-
мальный фермент тирозиназа. Из мутантных белков следует от-
метить протеин Ras — ГТФ-связывающий белок, участвующий в
трансмембранном проведении сигнала. Маркерами рака молочной
и поджелудочной желез, карцином кишечника являются модифи-
цированные муцины (MUC 1, 2 и др.).
В большинстве случаев опухольассоциированные антигены
представляют собой продукты экспрессии генов, в норме вклю-
чаемых в эмбриональном периоде. Они являются слабыми имму-
ногенами, хотя в отдельных случаях могут индуцировать реакцию
цитотоксических Т-лимфоцитов (Т-киллеров) и распознаваться в
составе молекул МНС (HLA) I класса. Синтезируемые к опухоль-
ассоциированным антигенам специфические антитела не угнетают
11. Практическое использование антигенов в медицине: вакцины, диагностикумы, аллергены. Получение, назначение.
Вакцинами называют иммунобиологические препараты, предназ_ наченные для создания активного специфического иммунитета Применяют их главным образом для профилактики, но иногда используют для лечения инфекционных болезней. Действующим началом вакцины является специфический антиген. В качестве антигена ИСПОЛЬЗУЮт
1) живые или инактивированныс микроорганй’змы (бактерии, вирусы);
2) вьщеленные из микроорганизмов специфические, так называемые протективные, антигены;
3) образуемые микроорганизмами антигенные вещества (вторичные метаболиты), играющие роль в патогенезе болезни (токсины);
4) химически синтезированные антигены, аналогичные природным;
5) антигены, полученные с помощью метода генетической инженерии.
На основе одного из этих антигенов конструируют вакцину, которая может в зависимости от природы антигена и формы препарата включать консервант, стабилизатор и активатор (адъювант). В качестве консервантов применяют мертиолат (1:10 000), азид натрия, формальдегид (О,1-О,3 %) с целью подавления посторонней микрофлоры в процессе хранения препарата. Стабилизатор добавляют для предохранения от разрушения лабильных антигенов. Например, к живым вакцинам добавляют сахарозожелатиновый агар или человеческий альбумин. Для повышения эффекта действия антигена к вакцине иногда добавляют неспецифический стимулятор-адъювант, активирующий иммунную систему. В качестве адъювантов используют минеральные коллоиды (Аl(ОН)3‚ АlРО4‘)‚ полимерные вещества (липополисахаридьх, полисахарицы, синтетические полимеры). Они изменяют физикохимическое состояние антигена, создают депо антигена на мес
Живые вакцины
2)дивергентные;
3)векторные рекомбинантные.
Неживые вакцины:
1)МОЛеКУлярные:
полученные путем биосинтеза;
полученные путем химического синтеза;
полученные методом генетической инженерии;
цельноклеточные, цельновирионные;
субклетОчные, субвирионные;
синтетические, полусинтетические.
Ассциированные “
Живыеаттенуированные вакцины конструируются на основе ослабленных штаммов микроорганизмов, потерявших вирулентность, но сохранивших антигенные свойства. Такие штаммы получают методами селекции или генетической инженерии. Иногда используют штаммы близкородственных в антигенном отношении, неболезнетворных для человека микроорганизмов (дивергентные штаммы), из которых получены дивергентные вакцины. Например, для прививки против оспы используют вирус оспы коров. Живые вакцины при введении в организм приживляются, размножаются, вызывают генерализованный вакцинальный процесс и формирование специфического иммунитета к патогенному микроорганизму, из которого получен аттенуированный штамм.
Получают живые вакцины путем выращивания аттенуированных шТаммов на питательных средах, оптимальных для данного микроорганизма. Бактериальные штаммы культивируют или в ферментерах на жидких питательных средах, или на твердых питательных средах; вирусные штаммы культивируют в куриных эмбрионах, первичнотрипсинизированных, перевиваемых культурах клеток Процесс ведут в асептических условиях.
Наиболее важные вакцины: бактериальные: туберкулезная(БЦЖ), чумная, туляремийная, сибиреязвенная, против ку-лихорадкики. Вирусные: оспенная(на основе вир. оСпы коров), коревая, полиомиелитная, против желтой лихорадки, гриппозная, паротитная.
Сущ-ют векторные рекомбинантные вакцины, которые получают методом генной инженерии. В геном вакцинного штамма встраивают ген чужеродного АГ. Пр: вирус оспенной вакцины с встроенным АГ вируса гепатита Б. Таким образом, вырабатывается иммунитет на 2 вируса.
Неживые
Корпускулярные– инактивированные физическими или хим. Способами культуры бактерий или вирусов. Инактивацию проводят в оптимальном режиме, чтобы штамм сохранил свою антигенность, но лишился жизнеспомобности. Их применяют для проф-ки коклюша, гриппа, гепатита А, клещевого энцефалита.
Субклеточные и субвирионные состоят из АГ комплексов, выделенных из бакткрий и вирусов после их разрушения. Примеры: против брюшного тифа(на основе О, Н и Vi - антигенов),сиб.язвы(на основе капсульного АГ)
Молекулярные это специфические АГ в молекулярной форме, полученные методом ген.инженерии, хим.и био.синтеза. примером может служить анатоксин – токсин, сохраняющий антигенные св-ва, но теряющий токсичность вследствие обезвреживания его формалином.
Примеры: столбнячный, ботулиновый, дифтерийный анатоксины.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.


Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
1) суперкапсидные антигены – поверхностные оболочечные;
2) белковые и гликопротеидные антигены;
3) капсидные – оболочечные;
4) нуклеопротеидные (сердцевинные) антигены.
Все вирусные антигены Т-зависимые.
Под специфичностью вирусного антигенаподразумевают его способность избирательно реагировать с антителами или сенсибилизированными лимфоцитами, являющимися ответом на введение данного антигена.
Вирионные белки разных вирусов различаются типоспецифичностью и вариабельностью. Одни из них обладают высокой вариабельностью, другие характеризуются консервативностью.
26.Основные клетки иммунной системы: антигенопредставляющие клетки (АПК), Т- и В-лимфоциты, их субпопуляции (Т-хелперы 1, 2(CD4+); Т-киллеры (CD8+), В1(CD5+),В2(CD5-), В-киллеры, клетки иммунологической памяти и др.). Рецепторы (антигеноспецифические, Fc-, С3- и др.) и СD-маркеры.
К клеткам иммунной системы относят лимфоциты, макрофаги и другие антиген- представляющие клетки (А- клетки, от англ. accessory- вспомогательный), а также так называемую третью популяцию клеток (т.е. клеток, не имеющих основных поверхностных маркеров Т- и В- лимфоцитов, А- клеток).
По функциональным свойствам все иммунокомпетентные клетки разделяют на эффекторные и регуляторные. Взаимодействие клеток в иммунном ответе осуществляется с помощью гуморальных медиаторов - цитокинов. Основные клетки иммунной системы- Т- и В- лимфоциты.
Лимфоциты имеют общую морфологическую характеристику, однако их функции, поверхностные CD ( от claster differenciation) маркеры, индивидуальное (клональное) происхождение, различны.
По наличию поверхностных CD маркеров лимфоциты разделяют на функционально различные популяции и субпопуляции, прежде всего на Т-(тимусзависимые, прошедшие первичную дифференцировку в тимусе) лимфоциты и В -(bursa- зависимые, прошедшие созревание в сумке Фабрициуса у птиц или его аналогах у млекопитающих) лимфоциты.
Т- лимфоциты.
Т- лимфоциты распознают процессированный и представленный на поверхности антиген- представляющих (А) клеток антиген. Они отвечают за клеточный иммунитет, иммунные реакции клеточного типа. Отдельные субпопуляции помогают В- лимфоцитам реагировать на Т- зависимые антигены выработкой антител.
При дифференцировке Т- лимфоциты приобретают определенный набор мембранных CD- маркеров. Т-клетки разделяют на субпопуляции в соответствии с их функцией и профилем CD- маркеров.
Выделяют три основные группы Т- лимфоцитов- помощники (активаторы), эффекторы, регуляторы.
Первая группа- помощники (активаторы), в состав которых входят Т- хелперы1, Т- хелперы2, индукторы Т- хелперов, индукторы Т- супрессоров.
1. Т- хелперы1 несут рецепторы CD4 (как и Т- хелперы2) и CD44, отвечают за созревание Т- цитотоксических лимфоцитов (Т- киллеров), активируют Т- хелперы2 и цитотоксическую функцию макрофагов, секретируют ИЛ-2, ИЛ-3 и другие цитокины.
2. Т- хелперы2 имеют общий для хелперов CD4 и специфический CD28 рецепторы, обеспечивают пролиферацию и дифференцировку В- лимфоцитов в антителпродуцирующие (плазматические) клетки, синтез антител, тормозят функцию Т- хелперов1, секретируют ИЛ-4, ИЛ-5 и ИЛ-6.
3. Индукторы Т- хелперов несут CD29, отвечают за экспрессию антигенов HLA класса 2 на макрофагах и других А- клетках.
4. Индукторы Т- супрессоров несут CD45 специфический рецептор, отвечают за секрецию ИЛ-1 макрофагами, активацию дифференцировки предшественников Т- супрессоров.
Вторая группа- Т- эффекторы.
5. Т- цитотоксические лимфоциты (Т- киллеры). Имеют специфический рецептор CD8, лизируют клетки- мишени, несущие чужеродные антигены или измененные аутоантигены (трансплантант, опухоль, вирус и др.). ЦТЛ распознают чужеродный эпитоп вирусного или опухолевого антигена в комплексе с молекулой класса 1 HLA в плазматической мембране клетки- мишени.
Третья группа- Т-клетки- регуляторы. Представлена двумя основными субпопуляциями.
6. Т- супрессоры имеют важное значение в регуляции иммунитета, обеспечивая подавление функций Т- хелперов 1 и 2, В- лимфоцитов. Имеют рецепторы CD11, CD8. Группа функционально разнородна. Их активация происходит в результате непосредственной стимуляции антигеном без существенного участия главной системы гистосовместимости.
7. Т- контсупрессоры. Не имеют CD4, CD8, имеют рецептор к особому лейкину. Способствуют подавлению функций Т- супрессоров, вырабатывают резистентность Т- хелперов к эффекту Т- супрессоров.
В- лимфоциты.
Существует несколько подтипов В- лимфоцитов. Основная функция В- клеток- эффекторное участие в гуморальных иммунных реакциях, дифференциация в результате антигенной стимуляции в плазматические клетки, продуцирующие антитела. Образование В- клеток у плода происходит в печени, в дальнейшем- в костном мозге. Процесс созревания В- клеток осуществляется в две стадии- антиген - независимую и антиген - зависимую.
Антиген -независимая фаза. В- лимфоцит в процессе созревания проходит стадию пре- В- лимфоцита- активно пролиферирующей клетки, имеющей цитоплазменные H- цепи типа C мю (т.е. IgM). Следующая стадия- незрелый В- лимфоцит характеризуется появлением мембранного (рецепторного) IgM на поверхности. Конечная стадия антигеннезависимой дифференцировки- образование зрелого В- лимфоцита, который может иметь два мембранных рецептора с одинаковой антигенной специфичностью (изотипа) - IgM и IgG. Зрелые В- лимфоциты покидают костный мозг и заселяют селезенку, лимфоузлы и другие скопления лимфоидной ткани, где их развитие задерживается до встречи со “своим” антигеном, т.е. до осуществления антиген- зависимой дифференцировки.
Антиген- зависимая дифференцировка включает активацию, пролиферацию и дифференцировку В- клеток в плазматические клетки и В- клетки памяти. Активация осуществляется различными путями, что зависит от свойств антигенов и участия других клеток ( макрофагов, Т- хелперов). Большинство антигенов, индуцирующих синтез антител, для индукции иммунного ответа требуют участия Т- клеток- тимус- зависимые пнтигены. Тимус- независимые антигены (ЛПС, высокомолекулярные синтетические полимеры) способны стимулировать синтез антител без помощи Т- лимфоцитов.
В- лимфоцит с помощью своих иммуноглобулиновых рецепторов распознает и связывает антиген. Одновременно с В- клеткой антиген по представлению макрофага распознается Т- хелпером (Т- хелпером 2), который активируется и начинает синтезировать факторы роста и дифференцировки. Активированный этими факторами В- лимфоцит претерпевает ряд делений и одновременно дифференцируется в плазматические клетки, продуцирующие антитела.
Пути активации В- клеток и кооперации клеток в иммунном ответе на различные антигены и с участием популяций имеющих и не имеющих антиген Lyb5 популяций В- клеток отличаются. Активация В- лимфоцитов может осуществляться:
- Т- зависимым антигеном при участии белков МНС класса 2 Т- хелпера;
- Т- независимым антигеном, имеющим в составе митогенные компоненты;
- поликлональным активатором (ЛПС);
- анти- мю иммуноглобулинами;
- Т- независимым антигеном, не имеющим митогенного компонента.
Кооперация клеток в иммунном ответе.
В формировании иммунного ответа включаются все звенья иммунной системы- системы макрофагов, Т- и В- лимфоцитов, комплемента, интерферонов и главная система гистосовместимости.
В кратком виде можно выделить следующие этапы.
1. Поглощение и процессинг антигена макрофагом.
2. Представление процессированного антигена макрофагом с помощью белка главной системы гистосовместимости класса 2 Т- хелперам.
3. Узнавание антигена Т- хелперами и их активация.
4. Узнавание антигена и активация В- лимфоцитов.
5. Дифференциация В- лимфоцитов в плазматические клетки, синтез антител.
6. Взаимодействие антител с антигеном, активация систем комплемента и макрофагов, интерферонов.
7. Представление при участии белков МНС класса 1 чужеродных антигенов Т- киллерам, разрушение инфицированных чужеродными антигенами клеток Т- киллерами.
8. Индукция Т- и В- клеток иммунной памяти, способных специфически распознавать антиген и участвовать во вторичном иммунном ответе ( антигенстимулированные лимфоциты).
Антитела, классы иммуноглобулинов, структурные и функциональные особенности. Активные центры иммуноглобулинов, их функция. Неполные антитела, аутоантитела, лизины, опсонины, агглютинины, преципитины, антитоксины и др.
В ответ на введение антигена иммунная система вырабатывает антитела — белки, способные специфически соединяться с антигеном, вызвавшим их образование, и таким образом участвовать в иммунологических реакциях. Относятся антитела к γ-глобулинам. В организме γ-глобулины вырабатываются особыми клетками — плазмоцитами. γ-глобулины, несущие функции антител, получили название иммуноглобулинов и обозначаются символом Ig. Следовательно, антитела — это иммуноглобулины, вырабатываемые в ответ на введение антигена и способные специфически взаимодействовать с этим же антигеном.
Функции.Первичная функция состоит во взаимодействии их активных центров с комплементарными им детерминантами антигенов. Вторичная функция состоит в их способности:
• связывать антиген с целью его нейтрализации и элиминации из организма, т. е. принимать участие в формировании защиты от антигена;
• обеспечивать кооперацию иммунокомпетентных клеток (макрофагов, Т- и В-лимфоцитов);
• участвовать в различных формах иммунного ответа (фагоцитоз, киллерная функция, ГНТ, ГЗТ, иммунологическая толерантность, иммунологическая память).
Структура антител.Белки иммуноглобулинов по химическому составу относятся к гликопротеидам, так как состоят из протеина и сахаров. Иммуноглобулины по структуре, антигенным и иммунобиологическим свойствам разделяются на пять классов: IgM, IgG, IgA, IgE, IgD.
Иммуноглобулин класса G. Изотип G составляет основную массу Ig сыворотки крови. Легко проходит через плацентарный барьер и обеспечивает гуморальный иммунитет новорожденного в первые 3—4 месяца жизни. Способен также выделяться в секрет слизистых, в том числе в молоко путем диффузии.
IgG обеспечивает нейтрализацию, опсонизацию и маркирование антигена, осуществляет запуск комплемент-опосредованного цитолиза и антителозависимой клеточно-опосредованной цитотоксичности.
Иммуноглобулин класса М.Наиболее крупная молекула из всех Ig.
Синтезируется предшественниками и зрелыми В-лимфоцитами. Образуется в начале первичного иммунного ответа, также первым начинает синтезироваться в организме новорожденного — определяется уже на 20-й неделе внутриутробного развития. IgM обеспечивает нейтрализацию, опсонизацию и маркирование антигена, осуществляет запуск комплемент-опосредованного цитолиза и антителозависимой клеточно-опосредованной цитотоксичности.
Иммуноглобулин класса А.Существует в сывороточной и секреторной формах. Около 60 % всех IgA содержится в секретах слизистых.
Секреторная форма IgA— основной фактор специфического гуморального местного иммунитета слизистых оболочек желудочно-кишечного тракта, мочеполовой системы и респираторного тракта. Он препятствует адгезии микробов на эпителиальных клетках и генерализации инфекции в пределах слизистых.
Иммуноглобулин класса Е.Называют также реагином. Содержание в сыворотке крови крайне невысоко — примерно 0,00025 г/л. Не связывает комплемент. Не проходит через плацентарный барьер. Обладает выраженной цитофильностью — тропностью к тучным клеткам и базофилам. Участвует в развитии гиперчувствительности немедленного типа — реакция I типа.
Различают полные, или преципитирующие, антитела, которые при взаимодействии с антигеном дают видимые иммунологические реакции (агглютинации, преципитации и др.), и неполные, непреципитирующие, или блокирующие антитела, не дающие видимых реакций при соединении с антигеном.
По характеру действия на микроорганизмы антитела могут быть антимикробные, антитоксические, антиклеточные.Антимикробные антитела могут склеивать микробы — агглютинины, осаждать белковые молекулы или частички микробов — преципитины, растворять бактерии — лизины, убивать бактерии без заметного изменения их формы — бактерицидные антитела. Антитела, усиливающие фагоцитоз, называют опсонинами, или бактериотропинами. Существуют также вирус-нейтрализующие антитела и иммобилизующие антитела, обездвиживающие спирохет. Антитоксические антитела обезвреживают экзотоксины бактерий. Антиклеточные антитела дифференцируют на гемагглютинины (склеивают эритроциты), гемолизины (растворяют, лизируют эритроциты) и цитотоксины (умерщвляют клетки животных). Аутоантитела вырабатываются организмом против собственных белков и клеток тканей и органов при изменении химической структуры последних или при освобождении антигенов из разрушившихся органов и тканей.
Преципитинами называются антитела, вызывающие при контакте со специфическим антигеном образование мелкого осадка (преципитат).
Защитная роль антител в приобретенном иммунитете: участие антител в реакциях гиперчувствительности немедленного типа (ГНТ), комплементзависимый цитолиз, иммунный фагоцитоз, антителозависимая клеточная цитотоксичность и др.
Реакции гиперчувствительности могут быть классифицированы на основе иммунологических механизмов, их вызывающих.
При реакциях гиперчувствительности I типа иммунный ответ сопровождается высвобождением вазоактивных и спазмогенных веществ, которые действуют на сосуды и гладкие мышцы, нарушая таким образом их функции.
При реакциях гиперчувствительности II типа гуморальные антитела непосредственно участвуют в повреждении клеток, делая их восприимчивыми к фагоцитозу или лизису.
При реакциях гиперчувствительности III типа (иммунокомплексных болезнях) гуморальные антитела связывают антигены и активируют комплемент. Фракции комплемента затем привлекают нейтрофилы, которые вызывают повреждение ткани.
При реакциях гиперчувствительности IV типа возникает повреждение ткани, причиной которого является патогенный эффект сенсибилизированных лимфоцитов.
При реакциях гиперчувствительности II типа в организме появляются антитела, которые направлены против антигенов, расположенных на поверхности клеток или других компонентов тканей. Антигенные детерминанты могут быть связаны с клеточной мембраной или представляют собой экзогенный антиген, адсорбированный на поверхности клеток. В любом случае реакция гиперчувствительности возникает как следствие связывания антител с нормальными или поврежденными антигенами на поверхности клетки. Описаны три антителозависимых механизма развития реакции этого типа.
Комплементзависимые реакции. Существует два механизма, с помощью которых антитело и комплемент могут вызывать реакции гиперчувствительности IIтипа: прямой лизис и опсонизация. В первом случае антитело (IgM или IgG) реагирует с антигеном на поверхности клетки, вызывая активацию системы комплемента и приводя в действие мембраноатакующий комплекс, который нарушает целостность мембраны, "продырявливая" липидный слой.
Во втором случае клетки сенсибилизированы к фагоцитозу посредством фиксации антитела или СЗ — фрагмента комплемента к поверхности клетки (опсонизация). При этом варианте реакции гиперчувствительности II типа чаще всего затрагиваются клетки крови (эритроциты, лейкоциты и тромбоциты), но антитела могут быть направлены также против внеклеточных структур, например против гломерулярной базальной мембраны.
Антителозависимая связанная с клетками цитотоксичность не сопровождается фиксацией комплемента, однако вызывает кооперацию лейкоцитов. Клетки-мишени, покрытые IgG-антителами в низких концентрациях, уничтожаются несенсибилизированными клетками, которые обладают Fc-рецепторами. В этом виде цитотоксичности участвуют моноциты, нейтрофилы, эозинофилы и естественные киллеры (NK). Хотя в большинстве случаев в данном типе реакции участвуют антителаIgG; иногда (например, при связанной с эозинофилами цитотоксичности против паразитов) задействованы IgE-антитела. Этот вид цитотоксичности также имеет значение при реакции отторжения трансплантата.
Антителоопосредованная клеточная дисфункция.В некоторых случаях антитела, направленные против рецепторов на поверхности клеток, нарушают их функционирование, не вызывая повреждения клеток или развития воспаления. Например, при миастении антитела вступают в реакцию с ацетилхолиновыми рецепторами в двигательных концевых пластинках скелетных мышц, нарушая нервно-мышечную передачу и вызывая таким образом мышечную слабость. Наоборот, при антителоопосредованной стимуляции функций клетки развивается базедова болезнь. При этом заболевании антитела против рецепторов тиреотропного гормона на эпителиальных клетках щитовидной железы стимулируют клетки, что приводит к гипертиреозу. Этот же механизм лежит в основе реакций инактивации и нейтрализации.
Читайте также:


