Артрит и нефрит и гепатит
В обзоре анализируются особенности вторичной IgA-нефропатии, осложняющей пурпуру Шенлейна–Геноха, серонегативные спондилоартриты, глютеновую энтеропатию, HCV-инфекцию, ВИЧ-инфекцию, цирроз печени, наследственные нефриты.
The review discusses peculiarities of secondary IgA-nephropathy, complicating Henoch–Schonlein purpura, spondyloarthropathies, gluten enteropathy HCV infections, AIDS, liver cirrhosis, hereditary nephritis.
IgA-нефропатия (болезнь Берже) — одна из самых частых форм хронического брайтова нефрита, отличающаяся гематурией с медленным прогрессированием в хроническую болезнь почек (ХБП). Среди больных терминальной уремией, сегодня находящихся на заместительной почечной терапии, у каждого четвертого диагностируется IgA-нефропатия [1]. Более редкие формы IgA-нефропатии характеризуются такими признаками активности, как высокая протеинурия, диффузная пролиферация мезангия, пролиферация эндотелия капилляров клубочков, экстракапиллярная пролиферация, гломерулярные депозиты фибрина, выраженный фокальный гломерулосклероз [2, 3].
Дальнейшее изучение этиологии и патогенетических механизмов вторичных IgA-нефропатий перспективно для разработки новых методов лечения и профилактики болезни Берже.
IgA-нефропатия при HCV-инфекции
Для IgA-нефропатии при HCV-инфекции более характерна поздняя манифестация — после многолетнего медленного формирования вирусного ЦП, когда нарушается деградация IgA в печени и формируется инсулинорезистентность. Значительно раньше (на стадии хронического гепатита) формируется вирусный мембранопролиферативный нефрит (МБПГН). Поэтому от характерных проявлений IgA-нефропатии в виде гематурии с умеренной протеинурией на фоне нормотензии необходимо отличать криоглобулинемический МБПГН с рецидивами острого нефритического синдрома (ОНС), а также иммунотактоидный нефрит [7, 8]. При этом важное диагностическое значение имеет обнаружение криоглобулинемии смешанного II типа (СКГ II) с выраженной репликацией вируса гепатита С [9]. Криоглобулиемический МБПГН и иммунотактоидный нефрит отличаются ускоренным прогрессированием или развитием быстропрогрессирующего нефрита. Крайне неблагоприятен прогноз при HCV позитивной тромботической тромбоцитопенической пурпуре с злокачественной гипертензией (ЗГ) и прогрессирующей энцефалопатией.
IgA-нефрит при алкогольном циррозе печени
При алкогольном декомпенсированном ЦП признаки IgA-нефропатии обнаруживаются у каждого десятого больного. При этом механизмы нарастания в крови уровня IgA и IgA-содержащих иммунных комплексов, обусловленные снижением печеночной деградации IgA при прогрессировании цирроза [10], проявляются типичной картиной латентного нефрита с гематурией [11, 12]. Стойкая гипертензия наблюдалась в 15–20%, чаще носит контролируемый характер, ассоциируется с хроническими нарушениями пуринового обмена [13]. У половины больных алкогольным гематурическим нефритом обнаруживается кальцинирующий панкреатит, алкогольная кардиомиопатия, периферическая полинейропатия. Течение почечного процесса медленно прогрессирующее или рецидивирующее [13]. Рецидив нефрита развивается у 30% больных в первые сутки после алкогольного эксцесса, нередко ассоциирован с атакой острого алкогольного гепатита и напоминает ОНС. В 5% развивается экстракапиллярный быстропрогрессирующий нефрит (БПГН), наиболее неблагоприятный прогностически. У больного с далеко зашедшим портальным ЦП необходимо дифференцировать прогрессирующую IgA-нефропатию с гепаторенальным синдромом, алкоголь-парацетамоловым синдромом, а также с отравлениями суррогатами алкоголя (гликолин, метиловый спирт, дихлорэтан).
У ВИЧ-инфицированных больных [14] белой расы чаше других форм нефрита обнаруживается IgA-нефропатия. Мезангиальные IgA-депозиты обнаруживаются у 8% умерших от СПИДа. Дифференциальную диагностику указанной вторичной IgA-нефропатии следует проводить с такими ВИЧ-ассоциированными формами, как коллабирующий вариант фокально-сегментарного гломерулосклероза, мембранозная нефропатия, люпус-подобный пролиферативный нефрит, тромботическая тромбоцитопеническая пурпура, для которых, в отличие от IgA-нефропатии, характерны тяжелый нефротический синдром (НС), рецидивирующий ОНС или неконтролируемая гипертензия [15, 16].
В 30% ВИЧ-ассоциированной IgA-нефропатии характерна ЗГ. ЗГ сопровождается высокой протеинурией и быстрым прогрессированием в терминальную стадию хронической почечной недостаточности [17]. При этом биопсия почки демонстрировала сочетание мезангиопролиферативного IgA-нефрита с экстракапиллярной пролиферацией в 10–20% клубочков, тяжелым нефроангиосклерозом и фибриноидным некрозом артериол, напоминающим тромботическую микроангиопатию. Выявлена корреляция между тяжестью артериальной гипертензии и нефроангиосклероза, с одной стороны, и степенью вирусной нагрузки (ВИЧ) — с другой. Предполагается, что ЗГ с признаками ТМА обусловлена прямым повреждающим действием ВИЧ на эндотелий почечных артериол.
К серонегативным спондилоартритам относятся болезнь Бехтерева, артритры при распространенном псориазе, синдроме Рейтера, НЯК, болезни Крона. Данные формы объединяет патология иммунного ответа с антигеном гистосовместимости HLA В27 [18]. Общим для всех указанных спондилоартритов является нарушение клеточного иммунитета (СD4-Т-лимфоцитов). Реактивные артриты, ассоциированные с хронической воспалительной диареей (НЯК), хроническим уретритом (синдром Рейтера) характеризуются гиперпродукцией IgA с высоким риском прогрессирования ВИЧ-инфекции, нефропатиями и васкулитами [19]. Среди клинических маркеров — сакроилеит, гемоколит, мальабсорбция, прогрессирующий передний увеит, иридоциклит, конъюнктивит с уретритом [20]. IgA-нефропатия, как правило, проявляется микрогематурией с минимальной протеинурией без стойкой гипертензии и медленным прогрессированием.
Дифференциальная диагностика вторичной IgA-нефропатии должна проводиться с лекарственным хроническим тубулоинтерстициальным нефритом при свойственном сакроилеиту длительном приеме ненаркотических анальгетиков, нестероидных противовоспалительных средств, с хроническим уретритом и пиелонефритом (чаще при синдроме Рейтера). При далеко зашедшем спондилоартрите с нарастанием протеинурии и формированием стойкого НС на фоне тенденции к гипотензии вероятен диагноз генерализованного АА-амилоидоза. Решающее значение в диагностике амилоидной нефропатии имеет биопсия почки или слизистой прямой кишки.
Целиакия (лат. Morbus coeliacus; целиакия) — заболевание, характеризующееся непереносимостью глютена (с сенсибилизацией к нему). При этом всасывающиеся продукты неполного расщепления глютена оказывают токсическое действие на желудочно-кишечный тракт, индуцируют аллергические реакции (вплоть до глиадинового шока), что приводит к гиперрегенераторной атрофии слизистой оболочки тонкой кишки с развитием синдрома мальабсорбции.
При врожденной форме целиакии прогрессирующее поражение тонкого кишечника с тяжелым синдромом мальабсорбции препятствует росту и развитию ребенка [21]. Непереносимость глютена у взрослых мало изучена. Популяционные исследования последних десятилетий показали, что серологические и гистологические признаки целиакии регистрируются в десятки и сотни раз чаще, чем манифестные формы заболевания [22]. Также целиакия может иметь приобретенный характер, осложняя хронические энтериты.
Поражение почек при целиакии обусловлено циркулирующими иммунными комплексами, содержащими IgA-антитела к белку глиадину, которые способны фиксироваться на мезангиальных клетках с помощью глиадин-опосредованных лектиновых связей [23]. По данным многочисленных исследований антиглиадиновые IgA-антитела выявляются у большинства больных с IgA-нефропатией (70–100%), в то же время типичная целиакия обнаруживается лишь у 3% из них [24–28]. IgA-нефропатия при целиакии проявляется микрогематурией и протеинурией менее 1 г/сутки без гипертензии или может протекать субклинически [29, 30]. Имеются данные о положительном влиянии аглютеновой диеты на течение IgA-нефропатии [23, 31, 32].
Типичным проявлением геморрагического васкулита (пурпуры Шенлейна–Геноха) является сочетание рецидивов кожной геморрагической пурпуры с преходящим поражением крупных суставов, абдоминальным синдромом и поражением почек [33]. Атака абдоминального синдрома может осложниться желудочно-кишечным кровотечением, кишечной непроходимостью. Наблюдаются случаи нетипичного течения: почечная манифестация с отсроченным (на несколько месяцев, иногда — 1–2 года) присоединением артритов вместе с кожно-абдоминальной пурпурой. Учитывая указанные клинические наблюдения и общность патогенетических механизмов IgA-нефрита при геморрагическом васкулите с болезнью Берже, предполагается, что имеют место системная и локальная (почечная) формы одного и того же заболевания [34].
IgA-нефрит Шенлейна–Геноха чаще проявляется микрогематурией в сочетании с протеинурией, не превышающей 1 г/сутки. Гипертензия наблюдается не чаще чем у 15–20% больных [35]. Нефротический синдром формируется в 20–30% случаев чаще на поздней стадии болезни. В 5–10% случаев развивается БПГН с экстракапиллярной пролиферацией [36].
Синдром Альпорта — наследственный гематурический нефрит с прогрессирующей потерей слуха, наследуемый по доминантному типу и сцепленный с Х-хромосомой. Поражение почек, приводящее мужчин с синдромом Альпорта к исходу в терминальную стадию ХБП, не связано с иммунокомплексными механизмами, а обусловлено мутацией генов коллагена БМК клубочков [37, 38]. IgA-нефропатия в семьях носителей патологических генов и больных синдромом Альпорта встречается чаще и протекает с более быстрым прогрессированием. Дифференциальная диагностика IgA-нефропатии с синдромом Альпорта осложняется развитием обоих заболеваний в молодом возрасте и преимущественно у мужчин, а также сходством почечной симптоматики. Для разграничения c IgA-нефропатией имеют ценность инструментальное исследование слуха, выявление аномалий хрусталика и роговицы, иммунологических нарушений, а также генетический анализ и изучение родословной. В сложных случаях применяется биопсия почки [39].
В основе формирования аномального IgA-опосредованного иммунного ответа могут быть постэнтероколитическая или урогенитальная инфекция, нарушение печеночной деградации IgA при прогрессирующем ЦП, наследственная предрасположенность, включая носительство генов синдрома Альпорта, гена гистосовместимости HLA B27. Повышение в крови полимерного IgA и IgA-содержащих иммунных комплексов наблюдается у большинства ВИЧ-инфицированных, у пациентов с целиакией, НЯК и у 90% больных псориатическим артритом. Общим для большинства форм вторичной IgA-нефропатии является нарушение функции Т-хелперов (СD4-Т-лимфоцитов) с высоким риском иммунокомплексных осложнений, прогрессирования ВИЧ-инфекции. Полимерный IgA1 демонстрирует антительную активность к HIV-IgG и HIV-IgM [40, 41]. При IgA-нефритах необычно высока инфицированность другими вирусами. Так, от 60% до 80% больных алкогольным ЦП являются хроническими носителями HCV или HBV, что дополнительно усугубляет иммунодефицит. Иммунокомплексная патология реализуется рецидивами кожного васкулита, аортита, увеита, иммунокомплексным нефритом, инфекционными осложнениями. У 30–40% указанных больных выявляются инфицирование микобактериями туберкулеза, стафилококками.
Лечение вторичной IgA-нефропатии в первую очередь зависит от основного заболевания. При этом если при алкогольном циррозе и целиакии могут быть эффективны нелекарственные методы (алкогольная абстиненция, аглютеновая диета), то при ВИЧ+ и при HCV+ IgA-нефропатии показана противовирусная терапия, а при IgA-нефропатии в рамках Шенлейн–Геноховского васкулита или активного спондилоартрита показаны иммуносупрессанты.
Литература
А. Ю. Николаев 1 , доктор медицинских наук, профессор
А. В. Малкоч, кандидат медицинских наук
ФГБОУ ДПО РМАНПО МЗ РФ, Москва
IgA- нефропатия при системных заболеваниях, персистирующих инфекциях, хронических болезнях печени/ А. Ю. Николаев, А. В. Малкоч
Для цитирования: Лечащий врач № 1/2018; Номера страниц в выпуске: 48-51
Теги: инфекция, болезни печени, поражение почек
Введение
Ревматоидный артрит (РА) — хроническое, системное воспалительное заболевание, характеризующееся симметричным эрозивным синовитом, которое при отсутствии мер должного контроля может привести к инвалидности. Методы визуализации, такие как ультразвуковое исследование (УЗИ), могут быть использованы для детальной оценки состояния суставов при клиническом обследовании и постановке диагноза. Использование методом допплерометрии (ПД) наряду с традиционными УЗИ позволяет оценить состояние сосудистой системы мягких тканей и выявить активный синовит при РА.
Вирус гепатита С (ВГС) может быть связан со способностью вызывать иммунные нарушения у пациентов, генетически предрасположенных к РА. В то же время наличие сопутствующего ВГС приводит к сложной ситуации, связанной с терапией РА — традиционные методы лечения могут потенцировать гепатит. Кроме того, ВГС и его осложнения относятся к числу наиболее распространенных проблем системы здравоохранения, встречающихся в Египте. У египетских пациентов с РА и ВГС отмечается значительное увеличение антител к цитруллинированному виментину (анти-МСV).
Целью данного исследования была оценка влияния ВГС на пациентов с РА, связь гепатита с активностью заболевания, функциональным статусом и результатами ультразвукового исследования в Египте.
Пациенты и методы
Исследование включало 155 пациентов с РА, разделенных на 2 группы в зависимости от наличия сопутствующего ВГС; ревматоидный артрит (РА) и ревматоидный артрит/ вирус гепатита C (РА/ВГС). Все пациенты были подвергнуты тщательному сбору анамнеза заболевания, клиническому обследованию, лабораторным исследованиям, оценке активности болезни с использованием расчетной методики активности заболевания (DAS28) и оценке функционального состояния с использованием модифицированной анкеты для оценки состояния здоровья (MHAQ). УЗИ проводилась с использованием немецкой системы оценки US7.
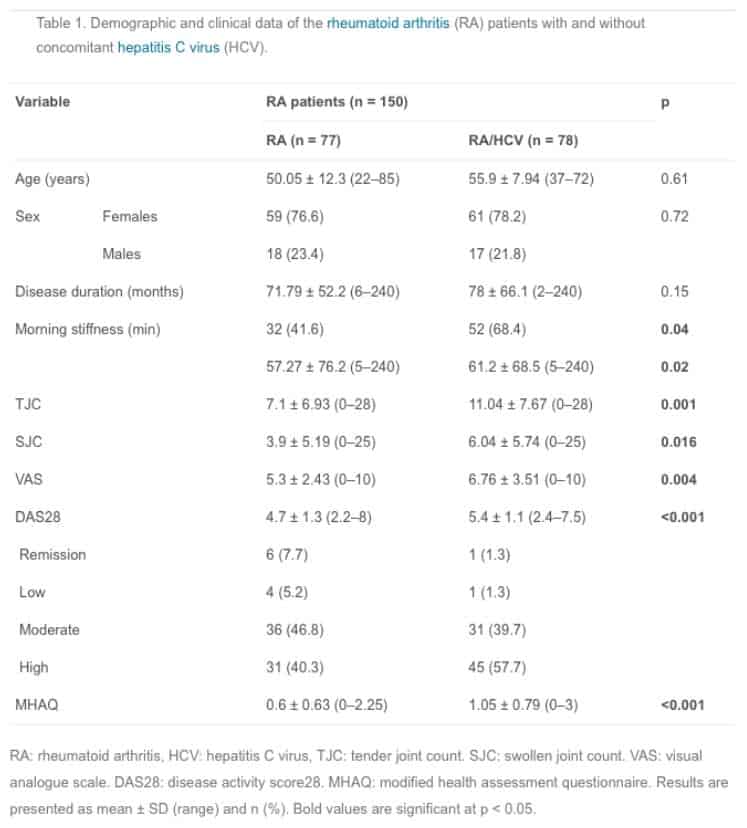
DAS28 и MHAQ показали значительные различия между группами РА и РА/ВГС (p 0,001), причем более высокие средние значения наблюдались в группе РА/ВГС (5,4 ± 1,1 и 1,05 ± 0,79 соответственно). Значительно более высокие показатели количества синовитов US7 были в группе РА/ВГС, по сравнению с группой РА (p = 0,03). Показатели US7 выявили значительные положительные корреляции с оценкой синавита DAS28, которые в обеих группах коррелировали с оценкой MHAQ.
Ревматоидный артрит — хроническое системное воспалительное заболевание. Наличие синовита признано одним из важнейших предрасполагающих факторов последующих структурных повреждений. Минимизация активности заболевания за счет строгого контроля и агрессивной терапевтической коррекции стала предпочтительным планом лечения для улучшения исхода у пациентов с РА, включая достоверное снижение скорости прогрессирования с рентгенологическим контролем и увеличение показателей ремиссии. Ультразвуковые методы визуализации дают дополнительную информацию о состоянии суставов у пациентов с подозрением на РА. По сравнению с клиническим обследованием УЗИ демонстрирует более высокую чувствительность при выявлении синовита как при РА с длительным течением, так и при раннем обнаружении. Для выявления синовита УЗИ выгодно отличается от других методов визуализации, таких как: контрастная МРТ, артроскопия и сцинтиграфия. Использование методов допплерометрии позволяет оценить состояние сосудистой системы мягких тканей и с высокой достоверностью выявлять активный синовит при РА.
В 2008 году было проведено демографическое и медицинское обследование (DHS) для выявления антител к ВГС на общенациональной выборке (6052 женщины и 5074 мужчины) в Египте. Показатели заболеваемости оцениваются как 2,4/1000 человек/год, что свидетельствует о высоком уровне распространения ВГС. Данное исследование проводилось с целью оценки влияния ВГС на пациентов с РА, ее связи с активностью заболевания и связи с результатами ультразвукового исследования.
Данное исследование проведено на 155 пациентах РА, разделенных на две группы по наличию ВГС. Исследование Patel имело схожий дизайн. Результаты нашего исследования выявили незначительные различия по возрасту, полу или длительности заболевания между группами РА и РА/ВГС, хотя более высокие показатели возраста были отмечены в группе РА/ВГС, что соответствовало результатам другого исследования на 150 пациентах с РА. Однако Patel отмечает достоверно более молодой средний возраст в группе РА/ВГС по сравнению с группой РА без ВГС.
В нашем исследовании длительность утренней скованности, отеки и значение DAS28 сильно разнились между группами РА и РА/ВГС. Значения DAS28 были выше у пациентов в группе РА/ВГС по сравнению с группой РА. В то же время Patel сообщил о неточностях в расчетной методике, что привело к увеличению показателей DAS28 у пациентов с РА сопутствующим ВГС по сравнению с пациентами в группе РА. Противоречивость результатов выявило несущественные различия в оценке DAS28 между данными группами, обусловленными небольшим размером выборки. Однако, результаты показали значительно большую интенсивность болевого синдрома в группе РА/ВГС по сравнению с группой РА. Это согласуется с предыдущим исследованием, в котором обнаружены более высокие показатели активности воспаления и соответствующие признаки (боль, скованность, отеки и значение DAS28) среди пациентов с ВГС и РА.
Данное исследование показало значительно более высокий средний показатель MHAQ у пациентов с РА/ВГС. Эти результаты подтверждаются предыдущим исследованием Mahmoud, который продемонстрировал значительно более высокие значения оценки MHAQ в группе РА/ВГС по сравнению с группой РА без ВГС; однако Patel обнаружили незначительные различия данных показателей, несмотря на явную тенденцию к высокому среднему MHAQ в группе РА/ВГС. Наши результаты, касающиеся самооценки боли у пациентов, объясняются более высоким уровнем поражения суставов наблюдаемым в группе РА/ВГС. Роль сопутствующего ВГС при самооценке боли и качества повседневной жизни согласуется с работой Foster, в которой пациенты с хроническим ВГС имели значительно более высокие показатели функциональных ограничений в социальной сфере, низкой физической силы и выносливости, высокой утомляемости по сравнению с пациентами, имеющими хронический гепатит B. Кроме того, Barkhuizen продемонстрировали значительные жалобы на усталость и скелето-мышечную боль среди пациентов имеющих ВГС по сравнению с другими группами пациентов, имеющих сопоставимую степень поражения печени, не связанную с ВГС. Более того, в систематическом обзоре Spiegel, при исследовании пациентов с ХВГС при использовании количественного оценочного инструмента для анализа качества жизни связанного со здоровьем (HRQoL) полученные значения были достоверно меньше по сравнению с контрольной группой без ВГС. В исследовании, посвященном изучению фибромиалгии среди 185 пациентов с ВГС, сообщалось о более высокой распространенности данного симптомокомплекса (57%), при этом, одна треть пациентов страдала от функциональной недостаточности.
Были отмечены незначительные различия между группами РА и РА/ВГС, относящимися к ревматоидному фактору (РФ) и антителам к циклическому цитруллинированному пептиду (АЦЦП): в группе РА / ВГС была обнаружена более высокая активность РФ и АЦЦП по сравнению с группой РА.
В данном исследовании также отмечено значительное увеличение использования преднизона, сульфасалазина, МТХ, хлорохина/гидроксихлорохина и НПВС у пациентов с РА/ВГС по сравнению с группой РА. Аналогично, Patel сообщил о тенденции к более частому использованию преднизона в группе пациентов с РА/ВГС. Различия в исследовании Patel могут быть связаны с большим использованием ингибиторов фактора некроза опухоли (анти-ФНО) в группе РА/ВГС, при этом ни один из наших пациентов не получал аналогичных препаратов — это может объяснить более высокие показатели значений DAS28 и MHAQ, наблюдаемые в нашей группе пациентов РА/ВГС.
US7 показал значительную разницу между группами РА и РА/ВГС с более высокими средними значениями, наблюдаемыми в группе РА/ВГС. Незначительные различия были отмечены в отношении синовита, тендосиновита и эрозий. Возможным объяснением несущественной разницы между обеими группами является тот факт, что гормональная терапия чаще проводилась в группе РА/ВГС. Было высказано предположение, что прием гормональных препаратов даже в низкой дозе может приводить к заметному уменьшению синовита по сравнению с монотерапией MTX.
Оценки синовита и теносиноита US7 значительно коррелировали с результатами DAS28 как в группах РА, так и в РА / ВГС. Backhaus так же оценил достоверность US7 среди пациентов с РА при различных методах лечения в течение одного года и обнаружили значительную корреляцию с DAS28.
Рост общих повреждений связан с увеличением риска будущей инвалидности, особенно по мере увеличения длительности течения заболевания. Данные немецкой US7 для оценки эрозии достоверно коррелировали с продолжительностью заболевания как в группе РА, так и в группах РА/ВГС — US7 способен исследовать суставы в нескольких разных плоскостях, а также небольшие суставы. Безусловно, дальнейший статистический и регрессионный анализ был бы ценным для определения достоверности оценки US7 по сравнению с другими показателями активности болезни в качестве диагностического инструмента для выявления активности заболевания среди пациентов с РА независимо от наличия сопутствующего ВГС.
В заключение, сопутствующий ВГС у пациентов с РА может привести к ограничению при выборе терапевтических средств и потребует внесения корректировок в планы лечения обоих заболеваний, при этом ВГС оказывает влияние на активность течения РА. Это может объяснить более высокие показатели активности болезни (DAS28) и функционального статуса (MHAQ), наблюдаемые в группе РА/ВГС по сравнению с группой РА. В тоже время, следует заметить, что немецкая система US7 является ценным объективным инструментом для оценки активности РА, независимо от наличия сопутствующего ВГС.
Nabila Ab, EI-Hamid Gohar, Mayada Ali Abdalla, Marwa Khairy Mehasseb, Walaa Abd El-Rahman Saleh.
Rheumatology and Rehabilitation Department, Faculty of Medicine, Cairo University, Egypt
Endemic Medicine Department, Faculty of Medicine, Cairo University, Egypt
Ревматоидный артрит является системным заболеванием. По мере прогрессирования патологии, воспалительный процесс может распространяться на внутренние органы, вызывая серьезные нарушения в их работе. Наиболее опасно поражение почек при ревматоидном артрите, так как это уменьшает длительность жизни пациента. При первых подозрениях на ухудшение работы почек следует обратиться к лечащему врачу и пройти комплексное обследование.
Почему возникают проблемы с почками?

Заболевания почек могут быть обусловлены самим артритом
Ревматоидный артрит не лечится, часто обостряется и дает осложнения на внутренние органы. В подавляющем большинстве случае первыми под удар попадают почки. Причем заболевания почек могут быть обусловлены самим артритом, либо действием препаратов, применяющихся для купирования симптоматики заболевания.
Оба случая одинаково опасны и требуют своевременного лечения почек, так как могут привести к опасным последствиям, вплоть до летального исхода.
Риски поражений почек при ревматоидном артрите возрастают при злокачественном заболевании, которое сложно поддается медикаментозному лечению и быстро прогрессирует.
Виды патологий и их симптомы

Женщины сталкиваются с осложнением чаще, чем мужчины
Вероятные осложнения на почки можно поделить на две группы – первичные поражения, вызванные непосредственно изменениями, происходящими в организме на фоне артрита, и вторичные патологии, развивающиеся на фоне приема медикаментов.
По статистике, с заболеваниями почек сталкиваются около 10% пациентов с ревматоидным артритом. Риск такого осложнения возрастает пропорционально возрасту. Как правило, первые симптомы ухудшения работы органа диагностируются в возрасте старше 50 лет. Женщины сталкиваются с осложнением чаще, чем мужчины. Во многом это обусловлено тем, что 2/3 пациентов с артритом – это женщины. К тому же, у представительниц прекрасного пола есть один отягощающий фактор, повышающий риск развития осложнений – это наступление менопаузы. По статистике, во время климакса артрит чаще обостряется и быстрее прогрессирует.
Лекарственный нефрит относится к вторичным поражениям почек на фоне артрита. Это заболевание может быть следствием длительной терапии антибиотиками, кортикостероидами или нестероидными противовоспалительными средствами. Патология характеризуется развитием асептического воспалительного процесса в органе.
- быстрая утомляемость;
- боль в пояснице;
- мигрень;
- отеки;
- уменьшение объема мочи.
При нефритах возможно изменение цвета мочи. Она становится мутной, могут появляться вкрапления крови.
Данная патология относится к прямым следствиям ревматоидного артрита. Болезнь характеризуется отложением иммунных комплексов вдоль стенок клубочковых капилляров. Это приводит к развитию ряда специфических симптомов:
- отек лица;
- отеки рук и ног;
- протеинурия;
- помутнение мочи.
При этом изменения в объеме мочи или частоте мочеиспускания не наблюдаются.
Амилоидоз почек – наиболее распространенное осложнение при ревматоидном артрите. С ним сталкивается каждый десятый пациент с ревматоидным артритом. Болезнь развивается как на фоне медикаментозной терапии, так и в результате быстрого прогрессирования артрита. Стоит отметить, что амилоидоз может проявляться как в начале развития артрита, так и при многолетнем течении заболевания.
При амилоидозе происходит нарушение белкового обмена. Это негативно сказывается на работе почек, печени, селезенки. Прогрессирующий амилоидоз опасен нарушениями работы сердечно-сосудистой системы и развитием почечной недостаточности. Острая почечная недостаточность потенциально опасна летальным исходом.
- протеинурия;
- отеки лица и нижних конечностей;
- почечная недостаточность;
- внезапное повышение уровня холестерина;
- увеличение объема печени;
- набухание лимфатических узлов.
Амилоидоз диагностируется по наличию белка в моче. Для выявления этого заболевания необходимо сдать соответствующие анализы.
Гранулематоз – это системное аутоиммунное нарушение, поражающее почки, миокард, легкие и другие внутренние органы. Болезнь является прямым следствием ревматоидного артрита и опасна развитие осложнений, несовместимых с жизнью.
Патология характеризуется поражение почечных клубочков. Симптомы заболевания:
- кровь в моче;
- артериальная гипертензия;
- протеинурия;
- острая почечная недостаточность.
Если патология своевременно не выявлена, она переходит в хроническую форму и поражает все большее количество органов и систем. Гранулематоз опасен риском развития тяжелой формы хронической почечной недостаточности.
Васкулит почек является редким осложнением ревматоидного артрита, однако очень опасен, и требует своевременного выявления. Патология характеризуется воспаление кровеносных сосудов по всему телу. В патологический процесс вовлекаются сосуды кожи, почек, печени, головного мозга. Васкулит носит системный характер и быстро прогрессирует. При поражении почек наблюдается нарушение мочевыделения, болевой синдром в пояснице, в тяжелых случаях возможно внутреннее кровотечение и некроз.
Диагностика

При первых же симптомах нужно обратиться к врачу
Обратиться к врачу необходимо при появлении отеков лица и конечностей, изменениях уродинамики и повышении артериального давления. Эти симптомы являются общими для различных нарушений работы почек.
Необходимые обследования для выявления патологии:
- анализ мочи;
- анализ крови;
- УЗИ почек;
- УЗИ лимфатических узлов.
Обычно этих обследований достаточно для постановки диагноза и назначения схемы терапии.
Принцип лечения

Лечение почек при артрите необходимо начинать сразу же
Лечение амилоидоза почек при ревматоидном артрите и других патологий почек должно быть комплексным. Терапия включает:
- устранение инфекционных агентов;
- диетотерапию;
- почечно-заместительную терапию;
- симптоматическое лечение.
При воспалении почек применяют специальные препараты. Так как осложнения на этот орган связан с аутоиммунным процессом, назначают специальную корректирующую терапию для уменьшения иммунопатологического ответа организма при ревматоидном артрите.
Симптоматическое лечение патологий почек включает прием диуретиков и препаратов железа. При повышении артериального давления вследствие отеков на фоне почечной недостаточности необходимо принимать препараты гипотензивного действия.
Почечно-заместительная терапия зависит от тяжести нарушения функции органа. Для этого применяется гемодиализ, позволяющий скорректировать химический состав крови, тем самым уменьшив нагрузку на почки.
Лечение осложнений ревматоидного артрита народными средствами нецелесообразно и может навредить здоровью. При патологиях почек народные средства можно принимать лишь после медикаментозной терапии. Рекомендовать народные средства нельзя, так как при почечной недостаточности и амилоидозе они могут навредить здоровью.
Диетотерапия необходима как для продления ремиссии при артрите, так и для уменьшения нагрузки на почки. Рекомендуется минимизировать потребление мяса, увеличив количество субпродуктов, в первую очередь печени, в рационе. Нужно отказаться от полуфабрикатов, копченостей, большого количества соли. Основной упор делается на фрукты и овощи, каши, рыбу и птицу.
Что будет без лечения?

Почечная недостаточность становится причиной летального исхода
По статистике, почечные нарушения встречаются у каждого третьего пациента с ревматоидным артритом. Примерно в 10% случаев диагностируются опасные для жизни нарушения работы почек. При этом патологии почек своевременно устанавливаются лишь в 53% случаев, у остальных пациентов почечная недостаточность становится причиной летального исхода и выявляется посмертно.
По последним данным, примерно в 38% случаев ранней смертности у пациентов с ревматоидным артритом, летальный исход провоцирует острая почечная недостаточность, развивающаяся как вторичное осложнение аутоиммунного заболевания соединительной ткани. В связи с этим каждый пациент должен как минимум дважды в год проходить комплексное обследование для своевременного выявления патологии почек.
Как сохранить ремиссию?
Продлить ремиссию при артрите и минимизировать риски развития опасных осложнений поможет только бережное отношение к собственным суставам. Пациент должен выполнять рекомендации врача, избегать травм и переохлаждений, своевременно лечить любые инфекционные заболевания и соблюдать гипоаллергенную диету.
Читайте также:


