Асцит вирусный перитонит от чего
Асцит - это состояние, при котором в брюшной полости появляется свободная жидкость в больших количествах.
Асцит является следствием цирроза печени в 75%; злокачественных новообразований - в 10%; сердечной недостаточности в 5% случаев.
В клинической картине у пациентов отмечается вздутие живота и прогрессирующее нарастание веса.
Диагноз основывается на результатах физикального и визуализирующих (рентгенологических, ультразвуковых) методов исследования.
Лечение заключается в назначении бессолевой диеты, диуретиков. Больным может производиться терапевтический лапароцентез, выполняются хирургические вмешательства. Пациенты с асцитом - кандидаты на трансплантацию печени.
Наиболее частым осложнением асцита является спонтанный бактериальный перитонит . Он возникает при инфицировании асцитической жидкости, которое в 90% случаев происходит спонтанно. У больных появляются боли в животе, повышается температура тела.
Для диагностики этого осложнения производится исследование асцитической жидкости. Для лечения спонтанного бактериального перитонита назначаются антибактериальные препараты.
-
Классификация асцита
Асцит классифицируется в зависимости от количества жидкости, наличия инфицирования асцитической жидкости и варианту ответа на медикаментозную терапию.
- По количеству жидкости в брюшной полости:
- Небольшое количество жидкости.
- Умеренное количество жидкости.
- Значительное количество жидкости (напряженный, массивный асцит).
- По инфицированности содержимого:
- Стерильное содержимое.
- Инфицированное содержимое.
- Спонтанный бактериальный перитонит.
- По варианту ответа на медикаментозную терапию:
- Асцит поддающийся медикаментозной терапии.
- Рефрактерный асцит.
Асцит, который не может быть устранен, или ранний рецидив которого не может быть адекватно предотвращен лечением.
- Асцит, резистентный к диуретикам: асцит, рефрактерный к диете с ограничением натрия и интенсивной терапии диуретиками ( спиронолактон 400 мг/день, фуросемид 160 мг/день в течение не менее 1 недели; диета с ограничением поваренной соли менее 5,2 г/день).
- Асцит, не контролированный диуретиками: асцит, рефрактерный к терапии из-за развития вызванных диуретиками осложнений, которые препятствуют применению эффективных дозировок диуретиков.
- Эпидемиология асцита
Асцит является следствием цирроза печени в 75%; злокачественных новообразований - в 10%; сердечной недостаточности - в 5% случаев.
Примерно у половины пациентов с циррозом печени асцит развивается в течение 10 лет от начала заболевания. Он обусловлен нарушениями почечной функции, портального и висцерального кровообращения.
Примерно 50% пациентов с цирротическим асцитом умирают в течение 2 лет от начала заболевания. Показатели однолетней выживаемости у больных с асцитом, резистентным к терапии, составляют 50%.
У здоровых мужчин внутриперитонеальная жидкость обнаруживается в меньших количествах, чем у женщин, у которых ее объем составляет примерно 20 мл (в зависимости от фазы менструального цикла). При асците этот объем значительно увеличивается.
Частота возникновения спонтанного бактериального перитонита составляет 15-20%.
-
Этиология и факторы риска развития асцита
- Факторы риска при отсутствии патологических процессов в брюшине.
- Портальная гипертензия (градиент концентрации альбумина сыворотка-асцит ≥11 г/л).
- Цирроз печени .
- Алкогольный гепатит.
- Фулминантная печеночная недостаточность.
- Метастазы в печень .
- Хроническая сердечная недостаточность .
- Констриктивный перикардит .
- Синдром Бадда-Киари .
- Обструкция нижней полой вены.
- Гипоальбуминемия (градиент концентрации альбумина сыворотка-асцит 11г/л) и другими причинами (градиент концентрации альбумина сыворотка-асцит 225 мЕ/мл (или выше верхней границы нормы для сыворотки крови).
О рефрактерном асците свидетельствует отсутствие эффекта от проводимой терапии, которая заключается в назначении пациенту бессолевой диеты и диуретиков в высоких дозах.
Клинически различают две формы рефрактерного асцита:
- Асцит с ежедневной потерей менее чем 200 г массы тела (несмотря на ограничения натрия) и прием 400 мг спиронолактона (Верошпирон) или 30 мг амилорида (Амипразид, Арумил, Мидамор), а также 160 мг фуросемида (Лазикс) в течение 2 недель.
- Асцит, который невозможно контролировать; рецидивирующий асцит, обострения которого невозможно предупредить, назначая диуретики в дозах, не вызывающих побочных явлений.
- Основные диагностические критерии гепаторенального синдрома:
- Гепаторенальный синдром развивается у пациентов с хроническими или острыми заболеваниями печени, выраженной печеночной недостаточностью, портальной гипертензией и асцитом.
- Существуют два варианта течения гепаторенального синдрома.
- Синдром первого типа характеризуется прогрессирующим течением: быстрым нарастанием симптомов почечной недостаточности. Диагностика синдрома первого типа производится на основании увеличения почти вдвое содержания сывороточного креатинина (более чем 1,5 мг/дл) или 50%-ным снижением суточного клиренса креатинина (менее 40 мл/мин) в течение 2 недель. Пациенты с синдромом первого типа нуждаются в трансплантации печени. В противном случае синдром заканчивается летально у 90% больных.
- Для синдрома второго типа характерно медленно прогрессирующее течение.
- Отсутствие шока, текущей бактериальной инфекции, данных о приеме нефротоксических препаратов, отсутствие диареи и рвоты, потери жидкости с почками (снижение веса более чем на 500 г в течение нескольких дней у пациентов с асцитом без периферических отеков и более 1 кг/сут у больных с периферическими отеками).
- Отсутствие улучшения почечной функции (сохранение уровня сывороточного креатинина более чем 1,5 мг/дл и суточного клиренса креатинина менее 40 мл/мин) после назначения диуретиков и увеличения объема плазмы за счет введения 1,5 л изотонического раствора.
- Протеинурия менее 500 мг/дл и отсутствие ультразвуковых признаков поражения почечной паренхимы или обструктивной уропатии.
- Дополнительные диагностические критерии гепаторенального синдрома:
- Объем суточной мочи менее 500 мл/сут.
- Концентрация натрия в моче менее 10 мЭкв/л.
- Осмолярность мочи выше, чем осмолярность крови.
- Концентрация натрия в сыворотке крови менее 130 мЭкв/л.
- Количество эритроцитов в моче более 50 в поле зрения.
Немедикаментозная терапия асцита заключается в соблюдении определенного режима жизни и ограничений в диете.
Постельный режим и ограничение потребления натрия являются эффективными терапевтическими мероприятиями у 10% пациентов с асцитом.
Ограничения в диете и лечение диуретиками оказывают терапевтический эффект у 90% пациентов с асцитом. При отсутствии эффекта или при выраженном асците необходимо стационарное лечение.
Больные с асцитом, не получающие диуретиков, ежедневно экскретируют почками примерно 20 ммоль/сут натрия.
Отрицательный баланс натрия может быть достигнут благодаря ограничению потребления натрия с пищей до 22 ммоль/сут, что затруднительно для больных. Как правило, удается поддерживать количество натрия в пище в количестве 44 ммоль/сут.
В пищевом рационе пациентов с асцитом должны содержаться низкие количества соли (1-1,5 г/сут или 40-60 ммоль/сут).
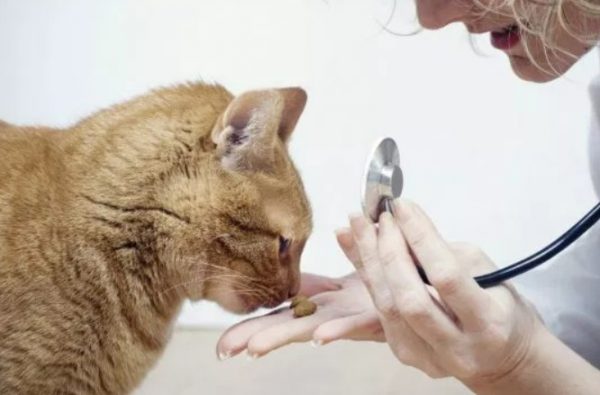
Вирусный перитонит у кошек – системное инфекционное заболевание, возбудителем патологии выступает коронавирус.
Воспаление характеризуется формированием гранулем на внутренних органах и выделением жидкости в полость брюшины (асцит) или плевральную область (плеврит). Инфекция сложно поддается лечению, часто приводит к гибели животного.
Формы перитонита
Перитонит – воспалительный процесс в брюшной полости, исходя из этиологии и типа течения воспалительного процесса, заболевание разделяют на формы.
Тип неспецифического инфекционного воспаления формируется при проникновении в брюшину патогенной флоры, процесс возникает при травмах, повреждении органов пищеварения костями или другими острыми предметами.
Провоцирующим фактором может стать язва или разрастание опухоли в ЖКТ.
Иногда плотный кал или волосяные шары, проходя по кишечнику, повреждают слизистую и образуют микротрещины, что ведет к развитию патологии.
У кошек вирусный перитонит, или FIP, возникает после заражения относительно безопасным штаммом РНК-вируса FECV, вызывающим коронавирусную инфекцию.
При проникновении возбудителя в ротовую полость вначале он размножается в эпителиальных клетках глотки, органах дыхания и кишечника.
![]()
Перитонит в 90% случаев заканчивается летальным исходом.У взрослых животных болезнь обычно протекает бессимптомно, у котят проявляется в форме энтерита, сопровождается рвотой и диареей. После выздоровления кошка еще до 3-8 месяцев остается носителем и распространителем возбудителя.
В 10% случаев вирус мутирует, видоизменяется в патогенный штамм FIPV, поражает макрофаги – Т-клетки, отвечающие за иммунитет, распространяется с кровотоком по всему организму.
Заболевание приобретает системный характер и проявляется тяжелым перитонитом. В зависимости от того, как дальше будет развиваться процесс, выделяют три формы перитонита.
Отмечается у 75% животных, когда зараженные макрофаги массово концентрируются вокруг кровеносных сосудов, обычно под серозными оболочками и полостями органов.
![]()
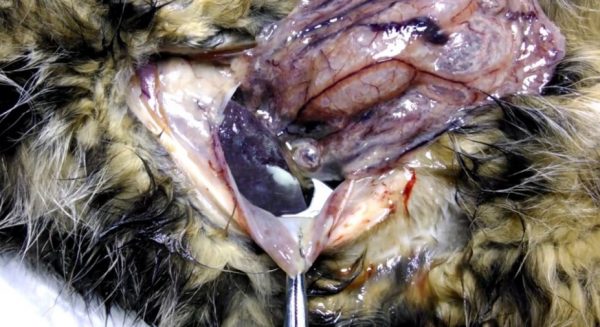
Перитонит — воспалительное заболевание оболочки, покрывающей органы брюшной полостиЭто влечет увеличение проницаемости их стенок, становится причиной скапливания белкового выпота в брюшине, плевральной области, у некоторых животных в сердечной сумке или мошонке.
Формируются небольшие некротические или гранулематозные узелки. Состояние опасное, характеризуется острым или подострым течением.
Если сосуды подверглись меньшему воздействию вируса, развивается состояние, когда в тканях тела образуются гранулемы. Заболевание протекает в хронической форме, носит пролиферативный характер.
Гной в брюшной полости образуется при разложении патологического экссудата.
![]()
Причины возникновения и пути передачи
Причиной мутации вириона в организме кошки часто становятся:
- ослабленный иммунитет;
- плохие условия содержания;
- скудный и несбалансированный рацион;
- перенесенные болезни и операции.
Возможная трансформация штамма обусловлена количеством патогена, присутствием стрессовых ситуаций и генетической предрасположенности.
Важно! Особенно чувствительны к возбудителю молодые особи до 2 лет, старые животные после 10 лет и кошки британской породы.
Резервуар инфекции – больное животное или латентный носитель вируса, выделяющие микроорганизмы с фекалиями, мочой, секретами носоглотки начиная с 2-5 суток с момента инфицирования.
Заражение происходит алиментарным способом, через рот кошки.
Послеоперационный перитонит развивается у кошек как осложнение в период хирургического вмешательства вследствие проникновения болезнетворных бактерий в брюшную полость.
Причиной воспалительного процесса после стерилизации становятся:
- несоблюдение асептических и антисептических мер персоналом ветклиники;
- повреждение внутренних органов во время операции:
- нагноение в матке;
- инфицирование послеоперационного шва;
- оставление в полости посторонних предметов;
- ослабленный иммунитет;
- пониженная способность тканей к регенерации.
Провоцирующим фактором выступает присутствие хронического очага воспаления в организме, когда патогенные микроорганизмы переносятся в зону хирургического разреза с кровью.
Симптомы послеоперационного перитонита могут проявиться через 2-5 суток после операции, в некоторых случаях – спустя 2-3 недели.
Внимание! Хирургическое вмешательство ослабляет организм животного. Если требуется стерилизация питомца, чтобы снизить риск развития перитонита, при положительном тесте на коронавирус операцию лучше отложить до выздоровления.
ФИП часто встречается в питомниках, где кошки содержатся большими сообществами. В группу риска входят животные, проживающие на улице, но и у домашних питомцев нельзя исключать развитие инфекции.
![]()
Симптом перитонита у кошки — раздражение кишечникаВ организм кошачьих коронавирус проникает:
- при соприкосновении с испражнениями, обсемененными возбудителем;
- через слюну;
- через предметы, контаминированные вирусом: шерсть, подстилка, игрушки, обувь или одежда хозяина;
- во время вязки;
- через плаценту и родовые пути при родах.
При скученном содержании инфекция может передаваться воздушно-капельным путем.
Инкубационный период и симптомы
Продолжительность инкубационного периода ФИП зависит от состояния иммунитета кошки: в среднем это 2 или 3 недели, иногда несколько месяцев.
Клиническая картина инфекционного перитонита отличается разнообразием, болезнь камуфлируется под патологию сердечно-сосудистой системы, органов пищеварения, даже онкологию.
![]()
Поскольку проявления бактериального перитонита отражают особенности воспалительного процесса, его симптоматика зависит от формы заболеванияВнешние признаки можно перепутать с воспалением глаз, мозга или позвоночника, паразитарной инвазией, вирусом лейкоза.
Поскольку проявления бактериального перитонита отражают особенности воспалительного процесса, его симптоматика зависит от формы заболевания.
При экссудативном течении наблюдаются следующие признаки:
- угнетенное состояние, отказ от пищи;
- потеря веса;
- рвота и диарея;
- повышение температуры;
- скопление жидкости в кишечнике и плевральной полости;
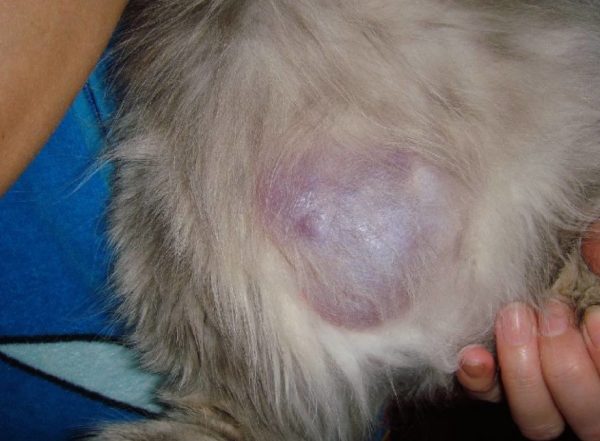
- асцит приводит к увеличению живота;
- плеврит вызывает одышку.
![]()
Прогрессирование патологии вовлекает в процесс близлежащие органы: нарушаются функции печени, почек, поджелудочной железы. Реже возможны нарушения нервной системы и зрения.
Признаки пролиферативного перитонита не всегда определенны, нередко выражаются слабо, поэтому состояние сложно диагностировать. К типичным проявлениям патологии относят отказ от корма и потерю веса.
Появление симптомов обусловлено органами-мишенями и степенью поражения, чаще наблюдаются:
- Воспалительные процессы в сосудистой оболочке глаз, повреждение роговицы и сетчатки, деструкция стекловидного тела.
- При нарушениях ЦНС наблюдаются изменения в поведении, неконтролируемое движение зрачков, расстройство вестибулярного органа и утрата равновесия, а также недержание мочи, судороги, парезы.
- Увеличение печени, желтушность кожи и склер.
При пальпации живот уплотнен, прощупываются пиогранулемы в почках, брыжеечные лимфатические узлы.
Какие системы может поразить вирус?
Проникая в организм кошки, вирус разноситься по всему организму, в результате инфекция принимает генерализованный характер.
Ее повреждающее действие распространяется:
- на кровеносную и лимфатическую систему;
- на кишечник;
- на внутренние органы – печень, поджелудочную железу и селезенку;
- на легкие, почки.
Страдает сердце, нервная система, органы зрения и мозг.
Как диагностируется FIP
Диагностика FIP осуществляется на основе комплексного обследования, применяются следующие методы:
- Сбор анамнеза. Данные дают представление об условиях содержания, перенесенных заболеваниях, контактах с вирусоносителями.
- Осмотр. Позволяет выявить нарушения в работе сердца, увеличение печени, лимфоузлов, асцит.
- Рентген и УЗИ. Показывают изменения во внутренних органах, наличие жидкости и гранулематозных образований.
- Тестирование. Проводится методом иммунофлуоресцентного анализа (МФА). Исследование выявляет антитела к вирусу в крови и выпоте. Обратная ЦПР определяет наличие коронавируса в кале, слюне или крови больного животного.
- Анализ экссудата. По состоянию жидкости и химическим свойствам можно исключить или диагностировать заболевание.
Проведение лапароскопии и взятие биопсии – наиболее достоверный метод диагностики перитонита, доказывает присутствие патологических изменений в тканях.
Лечение
Специфического лечения инфекционного перитонита не существует, ветеринарный врач проводит комплексные симптоматические мероприятия для облегчения состояния питомца, устранения интоксикации.
Выбор тактики зависит от тяжести и формы болезни, назначаются:
- антибактериальные препараты;
- обезболивающие и мочегонные средства;
- иммуностимуляторы или иммуносупрессоры;
- витаминные комплексы и сбалансированная легкая диета.
В некоторых случаях проводится гормональное лечение и химиотерапия. При скоплении жидкости выводят экссудат из брюшной полости.
Перитонит – угрожающее состояние для жизни кошки, а ФИП оставляет мало шансов на выживание: гранулематозные узлы и выпот препятствуют нормальной работе внутренних органов и нервной системы.
Происходит нарушение обменных процессов, поэтому по статистике погибает более 90% животных, а при экссудативном течении патологии смертность составляет 99%.
![]()
Осторожный прогноз оставляют ветеринары и для бактериального воспаления: только половина котов выздоравливает после инфекции в брюшной полости. Послеоперационный перитонит чаще заканчивается выздоровлением, выживают 70% питомцев.
При пролиферативном типе течения болезни и правильном лечении домашний любимец может прожить 8 месяцев и даже год.
![]()
Укрепление иммунной системы позволит избежать появление вирусных заболеванийПри перитоните, сопровождающимся выпотом в полости тела, с начала болезни кошка живет несколько дней, иногда недель. Котята погибают в течение нескольких дней.
В США разработана вакцина Primucell, включающая высушенный живой штамм вируса ФИП – DF2-FIPV. Разновидность микроорганизма термозависима: размножается только в носоглотке при +31°C, защищая организм кошки без увеличения титра антител.
Назальная прививка эффективна на 50-70%, но не работает, если животное уже заболело или является носителем коронавируса.
Возможно снижение иммунного ответа у кошек, которые перенесли стресс или содержались в неблагоприятных условиях, а также при несоблюдении рекомендаций по хранению и введению.
Внимание! Чтобы предохранить животных от инфекции при скученном содержании, важно вакцинировать всех кошек сообщества без исключения.
Вакцинация и профилактика
ФИП – следствие мутации коронавируса, поэтому основная задача профилактики заболевания – предупреждение инфицирования домашних питомцев и поддержание иммунитета.
Вакцинацию проводят котятам в возрасте 16 недель дважды с интервалом в 21 день, в дальнейшем достаточного разового введения препарата. Его действие начинается спустя 28 суток, продолжается до 12 месяцев.
Какие меры профилактики требуется соблюдать:
- содержать животных небольшими группами, не более 4 особей;
- поддерживать чистоту лотков, содержать их отдельно от мест кормления;
- не допускать контакта с инфицированными особями;
- выдерживать карантин при введении в сообщество новых животных;
- проводить обследование на предмет наличия вируса;
- обеспечить полноценное сбалансированное питание и двигательную активность;
- не допускать стрессов;
- регулярно проводить обработку против гельминтов и накожных паразитов.
Когда котята рождаются от инфицированной кошки, рекомендуется ранний отъем молодняка: до 4-6 недель, пока действуют антитела, полученные с молоком матери.
Может ли заразиться человек от больной кошки
Людям кошачий коронавирус не передается, поэтому с носителем инфекции или животным, заболевшим ФИП, можно контактировать без опаски заразиться.
Заключение
Перитонит для кошки – смертельная опасность, только хозяин сможет обезопасить любимца от тяжелой инфекции.
Поэтому важно контролировать состояние питомца, укреплять иммунитет, обеспечивать сбалансированный рацион, не допускать стрессовых ситуаций.
Вирус уничтожается простыми моющими и дезинфицирующими средствами, поэтому важно соблюдать гигиену, чтобы не допустить появления возбудителя в помещении, где живет кошка.
Е.В. ВИННИЦКАЯ, старший научный сотрудник отделения хронических заболеваний печени Центрального научно-исследовательского института гастроэнтерологии Департамента здравоохранения г. Москвы, доктор медицинских наук
Грозное последствие цирроза
Спонтанный бактериальный перитонит (СБП) остается часто встречающимся, но редко диагностируемым осложнением цирроза печени (ЦП). Уточню, что СБП— это прогностически тяжелое осложнение декомпенсированного ЦП. Оно развивается в результате бактериальной транслокации на фоне снижения резистентности организма, избыточного бактериального роста. СБП проявляется контаминацией асцитической жидкости и воспалением брюшины. Частота этого грозного осложнения за последние годы колеблется в пределах от 10 до 37% среди стационарных больных ЦП, осложненным асцитом.
В 1960 годы летальность при этом осложнении составляла около 90%. Отсутствие понимания, правильной диагностики, своевременной и адекватной терапии приводило к неоправданно высокой смертности. В последующие годы смертность от СБП в условиях стационара снизилась до 20—38%.
По своей сути спонтанный бактериальный перитонит — это частная форма первичного асцита-перитонита. Этот термин отражает острое или хроническое воспаление брюшины у больного с асцитом и инфицированием асцитической жидкости, сопровождающееся местными и общими симптомами и нарушением жизненно важных функций организма.
Бактерии проникают через барьер
В основе патогенетических механизмов СБП лежит теория бактериальной транслокации. Суть этого явления заключается в проникновении жизнеспособных бактерий через эпителиальный барьер ЖКТ в экстраинтестинальные ткани организма, например мезентериальные лимфоузлы, селезенку. Там часть из них подвергается лизису макрофагами, часть — через воротную вену попадает в печеночные синусы и лизируется макрофагами печени.
При декомпенсированном ЦП классов В и С по Child-Pugh возникает целый ряд взаимосвязанных механизмов, нарушающих нормальные функции организма, способствующих бактериальной кишечной транслокации и развитию СБП. Это портальная гипертензия, асцит, повышение внутрибрюшного давления, замедление пассажа содержимого по кишечнику, синдром избыточного бактериального роста, снижение белково-синтетической функции печени, белковое голодание, снижение общей иммунореактивности, энтеральной недостаточности, эндотоксемии, а также локальные изменения слизистой кишки в виде нарушения микроциркуляции и проницаемости.
Важную роль в развитии СБП имеет внутрибрюшная гипертензия (ВБГ), которая возрастает при декомпенсации ЦП за счет портальной гипертензии и асцита, с одной стороны, и развития синдрома избыточного бактериального роста— с другой. Увеличение ВБГ замедляет кровоток по нижней полой вене и уменьшает венозный возврат, способствует снижению лимфооттока по грудному лимфатическому протоку, замедляет всасывание асцитической жидкости. Транслокация бактерий формируется по прошествии 3 часов после повышения внутрибрюшного давления до 15 мм рт. ст. А транслокация бактерий при внутрибрюшном давлении > 25 мм рт. ст. развивается в течение часа.
Наличие ЦП классов В и С по Child-Pugh с нарушением функции печени, сопровождается снижением как белково-синтетической функции, так и нарушением функции ретикуло-эндотелиальной системы, что приводит к снижению способности образования антител и формированию вторичного иммунодефицита.
Доказано, что активированные микроорганизмами нейтрофилы, моноциты, макрофаги и клетки эндотелия продуцируют провоспалительные медиаторы — цитокины, кинины, метаболиты арахидоновой кислоты, фактор активации тромбоцитов и оксид азота, которые инициируют и поддерживают воспалительную реакцию, вызывают вторичное выделение аналогичных медиаторов с повреждением эндотелия и снижением органной перфузии и доставки кислорода. В этих условиях печень вместо синтеза альбумина, который и так резко снижен при декомпенсированном ЦП, начинает продуцировать белки острой фазы, такие как гликопротеины, ?1-антитрипсин, С-реактивный белок, церулоплазмин, факторы свертывания, компоненты комплемента, ферритин — вещества, которые, обладая различным действием, способствуют усилению процессов свертывания, воспаления, нарушению метаболизма.
Кроме того, при СБП в итоге происходит снижение функции нейтрофилов, нарушение синтеза лейкотриена, супероксидного аниона, тромбоцитоактивирующего фактора.
Контроль за реализацией иммунной и воспалительной реактивности осуществляется системой цитокинов. Именно баланс взаимоотношений между про- и антивоспалительными медиаторами, при физиологических условиях, способствует созданию условий для уничтожения патогенов и поддержания гомеостаза. При нарушении баланса цитокиновой системы превалируют деструктивные эффекты медиаторов воспаления. Концентрация отдельных провоспалительных цитокинов в крови в норме обычно не превышает 5—20 пкг/мл, может возрастать в 5—10 и более раз, все это приводит к нарушению проницаемости и функции эндотелия капилляров, запуску синдрома ДВC (диссеминированное внутрисосудистое свертывание крови), формированию отдаленных очагов системного воспаления.
Осложнение распознается с трудом
СБП представляет трудно разрешимую диагностическую задачу для клинициста и является одним из наиболее тяжелых и трудно распознаваемых осложнений декомпенсированного ЦП.
Очень редко заболевание дебютирует картиной септического шока, проявляющегося снижением АД ниже 90 мм рт. ст., тахикардией более 100 ударов в 1 мин, олигурией менее 20 мл в 1 час. Многие авторы подразделяют симптомы СБП на местные (боль в животе, рвота, диарея, признаки пареза кишечника) и системные проявления инфекции: лихорадка (повышение температуры выше 37,4 ?С), лейкоцитоз (повышение числа лейкоцитов выше 10 х 109 кл/л), а также энцефалопатия, быстро нарастающая печеночная недостаточность, гепаторенальный синдром. Почечная недостаточность является одним из наиболее грозных осложнений, в значительной степени определяющих прогноз. В связи с этим любое клиническое ухудшение у больного ЦП, осложненным отечно-асцитическим синдромом, может являться следствием СБП.
Диагностика СБП многие годы основывалась на выявлении микроорганизмов в асцитической жидкости с использованием посева на специальные среды. В литературе широко обсуждался вопрос о целесообразности и безопасности диагностического парацентеза при отсутствии подозрений на СБП. До настоящего времени обязательным в диагностике СБП считается исследование асцитической жидкости с проведением подсчета числа полиморфноядерных лейкоцитов (ПЯЛ), определение содержания белка, концентрации альбумина, посева асцитической жидкости на культуральные среды.
Перед диагностическим парацентезом, как правило, проводится УЗИ, при котором в асцитической жидкости могут быть визуализированы нити фибрина, взвесь. При бактериальном перитоните вне зависимости от этиологии увеличивается количество и калибр взвешенных частиц, выявляются множественные нити фибрина, свободно колеблющиеся в асцитической жидкости в такт дыхательным движениям.
В общепринятой клинической практике диагностика СБП основывается на количественном определении содержания нейтрофилов в асцитической жидкости и результатах культурального метода. В соответствии с международными рекомендациями достаточным для постановки диагноза СБП является количество ПЯЛ, равное 250 кл/мм?.
В зависимости от числа нейтрофилов и идентификации возбудителей инфекции выделяют 3 формы проявления СБП:
I — классический, полный вариант СБП. Асцитическая жидкость содержит более 250 ПЯЛ на мм?, дает рост культуры при высевании. Такое сочетание определяет назначение антибактериальной терапии.
II — культуро-негативный нейтрофильный асцит, когда асцитическая жидкость содержит более 250 ПЯЛ на мм?, не дает ростa культуры при высевании. Это состояние также требует обязательного проведения антибактериальной терапии.
III — культуропозитивный асцит с низким содержанием нейтрофилов. Асцитическая жидкость содержит менее 250 ПЯЛ на мм?, дает рост культуры при высевании.
Однако пока остается неясным, какова правильная тактика по отношению к той группе больных, где имеет место клиническая картина СБП, но отсутствует нейтрофилез в асцитической жидкости, а посев жидкости и крови не дает роста, поскольку совершенно очевидно, что такие больные вызывают тревогу у врачей и требуют особой клинической настороженности. Низкая чувствительность метода культивирования асцитической жидкости на средах не позволяет исключить и так называемый IV вариант течения СБП — ложнокультуронегативный с низким содержанием нейтрофилов и наличием клинической картины СБП.
Амилаза и липаза — важные критерии
Дифференциальная диагностика СБП основана на исключении перитонита вторичного генеза, определении основного заболевания, вызвавшего асцит, исключении асцита смешанного генеза, определении наличия инфицированности асцитической жидкости. Наиболее часто у больных с декомпенсированным ЦП проводится дифференциальный диагноз между СБП и вторичными перитонитами, среди которых наиболее часто встречается панкреатит, а также туберкулез. Во многом это связано с тем, что большая часть больных СБП страдает ЦП алкогольной этиологии, хроническим панкреатитом, туберкулезом.
Инфекционные осложнения с поражением поджелудочной железы и забрюшинного пространства развиваются у 40—70% больных панкреонекрозом. Особенно трудна диагностика панкреонекроза у больных с ЦП алкогольной этиологии с транзиторным асцитом, продолжающих злоупотребление алкоголем, когда нарастание асцита может ошибочно расцениваться как проявление отечно-асцитического синдрома. Основными клинико-морфологическими формами панкреатической инфекции являются инфицированный панкреонекроз и панкреатогенный абсцесс, нагноение псевдокисты поджелудочной железы.
Важными диагностическими критериями является повышение уровня амилазы и липазы в асцитической жидкости. В качестве критерия инфицированности применяется определение С-реактивного белка, прокальциотонина.
Во всех случаях необходима оценка клинической картины заболевания, с учетом причин, которые могут вызвать перитонит у больных и без асцита. Число нейтрофилов в асцитической жидкости, как правило, в этих случаях превышает 500 кл/мм3. Наиболее характерным является повышение уровня лактатдегидрогеназы >225 mU/L, общего белка >1 г/дл, снижения глюкозы до 50 мг/дл. По данным УЗИ при вторичном перитоните значительно чаще, чем при СБП, выявляются множественные нити фибрина. Решающее значение в этих случаях имеет лапароскопия.
В дифференциальной диагностике первичного и вторичного бактериальных перитонитов всегда стоит вопрос о целесообразности проведения диагностической лапаротомии или лапароскопии. Хорошо известно, что при ЦП с осложненным течением внутрибрюшные хирургические вмешательства часто имеют неблагоприятный исход. Оперативное вмешательство, даже малоинвазивное, целесообразно только при подозрении на ургентную патологию, поскольку может осложнять течение СБП, приводить к острой печеночной недостаточности.
Международный клуб асцита рекомендует
В соответствии с Рекомендациями Международного клуба асцита подходы к лечению больного с СБП при ЦП могут быть представлены следующим образом. Необходимы, во-первых, антибактериальная терапия, во-вторых, парацентез с возмещением объема плазмы альбумином, в-третьих, лечение и профилактика осложнений.
Антибактериальную эмпирическую терапию проводят цефалоспоринами III поколения (цефотаксим, цефтизоксим, цефтазидим, цефоницид). Наиболее хорошо изученный и часто применяемый препарат из этой группы цефотаксим назначается каждые 12 часов в течение 5 дней в/в, минимальная разовая доза 2 г. Амоксициллин/клавунат калия по эффективности сравним с цефотаксимом, применяется в/в 1,2 г каждые 6 часов в течение 5—7 дней.
Точка зрения на выбор антибиотиков первой линии на сегодняшний день неоднозначна, что связано с ростом резистентности микроорганизмов к антибиотикам. Больным неосложненным СБП (при отсутствии шока, илеуса, гастроинтестинального кровотечения, выраженной печеночной энцефалопатии или повышения сывороточного креатинина более 3 мг/дл), не получавшим ранее профилактически фторхинолоны, может быть рекомендован офлоксацин внутрь в дозе не менее 400 мг каждые 12?часов. Есть исследования, указывающие, что по эффективности применение таблетированного ципрофлоксацина по 500 мг каждые 12 часов не уступает по эффективности цефотаксиму и цефтриксону и даже превосходит их по эффективности в лечении СБП.
В соответствии с международными рекомендациями эффективность проведения адекватной антибактериальной терапии достигает 90%, и она оценивается по снижению содержания ПЯЛ менее 250 кл/мм3 в асцитической жидкости, по исчезновению местных и системных проявлений инфекции.
Оптимальным критерием эффективности считается снижение числа ПЯЛ в асцитической жидкости через два дня от начала антибактериальной терапии по сравнению с исходными показателями. В связи с этим в ходе терапии рекомендуется проводить хотя бы один повторный парацентез через 48 часов от начала терапии. Критериями же неэффективности считается ухудшение состояния в течение первых часов антибактериальной терапии, а также снижение числа ПЯЛ в асцитической жидкости менее чем на 25%.
При отсутствии эффекта от антибактериальной терапии рекомендуется смена антибиотика с учетом чувствительности микрофлоры или эмпирически при отрицательных результатах посева, а также необходимо проведение более тщательной дифференциальной диагностики с вторичным перитонитом.Парацентез с возмещением объема плазмы альбумином рекомендуется к применению при лечении рефрактерных асцитов. Взгляд на эффективность и безопасность этой методики у пациентов с СБП остается спорным.
Непреложной истиной является необходимость проведения мероприятий, направленных на предупреждение и лечение осложнений ЦП, являющихся факторами риска СБП, первичную профилактику СБП.
В настоящее время большие рандомизированные исследования показали высокую эффективность непрерывной профилактики СБП с применением фторхинолонов у больных ЦП, перенесших СБП. В соответствии с Международными рекомендациями профилактика возвратного бактериального перитонита проводится непрерывно норфлоксацином по 400 мг/сут. В связи с низкой выживаемостью после первого эпизода спонтанного перитонита, которая в течение первого года составляет 30—50%, а в течение второго всего 25—30%, рекомендуется рассматривать таких пациентов в качестве кандидатов на трансплантацию печени.
Спонтанный бактериальный перитонит при циррозе является распространенным осложнением, характеризуется высокой смертностью, поздней выявляемостью. Существующие методы диагностики являются либо недостаточно чувствительными, либо обладают низкой специфичностью, сложны в практическом применении, длительны по срокам выполнения. Все это делает актуальными проблемы поиска и разработки новых методов диагностики, лечения и профилактики подобного заболевания.
В связи с расширением представлений о патогенезе спонтанного бактериального перитонита, позволяющим оценить роль избыточного бактериального роста, процессов микробной транслокации, обоснован интерес гепатологов к бактериальным препаратам пробиотикам и эубиотикам в аспекте лечения этого заболевания.
Диагностика вторичного бактериального перитонита требует срочного хирургического вмешательства.
- Портальная гипертензия (градиент концентрации альбумина сыворотка-асцит ≥11 г/л).
Этиология асцита в 90% случаев связана с хроническими заболеваниями печени: портальной гипертензией (развившейся вследствие цирроза печени ), алкогольным гепатитом, обструкцией печеночной вены (синдром Бадда-Киари).
Непеченочными причинами асцита могут быть: заболевания сердца ( сердечная недостаточность , констриктивный перикардит), злокачественные новообразования (карциноматоз, псевдомиксома брюшины), заболевания брюшины (инфекционный перитонит), выраженная гипоальбуминемия (нефротический синдром), другие болезни (опухоли и кисты яичников, панкреатит , саркоидоз , системная красная волчанка, микседема).
Факторы риска возникновения асцита:
Читайте также: