Бактерии против вируса спида
Где не справляется человеческая — справится бактериальная иммунная система.
Возможности применения CRISPR / Cas9 для генной терапии вируса иммунодефицита человека
Вирус иммунодефицита человека (ВИЧ) атакует клетки иммунной системы, а именно CD4 + Т-хелперы, оставляя организм человека жертвой возбудителям самых разных инфекций. Однако, сколь бы невероятным ни казалось бы вам такое утверждение, на помощь человеку в наиболее трудный час приходит иммунная система бактерии. Упомянутый вирус окутан туманной аурой различных мифов: будто бы его выпустили ЦРУ для контроля населения Африки, или это сделали китайцы с той же целью против США, а интернет-сообщения об изобретении чудодейственных лекарств против ВИЧ появляются чуть ли не каждый час. В то же время, каждый год в мире публикуются тысячи научных работ по исследованиям наноскопического убийцы. Факт: интересно, что знаменитые японские традиции с травами у современных гейш позиционируют себя, как Анти-Вич.
Вирус ВИЧ с хладнокровным безразличием делает свое убийственное дело. Мы же с вами оставим в стороне спекуляции и сговоры, которые, конечно, не имеют ничего общего с реальностью, (как и то почему женщины тупят за рулем) и критически оценим возможности применения бактериальной системы защиты от фагов CRISPR / Cas9 в борьбе с ВИЧ / СПИДом, мимоходом смакуя красивые моменты из истории генной терапии этой недуга.
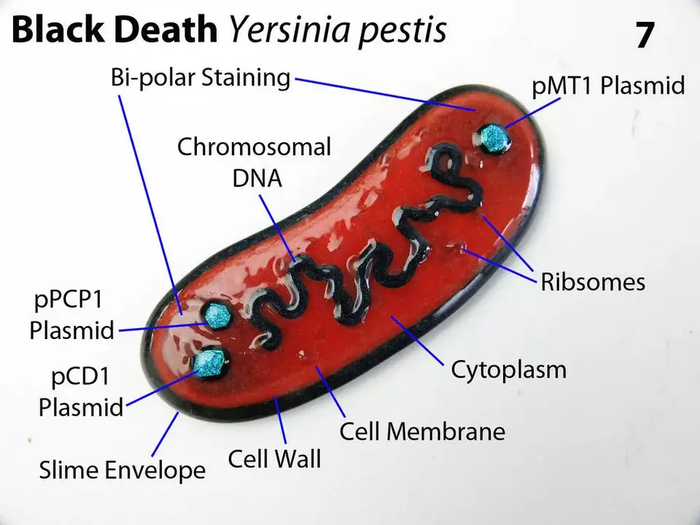
Пример 1. Резистентность к вирусу носителей гомозиготной мутации CCR5-32, которая является делецией 32-х пар оснований с 794 по 825 нуклеотида. Такая делеция по сути нонсенс. Приводит к сдвигу и появлению преждевременного стоп-кода. Поэтому, такие индивиды экспрессируют CCR5 на поверхности иммунных клеток, чувствуют себя хорошо и не болеют СПИДом. По данным генетиков носителями такой мутации являются до 18% жителей Европы, а в ее северной части до 20%. Существует предположение, что высокая частота такой мутации вызвана селективным давлением на человеческую популяцию таких патогенов как Yersinia pestis (возбудитель чумы) и Variola virus (возбудитель оспы) в течение длительного времени.
Пример 2. В 2008 году пациенту с ВИЧ / СПИД, у которого на фоне иммунодефицита наблюдалось развитие острого лимфобластного лейкоза, была осуществлена трансплантация костного мозга от здорового донора, гомозиготного с CCR5-32 мутацией. Операция прошла успешно, и заодно с лейкемией его таким образом вылечили от ВИЧ. Точнее сказать, у него наблюдался резкий спад количества вируса в крови, но, как известно, пациенты после трансплантации от неродственного донора должны постоянно принимать иммунодепрессанты для предотвращения возможного отторжения. Поэтому, такова циничная ирония судьбы.
Пример 3. В ходе исследования больных гемофилией, которые получали фактор VIII из сыворотки крови человека, оказалось, что они были невосприимчивы к ВИЧ. Исследование проводилось в середине 80-х, когда о ВИЧ только узнали — обязательного скрининга доноров сыворотки тогда еще не проводили. Выяснилось, что у пациентов-гемофиликов были повышенные уровни экспрессии бета-хемокинов. Последние конкурировали с лентивирусом (в том числе ВИЧ) за связывание с CCR5 рецептором, не давая ему шанса пробраться в клетку.
По состоянию на 2015 год Национальный Институт Здоровья США суммарно профинансировал три десятка лабораторий на сумму 10000000 докризисных долларов, поставив им задачу разработать эффективную генную терапию от СПИДа и проработать вопрос как поднять иммунитет ребенку. Это не считая 14000000, которые получил нобелевский лауреат Дэвид Балтимор на разработку супер-антитела против вируса имонудефицита. Поэтому, как видим, американские ученые достаточно плотно взялись за эту проблему.
Вообще все подходы генной терапии СПИДа имеют несколько похожих этапов: ученые забирают клетки крови пациента из коровотока или непосредственно из костного мозга, обогащают препарат на клетки, на какие именно нацелен вирус, вносят генетические модификации в них разными путями, и возвращают клетки обратно пациенту. Главные отличия заключаются в типе генного вектора, используемого для осуществления модификации, а также в способе культивирования клетки перед процедурой трансфекции, что в свою очередь зависит от степени дифференцированности клеток, которые берутся — предшественники миело- и лимфопоэза, которые уже стали на путь дифференцировки ( так называемые committed progenitor cells ), или недифференцированные стволовые клетки кроветворения. Ключом к успешности терапии является как эффективная трансформация большого количества клеток, так и выживаемость клеток после возвращения в организм пациента. Следует отметить, что существуют многочисленные стратегии генной терапии ВИЧ, но, при невозможности охватить их все, мы сосредоточимся именно на тех, которые направлены против гена CCR5.
Во-первых, принципиально невозможно достичь 100% трансформации всех клеток (Т-хелперов и дендритных клеток). На самом деле, вероятность вставки гена даже путем гомологичной рекомбинации настолько низкая, что просто не позволит получить нужное количество модифицированных клеток, где intrabody или siRNA было бы достаточно для успешного подавления CCR5. Но это, еще полбеды, поскольку даже такая неопределенная вставка может теряться (через еще одно рекомбинационное событие) в течение первого же года после терапии. И в таком случае синтез функционального CCR5 рецептора будет возобновляться.
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
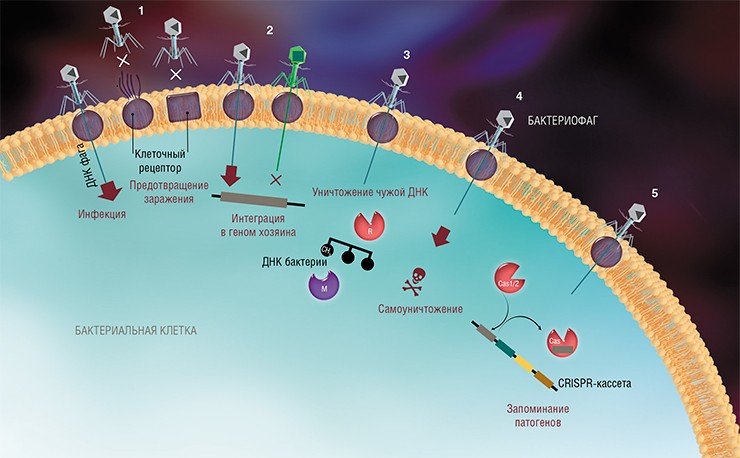
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)
— Валерий Владимирович, насколько опасен новый коронавирус для ВИЧ-инфицированных?
— Наверное, правильнее будет оценивать новый вирус с позиции опасности для всего человечества. Да, если говорить простым языком, люди со сниженным иммунитетом находятся в группе риска. Но в первую очередь рискуют пожилые и беременные. Пациенты с ВИЧ при условии своевременного регулярного приема антиретровирусной терапии не отличаются от обычных людей. У них тот же период наблюдения, те же меры профилактики, та же ответственность перед обществом.
— Как вы относитесь к призыву не выходить из дома?
— Нужно его услышать и выполнить, и неважно, хороший у вас иммунитет или нет. Молодым тоже нужно побыть в изоляции — пусть они лучше переносят эту инфекцию, но они могут стать источником для близкого возрастного человека и не близкого. Нужно понимать, что возрастные люди рискуют не просто заболеть, а получить осложнения и умереть.
Ведущие инфекционисты и эпидемиологи мира пока не могут спрогнозировать, что будет завтра. У нас нет способа профилактики — вакцины, поэтому разобщение самый эффективный метод. Это один из законов эпидемиологии.
— Говорят, что коронавирус лечат теми же препаратами, что и ВИЧ. Это правда?
— Да, поэтому еще нужно выяснить, кто в большей группе риска — ВИЧ-инфицированные или остальные люди. Пациент, принимающий антиретровирусную терапию, может переболеть коронавирусом в легкой форме и даже не отличит его от ОРВИ.
Исторически сложилось так, что в ситуации, когда нет препарата против нового вируса, пробуют то, что имеется в арсенале. После ряда эпидемий в 2000-х годах врачи поняли, что ВИЧ-препараты работают.

— Как будет развиваться вирус? Может ли он мутировать и стать более опасным и для молодых людей?
В период пандемии уровень летальности выше, чем год спустя. Тот же вирус 2009 года уже перешел в категорию сезонного, он циркулирует, но за последние 10 лет потерял свою вирулентность — стал менее зловредным. С коронавирусом все пока непонятно, но скорее всего, с ним будет то же самое. А может, он и вовсе исчезнет.
— Что вы думаете по поводу рекламы противовирусных средств, которая утверждает о якобы эффективности против нового вируса? Некоторых производителей уже проверяет антимонопольная служба.
— Дело в том, что рекомендации исходят из инструкции, в которой может быть указано, что препарат работает в отношении коронавируса. Но нужно понимать, что коронавирус — это не новое для человечества явление. Просто тот, что обнаружили в Китае — новый. Поэтому к такой рекламе я отношусь в зависимости от того, как в ней расставлены акценты. Сейчас еще ведутся исследования нескольких десятков препаратов, существующих на рынке.
— Как вы относитесь к антипрививочникам и ВИЧ-диссидентам? Они сильно мешают борьбе с инфекциями?
— Крайне негативно отношусь к этим явлениям — как врач, который старается сохранить жизнь пациенту и улучшить качество его жизни. Мы сталкиваемся с единичными эпизодами ВИЧ-диссиденства. Неверие в сам факт болезни, отказ от лечения — это трагедия для одного человека. Но когда мать отказывается ребенка лечить — это катастрофа.
Что касается антипрививочников — все они сравнительно молодые люди, которые никогда не видели эпидемий, последствий дифтерии, полиомиелита, кори, паротита. Это как раз те заболевания, прививки от которых входят в национальный календарь. Причем сами антипрививочники привиты в большинстве случаев.

Никто не говорит, что вакцина абсолютно безопасна — как у любого эффективного препарата, у нее есть противопоказания и побочные эффекты. Но без вакцины мы получим вспышку. Если болезни нет, это не значит, что вокруг нет ее возбудителей. И привитость не исключает факт носительства.
— Периодически всплывают новости, что ученые создали вакцину против ВИЧ. Что вы думаете по этому поводу? Будет ли такая вакцина когда-нибудь?
— Каждый выпуск новых врачей приходит к нам с информацией о вакцине, которая вот-вот появится. Но пока по факту ее нет. А все разговоры о том, что якобы кто-то скрывает готовую вакцину — на уровне слухов, доказательств этому нет.
— То есть, вылечить ВИЧ пока невозможно?
— Вылечиться — это значит либо избавиться от болезни, либо выработать устойчивость к возбудителю. При ВИЧ такое пока невозможно. Все варианты помощи при этой инфекции сводятся к подавлению вируса до неопределяемого показателя. Он есть в организме, но он не вредит.
— А существуют ли люди, которые не подвержены заражению ВИЧ?
— Да, это люди с генетической мутацией белка, куда встраивается вирус. Из-за этого ВИЧ просто не может закрепиться на поверхности клетки и заразить ее.
— Были ли у нас случаи умышленного заражения ВИЧ?
— Прямо умышленного не припомню. Было неинформирование партнера, из-за чего люди подавали иски в суды. Но на моей памяти эти процессы закончились мировыми соглашениями.

— Однозначно ответить сложно. У нас есть проблема антибиотикорезистентности — когда из-за бесконтрольного употребления либо устаревания антибиотики перестают работать при известных болезнях. Это реально представляет опасность для человечества. Новых антибиотиков не появляется, и сомнительно, что кто-то изобретет суперантибактериальные средства.
В отношении вирусов все тоже очень сложно. ВИЧ сейчас нельзя уничтожить, и в целом человечество не вооружено на 100% в отношении инфекционных агентов. И если пофантазировать, что появится какой-то новый вариант… Да вот пример — коронавирус. Кто думал об этом еще полгода назад?
— Как думаете, вакцину от коронавируса изобретут?
— Думаю, да. По наблюдениям ведущих специалистов, коронавирус довольно устойчивый, он не меняет состав белков на своей поверхности, его структура не меняется. Это очень важно для создания вакцины.
А вот ВИЧ и вирус гепатита С многократно меняются в организме, у них нет маркеров-зацепок, в отношении которых могла бы сработать вакцина. Они просто быстрее меняются, прежде чем вакцина создается.
Факт
ЧИТАЙТЕ ТАКЖЕ:
Количество заболевших коронавирусом в Барнауле: последние новости на 30 марта 2020
Вместе с первой заболевшей коронавирусной инфекцией жительницей Барнаула в одном самолете летели несколько депутатов Госдумы , известные в крае бизнесмены и депутат Алтайского Заксобрания (подробнее)
Все больше людей приходят сдать анализ в алтайский СПИД-центр (подробнее)
Испытано на себе. Как провести анализ на ВИЧ в домашних условиях
Экспресс-тесты на наличие вируса иммунодефицита можно купить в обычной аптеке [видео]
"От коронавируса померло 2000 человек, и весь мир надел марлевые повязки. А ВИЧ больны 30 миллионов, но гондоны никто не надевает.
Сравнение для дебилов.
Коллективное бессознательное во всей красе. Про короновирус кричат из всех новостных щелей, вот все и думают о нем постоянно.
"ВИЧа нет", а СПИД возникает из-за грехов.
ну так то и по улицам мало кто ходит хуями размахивает
Ну, не знаю. Я голым писюном не размахиваю. Сложил его калачиком в трусах и занимаюсь своими делами.
В газете статский физкультурник, которой у меня стены под обоями оклеены.
Эволюция живых организмов, происходящая прямо на глазах

У эволюции много доказательств:
морфологические, эмбриологические палеонтологические, биохимические, биогеографические, и генетические. Самые наглядные - это филогенетические ряды, на которых можно поэтапно пронаблюдать изменения в строении животных. Правильно расставить порядок скелетов позволяет радиоизотопный и другие виды анализов возраста окаменелостей.

Здесь, например, вы можете посмотреть, как исчезли пальцы, возникли копыта и изменилась форма черепа лошади. Но креационистам мало подобных филогенетических рядов. Они говорят, что пока эволюцию вживую никто не видел, она не может называться фактом. И мутации не бывают полезными. Чтобы это опровергнуть, вспомним историю австралийских кроликов

В Австралию завезли кроликов, и они быстро расплодились, нанося вред сельскому хозяйству. Тогда учёные использовали вирус миксоматоза. Вирус очень быстро выкашивал кроликов, добрался даже до домашних. Часть кроликов, пережившая эпидемию, сново расплодилась. Но у них было отличие от предыдущих поколений. Это мутация в гене, кодирующем интерферон IFN-α21A. Это влияет на иммунную систему и ее борьбу с вирусом. То есть несмотря на то, что мутации чаще редки и приводят к болезням, порой они приводят и к положительным изменениям. Это эволюция.

Ещё более интересна ситуация, произошедшая с итальянской стенной ящерицей. Тут речь идёт о более радикальных изменениях. Экспериментаторы перевезли их с острова Копиште в Адриатике на соседний остров Мрчару. Там было много травы и не было хищников. Через 36 лет у ящериц изменилось страница тела. Поскольку травы было много, насекомоядные рептилии стали травоядными, их челюсти стали более массивными и сильными для переживывания травы. В их пищеварительной системе появилось место для бактерий, которые помогают переварить траву. Поскольку им больше не надо было быть юркими, чтобы убегать от хищников, они стали большими и неповоротливыми.

Но креационистам этого не достаточно. Их ведь и селекция как доказательство не устраивает. Они хотят увидеть более серьезные изменения в строении организмов. Но полезным мутациям нужно накопиться, чтобы изменения было серьезны, поэтому такая эволюция длится миллионы лет. Неужели мы не можем посмотреть на эволюцию? Можем. Благодаря вирусам и бактериям, у которых смена поколений происходит гораздо быстрее. Учёные в лабораториях наблюдают, что кардинальные изменения в строении вирусов и бактерий происходят не мгновенно, по воле божьей, а засчет процесса накопления полезных мутаций. То есть строение вируса или бактерии продиктовано эволюцией.
Когда смотришь на то, как совершенно устроены животные, кажется, что такое разумное строение мог обеспечить только разумный создатель. А у вирусов и бактерий, напомню, доказано, что строение обусловлено эволюцией. И они устроены не менее "разумно", чем животные. Порой они даже похожи на роботов.
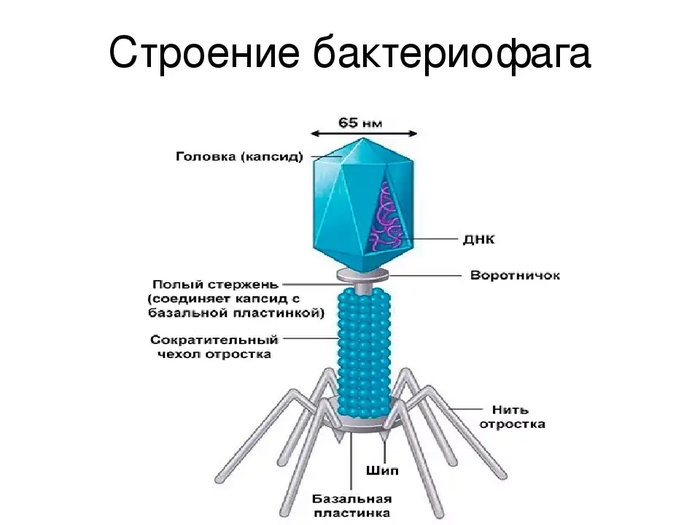
Рассмотрим, к примеру, вирус бешенства. Он поражает мозг заражённого животного именно таким образом, чтобы вызвать у него агрессию. Тогда жертва кусает других и переносит вирус. Разумно? Разумно.

Или вирус СПИДА. Он поражает именно своих главных врагов в теле человека - клетки иммунной системы. В результате организм не способен ему противостоять и выздороветь. Разве не гениально он устроен?
Или чума.. Бубонная чума размножается в глотке блохи и перекрывает ее. Блоха не может пить. В результате насекомое в порыве жажды мечется от жертвы к жертве, отчаянно пытаясь напиться,и заражает чумой больше жертв. Тоже разумно. Но это бактерия, а доказано, что они формируются в процессе эволюции.
А напомню, что с животными происходят те же процессы, что и при эволюции бактерий, только медленные. Мы не можем увидеть в лаборатории эволюцию животных, но благодаря микроорганизмам мы всё же можем пронаблюдать ее вживую.

![]()
Короновирус .

![]()
В Златоусте для медика, которой в глаза попала кровь ВИЧ-инфицированного, второй день ищут противовирусный препарат
По ее словам, накануне вечером фельдшер в темном подъезде оказывала помощь ВИЧ-инфицированному мужчине, у которого уже развился СПИД. Кровь пациента брызнула в глаза медику.
По словам депутата, главврач станции скорой помощи Златоуста заявила, что давала поручение закупить противовирусные средство еще прошлом году, но почему-то этого сделано не было.
В результате необходимое лекарство нашлось только в областном ВИЧ-центре в Челябинске. Сегодня его передадут в Златоуст.
В Минздраве региона оперативно прокомментировать ситуацию не смогли

![]()
Второй пациент вылечен от ВИЧ: новый рубеж в борьбе с глобальной эпидемией СПИДа
Учёные долго пытались повторить последовательность действий, которые привели к первой долгосрочной ремиссии 12 лет назад. С так называемым “Лондонским пациентом” у них, кажется, получилось.

Уже во второй раз с начала глобальной эпидемии пациент излечен от ВИЧ-инфекции – вируса, который вызывает СПИД.
Новость появилась почти через 12 лет после того, как стало известно об излечении первого пациента – о подвиге, который учёные долго и безуспешно пытались повторить.
Исследователи опубликовали свой доклад в журнале “Nature” и представили некоторые детали на конференции по ретровирусам и оппортунистическим инфекциям в Сиэтле. В данной публикации учёные описывают этот случай как долгосрочную ремиссию. В интервью же большинство экспертов называли это излечением, но с оговоркой, что очень сложно определить, какое слово стоит использовать, так как пока известно только два таких случая.
Оба выдающихся результата достигнуты благодаря пересадке заражённым пациентам костного мозга. Но в обоих случаях трансплантация предназначалась для лечения рака, а не ВИЧ.
Трансплантация костного мозга вряд ли станет предпочтительным вариантом лечения в ближайшем будущем. Сейчас для контроля ВИЧ-инфекции используются сильнодействующие препараты, пересадка же остается рискованным вмешательством из-за серьёзных побочных эффектов, которые могут длиться годами.
Однако, как говорят учёные, замена собственных иммунных клеток организма на специально модифицированные к сопротивлению ВИЧ-инфекции может успешно применяться на практике.
Доктор Венсинг соруководитель “IciStem” – консорциума европейских учёных, изучающих пересадку стволовых клеток в качестве лекарства от ВИЧ-инфекции. Консорциум поддерживается “amfAR” – американской организацией по изучению СПИДа.
Новый пациент предпочел сохранить анонимность, и учёные называют его исключительно “Лондонским пациентом”.
На той же конференции в 2007 году доктор из Германии описал первый случай излечения “Берлинского пациента”, позже идентифицированного как Тимоти Рэй Браун 52-х лет, сейчас проживающего в Палм Спрингс, Калифорния.
Эта новость, размещенная на плакате в задней части конференц-зала изначально не привлекла много внимания. Как только стало ясно, что мистер Браун вылечен, учёные начали попытки повторить этот результат с другими раковыми пациентами, зараженными ВИЧ.
Раз за разом вирус возвращался примерно через девять месяцев после того, как пациенты прекращали антиретровирусную терапию, или же пациент умирал от рака. Неудачи заставляли учёных гадать, останется ли излечение мистера Брауна счастливой случайностью.
У мистера Брауна была лейкемия, и после неудачной химиотерапии ему потребовалась пересадка костного мозга.
Трансплантация была от донора с мутацией белка CCR5, который находится на поверхности определенных иммунных клеток. ВИЧ использует этот белок, чтобы проникнуть внутрь клеток, но не может попасть в их мутированную версию.
Мистеру Брауну давали сильнейшие имуносупрессивные лекарства, которые больше не используются, он страдал от сильнейших побочных эффектов месяцами после трансплантации костного мозга. Его даже погрузили в искусственную кому, и он едва не умер.
У него была лимфома ходжкина, и он перенес трансплантацию костного мозга от донора с мутацией белка CCR5 в мае 2016 года. Ему также была назначена имуносупрессивная терапия, но лечение было менее интенсивным, согласно нынешним стандартам трансплантации.
Он перестал принимать лекарства от ВИЧ в сентябре 2017 года, что сделало его первым пациентом после Брауна, у которого не обнаружен вирус спустя более чем год после прекращения терапии.
Хотя “Лондонский пациент” после трансплантации не был болен так же сильно, как мистер Браун, вмешательство все равно сработало: трансплантация уничтожила рак без разрушительных побочных эффектов. Пересаженные иммунные клетки, устойчивые к ВИЧ, похоже, полностью заменили его собственные уязвимые клетки.
Большинство людей с мутацией устойчивости к ВИЧ, названной “Дельта 32”, североевропейского происхождения. В базе данных “IciStem” насчитывается около 22 тысяч таких доноров.
Пока учёные отслеживают 38 ВИЧ-инфицированных, перенесших пересадку костного мозга, включая шестерых с пересадкой от доноров без мутации. Лондонский пациент 36-й в этом списке. Другой, 19-й номер из списка, называемый также “Дюссельдорфским пациентом”, не принимает анти-ВИЧ терапию уже четыре месяца. Детали этого случая будут представлены на Сиэтльской конференции позже.
Консорциум учёных повторно проанализировал кровь “Лондонского пациента” на наличие вируса. Они увидели слабые признаки инфекции в одном из 24-х тестов, но говорят, что это может быть результатом загрязнения образца.
Большинство экспертов, которые знают подробности, согласны, что этот новый случай выглядит, как легитимное лечение, однако некоторые не уверены в его актуальности для терапии против СПИД в целом.
Несколько компаний стремятся разработать такие генные терапии, но еще не достигли успеха. Изменения должны быть нацелены на нужное количество клеток и в нужном месте – например, только в костном мозге, а не в головном мозге – и менять только гены, связанные с производством CCR5.
По словам доктора МакКьюна, сейчас над преодолением этих трудностей работает сразу несколько групп учёных.
В конце концов, у них может получиться вирусная система доставки, которая, после введения в организм, будет находить и удалять все рецепторы CCR5. А может быть, даже создадут стволовые клетки, устойчивые к ВИЧ, которые можно перенести любому пациенту.
Одним из важных предостережений для любого подхода является то, что пациент всё равно будет уязвим к форме ВИЧ X4, который использует другой белок, CXCR4, чтобы попасть в клетки.
Если у человека есть даже небольшое количество вируса X4, то его количество многократно увеличится в отсутствие конкуренции с его вирусными собратьями.
Существует как минимум один описанный случай пациента, которому пересадили “Дельта 32” от донора, но позже у него был найден вирус Х4. (В качестве предосторожности от вируса Х4 мистер Браун ежедневно принимает таблетки для предотвращения ВИЧ).
Читайте также:


