Биологические особенности онкогенных вирусов
ВНИМАНИЕ! САЙТ ЛЕКЦИИ.ОРГ проводит недельный опрос. ПРИМИТЕ УЧАСТИЕ. ВСЕГО 1 МИНУТА.
ПЛАН
1. Общая характеристика вирусов. Формы существования, химический состав. Размножение вирусов, классификация вирусов, ДНК – содержащие вирусы.
2. Семейство аденовирусов, ультраструктура и методы культивирования их. Роль аденовирусов в возникновении острых респираторных и острых кишечных вирусных инфекций.
3. Семейство герпесвирусов, морфологические особенности. Роль вирусов простого герпеса в возникновении лабиального и генитального герпеса.
4. Герпес зостер – этиологический фактор ветряной оспы и опоясывающего лишая.
5. Особенности цитомегаловируса, его роль в патологии. Роль вируса Эпстейна – Барра в этиологии инфекционного мононуклеоза и карциномы носоглотки.
Общая характеристика вирусов. Формы существования, химический состав. Размножение вирусов.
Основоположником вирусологии является Д.И. Ивановский, который в 1892 г. открыл вирус мозаичной болезни табака.
Вирусы содержат только один тип НК: ДНК или РНК.
Две формы существования:
§ внеклеточная (корпускулярная, покоящаяся);
§ внутриклеточная (репродуцирующая, вегетативная);
внеклеточные вирусы представляют собой корпускулы- частицы различной формы (сферической, кристалловидной, нитевидной), которые называют вирусными частицами, элементарными тельцами, а чаще - вирионами. Размеры вирионов от 15-30 до 200-500 нм. Можно увидеть большинство вирусов только с помощью электронного микроскопа.
Вирусы просты по строению: не имеют цитоплазмы, ядра, других органелл, у многих отсутствуют ферменты.
Различают простые и сложные вирионы:
Структура простого вириона
2. Капсид (белковая оболочка)
3. Суперкапсид (внешняя оболочка)
Суперкапсидные вирусные полимеры выполняют функции:
- распознают специфичные клеточные рецепторы и взаимодействуют с ними
- обуславливают проникновение вирусов в клетки, легко сливаясь с клеточными мембранами, вследствие чего их называют белками слияния.
В корпускулярной форме вирус обладает скрытой инфекциозностью. Проявляется она вслед за проникновением в клетку вирионной НК, которая и представляет собой внутриклеточную форму, вступающую в определенные взаимоотношения с генетическим аппаратом клетки-хозяина. По этому признаку выделяют две группы вирусов:
§ инфекционные вирусы: с автономной репликацией НК и продукцией вирионов (продуктивная инфекция). Эти вирусы угнетают функцию клеток, деформируют и разрушают их;
§ интеграционные - способны интегрироваться с геномом клетки и индуцируют злокачественное перерождение клеток или трансформируют их АГ структуру. Характер взаимодействия вирусной НК с клеткой позволяет называть вирусы генетическими паразитами, а вызываемые ими инфекции – молекулярными. При взаимодействии вируса и клетки происходит встраивание вирусной НК в ДНК клетки хозяина, возникает вирогения –форма сосуществования вируса и клетки хозяина, происходит синхронная репликация вирусной и клеточной ДНК. У фагов это называется лизогения.
Биологические особенности вирусов
Вирусы не имеют собственного метаболизма, поэтому не нуждаются в ферментах. Однако у некоторых вирусов выявлено наличие ферментов, способствующих проникновению в клетку хозяина. Например, у вирусов гриппа А обнаружена нейраминидаза, отщепляющая нейраминовую кислоту, содержащуюся в оболочках животных клеток. У фагов – обнаружен лизоцим, разрушающий клеточную оболочку.
Репродукция (размножение) вирусов, стадии:
1. Начинается адсорбция к клетке за счет рецепторов капсида (суперкапсида).
2. Проникновение в клетку хозяина.
4. Репликация (воспроизведение) НК и синтез вирусных белков. Эта стадия происходит при участии ДНК или РНК клетки хозяина.
5. Сборка вирусов – самосборка белковых частиц, вокруг вирусной НК. У некоторых вирусов самосборка происходит в цитоплазме, у других в ядре.
6. Выход вируса из клетки хозяина путем просачивания вируса через оболочку клетки либо через отверстие, образовавшееся в клетке хозяина (в этом случае клетка хозяина погибает).
Вирусы являются внутриклеточными паразитами, которые не способны размножаться вне клетки организма-хозяина. В данном случае мы имеем дело с единственной известной на данный момент внеклеточной формой жизни. В отличие от других микроорганизмов, абсолютно все вирусы являются паразитами.В соответствии с тканями-мишенями можно условно разделить вирусы на дермотропные, нейротропные, пневмотропные (поражающие дыхательные пути).
Семейство аденовирусов
Таксономия аденовирусов: ДНК-содержащиевирусы, семейство Adenoviridae, род Mastadenovirus, вид аденовирусы; различают 91серовар, из них 41 – у людей. Выделены из аденоидов в 1953 г. У. Роу.
Ультраструктура.
Вирионы аденовирусов имеют сферическую форму, икосаэндрический тип симметрии (кубический), нуклеоидсостоит из двунитчатой линейной ДНК; нуклеокапсид в диаметре 70-90 нм. Внешняя оболочка отсутствует.
Биологические свойства.
Аденовирусы довольно устойчивы во внешней среде: длительно сохраняются в воздухе, воде, на предметах обихода, не инактивируются эфиром и хлороформом; при 56 0 С разрушаются через несколько минут.
Аденовирусы культивируются в клетках почек и перевиваемых эпителиальных клетках с выраженным ЦПД: вызывают образование внутриядерных включений и деструкцию монослоя.
Патогенез, клиника, иммунитет.
Аденовирусы человека вызывают острый катар верхних дыхательных путей, пневмонии, конъюнктивит, гастроэнтериты (этиологически чаще всего связанные с 1-7, 14, 40 и 41-м сероварами).
Источником инфекции являются больные, реконвалесценты и здоровые носители. Наиболее восприимчивы к аденовирусам дети от 6 месяцев до 5 лет.
Механизм: воздушно-капельный и фекально-оральный.
Вирусы проникают в организм человека через верхние дыхательные пути, локализуются в ткани аденоидов или миндалин, поражают слизистую оболочку респираторного тракта.
Некоторые аденовирусы (12, 18, 31 серовары) обладают онкогенными свойствами.
Аденовирусные инфекции по частоте заболеваемости занимают второе место после гриппа.
Аденовирусы человека непатогенны для животных.
Постинфекционный иммунитет типоспецифический.
Лабораторная диагностика.
Исследуют отделяемое слизистой оболочки носоглотки, конъюнктивы глаз, испражнения, сыворотку крови.
Методы:
1. Экспресс-диагностика: выявление антигенов аденовирусов в носовом отделяемом выявляют с помощью РИФ и ИФА.
2. Вирусологический: заражают материалом культуру клеток и инкубируют при 37 о С 14 дней. Наличие вируса определяют по ЦПД. Идентифицируют аденовирусы, определяют серовар в РН, РСК, РТГА.
3. Серодиагностика: с помощью РСК, РН, РТГА в парных сыворотках.
Средства специфической терапии и профилактики:
Для лечения больных рекомендуется использовать: трифторидин (вироптик) и рибавирин; закапывать в носовую полость и конъюктивальный мешок 0,05% раствор дезоксирибонуклеазы; внутримышечно вводить специфический иммуноглобулин; интерферон.
Для профилактики предложены:
- инактивированная формалином аденовирусная вакцина;
- живая поливалентная аденовирусная вакцина;
В обе вакцины входят серотипы 3, 4 и 7
ОРВИ, включая грипп, составляют комплекс сопряжённых инфекций, поэтому процесс распространения этих инфекций - единая сбалансированная система. В настоящее время известно около 170 видов возбудителей, вызывающих гриппоподобные заболевания, причём даже в период эпидемии на долю гриппа приходится не более 25-27% всех ОРВИ. При аэрозольном заражении возбудитель проникает в организм человека через слизистые оболочки верхних дыхательных путей и распространяется по бронхам в их нижние отделы. Входными воротами инфекции могут быть слизистые оболочки глаз, а также кишечника, куда вирус попадает при заглатывании слизи из верхних дыхательных путей. Вирус локализуется в клетках эпителия дыхательных путей и тонкой кишки, где происходит его размножение. В очагах поражения развивается воспалительная реакция, сопровождаемая расширением капилляров слизистой оболочки, гиперплазией подслизистои ткани с инфильтрацией мононуклеарными лейкоцитами и иногда кровоизлияниями в ней, что клинически проявляется ангиной, фарингитом, конъюнктивитом (часто плёнчатого характера), диареей. Иногда развивается кератоконъюнктивит с помутнением роговицы и нарушением зрения. Лимфогенным путём возбудитель проникает в регионарные лимфатические узлы, где происходят гиперплазия лимфоидной ткани и накопление вируса в течение инкубационного периода заболевания. В клинической картине эти механизмы обусловливают развитие периферической лимфаденопатии и мезаденита. В результате подавления активности макрофагов и повышения проницаемости тканей в дальнейшем развивается вирусемия с диссеминацией возбудителя по различным органам и системам. В этот период вирус проникает в клетки эндотелия сосудов, повреждая их. При этом часто наблюдают синдром интоксикации. Фиксация вируса макрофагами в печени и селезёнке сопровождается развитием изменений в этих органах с увеличением их размеров (гепатолиенальный синдром). Вирусемия и репродукция возбудителя в клетках эпителия и лимфоидной ткани могут быть длительными. Патологические изменения со стороны сердечно-сосудистой системы развиваются лишь при редких тяжёлых формах заболевания. Характерны приглушение тонов сердца и мягкий систолический шум на его верхушке. Поражения различных отделов дыхательных путей могут сочетаться с нарушениями со стороны ЖКТ. Возникают боли в животе и дисфункция кишечника (диарея особенно характерна для детей младшего возраста). Увеличиваются печень и селезёнка. Аденовирусная инфекция чаще поражает детей и лиц среднего возраста. Заболевание в среднем продолжается от нескольких дней до 1 нед, но при длительной задержке вируса в организме возможно рецидивирующее течение, при этом инфекция затягивается на 2-3 нед. Наиболее типичны отиты и гнойные синуситы, обструкция евстахиевой трубы у детей вследствие длительной гипертрофии лимфоидной ткани в глотке, ларингоспазм (ложный круп), вторичные бактериальные пневмонии, поражения почек. Прогноз заболевания обычно благоприятный.
Семейство герпесвирусы.
Таксономия: ДНК-содержащие вирусы, семейство Herpesviridae, подразделяется на три подсемейства: α - герпесвирусы, β – герпесвирусы, γ – герпесвирусы, родHerpesvirus, насчитывается около 50 видов.
Ультраструктура.Герпесвирусы имеют сложное строение вириона. Нуклеоид представлен двунитчатой ДНК с незамкнутыми концами, окруженной капсидом из 162 кап-сомеров, уложенных по кубическому типу симметрии, что придает вириону икосаэндрическую форму; диаметр вирионов 120-300 нм; есть суперкапсид с шиповидными отростками.
Биологические свойства.
Герпесвирусы чувствительны к эфиру, детергентам, низким значениям рН, повы-шенной температуре. Длительно сохраняются в лиофилизированном состоянии.
Вирусы различаются по своей способности репродуцироваться в курином эмбрионе.
Культивируются в клетках различных тканей: первично-трипсинизированные эмбриональные тканевые культуры, фибробласты и диплоидные клетки легких человека, в которых они вызывают ЦПД, выражающийся в постепенно нарастающей деструкции клеток.
Клинико-эпидемиологические особенности.
Герпесвирусы вызывают у человека:
· простой герпес (simplexherpes);
· ветряную оспу (varicella);
· опоясывающий герпес (zoster);
Три первых заболевания характеризуются лихорадкой и высыпаниями на коже и слизистых оболочках везикул (мелких пузырьков), наполненных прозрачной жидкостью. При простом герпесе - гингивостоматите – они локализуются по красной кайме губ вокруг рта, а при генитальной – на кожных покровах наружных половых органов.
Ветряночные везикулы появляются на лице, волосистой части головы, туловище и конечностях, а при опоясывающем герпесе – по ходу межреберных нервов.
Высыпание пузырьков сопровождается зудом, жжением, болью и общим недомоганием.
При благоприятном течении везикулы через несколько дней подсыхают, покрываются корочкой, которая отпадает, не оставляя рубцов. При тяжелых формах заболевания может произойти некротизация с обширным поражением кожи и слизистых, иногда пневмонии, менингоэнцефалит, гепатит.
Цитомегалия – воспаление слюнных желез, но цитомегаловирус может проникнуть в печень, селезенку, почки, костный мозг, вызывая желтуху, эритробластоз и летальный исход.
Источником инфекции при герпесвирусных заболеваниях являются вирусоносители и больные люди.
Первичное заражение вирусом простого герпеса происходит при родах, затем он мигрирует в тройничный нерв и нервные поясничные узлы, где сохраняются на протяжении всей жизни. Вирус ветряной оспы передается воздушно-капельным путемиликонтактным.
Цитомегаловирус передаетсядетям от матери при рождении и кормлении, а взрослым – при гемотрансфузиях и половых контактах.
Лабораторная диагностика.
Исследуют содержимое пузырьков, носоглоточные смывы, слюну, кровь, ликвор, биоптаты органов и секционный материал.
1. Вирусоскопический: а) при ветряной оспе в мазках, отработанных серебрением по Морозову, выявляют тельца Арагана; б) в биоптатах тканей, пораженных герепесвирусами и окрашенных по Романовскому-Гимзе, - гигантские многоядерные клетки с внутриядерными включениями; в) можно обнаружить вирусные антигены при помощи РИФ, РПГ.
2. Вирусологический: заражают культуру клеток и определяют наличие герпесвирусов по ЦПД, а идентификацию проводят с помощью РСК, РН, реже – ПЦР и ДНК-зондирование.
3. Серодиагностика: при ветряной оспе с помощью РСК в парных сыворотках.
Средства специфической терапии:
· убитая культуральная антисимплексгерпесная вакцина;
· аномальные нуклеозиды в виде мазей (0,5-5%) или растворов (0,1-0,5%): ацикловир, фамцикловир, ганцикловир;
· интерфероны и дезоксирибонуклеазы как примочки;
· антибиотики широкого спектра действия для профилактики вторичной инфекции.
Средства специфической профилактики:
· живая цитомегаловирусная вакцина;
· живая дивакцина (цитомегаловирусная в сочетании с аттенуированным вирусом краснухи);
PS. Обе вакцины применяют по эпидпоказаниям.
· противокоревой иммуноглобулин (для профилактики ветряной оспы, а в качестве стимулятора при простом герпесе).
Основное свойство онкогенных вирусов — способность вызывать развитие опухолей у лабораторных животных, у природных хозяев и трансформировать клетки в культуре тканей.
- РНК-содержащие — семейство Retroviridae, подсемейство Oncovirinae\
- ДНК-содержащие — семейства Papovaviridae и Adenoviridae, серотипы 12, 18 и 31,
- семейства Poxviridae, Herpesviridae, Hepadnaviridae.
Представители подсемейства Oncovirinae являются сложно организованными вирусами. Вирион состоит из сердцевины и суперкапсида с шипами. Размеры и форма шипов служат основой для подразделения вирусов на роды внутри подсемейства. В состав сердцевины входят капсид, построенный по кубическому типу, фермент (обратная транскриптаза, или ревертаза) и геном, представленный двумя идентичными нитями РНК. Онкогенные вирусы культивируют в первичных и перевиваемых культурах клеток. Вирусы культивируются в организме тех животных, для которых они обладают выраженной онкогенностью.
Вирусы чувствительны к эфиру, детергентам, УФ-лучам. Обладают группоспецифическими белковыми антигенами, локализованными в сердцевине вириона, и поверхностными антигенами глико-протеиновой природы, входящими в состав шипов суперкапсида.
В процессе вирусной инфекции ревертаза катализирует синтез ДНК на матрице вирусной РНК. Синтезированная ДНК замыкается в кольцо и встраивается в хромосому клетки, в результате чего образуется провирус. Механизм онкогенеза, вызываемого ретровирусами, связан с функционированием онкогенов (ONC-гены), которые имеются в геноме всех клеток человека и животных. Включение в геном клетки ДНК-провируса приводит к активации онкогена, который в нормальных здоровых тканях находится в неактивном состоянии. В результате активации онкогена происходит трансформация клетки.
Главным феноменом изучаемых in vitro систем является трансформация клеток, которую можно наблюдать при заражении фибробластов некоторыми онкогенными вирусами.
Из лейковирусов способны трансформировать фибробласты лишь вирусы саркомогенного типа. Иногда трансформация может сопровождаться размножением вируса. Однако в случае онкогенных ДНК-вирусов трансформация и образование вируса — процессы взаимоисключающие. Например, трансформация вирусом полиомы или SV40 происходит либо при заражении полноценным вирусом клеток, в которых невозможно полное выражение вирусных генов, либо при заражении пермиссивных клеток дефектными мутантами вирусов.
Онкогенные ДНК-вирусы вызывают трансформацию двух типов:
- абортивную трансформацию, которая происходит с высокой частотой, но проявляется на протяжении лишь нескольких клеточных генераций,
- стабильную трансформацию, которая происходит реже, но ведет к стойким изменениям фенотипа клетки.
Независимо от того, носит ли трансформация стабильный или абортивный характер и вызывается ли она ДНК- или РНК-вирусами, для установления и поддержания трансформированного фенотипа клетки требуется функционирование вирусного генома.
При трансформации, вызываемой онкогенными как ДНК, так и РНК-вирусами, происходит стабильная ассоциация вирусной нуклеиновой кислоты и клеточной ДНК. В случае вируса полиомы, SV40 и аденовирусов этот процесс осуществляется путем прямого включения вирусной ДНК в геном клетки. В случае РНК-вирусов ситуация не столь ясна, так как все или почти нее клетки позвоночных содержат вирусные нуклеотидные последовательности как нормальную составную часть своего генома. Следовательно, не вполне ясно, происходят ли при трансформации включение новой вирусной нуклеиновой кислоты в геном клетки или же имеет место активация предсуществующей вирусной ДНК. Известно, однако, что клетки, трансформированные температурочувствительными мутантами онкогенных РНК-вирусов, обладают температурочувствительным фенотипом. Этот факт означает, что именно внесенный (а не эндогенный) вирусный геном играет решающую роль в определении фенотипа трансформированной клетки. Поскольку трансформация становится постоянным наследуемым признаком, полагают, что геном РНК-вируса в виде ДНК-копии сохраняется в клеточной ДНК при последующих делениях. Механизм, благодаря которому небольшое количество вирусной нуклеиновой кислоты вызывает столь большие изменения в поведении клеток, неясен.
Неизвестно, одинаков ли механизм индукции опухолей онкогенными РНК- и ДНК-вирусами. Онкогенные РНК-вирусы содержат ферменты, способные синтезировать полную ДНК-копию их генома. Этот факт позволяет предполагать, что механизмы превращения нормальной клетки в опухолевую под воздействием и РНК- и ДНК-вирусов в основном сходны. Однако, даже если вирусы обоих типов окажутся идентичными в этом отношении, их биологические свойства совершенно различны.
Онкогенные РНК-вирусы выделены от представителей трех классов позвоночных — пресмыкающихся, птиц и млекопитающих. Все они имеют значительное сходство в морфологии вириона; их можно различать только с помощью чувствительных серологических реакций. Некоторые из этих вирусов вызывают неопластические заболевания кроветворной системы своих хозяев, другие — солидные опухоли. Однако наиболее существенная особенность этого «класса вирусов состоит в том, что они могут передаваться вертикально как часть генома хозяина. Поскольку было обнаружено, что во время эмбриогенеза происходит выражение вирусных генов, предполагают участие вирусов в онкогенезе. Индукция вирусов типа С спонтанно происходит как у животных, так и в клеточных культурах, причем частоту индукции можно повысить специальными искусственными воздействиями.
Онкогенные ДНК-вирусы гораздо более вариабельны по своим свойствам, чем вирусы, содержащие РНК.Они относятся к нескольким родам. Злокачественные опухоли у естественных хозяев вызывают представители только одного рода — герпесвирусы. Единственным признаком инфекции, вызываемой некоторыми другими онкогенными ДНК-вирусами, является доброкачественная опухоль. Большинство же этих вирусов, по-видимому, вызывает у естественных хозяев лишь скрытую и безвредную для них инфекцию. В то же время в искусственных лабораторных условиях такие вирусы способны вызывать опухоли.
В настоящее время нет убедительных данных об онкогенных вирусах человека. Однако предпринимаются большие усилия, чтобы установить причинную связь между герпесвирусами и опухолями человека, а также выделить предполагаемые естественные вирусы типа С человека.
РНК-содержащие: семейство Retroviridae.
ДНК-содержащие: семейства Papillomaviridae, Polyomaviridae, Adenoviridae 12, 18, 31, Hepadnaviridae, Herpesviridae, Poxviridae
Семейство Retroviridae включает 7 родов.
Онковирусы являются сложноорганизованными вирусами. Вирионы построены из сердцевины, окруженной липопротеиновой оболочкой с шипами. Размеры и формы шипов, а также локализация сердцевины служат основой для подразделения вирусов на 4 морфологических типа (А, В, С, D), а также вирус бычьего лейкоза.
Капсид онковирусов построен по кубическому типу симметрии. В него заключены нуклеопротеин и фермент ревертаза. Ревертаза обладает способностью транскрибировать ДНК. Геном – 2 идентичные цепи РНК.
Культивирование вирусов: не культивируются на куриных эмбрионах, культивируются в организме чувствительных животных, в культурах клеток.
Репродукция вирусов: проникают в клетку путем эндоцитоза. 3 этапа: синтез ДНК, на матрице РНК; ферментативное расщепление матричной РНК; синтез комплементарной нити ДНК на матрице первой нити ДНК.
К семейству Retroviridae относится примерно 150 видов вирусов, вызывающих развитие опухолей у животных, и только 4 вида вызывают опухоли у человека: HTLV-1, HTLV-2, ВИЧ-1,ВИЧ-2.
Вирусы Т-клеточного лейкоза человека
К семейству Retroviridae роду Deltaretrovirus относятся вирусы, поражающие CD4 Т-лимфоциты, для которых доказана этиологическая роль в развитии опухолевого процесса у людей: HTLV-1 и HTLV-2
Вирус HTLV-1 является возбудителем Т-клеточного лимфолейкоза взрослых. Он является экзогенным онковирусом, который, в отличие от других онковирусов, имеет два дополнительных структурных гена: tax и rех.
Продукт tax-гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование ИЛ-2 рецепторов на поверхности зараженной клетки. Продукт rex-гена определяет очередность трансляции вирусных иРНК.
HTLV-2 был изолирован от больного волосисто-клеточным лейкозом.
Оба вируса передаются половым, трансфузионным и трансплацентарным путями.
Семейство Papillomaviridae – вирус папилломы человека, собак. Вызывают инфекцию в клетках плоского эпителия. Доброкачественные папилломы в области половых органов, на коже, на слизистых дыхательных путей.
Семейство Polyomaviridae – вакуолизирующий вирус обезьян SV-40.Вирус полиомы человека.
Семейство Adenoviridae – аденовирусы, особенно серотипы 12,18,31 – индуцируют саркомы и трансформируют культуры клеток.
Семейство Poxviridae – вирусы фибромы-миксомы кролика, вирус Ябы, вызывающий развитие опухолей, вирус контагиозного моллюска.
Семейство Herpesviridae – лимфомы, карциномы. Онкогенез у человека связан с вирусом простого герпеса 2 типа (ВПГ-2) и вирусом Эпштейна-Барр (ВЭБ).
41-42. ВИЧ. Классификация. Свойства вирусов. Патогенез заболевания. Иммунитет.
Лабораторная диагностика вич – инфекции. Эпидемиология (ее особенности в рф), профилактика и терапия.
Вирус иммунодефицита человека вызывает ВИЧ-инфекцию, заканчивающуюся развитием синдрома приобретенного иммунного дефицита.
Возбудитель ВИЧ-инфекции — лимфотропный вирус, относящийся к семейству Retroviridae роду Lentivirus.
Морфологические свойства: РНК-содержащий вирус. Вирусная частица сферической формы Оболочка состоит из двойного слоя липидов, пронизанного гликопротеинами. Липидная оболочка происходит из плазматической мембраны клетки хозяина, в которой репродуцируется вирус. Гликопротеиновая молекула состоит из 2 субъединиц, находящихся на поверхности вириона и пронизывающих его липидную оболочку.
Сердцевина вируса конусовидной формы, состоит из капсидных белков, ряда матриксных белков и белков протеазы. Геном образует две нити РНК, для осуществления процесса репродукции ВИЧ имеет обратную транскриптазу, или ревертазу.
Геном вируса состоит из 3 основных структурных генов и 7 регуляторных и функциональных генов. Функциональные гены выполняют регуляторные функции и обеспечивают осуществление процессов репродукции и участие вируса в инфекционном процессе.
Вирус поражает в основном Т- и В-лимфоциты, некоторые клетки моноцитарного ряда (макрофаги, лейкоциты), клетки нервной системы.
Культуральные свойства: на культуре клеток Т-лимфоцитов и моноцитов человека (в присутствии ИЛ-2).
Антигенная структура: имеет ряд поверхностных (gpl60, gpl20, gp41) и сердцевинных (р24, р18 и др.) антигенов, определяющих его серологические свойства. В настоящее время выделяют две антигенные разновидности вируса: ВИЧ-1 и ВИЧ-2. Основные антигены вызывают образование антител у инфицированных людей; вначале появляются антитела к gp120 и gp41, затем р24, которые длительно сохраняются в крови.
ВИЧ обладает уникальной антигенной изменчивостью, которая в сотни и тысячи раз превосходит изменчивость вируса гриппа, благодаря тому, что скорость его транскрипции значительно выше, чем у других вирусов. Это затрудняет диагностику и специфическую профилактику ВИЧ-инфекции.
Факторы патогенности, патогенез: ВИЧ обладает лимфотропностью благодаря тому, что на лимфоцитах Т-хелперах существуют в норме рецепторы CD-4, имеющие сродство к белку gpl20 вируса. Это создает благоприятные условия для прикрепления вируса к лимфоцитам, проникновения их в клетку и последующего размножения в лимфоците. В результате размножения ВИЧ в лимфоцитах последние разрушаются и погибают или снижают свою функциональную активность. Однако ВИЧ поражает не только Т4-лимфоциты, но и другие клетки (нервные, В-лимфоциты, макрофаги, клетки Лангерганса), которые имеют рецепторы типа CD-4, как у Т-лимфоцитов. Поражение иммунных и других клеток приводит к снижению защитных функций иммунной системы, развитию иммунодефицитного состояния и проявлению в результате этого вторичных заболеваний инфекционной и неинфекционной природы.
Клиника: поражается дыхательная система (пневмония, бронхиты); ЦНС (абсцессы, менингиты); ЖКТ (диареи), возникают злокачественные новообразования (опухоли внутренних органов).
ВИЧ-инфекция протекает в несколько стадий: 1) инкубационный период, составляющий в среднем 2—4 недели; 2) стадия первичных проявлений, характеризующаяся вначале острой лихорадкой, диареей; завершается стадия бессимптомной фазой и персистенцией вируса, восстановлением самочувствия, однако в крови определяются ВИЧ-антитела, 3) стадия вторичных заболеваний, проявляющихся поражением дыхательной, нервной системы. Завешается ВИЧ-инфекция последней, 4-й терминальной стадией- СПИДом.
Вирусологические и серологические исследования включают методы определения антигенов и антител ВИЧ. Для этого используют ИФА, ИБ и ПЦР. Сыворотки больных ВИЧ-1 и ВИЧ-2 содержат антитела ко всем вирусным белкам. Однако для подтверждения диагноза определяют антитела к белкам gp41, gpl20, gpl60, p24 у ВИЧ-1 и антитела к белкам gp36, gpl05, gpl40 у ВИЧ-2. ВИЧ-антитела появляются через 2—4 недели после инфицирования и определяются на всех стадиях ВИЧ.
Метод выявления вируса в крови, лимфоцитах. Однако при любой положительной пробе для подтверждения результатов ставится реакция ИБ. Применяют также ПЦР, способную выявлять ВИЧ-инфекцию в инкубационном и раннем клиническом периоде, однако ее чувствительность несколько ниже, чем у ИФА.
Клинический и серологический диагнозы подтверждаются иммунологическими исследованиями, если они указывают на наличие иммунодефицита у обследуемого пациента.
Диагностическая иммуноферментная тест-система для определения антител к ВИЧ – включает вирусный АГ, адсорбированный на носителе, АТ против Ig человека. Используется для серодиагностики СПИДа.
Лечение: применение ингибиторов обратной транскриптазы, действующих в активированных клетках. Препараты являются производные тимидина — азидотимидин и фосфазид.
Профилактика. Специфическая - нет.

Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции).
Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно.
Вирус Эпштейн-Барр
Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр.
Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
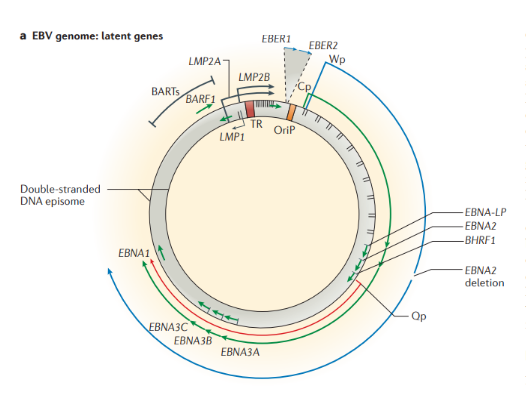
- необходим для трансформации В-лимфоцитов;
- функционирует как конститутивный активатор рецептора ФНО и имеет сходство с CD-40 рецептором;
- активирует сигнальные пути, которые делают вклад в онкогенный эффект.
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация).
Папилломавирусы человека
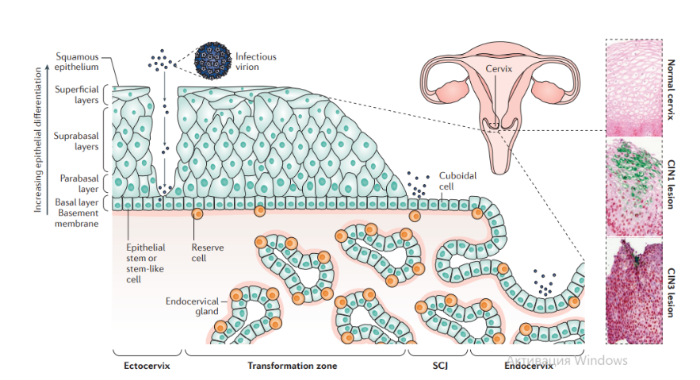
Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58.
Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью.
Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия.
Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.
Герпесвирус, ассоциированный с саркомой Капоши
KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры.
Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками.
KSHV кодирует несколько важных белков, которые обладают некоторой онкогенной активностью для индуцирования пролиферации клеток, иммортализации, трансформации и передачи сигналов; производства цитокинов; иммунного контроля; антиапоптозной активности; и ангиогенеза. К ним относятся вирусные латентные белки, латентный ассоциированный ядерный антиген (LANA), vFLIP (FADD (Fas-ассоциированный белок с доменом смерти), подобный ферменту, ингибирующему синтез интерферона или ингибирующему белок каспазы 8 (FLICE)), vCyclin и вирусные литические белки G-белкового рецептора (vGPCR), интерферон-регуляторный фактор 1 (vIRF-1) и K1. Хотя истинную онкогенную природу каждого белка еще предстоит определить, накопление доказательств указывает на то, что каждый из них вносит свой вклад в онкогенез KSHV. Таким образом, полный спектр вызванной KSHV злокачественности может потребовать, чтобы несколько онкогенных продуктов работали вместе в присутствии клеток хозяев и экологических факторов. Например, как LANA, так и vIRF-1 нацелены на клеточный опухолевый супрессор p53. LANA также ингибирует pRB и PP2A.vCyclin, активатор CDK4 6,198, подавляет p27kip1, ингибитор CDK199 и вызывает реакцию на задержку старения G1, результаты от гиперактивации NF-κB. vFLIP и K1 активируют путь сигнала NF-κB для предотвращения апоптоза B-клеток. vGPCR и K1 влияют на сигнальные пути AKT и NF-κB и способствуют ангиопролиферативному и воспалительному поражению саркомой Капоши.
Т-лимфотропный вирус человека (HTLV)
T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой.
Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3'-LTR, все остальные гены кодируются плюсовой нитью по направлению 5'-LTR. Следует отметить, что 5'-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.
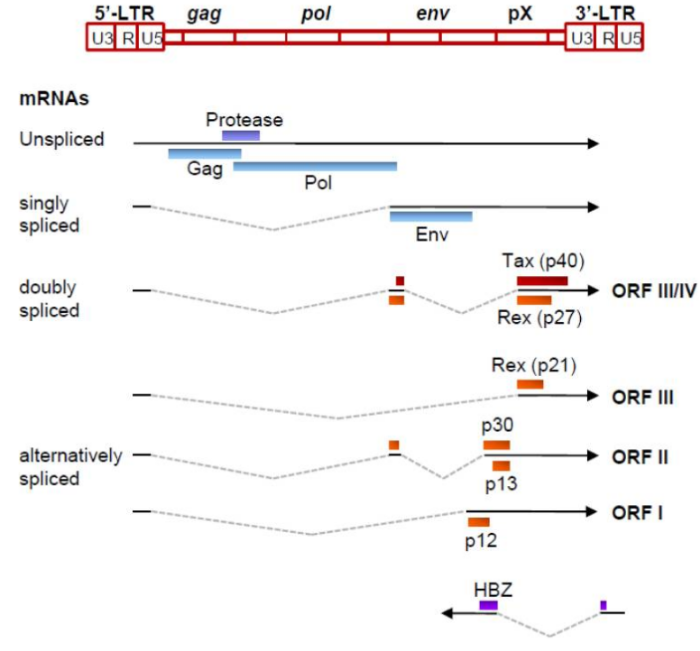
Рисунок 3. Gag, Pol и Env вирусные регуляторные/вспомогательные белки HTLV
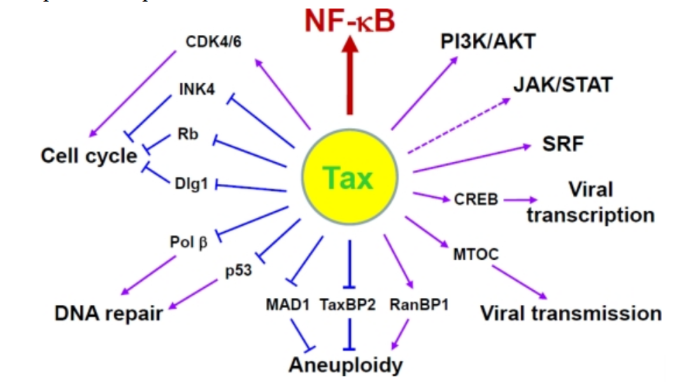
Рисунок 4. К леточные пути вирусного онкобелка tax
Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5' и 3' концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу.
Вирусы гепатита
Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC).
Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения.
Читайте также:


