Что такое реверсия вируса
Синонимы. Атавизм, махровость, zvrat cerneho rybizu. История и географическое распространение. Реверсия смородины впервые была описана в Нидерландах и Англии между 1904 и 1912 гг. К тому времени она стала широко распространена в садах и на плантациях, обычно приуроченной к местному появлению смородинного клеща (Phytoptus ribis Nal.), который уже давно был известен как серьезный вредитель черной смородины. Прямой вред, наносимый клещом, был вначале спутан с воздействием переносимого им вируса. Это объясняется тем, что вирус реверсии и его переносчик находятся в сложном и уникальном взаимоотношении на их хозяине черной смородине [44].
Реверсия зарегистрирована фактически во всех странах, где выращивается черная смородина. Заболевание является редким в Новой Зеландии, Австралии и Британской Колумбии, но широко распространено в большинстве европейских стран. В последние годы заболевание приобретает большое значение в Австралии, ГДР, ФРГ, Польше и Швейцарии, где прежде оно было редким.
Экономическое значение. Реверсия - наиболее важное заболевание, поражающее черную смородину в Англии и некоторых других европейских странах, и его влияние на урожай является очень сильным. Реверсия представляет потенциальную угрозу для всех других стран, где выращивается черная смородина.
Круг растений-хозяев. Черная смородина - обычный хозяин вируса реверсии, но он обнаружен на естественно зараженных растениях R. bracteosum Dougl., R. rubrum L. var. pubescens Swartz, R. "carrierii" (R. glutinosum Benth. X R. nigrum L.). Несколько других видов и гибридов заражались прививкой, но не проявляли более отчетливых симптомов, чем черная смородина.
Все основные промышленные сорта черной смородины восприимчивы к заболеванию, хотя имеется слабое различие в их устойчивости к заражению клещом и толерантности к вирусной инфекции. Значение основных промышленных сортов красной смородины в качестве хозяев клеща и вируса пока еще не ясно, но, по-видимому, они иммунны к обычным его штаммам.
Симптомы. Симптомы на черной смородине не заметны до года после инокуляции, и сначала они ограничиваются одним или несколькими побегами. На второй год поражается от 1/3 до 1/2 куста. Инфекция становится полностью системной на третий или четвертый год. Характер роста изменяется вместе со специфическим воздействием на цветки и листья.
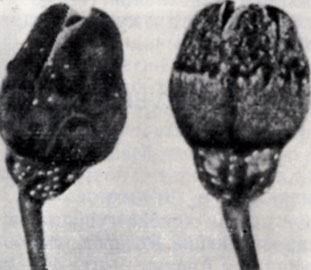
Рис. 43. Слева - неопушенная (гладкая) цветочная почка черной смородины, пораженной реверсией; справа - здоровая почка, покрытая волосками
а) При заболевании махровостью уменьшаются число и размер первичных листьев, которые противолежат цветкам, а листья, образовавшиеся во время цветения, хлоротичны. Имеется небольшое различие в числе или окраске листьев во время затянувшегося роста, хотя побегов на здоровых кустах несколько меньше и они длиннее, чем побеги на больных кустах. Эти различия не настолько велики и постоянны, чтобы служить признаком для диагностики заболевания.
б) обычные штаммы вируса, встречающиеся в Англии и во многих других европейских странах, уменьшают опушенность чашелистиков, так что цветочные почки почти голые и выглядят ярко окрашенными по сравнению с серыми, опушенными нормальными почками (рис. 43).
Разница ясно видна, если кусты не влажны или не заражены авирулентным штаммом.
В Советском Союзе, Скандинавии и некоторых других странах цветки реверсивных кустов голые (неопушенные), а также несколько уродливые с удлиненным пестиком и добавочными лепестками вместо тычинок. Эта "махровость" цветков, вызванная по-видимому, особым штаммом вируса, необычна для Англии и Запад-нои Европы.
в) На больных кустах образуются более плоские листья и с меньшей выемкой у основания, чем у нормальных. Заболевание также уменьшает число основных жилок и краевых зубчиков (рис. 44, в центре; сравните с нормальным листом слева) При некотором навыке эти различия могут быть использованы для точной диагностики в мае, июне или июле, если внимание будет сосредоточено только на листьях непораженных побегов в период, роста в длину. На раздвоенных побегах и на побегах, поврежденных механически или насекомыми, образуются нетипичные листья Дальнейшее осложнение состоит в том, что имеются наследственные различия между листьями определенных сортов.
г) Листья, которые поражены некоторыми штаммами вируса реверсии, образуют неисчезающий жилковый узор (рис. 44 справа). Этот признак имеет ограниченную ценность для диагностики так как симптомы часто слабые и наблюдаются на немногих листьях, часто скрытых листьями более позднего прироста.

Рис. 44. Слева - нормальный лист черной смородины; в центре и справа - листья, пораженные реверсией
Симптомы инфекционной пестролистности, которые несколько сходны с вышеописанными симптомами на других сортах, особенно резки на кустах, пораженных реверсией.
Характеристика вируса. Нет сведений о свойствах вируса реверсии.
Передача. Реверсия легко передается различными способами прививки, но некоторые способы непригодны, так как клещ-переносчик может быть перенесен с почками, взятыми с больных кустов. Этой опасности можно избежать при прививке кусочками коры. Реверсия не передавалась пыльцой, семенами или соком.
Последние опыты подтвердили более раннее доказательство о роли смородинного клеща в качестве переносчика реверсии. Вирус переносится эффективно в конце весны и начале лета, когда клещи перемещаются из старых галлов в почки нового прироста. Дальнейшего распространения не происходит до следующего года, и клещи остаются внутри зараженных почек, которые теряют способность образовывать цветки или листья и превращаются в округлые галлы [45].
Симптомы развиваются через год после заражения, и имеется тесная корреляция между числом случаев вирусной инфекции и предшествующим распространением галлов.
Мало сведений имеется о процессе передачи вследствие трудности переноса клеща, его явной неспособности питаться иначе как внутри галлов или почек. Вирус передавался отдельными особями клещей и клещами, которых уничтожали эндрином* спустя 4 ч после того, как их переносили из галлов на молодые здоровые сеянцы.
*( В СССР не применяется. - Ред. )
Эндрин является особенно эффективным препаратом для защиты листьев и почек от непосредственного повреждения клещами, что осложняло интерпретацию результатов ранних экспериментов.
Распространение в естественных условиях. В одном галле находится до 35 000 клещей, и несколько сотен галлов может появиться на сильно зараженном кусте, с которого клещи могут переползать, перепрыгивать или сдуваться ветром во время миграционного периода. Насекомые также являются активными переносчиками клещей, и возможно значительное заселение клещом растений, произрастающих на большом расстоянии от крупных источников инфекции [46]. Дополнительная особенность решающего момента эпифитотиологии состоит в том, что устойчивость здоровых кустов черной смородины к клещу уменьшается с началом заражения реверсией. Поэтому вряд ли удивительно, что вирус реверсии является таким широко распространенным и преуспевающим патогеном с необычно быстрой скоростью распространения для вирусного заболевания древесного многолетника, такого, как черная смородина.
Меры борьбы. Предлагаемые для продажи кусты могут быть получены из зараженного источника, и часть почек может быть заражена клещами. Эти возможности следует принимать во внимание, и должны проводиться строгие карантинные ограничения для того, чтобы избежать распространения клещей и дополнительной инфекции или других штаммов вируса в районах, где прежде заболевание было редким.
В местностях, где реверсия встречается, новые плантации следует закладывать кустами или черенками из хорошего питомника, свободного от инфекции. Плантация должна быть защищена от ветра и отдалена не менее чем на 90 м от сильно зараженных участков, должны проводиться обычные обработки эффективными ака-рицндами.
Кроме того, кусты должны ежегодно просматриваться перед началом цветения и повторно в мае или июне, чтобы выявить и удалить зараженные кусты, как только они появятся. Эти мероприятия взаимозависимы в большой степени, и все должны проводиться для полной эффективности.
Терапия. Пораженные кусты, развивавшиеся в течение 20 - 30 дней при температуре 37°С, образовали бессимптомные листья, но симптомы вновь проявлялись на более позднем приросте, выросшем при нормальных температурах. Верхушки побегов, оставшиеся здоровыми ко времени отделения с прогретых растений, берут для окоренения [5].
Обнаружение и идентификация. Диагноз зависит от способности распознать характерное влияние реверсии на цветки или листья. Если нарушен рост или наблюдается уродливость листьев, а симптомы не отчетливы, подозрительный материал должен быть проверен инокуляцией прививкой на однолетние кусты сорта Болдуин. Этот широко распространенный сорт чувствителен к заражению и отличается равномерным ростом, при котором симптомы отчетливо видны в следующем году.
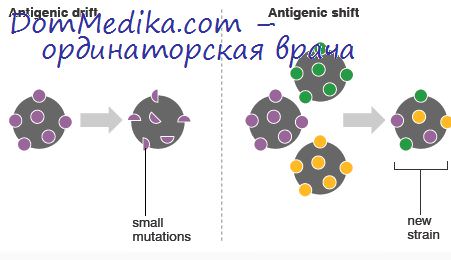
Этот мутант нормально размножается в пермиссивных (мышиных) клетках, инкубируемых при 31 °С, но не способен размножаться при 38,5 °С. Получена линия хомячковых клеток, трансформированных мутантом ts-З; когда эти клетки растут при 31 °С, они проявляют все признаки клеток, трансформированных вирусом полиомы. Однако после переноса клеток в условия с температурой 38,5 °С они в тесте агглютинации лектинами ведут себя как нетрансформированные и приобретают нормальное строение (Экхарт и др., 1971).
Если изменить температуру с 38,5 °С на 31 °С, они в течение суток восстанавливают все признаки трансформации.
После роста при 38,5 °С исчезают не все свойства трансформированных клеток; например, клетки сохраняют способность формировать колонии в агаре. Эти результаты показывают, что для проявления по крайней мере некоторых фенотипических признаков трансформированных клеток требуется присутствие минимум одного продукта, закодированного в геноме вируса.
Данные о наличии в трансформированных клетках вирус-специфических репрессоров противоречивы. С одной стороны, Дженсен и Копровский (1969) полагают, что некоторые линии пермиссивных клеток, трансформированные SV40, не содержат репрессора, так как полностью чувствительны к суперинфекции (Барбанти-Бродано и др., 1970). К подобному же заключению пришел Базилико (1971; Базилико и Ванг, 1971), изучавший клетки, трансформированные вирусом полиомы; оказалось, что гибриды клеток ВНК, трансформированных вирусом полиомы, и мышиных клеток ЗТЗ чувствительны к суперинфекции.
С другой стороны, Кассинджена и сотр. (1969а; Суарес и др., 1971) выделили из ряда клеток, трансформированных SV40, белок, обладавший, по-видимому, некоторыми свойствами, которых можно было бы ожидать у вирусного репрессора. Это вещество специфически подавляло образование бляшек вирусом SV40 на монослое клеток почки обезьяны. Однако максимальное уменьшение числа бляшек, достигнутое группой Кассинджены, составило около 50%, что вряд ли достаточно для серьезного обсуждения.
В линиях трансформированных клеток изредка возникают ревертанты, у которых восстанавливается нормальный фенотип; для отбора этих вариантов разработано несколько остроумных приемов. Например, Поллак и сотр. (1968) использовали 5-фтордезоксиуридин, который приводил к избирательной гибели делящихся клеток в плотных культурах мышиных клеток, трансформированных SV40. Выжившие клетки имели уплощенное строение нетрансформированных клеток, дорастали в культуре до низкой плотности насыщения, были менее онкогенными, чем родительская линия (Поллак и Тибор, 1969) и обладали сниженной способностью агглютинироваться лектинами (Поллак и Бургер, 1969).
Хотя ревертанты Поллака и Озанн приобретали фенотип, который во многих отношениях был характерен для нетрансформированных клеток, содержание вирусных последовательностей в их ДНК, судя по кинетике реассоциации, не изменялось. Более того, в них обнаруживалась вирусная РНК и синтезировался вирус-специфический Т-антиген (Озанн и др., 1973). Однако опыты по спасению инфекционного SV40 путем слияния ревертантов с пермиссивными клетками не давали стабильных результатов. Вначале Поллак (1970) сообщил, что вирус, выделенный из ревертантов, обладает как инфекционной, так и трансформирующей активностью.
Однако по мере длительного культивирования ревертантов становилось все труднее выделить из них вирус. Причина этого явления и механизм реверсии остаются неизвестными. Мы не знаем точно, связан ли этот процесс с мутациями и происходят ли они в вирусных или клеточных генах. С другой стороны, Рейтер и Базилико (1972) недавно получили линию обработанных SV40 мышиных клеток, которые при низкой температуре имели трансформированный фенотип, а фенотип клеток при повышенной температуре приближался к нормальному. Из этих клеток можно было выделить SV40, который во всех отношениях соответствовал вирусу дикого типа. Следовательно, в этом случае способность к реверсии была обусловлена мутацией, происходящей в клеточных, а не в вирусных генах. Существование этой линии показывает, что для поддержания клетки в трансформированном состоянии требуется постоянное функционирование по крайней мере одного клеточного гена.
Рис. 3. Схема патогенеза неврологических реакций.
Наиболее частым проявлением ПВО со стороны нервной системы являются судорожные (энцефалические) реакции в виде фебрильных (при Т > 38,0º) или афебрильных приступов (при Т
6. Смешанные генерализованные судороги (малые моторные или атипичный petit mal). Эта группа судорожных нарушений
типична для синдрома Леннокса - Гасто, который характеризуется частыми, плохо поддающимися контролю судорогами, включая атонические, миоклонические, тонические и клонические, которым сопутствует ЭЭГ-паттерн с атипичными спайками (от англ. Spike - пик) и волнами (менее трех спайк-волн в 1 с), мультифокальными спайками и полиспайками. Возраст пациентов чаще превышает 18 месяцев, но данный синдром может развиться и на 1-м году жизни вслед за инфантильными спазмами (трансформация из синдрома Веста). У детей часто имеется выраженное отставание в развитии.
Судорожный синдром на фоне гипертермии (фебрильные судороги) протекает в виде генерализованных тонических, клонико-тонических, клонических приступов, однократных или повторных, обычно кратковременных. Фебрильные судороги могут развиваться после применения всех вакцин, чаще при введении АКДС (Тетракока), на втором месте – коревая вакцина в виде моно- или в составе комбинированного трехвалентного препарата. Срок возникновения при использовании неживых вакцин – первый, реже – второй или третий дни после прививки, при вакцинации живыми вакцинами – в разгаре вакцинальной реакции – 5–12-й дни поствакцинального периода.
В настоящее время некоторые авторы не считают фебрильные судороги ПВО. Поскольку у детей первых трех лет жизни существует предрасположенность к судорожным состояниям при лихорадке, вызванной различными причинами, эти исследователи рассматривают фебрильные судороги после вакцинации как реакцию таких детей на подъем температуры. У детей старшего возраста эквивалентом судорожной реакции является галлюцинаторный синдром, развивающийся на фоне высокой температуры. Характерными особенностями простых фебрильных судорог являются: единичные эпизоды, короткая продолжительность (не более 15 мин.), генерализованные тонико-клоннческие, клонические или тонические приступы. Как правило, простые фебрильные судороги возникают у нормально развивающихся детей, не имеющих очаговых неврологических нарушений. Сложные фебрильные судороги характеризуются следующими признаками: продолжительность более 15 мин., повторяемость в течение 24 часов, фокальный характер (моторные фокальные пароксизмы, девиация глазных яблок, остановка взора, аура или изменение психического статуса). После сложных фебрильных судорог нередко возникают транзиторные неврологические расстройства в виде пареза конечностей. Возможно также развитие фебрильного эпилептического статуса - возникающих на фоне лихорадки, повторяющихся генерализованных тонико-клонических приступов продолжительностью более 30 мин.
· фебрильные судороги в поствакцинальном периоде следует дифференцировать с судорожным приступом при интеркуррентном инфекционном заболевании, возникшем у привитого;
· афебрильные судороги дифференцируют с дебютом эпилепсии, другим органическим заболеванием нервной системы с судорожным синдромом (синдром Веста, инфантильные спазмы и пр.), соматическими заболеваниями, которые могут сопровождаться судорогами (спазмофилия, диабет и др.).
· проведение ЭЭГ для выявления эпи-комплексов, судорожной готовности, что помогает дифференциальному диагнозу энцефалических реакций с эпилепсией.
· учитывается срок появления судорог – в разгаре вакцинального процесса или вне этого времени, наличие или отсутствие симптомов интеркуррентного заболевания, сведения о наличии судорог у пациента ранее, а также у его родственников.
· проводятся лабораторные исследования для исключения другой этиологии судорог (гипокальциемия, гипогликемия и пр.).
Синдром пронзительного крика
Упорный монотонный крик у детей первого полугодия жизни, возникающий через несколько часов после вакцинации, длится от трех до пяти часов. Регистрируется преимущественно при введении вакцин, содержащих убитую цельноклеточную коклюшную вакцину (АКДС, Тетракок). Считают, что развитие пронзительного крика связано с возможным воздействием коклюшной вакцины на изменение микроциркуляции в головном мозге. Это приводит к повышению внутричерепного давления и появлению головной боли.
Дифференциальный диагноз пронзительного крика проводят с беспокойством при болевом синдроме (отит, травма, кишечная колика и др.) и с острым приступом внутричерепной гипертензии (ВЧГ) при декомпенсации перинатальной энцефалопатии, возможной черепно-мозговой травме (ЧМТ), инфекционном токсикозе.
Подтверждению диагноза помогает наличие проявлений внутричерепной гипертензии с приступами декомпенсации ранее до прививки; выявление признаков интеркуррентного заболевания, вызвавшего данную симптоматику; обнаружение причины болевого синдрома.
Вакциноассоциированные заболевания
Наиболее тяжелыми из группы патологических процессов с поражением нервной системы являются вакциноассоциированный полиомиелит, энцефалиты и менингиты. Эта группа поствакцинальных осложнений наблюдается достаточно редко и только при использовании живых вакцин.
Вакциноассоциированный полиомиелит (ВАПП), или острый вялый паралич, вызван вирусом вакцины. Заболевание вызвано поражением передних рогов спинного мозга, протекает, как правило, в виде поражения одной конечности, с типичными неврологическими нарушениями: снижением мышечного тонуса, рефлексов, трофики (атония, арефлексия, атрофия), но с сохранением чувствительности, продолжается не менее двух месяцев, оставляет после себя выраженные последствия. Развивается у привитых на 4–30-й дни после иммунизации ОПВ и у контактных с привитыми людьми в срок до 60 суток. Возникает преимущественно после первых введений вакцины, в среднем с частотой 1 на 2,5 млн. доз. Риск заболевания у иммунодефицитных лиц во много раз превышает таковой у здоровых, поэтому у таких пациентов предпочтительно использование при первом введении инактивированной полиомиелитной вакцины.
Патологические изменения в головном мозге локализуются главным образом в белом веществе и характеризуются наличием периваскулярных инфильтратов и очаговой демиелинизацией нервных волокон. Деструктивный процесс может распространяться на осевые цилиндры и ганглиозные клетки.
Внезапно у ребенка отмечается резкий подъем температуры тела, развивается помрачение сознания вплоть до развития коматозного состояния. На фоне грубых общемозговых симптомов инсультообразно развиваются очаговые симптомы за счет поражения пирамидной, экстрапирамидной и мозжечковой системы, а также черепных нервов: параличи конечностей, гиперкинезы, атаксия, нисгагм, потеря зрения (амавроз), поражение мимических мышц. В спинномозговой жидкости отмечается кратковременное повышение давления и лимфоцитарный плеоцитоз.
При поствакцинальном коревом энцефалите отмечается высокая летальность (до 25 %), после заболевания нередки остаточные явления в виде двигательных расстройств, судорожных припадков, снижения интеллекта, гипоталамического синдрома.
Вакциноассоциированный серозный менингит, вызванный вирусом вакцины против эпидемического паротита.
Заболевание возникает обычно в срок с 11-го по 25-й дни после вакцинации. Отмечено, что у 6–8-летних детей серозный менингит встречается после вакцинации в три с половиной раза чаще, чем у детей в возрасте от одного до трех лет. Клиническая картина подобна таковой при заболевании серозным менингитом при эпидемическом паротите. При спинномозговой пункции вытекает прозрачная или слегка опалесцирующая жидкость, содержащая нормальное либо слегка повышенное количество белка и лимфоцитарный плеоцитоз, концентрация сахара в спинномозговой жидкости нормальная.
Дифференциальный диагноз поствакцинальных энцефалитов и менингитов проводят с энцефалитами/менингитами другой этиологии, энцефалическими реакциями (фебрильными судорогами), энцефалопатиями.
Дифференциальному диагнозу помогает клиническая симптоматика и лабонаторно-инструментальное обследование:
· энцефалические реакции, характеризующиеся кратковременными нарушениями функции ЦНС, недлительными судорогами;
· появление парезов и параличей свидетельствует в пользу ПВЭ;
· изменения в СМЖ при ПВЭ – умеренный лимфоцитарный плеоцитоз и увеличение содержания белка, при менингите – моноцитарный плеоцитоз;
· серологическое исследование парных сывороток, взятых на 14-й и 21-й дни (определяют антитела к наиболее распространенным вирусам, которые могут вызвать энцефалит или менингит: гриппу и другим респираторным вирусам, энтеровирусам (Коксаки, ЭКХО), герпеса, клещевого энцефалита).
· ЭМГ для дифференциального диагноза вакциноассоциированного полиомиелита с парезами и параличами другой этиологии с целью установления уровня и характера поражения спинного мозга и периферических нервов;
· ЭХО-ЭГ, УЗИ головного мозга, компьютерная или магнитно-резонансная томография для дифференциального диагноза энцефалических реакций, энцефалита с эписиндромом, резидуально-органическими изменениями, гидроцефалией, опухолями мозга и т. п.
Редкие осложнения.
Синдром Гийена–Баре.
Синдром Гийена-Баре - это острый, быстро прогрессирующий восходящий симметричный вялый паралич с потерей чувствительности, как правило, без повышения температуры в начале заболевания. Развитие синдрома Гийена–Баре (СГБ) после прививок, скорее всего, связано с предшествующим прививке заболеванием.
Гипотензивно-гипореспонсивный синдром.
Данный синдром является редким осложнением, характеризующимся транзиторной острой сердечно-сосудистой недостаточностью, сопровождающейся артериальной гипотонией, снижением мышечного тонуса, кратковременным нарушением или потерей сознания, бледностью кожных покровов.
Дифференциальный диагноз проводят с анафилактоидными поствакцинальными реакциями, обморочными состояниями, обусловленными другими причинами (нарушение сердечного ритма, эписиндром, гипогликемия, ортостатические реакции, вегетососудистая дистония). Подтверждению диагноза помогает уточнение анамнеза: наличие ранее обморочных состояний, ортостатических реакций, вегетососудистой дистонии, эмоциональной лабильности у детей старшего возраста.
Тромбоцитопеническая пурпура.
Крайне редкое поствакцинальное осложнение, проявляющееся резким снижением количества тромбоцитов в крови и острым геморрагическим синдромом. Доказана причинно-следственная связь с введением вакцин, содержащих вирус кори. В основе патогенеза – инфекционно-аллергический и иммуновоспалительный механизмы. Клинические проявления, характер течения, лечение и прогноз не отличаются от таковых при тромбоцитопенической пурпуре другой этиологии. Дифференциальный диагноз проводят с другими тромбоцитопениями и тромбоцитопатиями (осложнения острых вирусных инфекций, реакции на лекарственные препараты, синдром или болезнь Верльгофа, врожденные ферментопатии тромбоцитов и другое, которые регистрируются значительно чаще, чем реакция на прививку), а также с геморрагическими синдромами, не связанными с поражением тромбоцитов (васкулит, гемофилия и др.).
Артриты, артралгия.
Воспалительный не ревматоидный процесс одного и более суставов, имеющий транзиторный (менее 10 дней) и лишь в редких случаях хронический характер течения. Причинно-следственная связь с прививкой доказана для моно- и комбинированных препаратов, содержащих краснушную вакцину. Сроки возникновения – 5–30-й дни после вакцинации. Дифференциальный диагноз проводят с артритами другой этиологии, травмами суставов. Подтверждению диагноза помогает типичная клиническая картина артрита с гиперемией, отечностью, болезненностью сустава; сведения о проведенной прививке в соответствующие сроки; выделение из суставной жидкости вируса краснушной вакцины, четырехкратный прирост специфических антител в парных сыворотках.
Осложнения после вакцинации БЦЖ
Встречаются достаточно редко 0,02-0,004% от числа привитых новорожденных. Причиной часто является нарушение техники вакцинации – подкожное введение вместо внутрикожного, случайное использование большей дозы. Выделяют локальные и генерализованные поражения.
Локальные поражения:
· Лимфаденит – подмышечный или шейный, появляются через 2-3 мес. после вакцинации. Различают закрытые и свищевые лимфадениты. Начало развития бессимптомное, нет симптомов интоксикации, возможно выделение стерильного гноя. Лимфаденит может закончиться формированием кальцината в лимфоузле.
· Язва – поверхностная или глубокая появляется через 2-4 недели, имеет вялое течение, подрытые края.
· Холодный абсцесс развивается через 1,5-2 мес. после проведенной вакцинации или ревакцинации, без признаков воспаления. Заживает с образованием звездчатого рубца.
· Келоидный рубец наблюдается при ревакцинации девочек-подростков.
Генерализованные поражения:
· Персистирующая и диссеминированная БЦЖ-инфекция может развиться у новорожденных с первичным иммунодефицитом. При этом возникает тяжелое поражение органов и систем, включая нервную. Отмечена высокая летальность.
Дата добавления: 2015-10-02 ; просмотров: 624 . Нарушение авторских прав
Установлено, что для разных вирусов требуется разная продолжительность аттенуации. Примером короткого периода аттенуации могут служить вирусы чумы уток и ринотрахеита индеек. Для аттенуации первого требовалось примерно 20 пассажей в первичной культуре клеток куриного эмбриона, второго — 17 пассажей в культуре клеток Vero. Оба полностью авирулентных штамма обладали выраженной иммуногенностью и вызывали резистентность у привитых животных вскоре после однократного парентерального введения. В этом отношении они напоминали высокоиммуногенные живые вакцины против ряда других заболеваний животных.
Высокоэффективные и безопасные вакцинные штаммы чаще и быстрее удавалось получить у оболочечных вирусов, чем у безоболочечных. Тип геномной нуклеиновой кислоты, казалось, не имел значения.
Используя данный принцип, был получен аттенуированныи штамм А-14-2 для живой вакцины против японского энцефалита. Стабильная аттенуация вируса наступила после 23 быстрых пассажей в первичной культуре клеток почки хомяка.
Недостатками живых вакцин являются:
1) потеря аттенуации вакцинным штаммом (реверсия или компенсаторная мутация);
2) возможность содержания посторонних агентов (контаминация);
3) горизонтальное (контактное) распространение;
4) длительная персистенция в привитом организме.
Множественные точечные мутации и особенно делеции делают практически невозможной реверсию вирулентности вакцинного штамма в процессе его применения.
Реверсибельность вакцинных штаммов привлекает внимание при внедрении новых живых вакцин. Реверсия лицензированных вакцин не является проблемой их практического применения, хотя она существует теоритически. При массовом применении таких вакцин, если реверсия происходит, то происходит исключительно в редких случаях и остается, как правило, незамеченной.
И все таки, если случайная единичная реверсия состоялась, то вирулентный вирус вначале должен преодолеть резистентность привитого организма, обусловленную данной вакциной, а затем найти восприимчивые особи среди привитых для своего распространения. Однако к этому времени основной контингент вакцинированных станет иммунным. Действительно, при использовании живых вакцин в практических условиях еще не зарегистрировано случаев распространения заболевания в результате реверсии вакцинного штамма вируса, если он был надежно аттенуирован.
Так как пока отсутствуют надежные лабораторные маркеры дифференциации вирулентного и аттенуированного штаммов вируса, используют другие методы. Реверсибельность вакцинных штаммов, используемых для изготовления живых вакцин, применяемых в ветеринарии, проверяют на естественно восприимчивых животных. Аттенуированные штаммы, не усилившие реактогенность и не восстановившие вирулентность в течение пяти последовательных пассажей на наиболее чувствительном к естественной инфекции виде животных, считаются пригодными для изготовления живой вакцины. Проверка реверсибельности вакцинных штаммов вирусов человека более затруднительна. Для оценки аттенуации вирусных штаммов используют генотипические и фенотипические маркеры, кроме того надежность аттенуации вирусных штаммов, предназначенных для вакцинации людей, проверяют на экспериментальных животных, и в первую очередь на обезьянах.
Идентификация вакцинных штаммов против различных вирусных болезней человека, и в первую очередь против желтой лихорадки и полиомиелита, стала возможной с помощью таких животных.
Установлена возможность реверсии вакцинного штамма при серийном пассировании в культуре элективных клеток хозяина. Так например, аттенуированный штамм Рокборн вируса чумы плотоядных давал реверсию как при серийном пассировании на собаках, так и в культуре легочных макрофагов собак.
Горизонтальная передача и длительное носительство вакцинного штамма вируса считаются нежелательными явлениями.
Читайте также:


