Цитомегаловирус при бронхиальной астме


Автореферат диссертации по медицине на тему Клинико-иммунологические особенности течения бронхиальной астмы с персистенцией цитомегаловируса у детей
На правах рукописи
Супрун Евгений Николаевич
КЛИНИКО-ИММУНОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ТЕЧЕНИЯ БРОНХИАЛЬНОЙ АСТМЫ С ПЕРСИСТЕНЦИЕЙ ЦИТОМЕГАЛОВИРУСА У ДЕТЕЙ
Автореферат диссертации на соискание ученой степени кандидата медицинских наук
||| II1111111111 «III И"! 11111 '
Член-корреспондент РАМН, доктор медицинских наук, профессор,
заслуженный деятель науки РФ Козлов Владимир Кириллович
заслуженный врач РФ Сиротина Зинаида Васильевна
Минздравсоцразвития РФ, г. Владивосток Осин Александр Яковлевич Ведущая организация
ФГБУ "Научно-исследовательский институт экспериментальной медицины" Северо-Западного отделения Российской академии медицинских наук
Автореферат разослан 2-2012 г.
диссертационного совета Д 208.026.01
доктор медицинских наук, доцент
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ Актуальность проблемы
Наибольший интерес в целях достижения контроля бронхиальной астмы и улучшения прогноза заболевания представляет выявление роли внутриклеточных инфекций, способных к длительной персистенции в слизистой бронхов, являющихся при бронхиальной астме органом-мишенью, и, следовательно, к длительному и постоянному поддержанию и усилению аллергического воспаления бронхов. К таз
Исходя из вышеизложенного, очевидна необходимость тщательного исследования вопроса о влиянии цитомегаловируса на течение бронхиальной астмы, изучения особенностей состояния иммунной системы у таких детей и обоснования включения в комплексное лечение препаратов, прекращающих активную репликацию цитомегаловируса.
Изучить клинико-иммунологические особенности течения бронхиальной астмы у детей, выделяющих ДНК цитомегаловируса с мокротой, и обосновать включение препарата, прекращающего репликацию цитомегаловируса в бронхах, в комплексную терапию бронхиальной астмы. Задачи исследования:
1. Оценить частоту выявления ДНК цитомегаловируса в мокроте и антител к нему в сыворотке крови у детей с бронхиальной астмой.
2. Выявить особенности клинического течения бронхиальной астмой у детей при выделении ДНК цитомегаловируса с мокротой.
3. Изучить состояние иммунитета при бронхиальной астме у детей в зависимости от выделения ДНК цитомегаловируса с мокротой.
Научная новизна. Изучена частота инфицированности пневмотропными внутриклеточными возбудителями (Cytomegalovirus, M.pneumoniae, Ch.pneumoniae, Pneumocysta Carini) у детей, страдающих бронхиальной астмой, в том числе частота персистенции инфекта в органе-мишени - бронхах. Наиболее часто обнаруживается цитомегаловирус. Это подтверждается как детекцией антител в сыворотке крови, так и выделением ДНК возбудителей из мокроты.
Выявлено влияние цитомегаловируса на клиническое течение бронхиальной астмы. Проявления бронхиальной астмы у детей, выделяющих ДНК цитомегаловируса с мокротой, характеризуются более тяжелым течением, увеличением частоты и тяжести обострений, большим объемом базисной терапии, требующейся для контроля заболевания. Выявлены анамнестические факторы, повышающие вероятность выявления цитомегаловируса в мокроте у детей с бронхиальной астмой.
Доказано влияние цитомегаловируса на показатели иммунитета у детей с бронхиальной астмой. При изучении клеточного звена иммунитета было выявлено снижение абсолютного числа всех типов лимфоцитов, наиболее выраженное для натуральных киллеров, повышение уровня общего IgA, нарастание фагоцитарной активности нейтрофилов. Отмечается достоверная сильная обратная связь наличия
цитомегаловируса и числа клеток, несущих маркеры СБ 16+. Обострение бронхиальной астмы имеет достоверную сильную обратную связь с количеством клеток СБ8+.
Практическая значимость работы
Установлены особенности клинического течения бронхиальной астмы у детей на фоне выделения цитомегаловируса с мокротой. Определены особенности иммунной системы у детей с бронхиальной астмой, выделяющих ДНК цитомегаловируса с мокротой. Выявлены анамнестические факторы, позволяющие выделить группу риска по обнаружению цитомегаловируса среди детей, страдающих бронхиальной астмой.
Применение оптимизированной схемы терапии бронхиальной астмы у детей, выделявших цитомегаловирус с мокротой, позволило облегчить клиническое течение бронхиальной астмы и снизить объем базисной терапии с сохранением контроля над заболеванием.
Внедрение результатов в практическую деятельность. Результаты работы внедрены в клиническую практику клиники НИИ ОМиД и успешно используются в работе врачей-педиатров, аллергологов. Теоретические положения и практические рекомендации диссертации внесены в программу и учебный процесс студентов 6 курса педиатрического факультета на кафедре детских болезней ДВГМУ.
Основные положения, выносимые на защиту
1. Цитомегаловирус часто встречается у детей с бронхиальной астмой, что подтверждается как детекцией их ДНК в мокроте, так и встречаемостью специфических антител (в, М).
2. У детей с бронхиальной астмой, выделяющих ДНК цитомегаловируса с мокротой, бронхиальная астма протекает тяжелее, что выражается в учащении обострений и в увеличении их тяжести, а так же в увеличении объема базисной терапии, необходимого для контроля заболевания.
3. У детей с бронхиальной астмой, выделяющих ДНК цитомегаловируса с мокротой, отмечаются более выраженные нарушения иммунной системы, (снижение абсолютного количества иммунокомпетентных клеток, повышение уровня общего иммуноглобулина А, напряжение фагоцитарного звена иммунитета), чем у пациентов без признаков персистенции возбудителя в бронхах.
Публикации результатов исследования: по теме работы опубликовано 14 работ, из них 3 в журналах, рекомендованных для публикаций ВАК и 1 - в зарубежном издании.
СОДЕРЖАНИЕ РАБОТЫ Материалы и методы
Нами было обследовано 108 больных, страдающих бронхиальной астмой, в возрасте от 1 до 17 лет. Средний возраст детей — 7,8 ±1,4 года, 43,5% составили девочки, 56,5% - мальчики. У 41,4% пациентов была легкая степень бронхиальной астмы, у 46,6% - средняя и у 12% - тяжелая. Осуществлялось общеклиническое обследование и наблюдение больных, сбор анамнеза. Оценка клинического течения бронхиальной астмы у обследуемых проводилась согласно критериям Националь-
Статистическая обработка проводилась при помощи пакета Statistica, версия 6.0, проводился общестатистический и корреляционный анализ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе исследования выявлено, что частота инфицированности пневмот-ропными инфекциями при бронхиальной астме высока. Это подтверждается как встречаемостью антител (табл. 1), так и выделением ДНК возбудителей (табл. 2).
Таблица 1 Частота детекции антител детей с бронхиальной астмой
Возбудитель Бронхиальная астма n=108
Mycoplasma pneumonia IgM 22 20
Chlamydophila pneumonia IgM 2 1,7
Cytomegalovirus IgM 4 3,6
Таблица 2 Частота детекции ДНК возбудителей в мокроте
Возбудитель Бронхиальная астма n=108
Mycoplasma pneumonia 12 11,1
Chlamydophila pneumonia 0 0
Cytomegalovirus 43 39,8
Pneumocystis carinii 1 0,9
Отсутствие возбудителей 52 48,1
Наиболее высокий процент выявления отмечен для цитомегаловирусной инфекции (ЦМВ). В группе больных бронхиальной астмой антитела класса в к ЦМВ отмечались в 52%, класса М - в 3,6% случаев. В результате исследований мокроты у детей, страдающих бронхиальной астмой, наличие ДНК ЦМВ обнаружено в 39,8%. Такое сочетание антител класса в, характеризующих предшествующий контакт с инфекционным агентом, с достаточно частым выделением фрагментов его ДНК из мокроты больных, показывающих персистенцию вируса в клетках слизистой бронхов, и редкая встречаемость антител класса М к данному возбудителю, манифестирующих первичное инфицирование, может свидетельствовать о хронической персистенции цитомегаповируса у детей с бронхиальной астмой. Учитывая, что наличие возбудителя в тканях органа-мишени - бронхах, представляет наибольший интерес для выявления их влияния на течение бронхиальной астмы, именно по этому признаку были сформированы группы для дальнейшего сравнения. В них входили дети, страдающие бронхиальной астмой, выделяющие ДНК ЦМВ с мокротой, и дети, страдающие бронхиальной астмой, но не выделяющие
ДНК возбудителя с мокротой. Однако методы ПЦР диагностики, определяющей наличие фрагментов ДНК цитомегаловируса в мокроте, являющиеся маркером пер-систеиции, пока не стали рутинными. В связи с этим возникает необходимость выявления групп риска по персистенции цитомегаловируса среди детей, страдающих бронхиальной астмой. В ходе исследований нами был выявлен ряд значимых для персистенции вируса факторов (табл. 3).
Факторы, влияющие на вероятность выделения цитомегаловируса с мокротой, при бронхиальной астме у детей
Дети с БА Дети с БА
Факторы ЦМВ + (п^З) ЦМВ - (п=65) Р
Средний возраст (год) 43 6,62±0,47 65 8,71 ±0,54 0,005
Астматический стаж (мес.) 43 42,58±8,13 65 45,86±9,21 0,798
Сопутствующие аллергические 35 81,4% 41 63,07% 0,042
Отягощенность наследственного 32 74,42% 32 49,23% 0,009
анамнеза по атопии
Возраст отца на момент родов 43 23,2±1,08 65 28,7±1,34 0,003
Профессиональная вредность отца 43 100% 44 67,69% 0,0008
Осложнения беременности: 43 100% 52 80% 0,0015
Угроза выкидыша 14 32,55% 13 20% 0,143
Гестоз 14 32,55% 13 20% 0,143
Токсикоз 29 67,44% 19 29,23% 0,00005
Искусственное 29 67,44% 24 36,92% 0,0016
Проживание на селе 34 79,06% 29 44,61% 0,0003
Средний возраст больных бронхиальной астмой, выделяющих фрагменты ДНК цитомегаловируса, составил 6,62±0,47 лет, что достоверно ниже, чем у детей, не выделяющих фрагменты ДНК возбудителя (8,71±0,54 лет). При этом достоверной разницы в их астматическом стаже не выявлено, что свидетельствует о более ранней реализации бронхиальной астмы у детей, в мокроте которых обнаруживается ДНК вируса. Сопутствующие аллергические заболевания у детей с выделением возбудителя наблюдались чаще - 81% (р Супрун, Евгений Николаевич :: 2012 :: Хабаровск
Глава 1. ЛИТЕРАТУРНОЙ ОБЗОР.
1.1 Распространенность бронхиальной астмы и степень её контроля у детей.
1.2 Особенности иммунной системы у больных с бронхиальной астмой.
1.3 Бронхиальная астма и внутриклеточная пневмотропная инфекция.
1.4 Особенности анамнеза и клинического течения бронхиальной астмы на фоне персистенции внутриклеточной пневмотропной инфекции.
1.5 Лечение цитомегаловирусной инфекции.
Глава 2. МАТЕРИАЛЫ И МЕТОДЫ.
2.1 Клиническая характеристика детей с бронхиальной астмой.
2.2. Оценка частоты персистенции внутриклеточных пневмотропных возбудителей у детей с бронхиальной астмой.
2.3 Оценка состояния иммунной системы у детей с бронхиальной астмой.
2.4. Применение специфического иммуноглобулина в комплексном лечении у детей больных бронхиальной астмой с персистенцией цитомегаловируса.
2.5. Статистические методы обработки данных.
Глава 3. КЛИНИЧЕСКИЕ ОСОБЕННОСТИ ТЕЧЕНИЯ
БРОНХИАЛЬНОЙ АСТМЫ ПРИ ПЕРСИСТЕНЦИИ ЦИТОМЕГАЛОВИРУСА В СЛИЗИСТОЙ БРОНХОВ.
3.1 Частота персистенции внутриклеточных пневмотропных возбудителей у детей с Б А.
3.2 Анамнестические факторы, способствующие персистенции ЦМВ у детей с бронхиальной астмой.
3.3 Характеристика клинического течения бронхиальной астмы у детей с персистенцией ЦМВ.
Глава 4. ИММУНОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ТЕЧЕНИЯ БРОНХИАЛЬНОЙ АСТМЫ ПРИ ПЕРСИСТЕНЦИИ ЦИТОМЕГАЛОВИРУСА В СЛИЗИСТОЙ БРОНХОВ И ОБОСНОВАНИЕ НЕОБХОДИМОСТИ КОМПЛЕКСНОГО ЛЕЧЕНИЯ.
4.1 Особенности состояния иммунной системы у детей с бронхиальной астмой при персистенции-ЦМВ.
4.2 Обоснование этиотропной терапии ЦМВ у детей с бронхиальной астмой.
4.3 Клинические примеры.
Введение диссертации по теме "Педиатрия", Супрун, Евгений Николаевич, автореферат
В настоящее время отмечается неуклонный рост распространенности бронхиальной астмы. По данным последней из проведенных Всероссийской диспансеризации 2002 года заболеваемость этим недугом за десять лет в группе детей до 14 лет выросла более чем в три раза, у подростков старше 15 лет - более чем в 13 раз [91].
В связи с этим лечение бронхиальной астмы не только остаётся с течением времени актуальной проблемой в аллергологии, но и приобретает все большее значение. Согласно современным представлениям, бронхиальную астму рассматривают как самостоятельную нозологическую форму, при которой развивается хроническое аллергическое воспаление, сопровождающееся обратимой бронхиальной обструкцией и гиперреактивностью бронхов. Основной механизм развития данного заболевания - иммунологический [5,13,61,76,102,189].
Благодаря достижениям современной фармакологии и аллергологии в лечении основного патологического процесса бронхиальной астмы достигнуты значительные успехи. За предыдущие десятилетия значительно снизился уровень относительной смертности от бронхиальной астмы, улучшилось качество жизни больных, достигнуто кратное снижение частоты тяжелых форм заболевания [12]. Однако добиться полного контроля бронхиальной астмы, что согласно Национальной программе является целью терапии [13], удаётся менее чем в половине случаев (NHWS-National Health and Wellness Survey, 2006г.).
Поэтому в настоящее время наряду с изучением основного механизма развития бронхиальной астмы стали привлекать внимание факторы, усугубляющие риск развития болезни и частоту обострений при их воздействии. К их числу относятся и вирусы, а так же другие инфекционные агенты [4,7,14, 17,28,45].
Наибольший интерес в целях достижения контроля бронхиальной астмы и улучшения прогноза заболевания представляет выявление роли внутриклеточных инфекций, способных к длительной персистенции в слизистой бронхов, являющихся при бронхиальной астме органом-мишенью, и, следовательно, к длительному и постоянному поддержанию и усилению аллергического воспаления бронхов. К таким инфекциям в первую очередь можно отнести микоплазменную, хламидийную, цитомегаловирусную и пневмоци-стную инфекции.
В отношении влияния хламидийной и микоплазменной инфекции на клиническое течение бронхиальной астмы, частоту и тяжесть обострений, существует ряд исследований [92,102]. Более того, получены положительные результаты после проведения лечения сумамедом в возрастной дозе [44]. В то же время данных о влиянии цитомегаловирусной инфекции на тяжесть течения бронхиальной астмы и тем более эффективности её терапии нет.
Исходя из вышеизложенного, очевидна необходимость тщательного исследования вопроса о влиянии цитомегаловируса на течение бронхиальной астмы, изучения особенностей состояния иммунной системы у таких детей и обоснования включения в комплексное лечение препаратов, специфически прекращающих репликацию цитомегаловируса в бронхах.
Цель исследования: Изучить клинико-иммунологические особенности течения бронхиальной астмы у детей, выделяющих ДНК цитомегаловируса с мокротой, и обосновать включение препарата, прекращающего репликацию цитомегаловируса в бронхах, в комплексную терапию бронхиальной астмы.
1. Оценить частоту выявления ДНК цитомегаловируса в мокроте и антител к нему в сыворотке крови у детей с бронхиальной астмой.
2. Выявить особенности клинического течения бронхиальной астмой у детей при выделении ДНК цитомегаловируса с мокротой.
3. Изучить состояние иммунитета при бронхиальной астме у детей в зависимости от выделения ДНК цитомегаловируса с мокротой.
Научная новизна Изучена частота инфицированности пневмотропными внутриклеточными возбудителями (Cytomegalovirus, M.pneumoniae, Ch.pneumoniae, Pneumocysta
Carini) у детей, страдающих бронхиальной астмой, в том числе частота перси7 стенции инфекта в органе-мишени - бронхах. Наиболее часто обнаруживается цитомегаловирус. Это подтверждается как детекцией антител в сыворотке крови, так и выделением ДНК возбудителей из мокроты.
Выявлено влияние цитомегаловируса на клиническое течение бронхиальной астмы. Проявления бронхиальной астмы у детей, выделяющих ДНК цитомегаловируса с мокротой, характеризуются более тяжелым течением, увеличением частоты и тяжести обострений, большим объемом базисной терапии, требующейся для контроля заболевания. Выявлены анамнестические факторы, повышающие вероятность выявления цитомегаловируса в мокроте у детей с бронхиальной астмой.
Доказано влияние цитомегаловируса на показатели иммунитета у детей с бронхиальной астмой. При изучении клеточного звена иммунитета было выявлено снижение абсолютного числа всех типов лимфоцитов, наиболее выраженное для натуральных киллеров, повышение уровня общего 1§Д, нарастание фагоцитарной активности нейтрофилов. Отмечается достоверная сильная обратная связь наличия ^С цитомегаловируса и числа клеток, несущих маркеры СБ 16+. Обострение бронхиальной астмы имеет достоверную сильную обратную связь с количеством клеток С08+.
Установлены особенности клинического течения бронхиальной астмы у детей на фоне выделения цитомегаловируса с мокротой. Определены особенно8 сти иммунной системы у детей с бронхиальной астмой, выделяющих ДНК цито-мегаловируса с мокротой. Выявлены анамнестические факторы, позволяющие выделить группу риска по обнаружению цитомегаловируса среди детей, страдающих бронхиальной астмой.
Применение оптимизированной схемы терапии бронхиальной астмы у детей, выделявших цитомегаловирус с мокротой, позволило облегчить клиническое течение бронхиальной астмы и снизить объем базисной терапии с сохранением контроля над заболеванием.
Результаты работы внедрены в клиническую практику клиники НИИ ОМиД и учебный процесс студентов 6 курса педиатрического факультета на кафедре детских болезней ДВГМУ.
Основные положения, выносимые на защиту:
1. Цитомегаловирус часто встречается у детей с бронхиальной астмой, что подтверждается как детекцией их ДНК в мокроте, так и встречаемостью специфических антител (в, М).
2. У детей с бронхиальной астмой, выделяющих ДНК цитомегаловируса с мокротой, бронхиальная астма протекает тяжелее, что выражается в учащении обострений и в увеличении их тяжести, а так же в увеличении объема базисной терапии, необходимого для контроля заболевания.
По теме работы опубликовано 14 работ, из них 3 в журналах, рекомендованных для публикаций ВАК и 1 - в зарубежном издании.
— Мало того, что вы один из лучших пульмонологов Европы, вы ещё и в главной группе риска сейчас по коронавирусу. Дайте, пожалуйста, рекомендации для людей вашего поколения и чуть помладше, то есть для тех, кто, как мы видим, действительно подвержен высокой летальности — и в Китае, и в Италии, и в Иране.
— Для того чтобы понять группы риска при этом заболевании: в первую очередь это люди, которые контактируют с животными, представляющими биологический резервуар. Скажем, 2002 год — это были африканские кошечки, в 2012 году это были верблюды, а сейчас немножко путается наука, до конца не установлено. Больше данных, что это определённый сорт летучей мыши — тот, который китайцы употребляют в пищу.
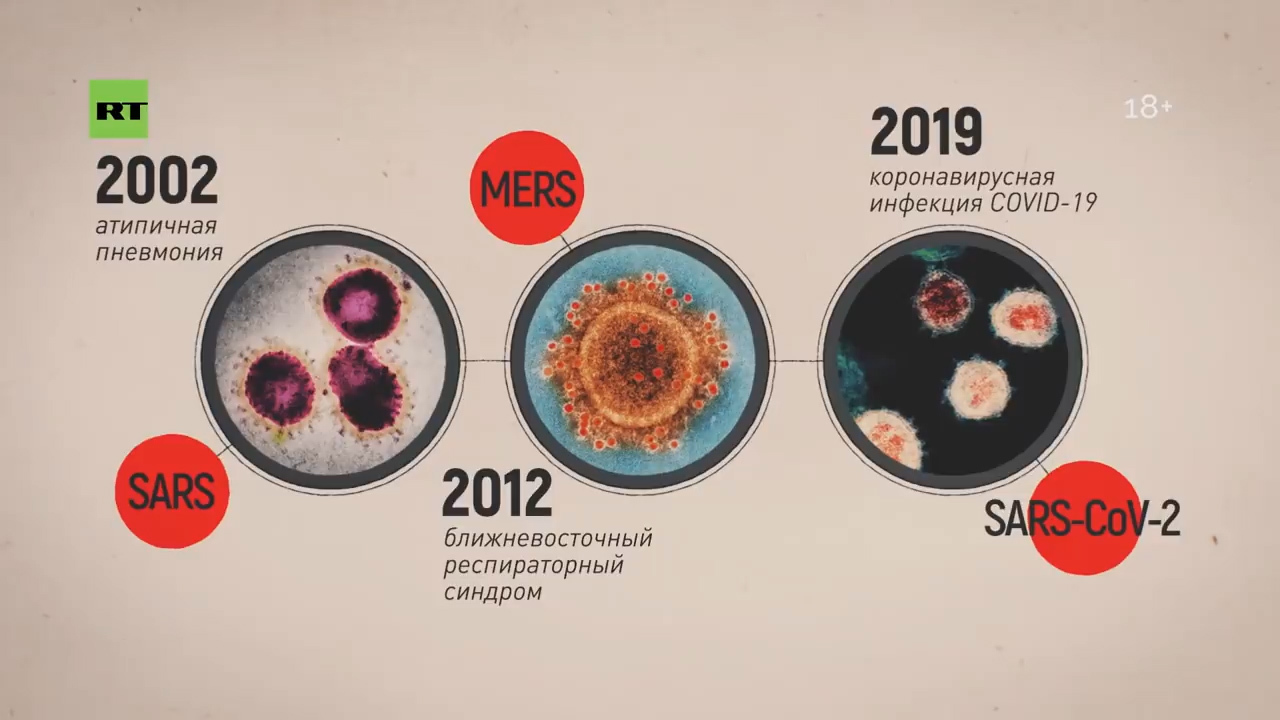
Вот эта летучая мышь распространяет коронавирус через испражнения. Поэтому идёт обсеменение. Допустим, рынок — морепродукты или какие-то другие продукты и так далее. Но когда мы говорим об эпидемии, то человек заражает человека. Поэтому эта фаза уже пройдена. Сейчас человек заражает человека.
Коронавирусы — очень-очень распространённая вирусная инфекция, и человек с ней встречается в жизни много-много раз. Ребёнок в течение года до десяти раз переносит заболевания, которые мы называем острой простудой. А за этой острой простудой стоят определённые вирусы.
И второе место по своей распространённости занимает как раз коронавирус. Проблема в том, что от этих вроде бы безобидных возбудителей отмахивались, никогда не могли понять причинно-следственных отношений. Если, скажем, ребёнок простыл, у него насморк, что за этим пойдёт? И так далее. Где-то в течение двух недель малыш или взрослый болеет — и всё это бесследно исчезало.
А вот в 2002-м, 2012-м и теперь уже в 2020 году ситуация качественно изменилась. Потому что те серотипы, которые стали циркулировать… они поражают эпителиальные клетки.

Эпителиальные клетки — клетки, которые выстилают дыхательные пути, желудочно-кишечный тракт и мочевыводящую систему. Поэтому у человека симптомы лёгочные, симптомы кишечные. И при исследовании анализов мочи тоже выделяют… такую нагрузку.
Но эти новые штаммы, о которых мы сейчас с вами ведём беседу, у них есть такие свойства — вступить в контакт с рецептором второго типа, ангиотензин-превращающего фермента. А с этим рецептором связано такое серьёзное проявление, как кашель.
Поэтому у больного, у которого появляются симптомы поражения нижнего отдела дыхательных путей, характерный признак — кашель. Это поражаются эпителиальные клетки самых-самых дистальных отделов дыхательных путей. Эти дыхательные трубочки очень маленькие.
— Дистальных — дальних, вы имеете в виду?
— Дальних. Маленького диаметра.
— Значит, это то, что рядом с бронхами находится у нас?
— Это бронхи, потом уже бронхиолы, респираторные бронхиолы. И когда воздух, диффузия газов идёт на поверхности альвеол, то они проходят как раз этот участок дыхательных путей.
— То есть первичный. Первое — это кашель.
— Нет, первое — это насморк, першение в горле.
— Вот говорят, что насморка как раз нет.
— Нет, это проблемы больших данных. Обработаны 74 тыс. историй болезни, и у всех ринорея (насморк. — RT) была. Когда вам так говорят — там действительно есть некоторые нюансы. Биология такая. Биологическая мишень вируса — эпителиальные клетки. Нос, орофарингеальная область, трахея, и потом мелкие бронхиолы, которые являются особенно опасными для человека. А оказалось, что, имея этот механизм, они приводят к резкому срыву иммунитета.
— Почему?
— Объяснение, которое сегодня даёт наука, — вовлекается в процесс белок, который называется интерферониндуцированный протеин-10. Вот именно с этим белком связана регуляция врождённого иммунитета и приобретённого иммунитета. Как это увидеть? Это очень глубокое поражение лимфоцитов.
— То есть у вас падают лимфоциты сразу на общем анализе?
— Да. И если там лейкоциты повысятся, тромбоциты повысятся, а более устойчивой является именно лимфопения, то есть лимфотоксический эффект самих вирусов. Поэтому сама болезнь имеет как минимум четыре очерченных этапа. Первый этап — это вирусемия. Безобидная простуда, ничего особого нет. Семь дней, девять — приблизительно в этом интервале.
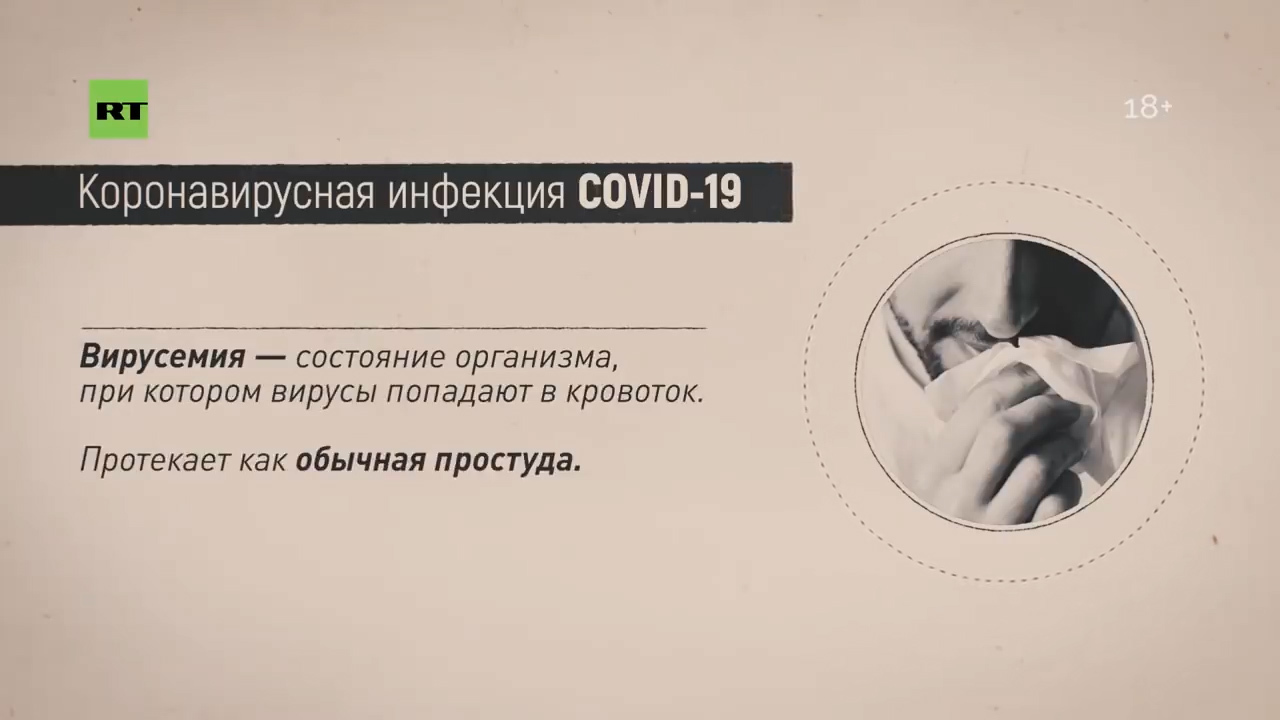
А вот начиная с девятого дня по 14-й ситуация качественно меняется, потому что именно в этот период формируется вирусно-бактериальная пневмония. После поражения эпителиальных клеток в анатомическом пространстве дыхательных путей происходит колонизация микроорганизмов, в первую очередь тех, которые населяют у человека орофарингеальную область.
— То есть уже бактерии?
— Бактерии, да. Поэтому эти пневмонии всегда вирусно-бактериальные.
— Значит, вирус, так сказать, наполняет альвеолы, где всё время живут какие-то бактерии? И они сами по себе где-то живут, в каком-то количестве?
— Вообще, мы считаем, что нижний отдел дыхательных путей стерилен. Вот так устроен механизм защиты, что именно нижний отдел дыхательных путей.
— Там ничего нет.
— Не заселён. Когда вирус внедрился и он нарушил этот барьер, там, где была стерильная среда в лёгких, начинают колонизироваться, размножаться микроорганизмы.
— То есть не вирус вызывает пневмонию? Всё равно пневмонию вызывают бактерии, конечно.
— Ассоциации: вирус — бактерии.
— Да.
— Окно, где врач должен проявить своё искусство. Потому что часто вирусемический период — как лёгкое заболевание, как лёгкая простуда, недомогание, насморк, лёгкая температура небольшая, субфебрильная. А вот период, когда кашель усилился и когда появилась одышка, — это два признака, которые говорят: стоп, это уже качественно другой пациент.
Если эта ситуация не контролируется и болезнь прогрессирует, то наступают уже более серьёзные осложнения. Мы называем это респираторным дистресс-синдромом, шоком. Человек дышать самостоятельно не может.

— Отёк лёгких?
— Понимаете, отёков лёгкого много, на самом деле, бывает. Если быть точными, мы это называем некардиогенный отёк лёгкого. Если, скажем, кардиогенный отёк лёгкого мы можем лечить с помощью определённых лекарственных препаратов, то этот отёк лёгкого можно лечить только с помощью машины механической вентиляции лёгких или продвинутых методов, таких как экстракорпоральная гемоксигенация.
Если человек переносит эту фазу, то иммуносупрессия, вызванная поражением приобретённого и врождённого иммунитета, становится губительной и у больного присоединяются такие агрессивные возбудители, как синегнойная палочка, грибы. И те случаи смерти, которые произошли, — у 50%, которые длительно находились на искусственной вентиляции лёгких, альвеолы все заполнены грибами.
Грибы появляются тогда, когда глубокая иммуносупрессия. Какая же судьба человека, который перенес всё это? То есть он перенёс вирусемию, он перенёс вирусно-бактериальную пневмонию, он перенёс респираторный дистресс-синдром, некардиогенный отёк лёгкого и он перенёс септическую пневмонию. Он будет здоров или нет? И вот, собственно говоря, сегодня мир озабочен именно этим: какая судьба у человека, у тех вот 90 тыс. китайцев, которые перенесли коронавирусную инфекцию?

— 90 тыс. — они сами по себе перенесли, они на ИВЛ не лежали, грибов у них не было. ОРЗ и ОРЗ.
— Но сама проблема — она очень важна. Потому что практическая медицина стоит перед фактом резкого роста так называемых лёгочных фиброзов. И вот у этой группы лиц, перенёсших коронарную инфекцию, в течение года формируется фиброз лёгкого.
— То есть когда лёгочная ткань уплотняется?
— Да. Как жжёная резина. Лёгкое становится как жжёная резина, если аналогию проводить.
— К вам попадает пожилой человек, у него точно диагностирован коронавирус. И он ещё не на девятом дне, то есть его ещё не надо на ИВЛ класть. Как вы его будете лечить?
— Вы знаете, в чём дело: мы таких больных пока не лечим, потому что нет лекарственных препаратов, лекарственных средств, которые надо применять в этой фазе. Панацеи нет. Потому что лекарство, которое бы действовало на вирусемию, на вирусно-бактериальную фазу, на некардиогенный отёк лёгкого, на сепсис, — панацея, такого не может быть.
Потому что, если вернуться к опыту 2002 года, когда увидели уязвимость медицинского персонала, врачам, сёстрам рекомендовали применять тамифлю и озельтамивир — антигриппозный препарат. И при определённых серотипах коронавируса, действительно, механизм внедрения в клетку тот же, как при вирусах гриппа. Поэтому показали, что эти препараты могут защитить лиц, где высокий риск развития этого заболевания.
Или же у него выявляется носительство вируса, ему дают эти препараты и так далее. Но это, я ещё раз хочу сказать, серьёзной доказательной базы не имеет. Ситуация, которая наиболее грозная, потому что она определяет судьбу человека. Простудное состояние — одно дело. А другое дело — когда вирусно-бактериальная пневмония, это принципиально другая вещь.
И здесь очень важно подчеркнуть, что только антибиотиками помочь такому больному проблематично. Здесь должна быть обязательно комбинированная терапия, которая включает средства, стимулирующие иммунитет. Это очень важный момент.
— А что вы имеете в виду? То есть, условно говоря, вы ему пропишете амоксиклав с каким-то иммуномодулятором?
— Да, обычно назначают цефалоспорины четвёртого поколения, не амоксиклав, в комбинации с ванкомицином. Такая комбинация — широкая, потому что очень быстро идёт смена грамположительной и грамотрицательной флоры. А вот какой иммуномодулирующий препарат назначить — это вопрос для научного исследования.
Итак, мы понимаем, что резко пострадает иммунитет. Мы понимаем высокую уязвимость человека к той инфекции, которая у него начинает колонизироваться в дыхательных путях. Поэтому, к сожалению, мы как бы чёткой линии не имеем. Но то, что реально может помогать таким больным в такой ситуации, — это иммуноглобулины. Потому что это заместительная терапия.
И поэтому таким больным, чтобы не разыгрался сепсис, по крайней мере, они не вошли в фазу сепсиса, назначают высокие иммуноглобулины. Американские врачи применили средство у своего больного, которое применяют при лихорадке Эбола. Это препарат группы, аналог нуклеозидов. Это группа препаратов, которые применяют при герпесе, при цитомегаловирусе и так далее.
— То есть это противовирусная или поддерживающая антивирусную терапию, да?
— Нет, это препарат, который действует всё-таки на те механизмы в клетке, которые противостоят репликации вируса. Вот у меня в руках (фотография президента США Дональда Трампа. — RT). Он собрал всю верхушку, которая могла бы высказаться по препаратам перспективным. Два вопроса, которые он поставил, он готовился к этой конференции. Первый вопрос: насколько учёные Соединенных Штатов Америки готовы к внедрению вакцины?
— Полтора года.
— Да, совершенно точно. Это два года. Он говорит: что в таком случае? Есть ли у страны препараты, которые могли бы защитить? И, собственно говоря, они сказали: да, такой препарат есть.
— Что?
— Что это за препарат? Он называется ремдесивир.

— Давайте посмотрим его.
— Вот учёные сказали, учитывая тот опыт, который есть, и обсуждения и так далее. Хотя, конечно, есть другие препараты, которые активно изучаются. Вообще, это направление очень интересное: что, собственно говоря, считается перспективным. Перспективным считается применение стволовых мезенхимальных клеток. Но в какой стадии?
— Слушайте, вот вы, как человек, который много лет этим занимается, от астмы до пневмонии, можете как-то попытаться спрогнозировать развитие этой эпидемии, например, в России?
— Вы знаете, в чём дело? Я хочу сказать, что, если Россию сравнивать с окружающим миром и брать коронавирус 2002 года, там ни одного больного не было.
— Может, мы просто не диагностировали?
— Он у нас вообще единственный сертифицированный, да?
— Вирус уже в России, как бы санэпидемслужба ни старалась. Как вы считаете, как он будет развиваться? Закончится ли он весной, например, с приходом лета?
— Знаете, мне кажется, картинка повторяет то, что было тогда. Это, если вы помните.
— Тогда — в 2002 году? То есть когда был SARS?
— Он отличается на 16, по-моему, нуклеозидов.
— Если пойдёт по этому сценарию, то нужно сказать, что где-то в апреле-мае эта проблема уже остро, по крайней мере, стоять не будет.
— Просто из-за сезонного прекращения респираторных инфекций?
— Да. Климатический фактор, целый ряд других факторов. Сейчас, когда беда, конечно, к нам приходит не из Китая, а из Европы. Те, кто возвращается из этих стран, в первую очередь из Италии, сегодня, запомните: Урбани. Это он сделал очень многое. Я считаю, это просто подвиг врача, который так много сделал. Это был вирусолог из Милана.

— Тогда, в 2002 году?
— Он эксперт ВОЗ, я с ним встречался по линии Всемирной организации здравоохранения. Он в списке был эксперт по коронавирусам. И тогда его направили в Ханой. Они распределились, ему достался Вьетнам. И во Вьетнаме, когда он приехал, была паника. Врачи перестали выходить на работу. Медицинский персонал тоже. Больные есть, а врачебного и медицинского персонала нет.
Он оценил ситуацию. С трудом ему удалось переломить её, снять эту паническую ситуацию, которая была тогда в госпитале. Ну а самое главное — он стал общаться с правительством и сказал: закрыть страну на карантин. Вот откуда всё это пошло. Это пошло от Урбани. Они начали артачиться.
— Вьетнамцы?
— Да, Вьетнам. Что это экономика, туризм и так далее. В общем, он нашёл эти слова, он убедил. И Вьетнам — первая страна, которая вышла из этого. И он посчитал, что его работа закончена. Он набрал материал для вирусологического обследования и сел в самолёт, который летел в Бангкок.
Там американские вирусологи, они должны были встретиться. А когда уже полетел, понял, что заболел. Заболел так же, как эти несчастные вьетнамцы в том госпитале. И он стал всё записывать, описывать. Вот время такое-то — моё самочувствие такое-то.
— Лететь три часа?
— Какие рекомендации вы можете дать человеку, который обнаруживает у себя… Ну то есть мы уже договорились, что вирус в общей популяции. Мы уже не можем, на самом деле, его контролировать.
— Да. Значит, такие обывательские рекомендации?
— Да, именно так.
— В первую очередь — это всё-таки хороший уход за слизистой носа и орофарингеальной областью.
— То есть покупаешь морскую воду и себе…
— Да, и промываешь тщательно. Но лоры — они очень хорошо показывают эффективный лаваж. То есть должно прийти всё-таки ощущение свободного дыхания. Второе место — это орофарингеальная область за увулой. И там тоже нужно хорошо сделать лаваж орофарингеальной области.
— То есть надо прыскать не только в нос, но и глубоко в гортань?
— Да, и прополаскивать. И не лениться делать до тех пор, пока не придёт чувство чистых, хороших дыхательных путей. Из всех путей это средство самое эффективное. Я бы посоветовал тем людям, которые могут себе позволить, приобрести небулайзер или.
— То есть такой аэрозольный, да? С ультразвуком?
— Да. И он позволяет гигиену именно верхней части дыхательных путей доводить до хорошего состояния. Когда присоединяется кашель — желательно всё-таки применить те лекарства, которые мы прописываем больным бронхиальной астмой. Это или беродуал, или вентолин, или сальбутамол. Потому что именно эти препараты улучшают мукоцилиарный клиренс, снимают спазм.
— То есть отхаркивающий? АЦЦ?
— Да, АЦЦ и флуимуцил. И чего нельзя делать — это применять глюкокортикостероиды. Этот вирус, его репликация резко нарастает.
— Что это значит?
— Глюкокортикостероиды — это преднизолон, метилпреднизолон, дексаметазон, метаметазон.
— То есть не надо колоть гормоны, условно говоря, если у вас вирусная инфекция?
— Есть ингаляционные стероиды. Но есть больные с астмой, которые заболели, находятся на этой терапии. Это уже как бы индивидуальные решения. Конечно, 2020-й войдёт в историю медицины как новая болезнь. Мы должны это признать, что мы поняли новую болезнь. Две новые пневмонии пришли. Это пневмония, которая вызывается электронными сигаретами, вейпами, и сейчас в Соединённых Штатах от этого умерли.
— . несколько тысяч подростков. Да, это известный факт, и чем лечить — непонятно. Сажаешь на ИВЛ — они умирают сразу.
— Да. Вы понимаете, в чём проблема-то? Вот у них развиваются те изменения в лёгких, которые возникают при этом. Они вроде бы схожие. Это респираторный дистресс-синдром, о котором мы с вами ведём разговор. В литературе поднимаются очень серьёзные вопросы: роль коронавирусов в трансплантологии. Одна из проблем — это облитерирующий бронхиолит, который возникает особенно при пересадке.
— Пересадке лёгких?
— Да, лёгких и костного мозга. Стволовых клеток. Вот, собственно говоря, всё хорошо сделано, всё нормально, человек ответил на эту терапию, а начинает нарастать проблема дыхательной недостаточности. И причину этих бронхиолитов поймали — это коронавирус. То есть новое знание пришло.
Читайте также:


