Цитомегаловирус у домашних животных
Источники инфекции. Дикие и домашние больные животные.
Пути передачи. Вирус бешенства передается прямым контактным путем от больных животных (укусы) либо при попадании слюны больного животного на поврежденную поверхность кожи или слизистых оболочек.
Патогенез. От момента укуса или ослюнения до заболевания человека проходит от 15—45 дней до 3—6 месяцев (описаны случаи инкубации свыше года). Длительность инкубации зависит от ворот инфекции, характера повреждения ткани. Наиболее короткий период инкубации при укусах в лицо и голову.
Из места внедрения вирусы распространяются по нервным стволам и попадают в клетки центральной нервной системы. Наибольшее количество вируса концентрируется в гип-покампе, продолговатом мозгу, черепных ядрах и в поясничной части спинного мозга. В нервных клетках вирус репродуцируется (размножается). В результате поражения нервной системы появляется повышенная рефлекторная возбудимость: судороги, особенно дыхательных и глотательных мышц. Возникает одышка и водобоязнь (гидрофобия). Одно представление о питье вызывает у больных сильные болезненные судороги. Смерть наступает через 4—5 дней. Летальность 100%.
Клиническая картина бешенства у собак. Животное становится угрюмым, появляется слюнотечение. Собака начинает пожирать несъедобные вещи — камни, щепки и прочие. Затем наступает период возбуждения. Собака бежит по прямой линии, низко наклонив голову. Нападает на встречающихся людей, животных без лая и кусает их. Период возбуждения сменяется параличами и гибелью животного.
Иммунитет. Постинфекционный иммунитет изучен не достаточно. Механизм иммунитета, возникающего после прививки, связан с вируснейтрализующими антителами, которые появляются через 2 недели после вакцинации, а также с интерференцией вакцинного и уличного вирусов. Феномен интерференции состоит в том, что фиксированный вирус значительно быстрее достигает клеток нервной системы, размножается в них и препятствует внедрению уличного вируса. Иммунитет сохраняется в течение 6 месяцев.
Профилактика. Уничтожение бешеных животных, бродячих собак. Регистрация собак и обязательная их вакцинация. В случае укуса немедленная обработка ран.
Специфическая профилактика. Введение антирабичес-кой вакцины предложил Л. Пастер. В настоящее время для лечебно-профилактической иммунизации бешенства используют следующие вакцины:
1) вакцина антирабическая культуральная из штамма Вну-кова-32;
Вводят внутримышечно по 1 мл, это разовая доза. Сразу же после укуса на 3, 7, 14, 30-й день. Ревакцинация на 90-й день.
Противопоказания к прививкам
1) острые инфекционные и неинфекционные заболевания и хронические заболевания в стадии обострения;
2) системные аллергические реакции на предшествующие введения препаратов;
3) аллергические реакции на аминогликаны;
В вышеперечисленных ситуациях применяют иммуноглобулин гетерологичный (лошадиный) или гомологичный (человеческий).
Особенности проведения антирабической иммунизации I. Если нет глубоких повреждений и произошло ослюне-ние кожных покровов или одиночные укусы или царапины, туловища, верхних и нижних конечностей кроме головы, лица, шеи, кисти.
1. Животное в момент укуса и в течение 10 суток наблюдения — здорово, вакцинация не назначается.
2. Животное в момент укуса здорово, в течение 10 суток заболело, погибло или исчезло — лечение начинают от момента появления признаков болезни у животного или от момента исчезновения.
3. Животное с подозрением на бешенство. Лечение проводить немедленно, если в течение 10 суток животное здорово — лечение прекращают.
II. Если произошел укус головы, шеи, лица, кисти, гениталии.
1. Животное в момент укуса здорово или с подозрением на бешенство. Проводят комбинированное лечение: вакцина + иммуноглобулин — немедленно. В течение 10 суток животное здорово — лечение прекращается.
2. Наблюдение за животным невозможно. Проводят комбинированное лечение полным курсом.
§ 6. Цитомегаповирусная инфекция
Несмотря на то, что прошло более столетия после первого описания цитомегалии и треть века после открытия цито-мегаловируса, только недавно выяснилось широкое распространение этой инфекции и ее значение в акушерстве, неона-тологии, педиатрии, клинической вирусологии, трансфузи-ологии и трансплантологии. Отмечается тот факт, что цито-мегаловирусная инфекция (ЦМВ) является одной из наиболее частых причин внутриутробной и перинатальной инфекции.
Этиология. Цитомегаловирус относится к семейству герпетических вирусов. Для них характерна способность перси-стировать в организме с нерегулярной продукцией вирусных частиц и обострениями хронической инфекции. Особенностями ЦМВ по сравнению с другими вирусами является необычайно крупный ДНК-геном, возможность репликации без повреждения клетки, меньшая цитопатогенность в культуре тканей, медленная репликация вируса, сравнительно низкая вирулентность и более узкий спектр хозяев, меньшая чувствительность к аналогам нуклеозидов и резкое подавление клеточного иммунитета со снижением соотношения CD4CD8.
Специфическая лабораторная диагностика ЦМВ приобретает особое значение. Для обнаружения вируса и его антигенов существует ряд методик. Изоляция ЦМВ на клеточной культуре основана на характерном цитопатическом эффекте, который при ЦМВ развивается медленно — в традиционном исполнении 2—3 недели. Тем не менее, культивирование ЦМВ считается самым достоверным и надежным методом диагностики. В последнее время это исследование значительно усовершенствовано и доведено до уровня экспресс-метода, позволяющего с помощью центрифугирования и последующего применения моноклональных антител выявить в культуре тканей ранние антигены ЦМВ. Материалом для заражения культуры тканей могут служить слюна, моча, кровь, цервикальное отделяемое, амниотическая жидкость, сперма, образцы тканей при биопсии и аутопсии. Следует учитывать малую устойчивость ЦМВ во внешней среде и потому в вирусологическую лабораторию следует направлять свежий материал.
Дальнейшим шагом к рационализации обнаружения антигенов ЦМВ является применение молекулярной гибридизации, которая позволяет без применения культуры тканей обнаруживать вирусную ДНК непосредственно в исследуемых образцах.
Выявление цитомегалической клетки при гистоисследо-вании материалов аутопсии имеет бесспорное диагностическое значение, так же как и обнаружение антител к ЦМВ. Значительные преимущества имеет метод иммунофлюоресцентного анализа, позволяющий определять антитела М и G к ЦМВ, а также конкурирующий с ним по чувствительности ИФА. Первый метод более доступен, но в то же время второй более точен и чувствителен. В ряде лабораторий успешно применяется твердофазный иммуноанализ. Наиболее современным методом является иммуноблотинг, позволяющий с помощью полиакриламидного гель-электрофореза определять весь спектр антител к ЦМВ.
Эпидемиология. Источниками инфекции могут являться хронические носители ЦМВ или больные с различными вариантами цитомегаловирусной инфекции, а точнее — их биологические жидкости и выделения: кровь, моча, слюна, вагинальное отделяемое, слезы, грудное молоко, спинномозговая и амниотическая жидкости, отделяемое носоглотки, сперма, фекалии и др. Особенно велик риск инфицирования новорожденных при заменных переливаниях крови или повторных гемотрансфузиях от эпидемиологически опасных доноров. В то же время обнаружено, что донорская кровь при хранении в течение 2 дней при температуре 4°С реже сохраняет ЦМВ, чем свежая. В трансплантологии источником ЦМВ являются донорские ткани и органы. Особенно велик риск при пересадке костного мозга и почек.
Давно было известно, что женщина может быть источником передачи ЦМВ новорожденному, но в последнее время также установлено, что возможна передача ЦМВ от детей взрослым и прежде всего родителям.
Механизм передачи ЦМВ предполагает в первую очередь тесный контакт между беременной (родильницей) и плодом (новорожденным), между сексуальными партнерами, между детьми в закрытых детских коллективах. В настоящее время установлено, что интранатальная или ранняя постнатальная передача ЦМВ происходит в 10 раз чаще, чем трансплацентарная. В послеродовом периоде эпидемиологическая опасность матери для новорожденного также сохраняется. Это связано с нарушением женщиной гигиенических норм, а также с возможностью передачи вируса через грудное молоко (20% серопозитивных матерей имеют ЦМВ в грудном молоке и 76% их детей оказываются инфицированными).
ЦМВ является полигистиотропным, но особый тропизм он проявляет к слюнным железам. Отсюда реальна возможность передачи вируса при поцелуях, в отношении матери с ребенком.
Следует отметить, что первичная ЦМВ-инфекция у беременных возникает значительно реже, чем обострения хронической, но в то же время представляет большую опасность для плода и новорожденного. Генетическая предрасположенность также определяет восприимчивость к ЦМВ-инфекции. Что же касается суперинфекции при ЦМВ, то возможность ее возникновения недостаточно изучена, хотя с учетом вариантов ЦМВ-инфекции у человека она является теоретически возможной.
Клинико-патогенетические варианты ЦМВ-инфекции. Обнаружение ЦМВ не означает развития заболевания. В большинстве случаев формируется вирусоносительство или субклиническая, инаппарантная хроническая форма инфекции, не вызывающая вне иммунодепрессии никаких субъективных нарушений или объективных клинических проявлений. Состоянию длительной (нередко пожизненной) латенции ЦМВ способствует его внутриклеточное сохранение в лимфоцитах, где он надежно защищен от действия специфических антител и интерферона. По-видимому, надежным пристанищем для ЦМВ могут явиться и моноциты, реже — по-лиморфноядерные лейкоциты.
Многообразие клинико-патогенетических форм ЦМВ-инфекции связано в большинстве случаев с бессимптомной ла-тенцией и с полиморфизмом ее клинических проявлений. Диапазон клинических вариантов необычайно широк — от едва выраженного сиалоаденита, благоприятно текущего мо-нонуклеозоподобного заболевания, до тяжелейших поражений печени, легких и мозга, а также шока, который вызван деструкцией надпочечников при диссеминированной ЦМВ-инфекции. Последние формы особенно часто возникают при СПИДе. Появление ЦМВ-вирусемии при СПИДе расценивается как прогностически неблагоприятный признак.
ЦМВ и иммунодепрессия — наиболее важная особенность патогенеза цитомегалии. Это связано с тем, что для ЦМВ характерна реактивация в условиях так или иначе возникшего иммунодефицита. Наиболее ярким проявлением этой закономерности является присоединение ЦМВ к ВИЧ-инфекции.
Теоретически у беременной женщины возможно развитие любого из множества клинико-патогенетических вариантов ЦМВИ. В то же время многолетний опыт убеждает, что в этих случаях речь почти всегда идет об обострении хронической или латентной ЦМВИ, которая, как правило, не имеет ярких клинических проявлений у матери. При этом у женщины в анамнезе имеются указания на привычное невынашивание беременности, неразвивающуюся беременность, мертворождение, рождение нежизнеспособных детей, а также детей-инвалидов с врожденными пороками развития.
Первичная ЦМВИ у беременных возникает в 1—4% случаев и сопровождается 50% риском внутриутробного заражения плода. Обострение хронической или латентной ЦМВИ чаще (10—20%) возникают у серопозитивных беременных. Несмотря на то, что ЦМВ выявляется у 1—2% всех новорожденных, только 0,05—0,1% из них страдают от цитоме-галовирусных заболеваний. Даже при развитии во время беременности первичной ЦМВИ 90—95 % женщин имеют шанс родить здорового ребенка.
У женщины с доказанной ЦМВИ и отягощенным акушерским анамнезом наиболее вероятной и частой причиной внутриутробной гибели плода является ЦМВИ. Подобная ситуация может потребовать принятия неотложных практических решений: сохранять беременность у инфицированной ЦМВ женщины или считать ее противопоказанной. Трудности в решении этого вопроса возникают на поздних сроках беременности. При решении вопроса о сохранении беременности при ЦМВИ приходится учитывать не только ближайшие возможные отрицательные последствия, но и отдаленные исходы для ребенка. В 10% наблюдений у внутриутробно инфицированных детей в последующем возникают нарушения слуха и интеллекта, а также другие неврологические нарушения.
Лечение. Надежной противовирусной терапии при ЦМВИ до настоящего времени нет, хотя ведутся интенсивные поиски в этом направлении. Не оправдались надежды на противовирусные препараты широкого спектра действия, такие как видарабин или аденин-арабинозид, виразол, а также ацикловир. К перспективным противовирусным препаратам при ЦВМИ относятся новые лекарственные средства — ганцикловир и фоскарнет, которые в нашей стране не изучены. Использование с лечебной целью интерферо-нов при ЦМВИ малорезультативно, но их изучение продолжается.
§ 7. Клещевой энцефалит
Переносчики — клещи Ixodes persulcatus и Ixodes ricinus.
Сидя на травинках или на деревьях, клещи терпеливо ждут, пока мимо них пройдет животное или человек. Клещи не могут летать или прыгать, они могут только зацепиться за проходящую мимо и задевающую их жертву или же упасть на нее. Как и в случае других кровососущих насекомых, укус клеща может остаться незамеченным довольно долгое время, благодаря присутствию в его слюне особых разжижающих кровь (антикоагулянтов) и обезболивающих веществ. Именно по этой причине, простой, но очень эффективной мерой по обнаружению присосавшегося клеща являются само- и взаимоосмотры по выходе из леса и на привалах. Самцы клеща, в отличие от самок, присасываются на очень короткое время, что является еще одной причиной того, что многие заболевшие не помнят факта укуса.
Не исключено и заражение людей, не посещавших лес. Это может произойти при заносе клещей животными (собаками, кошками) или людьми — на одежде, с цветами, ветками и т. д.
Помимо вируса весенне-летнего.энцефалита, клещ может нести в себе возбудителей других инфекций — клещевого боррелиоза (болезни Лайма), клещевого сыпного тифа, Ку-лихорадки, лептоспироза.
Возбудитель и распространенность инфекции. Возбудитель инфекции — это вирусы семейства Flaviviridae. Вирус в целом довольно чувствителен к факторам внешней среды — он быстро погибает при комнатной температуре, нагревании до 60°С в течение 10—20 минут, при кипячении — через 2 минуты. Быстро разрушается под действием дезинфектантов. Однако в высушенном состоянии может сохраняться годами, в молоке и молочных продуктах — до 2 месяцев.
Выделяют два принципиально важных географических, клинических и биологических варианта вируса и заболевания.
В 1939 г. клещевой энцефалит был выявлен на европейской части территории России (было установлено его широкое распространение от восточных до западных границ России — от Приморья до Карелии) и в большинстве европейских стран. Сам вирус клещевого энцефалита был впервые выделен в 1949 г.
До начала массовых кампаний вакцинации в Европе клещевой энцефалит представлял около половины от всех инфекций центральной нервной системы. Собственно, со времени регистрации крупной вспышки в 1956 г. в лесистой части Австрии, и началась история создания вакцины для профилактики клещевого энцефалита.
В настоящее время инфекция регистрируется в Австрии, Германии, Польше, Чехословакии, Финляндии, Прибалтийских государствах, европейской и дальневосточной части России, Италии, Швейцарии. Максимальные показатели заболеваемости отмечаются в России и Австрии. За неполный
1999 г. в России было зарегистрировано более 1 тыс. случаев заболевания, что на 30% выше показателей 1998 г.
Наибольшему риску подвержены лица, деятельность которых связана с пребыванием в лесу: работники леспромхозов, геологоразведочных партий, строители автомобильных и железных дорог, нефте- и газопроводов, линии электропередач, топографы, охотники, туристы. В последние годы в числе больных до 75% составляют жители города, заразившиеся в пригородных лесах, на садовых и огородных участках.
Заболевание. Клещевой энцефалит (син.: таежный энцефалит, дальневосточный менингоэнцефалит, клещевой энцефаломиелит, русский весенне-летний менингоэнцефалит, tick-borne encepalitis) — вирусное, природно-очаговое (то есть характерное только для определенных территорий) заболевание с преимущественным поражением ЦНС. Инфекция также поражает и животных — грызунов, домашний скот, обезьян, некоторых лесных птиц (последние являются дополнительным резервуаром инфекции в природе).
Если заражение происходит через молоко (некоторые специалисты даже выделяют такой путь инфицирования и форму заболевания в отдельную инфекцию), вирус сначала проникает во все внутренние органы, вызывая первую волну лихорадки, затем, когда вирус достигает своей конечной цели, ЦНС — вторую волну лихорадки. Если же заражение произошло не с пищей (не через рот), развивается другая форма заболевания, характеризующаяся одной волной лихорадки, обусловленной проникновением вируса в головной и спинной мозг и воспалением в этих органах (собственно энцефалит от греч. энкефалон — головной мозг).
Инкубационный период в среднем составляет 1,5—2 недели, иногда затягиваясь до 3 недель. Разную длительность инкубационного периода можно объяснить характером укуса — чем дольше присасывался клещ, тем больше вирусов проникло в организм и тем быстрее будет развиваться заболевание.
Фармацевтика, медицина, биология
Цитомегаловирус
Цитомегаловирус (ЦМВ, англ. Cytomegalovirus / CMV) — род ДНК-содержащих вирусов семейства герпесвирусов, которой является составной частью понятия TORCH-инфекции.
История открытия вируса
Цитомегаловирус был открыт независимо друг от друга в 1955 американским патологом М. Смит из слюнных желез умершего ребенка, ее соотечественниками — вирусологом В. Роувом с соавторами из лимфоидной ткани человека (1956) и выдающимся педиатром и вирусологом, лауреатом Нобелевской премии по физиологии и медицины Т. Г. Веллером с соавторами от больного с подозрением на токсоплазмоз (1957 г.). Именно Веллер дал название вируса по вызванном тем эффектом в клетках — ЦМВИ.
Свойства вируса
Как и все представители герпесвирусов в организме, как правило, находится в латентной форме. Имеет выраженный тропизм к тканям слюнной железы. Есть достаточно распространенным, встречается примерно у 40% людей. Кроме человека, выделенный от обезьян, морских свинок и мышей. Название вирус получил в результате того, что при заболевании в слюне, моче, спинномозговой жидкости наблюдают гигантские клетки (цитомегалия) размерами 30 — 40 мкм, в ядре которых является включение диаметром 8 — 10 мкм.
Вирус термолабильный, инактивируется при 56 ° С через 10 — 20 минут при 4 ° С сохраняется в течение недели. Стабильный при рН 5,0-9,0, быстро разрушается при рН 3,0. В лабораторных условиях размножаются довольно медленно, только в культурах клеток. Цитопатическое действие наблюдают через 5 — 20 суток.
На сегодня известно 3 серотипов вируса человека I, II, III, к которым относят многие штаммы: AD-169, Davis, Towne, TB40 / E, Toledo, Merlin, 3157, 6397, 711, 5234, ESP. (Espaillat) и др. Штаммы различаются по набору гликопротеидов. На сегодня к различиям и структурных особенностей штаммов ЦМВ приковано наибольшее внимание вирусологов и клиницистов.
Каждый вирусный транскрипт обычно кодирует один белок и имеет регуляторную последовательность, цис-регуляторный элемент — ТАТА-бокс, сайт инициации транскрипции, 5 'нетранслюючу последовательность лидера в 30-300 bp, 3' нетранслируемые последовательности в 10-30 bp и поле А сигнал. Содержит много генов перекрытия, но ограниченное количество генов Сплайсинг (те, что создают возможность прикрепления одной молекулы ДНК к другой).
Литическая репликация, которая имеет следующие этапы:
- Прикрепление вируса с помощью гликопротеинов к рецепторам клетки-мишени с последующим эндоцитоза вируса внутрь клетки.
- Процесс вторжения в клетку-хозяина остается до конца еще не просветленным и может зависеть от типа клетки-хозяина. То есть преобладает в каждом конкретном случае — эндоцитоз или расплавления плазматической мембраны.
- Капсид транспортируется к отверстиям в ядре клетки-хозяина, где вирусная ДНК высвобождается внутрь ядра.
- Транскрипция немедленных ранних генов, которые способствуют транскрипции ранних генов и защищают вирус от иммунитета хозяина.
- Транскрипция ранней вирусной мРНК за счет полимеразы II клетки-хозяина, которая кодирует белки, вовлеченные в репликации вирусной ДНК.
- Первый раунд циркулярной амплификации генома путем двусторонней репликации.
- Синтез линейных конкатемерних копий вирусной ДНК по типу замкнутого круга.
- Транскрипция поздней вирусной мРНК за счет полимеразы II клетки-хозяина, которая кодирует белки, вовлеченные в репликации вирусной ДНК.
- Монтаж вируса в ядре, выход через модифицированных мембрану ядра, которая была изменена гликопротеинами цитомегаловируса, с помощью комплекса Гольджи и финальная реализация в плазматической мембране.
Репликация вирусного генома в тандеме с ДНК клетки-хозяина составляет сущность механизма персистенции цитомегаловируса в организме пораженного.
Цитомегаловирусная инфекция
Человеческий цитомегаловирус вызывает у людей ЦМВ-инфекции в широких пределах: от бессимптомной персистенции к тяжелым генерализованных форм при иммунодефиците, особенно при СПИДе, который возникает на поздних клинических стадиях ВИЧ-инфекции. Наиболее присуща для иммунокомпетентных человека является персистентная ЦМВ-инфекция. Цитомегаловирус человека имеет три гена, которые позволяют ему избежать эффективной элиминируя иммунного ответа. Есть ген US3, продукция которого предотвращает противодействия молекул главного комплекса гистосовместимости, которые способны транспортировать чужеродный антиген за пределы мембраны клетки. Продукты гена US6 ингибируют пептидной транслокацию тех белков, которые связаны с распознаванием чужеродных антигенов. Продукты гена US11 перемещают тяжелые цепи класса I антигена с эндоплазматического ретикулума в цитозоль, что делает его нефункциональным. Все эти три гена мешают распознаванию вирусного антигена в инфицированных клетках. Таким образом инфицированная клетка не может выявить антиген ЦМВ, и поэтому макроорганизм не получает информацию о заражении, из-за чего и нет иммунного ответа на ЦМВ. Именно это и объясняет возможность длительной ЦМВ-персистенции.
ЦМВ животных
Также еще несколько представителей этого рода вызывают инфекцию у приматов, мелких грызунов. Каждый из них паразитирует в конкретных видов: нескольких — из рода Cercopithecus, у шимпанзе, орангутанов, макак. Цитомегаловирус, что поражает обезьян одного вида, не встречается у представителей другого. Так же происходит и в мелких грызунов. Соответственно, человек заразиться от обезьян или грызунов их специфическими цитомегаловирусами не может.
Видео по теме

Цитомегаловирусная инфекция – широко распространенная вирусная инфекция, характеризующаяся многообразием проявлений от бессимптомного течения вплоть до тяжелейших генерализованных форм с поражением внутренних органов и центральной нервной системы. Во время трансплацентарной передачи инфекции возможно поражение плода.
Уровень инфицирования цитомегаловирусной инфекцией и степень зараженности организма зависит от социально-экономических условий, этнической принадлежности, практики медицинского обслуживания новорожденных и детей младшего возраста, времени вступления в половые отношения.
Доля носителей ЦМВ в России составляет около 90%.
Попадая в клетки человеческого организма, цитомегаловирус способен оставаться в нем пожизненно.
Возбудитель (Cytomegalovirus hominis) относится к вирусам герпеса (семейство Herpesviridae)
Резервуаром и источником инфекции является только человек. Вирус может находиться в слюне, молоке, моче, испражнениях, семенной жидкости, в секрете шейки матки.
У 20-30% здоровых беременных женщин ЦМВ присутствует в слюне, 3-10 % - в моче, 5-20% - в цервикальном канале или вагинальном секрете.
Кровь около 1% доноров содержит цитомегаловирус.
Хотя, вирусные частицы могут быть обнаружены по всему телу, цитомегаловирус, чаще всего, ассоциирован со слюнными железами.
Cпособы передачи инфекции
Цитомегаловирусная инфекция распространяется не только через слюну при близких контактах, но и во время полового контакта, через кровь, от беременной матери плоду, а также контактно-бытовым путем.
Наибольшую опасность для плода представляет первичная инфекция на ранних сроках беременности. Возбудитель, проникший в плод через кровь в ранние сроки беременности, вызывает формирование врожденных пороков развития.
При наличии инфекции в канале шейки матки у беременной, заражение плода может происходить в родах, во время прохождения плода по родовым путям.
Основной путь заражения ребенка до года – передача вируса через грудное молоко.
Источником заражения детей до 5-6 лет являются матери, выделяющие вирус со слюной или мочой.
Дети, находящиеся в организованных коллективах заражаются чаще контактно-бытовым путем.
Заражение в возрасте 16-30 лет происходит, как правило, при близком контакте через поцелуи и половым путем.
Переливание крови и другие манипуляции с кровью также могут приводить к заражению цитомегаловирусом.
Симптомы цитомегаловирусной инфекции
В здоровом организме вирус никак себя не проявляет, но может быть смертельно опасен для людей с иммунодефицитами: для ВИЧ-инфицированных, больных, после трансплантации органов, а также ожидающих трансплантацию, новорождённых.
При врожденной цитомегаловирусной инфекции характер поражения плода зависит от срока его заражения. Особенно опасно острое инфицирование матери в первые 20 недель беременности.
К чему может привести заражение в ранние сроки беременности?
Внутриутробная гибель плода;
Грубые врожденные пороки (анэнцефалия, микроцефалия, гидроцефалия, нарушение строения легких, бронхиального дерева, аномалии строения почек и др.).
Врожденные пороки в большинстве случаев несовместимы с жизнью.
При заражении ЦМВ в более поздние сроки беременности формирования пороков развития не происходит.
К чему приводит заражение ребенка цитомегаловирусом во время родов?
Клинические признаки, как правило, появляются через 1-2 месяца после родов.
Поражение легких (пневмония);
Увеличение печени, селезенки;
Поражение желудочно-кишечного тракта;
Заболевание может носить длительный рецидивирующий характер.
Максимальная летальность от цитомегаловирусной инфекции приходится на 2-4 месяц.
Профилактика цитомегаловирусной инфекции
Во время консультирования беременных женщин, или планирующих беременность необходимо информировать о главных источниках и путях инфицирования (половые контакты с инфицированными ЦМВ партнерами, физический контакт при ежедневном уходе за ребенком дома или профессиональный контакт с детьми младшего возраста в стационарах, домах ребенка, дошкольных учреждениях).
Для снижения риска первичного заражения ЦМВ беременным женщинам, использовать барьерные контрацептивы при половых контактах, соблюдать правила личной гигиены (мыть руки после прикосновения к дверным ручкам, прикосновения к игрушкам, испачканными слюной , мочой ребенка), не рекомендуется доедать или допивать за детьми, использовать совместную посуду, нельзя облизывать соску. Необходимо избегать поцелуев в губы детей грудного возраста, которые могут выделять вирус со слюной.
При планировании переливания крови недоношенному ребенку или взрослому человеку с ослабленной иммунной системой, необходимо осуществлять проверку крови и ее компонентов на наличие ДНК ЦМВ.
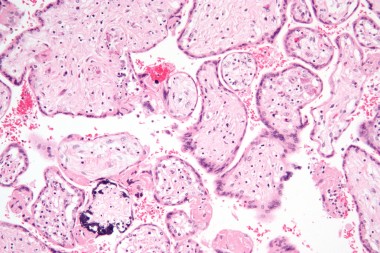
В статье проанализированы опубликованные данные по вопросам адекватной диагностики антенатальной и постнатальной цитомегаловирусной инфекции (ЦМВИ), а также лечению острых ЦМВИ у беременной, плода и новорожденного. Представлены отечественные клинические р
The article gives analysis of the data on the issues of relevance of diagnostics of antenatal and postnatal cytomegaloviral infection (CMVI), as well as treatment of acute CMVI in the pregnant, fetus and newborns. National clinical guidelines on diagnostics and treatment of congenital CMVI developed by the Russian Association of antenatal medicine in 2016, were presented; as well as the first unofficial international guidelines on the issues of diagnostics and treatment of congenital CMVI.
Цитомегаловирус (ЦМВ) — чрезвычайно распространенный вирус, поражающий людей всех возрастов и формирующий пожизненную персистенцию в организме инфицированного человека. Считается, что в большинстве случаев персистенция начинается в ранние годы жизни и протекает латентно, не оказывая выраженного патологического влияния на состояние здоровья инфицированного. С другой стороны, доказано, что персистенция вируса может сопровождаться хроническим воспалением, формировать разнообразные многочисленные иммунные дисфункции и определять развитие вторичных иммунных, аутоиммунных и дегенеративных нарушений. Различного рода иммунокомпрометации могут приводить к рецидивам размножения вируса и многообразным клиническим проявлениям с поражением любых органов и систем в любом возрасте.
Особое значение имеют врожденные инфекции детей, которые отличаются высоким риском развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией (ЦМВИ), что определяет потребность в своевременном пренатальном выявлении беременных и плодов с высоким риском развития врожденной ЦМВИ и ранней диагностике и лечении инфекций у новорожденных.
Теоретические дискуссии по вопросам адекватной диагностики антенатальной и постнатальной ЦМВИ, а также лечению острых ЦМВИ у беременной, плода и новорожденного продолжаются с 1990-х гг., но отсутствие единых руководящих принципов затрудняет практическую работу врачей. Российской ассоциацией специалистов перинатальной медицины в 2016 г. выработаны отечественные клинические рекомендации по диагностике и лечению врожденной ЦМВИ. Созданная в рамках 5-й Международной конференции по ЦМВИ (Брисбен, Австралия, 19 апреля 2015) международная группа экспертов на основе консенсусных дискуссий и обзора литературы выработала первые неофициальные международные рекомендации по вопросам диагностики и лечения врожденной ЦМВИ, которые опубликованы в Lancet Infect Dis в марте 2017. Все эти рекомендации будут нуждаться в постоянном обновлении по мере поступления дополнительных данных.
ЦМВ — двухцепочечный ДНК-вирус, член семейства герпес-вирусов (β-герпесвирус человека). Синтез вирусного генома ДНК происходит в ядре клетки-хозяина. Исследования последних лет подтверждают гипотезу о том, что штаммы ЦМВ могут варьировать в их вирулентности, тропизме и патогенном потенциале, который, в свою очередь, вероятно, связан с генетической изменчивостью ключевых для патогенеза генов. Внешняя оболочка вируса содержит множественные гликопротеины, кодируемые вирусом. Гликопротеин B и гликопротеин H, по-видимому, являются основными факторами для формирования гуморального иммунитета — антитела к ним способны нейтрализовать вирус. Эти гликопротеины используют сегодня при разработке анти-ЦМВ-вакцин [3].
Вирус распространяется различными способами: через продукты крови (переливание, трансплантация органов), грудное вскармливание, пролиферацию в местах контактов (кожа, любые слизистые оболочки), перинатально и половым путем. ЦМВИ может протекать в виде первичной инфекции ранее неинфицированных (серонегативных) пациентов, реинфекции или реактивации у инфицированных (серопозитивных) людей; может вызывать острое, латентное и хроническое течение врожденных или приобретенных форм болезни [4].
При острой ЦМВ-инфекции могут поражаться практически все типы клеток человеческого организма — эндотелиальные клетки, эпителиальные клетки, клетки гладкой мускулатуры, фибробласты, нейронные клетки, гепатоциты, трофобласты, моноциты/макрофаги, дендритные клетки и пр. Все типы клеток поражаются и в мозге: нейроны, астроциты, клетки эпендимы, выстилающие желудочки, макроглия, эндотелий капилляров, оболочек, микроглия, сплетения сосудистой оболочки, дендриты и аксоны — т. е. вирус в мозге не имеет избирательной клеточной цели, что объясняет многообразие клинических форм поражения нервной системы у больных [5].
Считается, что ЦМВ реплицируется в эндотелиальных клетках с низкой скоростью, вызывая преимущественно подострые инфекции, однако истинная скорость репликации вируса в клетках определяется эффективностью цитотоксического Т-клеточного иммунитета и степенью иммуносупрессии хозяина. Так, например, на моделях ЦМВИ у животных продемонстрировано, что отсутствие CD4 Т-клеток сопровождалось более тяжелым и стремительным заболеванием ЦМВИ. Известно также, что ВИЧ-инфицированные новорожденные имеют очень высокую частоту врожденной ЦМВИ с высоким риском смерти, неврологических дефектов и прогрессии ВИЧ-инфекции [6–7].
Особое свойство ЦМВИ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов (ИНФ), в первую очередь ИНФ-α. Внедрение ЦМВ приводит к иммунной перестройке в виде снижения реакции лимфоцитов на вирусы в связи с угнетением экспрессии антигена макрофагами, подавлением пролиферативной активности лимфоцитов (что коррелирует с тяжестью болезни), угнетением фагоцитарной активности и завершенности фагоцитоза [7].
Доказано, что и первичные и латентные ЦМВИ сами могут индуцировать хронические воспалительные системные реакции с устойчивой иммунной активацией, запускать и поддерживать аутоиммунные процессы, усиливать аллореактивность Т-клеток после трансплантации и, возможно, участвовать в комплексе причин повышения частоты нейродегенеративных состояний с возрастом человека (Jones R. P. The debility cascade in neurological degenerative disease). Установлено также, что ЦМВ-индуцированные иммунные изменения в пожилом возрасте могут отвечать, например, за замедленную элиминацию вируса гриппа из легких, сниженный поствакцинальный иммунитет на гриппозные вакцины, измененную реакцию организма на терапию интерферонами [8].
Многие годы риск развития врожденных инфекций плода ассоциировали преимущественно с первичной инфекцией матери, однако к настоящему моменту не вызывает сомнения, что большая доля врожденных ЦМВИ (до 75%) встречается в условиях рецидивирующей во время беременности материнской инфекции. Допускаются также и экзогенные реинфекции с новыми штаммами ЦМВ — доказательства основываются на молекулярных данных, подтверждающих получение нового штамма вируса.
Вместе с тем степень риска вертикального инфицирования плода в условиях первичной инфекции матери рассматривают по-прежнему как чрезвычайно высокую — в 30–50% случаев острой первичной инфекции беременной развивается врожденная инфекция ребенка. Показано, что ранее существовавший материнский иммунитет хоть и не гарантирует полной защиты, тем не менее обеспечивает снижение риска врожденной ЦМВИ при следующих беременностях на 69% [9].
Недавними исследованиями установлено, что ЦМВ может поражать амниотическую мембрану, ухудшая цитотрофобласт-индуцированный лимфангиогенез и ремоделирование сосудов в плаценте и задерживая правильное развитие клеток — предшественников трофобласта, одновременно вызывает врожденную провоспалительную иммунную реакцию. Это приводит к гипоксии плода, задержке внутриутробного развития и возможным последующим гипоксическим повреждениям головного мозга. Степень поражения плода определяется сроками антенатального инфицирования и вирусной нагрузкой в размножающихся клетках — чем меньше гестационный возраст, тем более выражена альтерация (разрушение) тканей с формированием пороков развития [10]. Особенно быстро ЦМВ достигает максимума в астроцитарных и глиальных клетках, при этом максимальная экспрессия вируса найдена в глиальных клетках развивающегося мозга мышат (что объясняет микрогирию, микроцефалию и другие пороки ЦМВ-инфицированного мозга детей). По мере увеличения срока гестации в клинической картине инфекционного заболевания плода преобладают симптомы системного воспаления с выраженной пролиферацией и экссудацией. У 1/3 умерших от ЦМВИ новорожденных (из них 60% — недоношенные) при морфологическом исследовании выявляют различные пороки развития. У 43% — признаки генерализованной внутриутробной инфекции с геморрагическими и ишемическими инфарктами (в том числе в головном и спинном мозге) [11].
Способность вируса реплицироваться в любых клетках человеческого организма определяет многообразие клинических форм болезни; ЦМВ может вызывать как генерализованные инфекции, так и поражения отдельных органов: печени, головного мозга, сердца, легких, мочеполовых органов, желудочно-кишечного тракта и др.
У беременных острая первичная ЦМВИ протекает чаще бессимптомно (25–50%) или малосимптомно — с неспецифическими проявлениями (обычно лихорадка, астения и головная боль).
Как первичная, так и рецидивирующая ЦМВИ матери может стать причиной антенатальных ультразвуковых признаков поражения плода в результате трансплацентарной инфекции. Самые частые УЗИ-признаки: задержка роста плода, вентрикуломегалия, микроцефалия, перивентрикулярная гиперэхогенность, кальцификаты в мозге, плевральный выпот или асцит, гепатоспленомегалия, гиперэхогенный кишечник и мекониальный илеус и др. Эти УЗИ-аномалии эмбриона прогнозируют тяжелую генерализованную манифестную врожденную ЦМВИ новорожденного с высоким риском формирования инвалидизирующих исходов болезни и смерти. Поэтому первичная острая ЦМВИ во время беременности может являться показанием к ее искусственному прерыванию. Установлено, что около 4% детей с антенатальной ЦМВИ умрут в утробе матери или вскоре после рождения, среди остальных около 60% будут иметь когнитивные дефекты, нейросенсорную потерю слуха и другие неврологические и прочие проблемы [11–12].
Сегодня установлено также, что нейросенсорная тугоухость является прогрессирующим заболеванием и может формироваться в течение 5–6 лет жизни даже у детей, родившихся с бессимптомной ЦМВИ (это связывают с многолетней репликацией ЦМВ в перилимфе), что требует соответствующей длительности наблюдения ребенка.
При инфицировании в поздние сроки гестации ЦМВИ у новорожденного может проявляться и как генерализованная инфекция, и как поражение отдельных органов с нетяжелыми транзиторными симптомами болезни, например, умеренной гепатомегалией, изолированным снижением количества тромбоцитов или повышенным уровнем аланинаминотрансферазы. Возможна и клинически бессимптомная ЦМВИ с изолированной нейросенсорной тугоухостью.
У 10% всех новорожденных в течение первого месяца жизни возникают инфекционные заболевания в результате в основном семейных контактов, в том числе грудного вскармливания. Экскреция ЦМВ с грудным молоком в течение первых недель после родов бывает низкой, достигает максимума к 4–8 неделям, завершается к 9–12 неделям. Считается, что риск трансмиссии вируса коррелирует с вирусной нагрузкой в молоке, передача максимальна при высокой экскреции. У доношенных детей в результате инфицирования ЦМВ через молоко матери формируется, как правило, субклиническое течение инфекции без остаточных явлений; в клинической картине более вероятно развитие энтероколита и транзиторного холестатического гепатита с минимальным цитолизом. Недоношенные дети (вес
И. Я. Извекова 1 , доктор медицинских наук, профессор
М. А. Михайленко
Е. И. Краснова, доктор медицинских наук, профессор
ФГБОУ ВО НГМУ МЗ РФ, Новосибирск
Цитомегаловирусная инфекция в практике врача: современный алгоритм диагностики и лечения/ И. Я. Извекова, М. А. Михайленко, Е. И. Краснова
Для цитирования: Лечащий врач № 4/2018; Номера страниц в выпуске: 90-95
Теги: новорожденные, беременность, инфекция, персистирование
Читайте также:
- Могут ли быть вирусы на симбиан
- Энзимотерапия при гепатите с
- Кровь в моче у собаки после прививки от бешенства
- Сколько всего типов вируса папилломы человека
- Секс парней с крупными яичками без вируса


