Двухцепочечная рнк у вирусов
Информация
Добавить в ЗАКЛАДКИ| Поделиться: |
РНК вируса двухцепочечные(ая)Все вирусы растений, исследованные до недавнего времени, содержали в качество генетического материала одноцепочечную РНК. Сейчас известно, что вирус раневых опухолей [210] и вирус карликовости риса [1228] содержат двухцепочечную РНК, а вирус мозаики цветной капусты содержит двухцепочечную ДНК [1561; Шеферд, личное сообщение]. Вероятно, будут обнаружены также вирусы растений, содержащие одноцепочечную ДНК, поскольку такие вирусы известны среди вирусов бактерий и вирусов животных.[ . ] Если двухцепочечная форма вирусной РНК имеет отношение к репликации вируса, то можно было бы, очевидно, ожидать, что в клетке она будет появляться раньше, чем иитактный вирус. Экспериментально, однако, это еще не было показано. Возможно, что продемонстрировать это вообще довольно трудно. С помощью заР удалось обнаружить двухцепочечную форму РНК ВЖМТ в листьях китайской капусты через 3 дня после заражения, тогда как серологические тесты не позволяли выявить присутствие вируса вплоть до 5-го дня [1379]. Этот результат почти несомненно отражает относительную чувствительность использованных методов. Применяя 32Р для обнаружения не только двухцепочечной РНК, но ВЖМТ, мы сумели выявить вирус на 2-й день после заражения, а двухцепочечную форму РНК лишь на 3-й день. Судя по содержанию РНК в клетках, можно думать, что очень небольшого количества двухцепочечной РНК достаточно для образования значительных (возможно, в 1000 раз больших) количеств вирусной РНК и эролых вирусных частиц. Задержка во времени между образованием двухцепочечной РНК и первым появлением зрелого вируса в клетке, по всей вероятности, невелика, не более нескольких минут. С другой стороны, минимальное время, необходимое для того, чтобы выявить включение 32Р в отдельные компоненты вируса, составляет 30—60 мин. Если для исследования используются ткани листа, то лшпь небольшая часть клеток оказывается инфицированной в начале периода включения 32Р; остальные клетки заражаются в значительной мере асинхронно, так что это заражение растягивается иногда на несколько дней. Таким образом, почти неизбежно первым моченым вирусным продуктом, обнаруживаемым после заражения, будет свободная одноцепочечная вирусная РНК или полный вирус, а не двухцепочечная вирусная РНК.[ . ] Дальнейшее подтверждение двухцепочечного строения РНК вируса раневых опухолей было получено при электронно-микроскопических исследованиях [1001]. Эта РЫК по общему виду и жесткости структуры похожа на двухцепочечную ДНК. Длина большей части цепей РНК оказалась значительно меньше 5 мкм, т. е. той величины, которой можно было ожидать, если бы РИК внутри вирусной частицы представляла собой одиночную цепь. Большинство цепей имело длину менее 1,5 мкм, а наиболее часто встречались частицы длиной около 0,3 мкм. Это может объясняться деградацией интактной структуры РНК или же тем, что РНК может существовать в виде нескольких единиц внутри вирусной частицы, как это было найдено для реовирусов (см. ниже).[ . ] Любая попытка точного определения вируса связана всегда с необходимостью дополнительной проверки. Например, реовирус, вероятно, служит исключением из приведенного выше определения. В каждой его частице содержится генетический материал, представленный не менее чем десятью дискретными единицами, состоящими из двухцепочечной РНК, а кроме того, еще несколько сотен единиц, состоящих из какого-то низкомолекулярного полирибоиуклеотида, богатого адениловой кислотой. Функция этого низко-молекулярного полирибонуклеотида, на долю которого приходится около 20% всей вирусной РНК, пока неизвестна [143, 144, 1840, 1867]. Таким образом, реовирус содержит относительно большое количество полирибону-клеотидного материала, который, вероятно, не выполняет генетической функции.[ . ] Для решения вопроса о месте синтеза вирусной РНК в клетке был применен метод фракционирования гомогенатов листьев табака, инфицированного ВТМ, с помощью дифференциального центрифугирования (двухцепочечную РНК вируса метили радиоактивным фосфором) [1379]. В этой работе не удалось обнаружить двухцепочечной РНК во фракции ядер и хлоропластов, но 40% общего количества устойчивой к нуклеазам PIIK находилось во фракции, которая но седиментациошшм свойствам соответствовала митохондриям. Было также найдено, что двухцепочечная РНК, синтезированная в бесклеточных экстрактах из листьев табака, инфицированного ВТМ, ассоциирована с какой-то цитоплазматической структурой, а не с ядром [1383]. В настоящее время эти результаты трудно согласовать с данными цитологических исследований. Возможно, что заражение ВТМ вызывает усиление синтеза определенного вида клеточной РНКГ а именно той РНК, которая относительно устойчива к ингибированию актиномицином D (например, тРНК).[ . ] Основы структур],! нескольких многокомпонентных вирусов обсуждаются в этой главе, тогда как некоторые другие ее аспекты — в гл. Как мы . ¡паем, нуклеиновая кислота почти всех вирусов, встречающихся в природе, защищена белковой оболочкой. Однако известны мутанты, полученные в лабораторных условиях, которые имеют дефектную оболочку (гл.[ . ] В табл. 4 приведены нуклеотидный состав, число цепей, а также молекулярная масса РНК различных вирусов растений. Для вирусов растений, которые имеют в качестве генетического материала одиоцепочечную РНК, нельзя ожидать, чтобы количество гуанина было равно количеству цитозина, а количество адепина — количеству урацила. И действительно, как явствует из табл. 4, такие вирусы не подчиняются никакому правилу спаривания оснований. Только для двух вирусов, у которых РНК двухцепочечная, отмечается та же закономерность в составе оснований РНК, что и в случае ДНК. а именно количество гуанина равно количеству цитозина, а количество аденина — количеству урацила.[ . ] Способ передвижения инфекционного материала от клетки к клетке неизвестен, но так как сами вирусы не обладают способностью к перемещению, то, вероятно, важную роль играет в этом деле ток цитоплазмы (а может быть, в какой-то мере и диффузия). Форма, в которой вирус передвигается, также неизвестна. Поскольку как шггактпый вирус, так и свободная РНК могут заражать здоровые клетки, в перемещении инфекции, вероятно, способны участвовать обе эти формы. Третьим кандидатом па ту же роль является минус-цепь вирусной РНК или какая-то структура, в состав которой она входит. До сих пор не было покапано, что двухцепочечная РПК вирусов растений в изолированном виде обладает инфекционпостыо, однако не исключено, что она инфекционна в том виде, в каком присутствует в клетке.[ . ] Бесклеточиые системы дали пока очень мало для понимания процесса синтеза структурных белков вирусов растений. Вследствие отмеченных выше трудностей, на которые наталкивается использование бесклеточиых систем, выделенных целиком из растительной ткани, многие авторы при попытке продемонстрировать синтез структурного белка фитогхатогенных вирусов в таких системах пользовались рибосомами, транспортными РНК и растворимыми ферментами из бактериальных источников, обычно из E. coli. Рибонуклеиновая кислота, выделенная из препаратов фитопатогенных вирусов, способна стимулировать включение аминокислот в полипептиды в бесклеточной системе из E. coli. Представляется наиболее вероятным, что в качестве матрицы при сиптёзо белков in vivo функционирует плюс-цепь, а не минус-цепь вирусной РНК. Это предположение довольно убедительно подкрепляется исследованиями мутантов ВТМ, полученных при действии азотистой кислоты на РНК вируса (гл. Однако лишь подавно удалось получить частичную характеристику белка, синтезированного in vitro, и таким образом идентифицировать его как структурный ■белок (см. ниже). Вплоть до этого момента не было прямых доказательств в пользу того, что транслируется только вирусная плюс-цепь. Вряд ли можно думать, что двухцепочечная РНК вируса способна служить матрицей для белкового синтеза. На примере РНК вируса карликовости риса было показано, что она действительно не выполняет такой функции.[ . ]
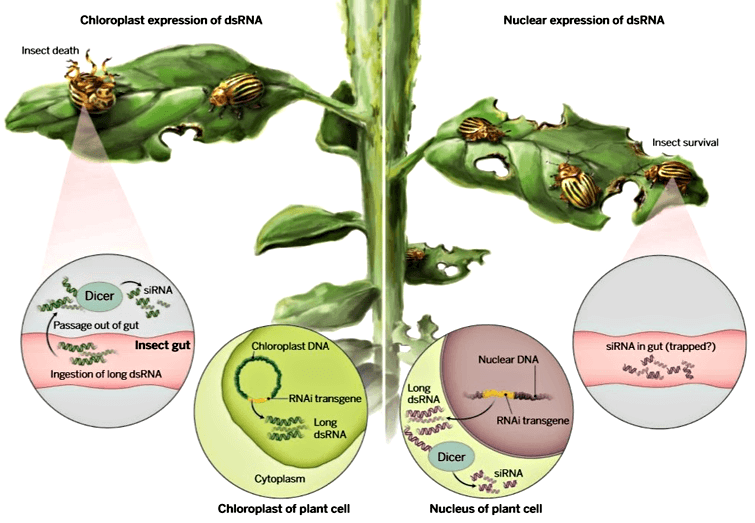
Ученые получили трансгенные растения, в хлоропластах которых образуется двухцепочечная РНК, нарушающая работу жизненно важного гена колорадского жука — гена белка цитоскелета β-актина. Все личинки жуков, которые в эксперименте питались листьями таких растений, погибали в течение пяти дней. В то же время разработанный подход высокоселективен в отношении вредителя и безопасен для опылителей. XXI век — это век биотехнологий: развиваются методы адресной доставки лекарств в определенные органы или клетки с минимальным количеством побочных эффектов [1], становится возможным контролировать активность отдельных генов в разных тканях организма. Но при этом в сельском хозяйстве по-прежнему используются на удивление грубые методы — к примеру, применение инсектицидов, действующих абсолютно не избирательно и причиняющих вред не только поедающим растения насекомым-вредителям. Каким же образом возможно точечно воздействовать на одних лишь вредителей? Все виды живых существ отличаются друг от друга своей ДНК, поэтому делать ДНК-ориентированную систему защиты от с/х-вредителей — это первое, что приходит на ум. Механизм можно позаимствовать у природы — во всех клетках эукариот существует система уничтожения подозрительных нуклеиновых кислот, которая используется для защиты от вирусов. Дело в том, что только у вирусов бывают нуклеиновые кислоты особой структуры — двухцепочечные РНК (дцРНК). У всех остальных организмов молекулы РНК представлены в виде одиночных цепочек нуклеотидов. Обнаружив двухцепочечную РНК, клетка активирует механизм защиты под названием РНК-интерференция [2]. Специальные белки (Dicer) режут подозрительную молекулу РНК на фрагменты. Антисмысловые цепи этих фрагментов раздаются другим белкам (RISK), как фотороботы сотрудникам правоохранительных органов. Когда эти белки находят РНК или ДНК с похожей последовательностью (неважно, одноцепочечные или двухцепочечные), они ее уничтожают. А поскольку РНК — это единственный способ для гена проявить свою активность, получается, что гены, которым соответствовала двухцепочечная РНК, перестают работать. Именно такую систему защиты от вредителей пытались реализовать в последние годы биотехнологи, создавая трансгенные растения вопреки предубеждению части общества относительно ГМО [3]. Они получали растения, в тканях которых синтезировались дцРНК с фрагментами генов колорадского жука (Leptinotarsa decemlineata). Если насекомое ело трансгенное растение, двухцепочечная РНК с последовательностью одного из важных генов попадала в его клетки. Запускался механизм РНК-интерференции, и жук погибал. Как известно, хлоропласты произошли от цианобактерий, которые поселились внутри клеток эукариот, дав им возможность фотосинтезировать. У бактерий нет системы классической РНК-интерференции, потому и у хлоропластов ее тоже нет. Поэтому двухцепочечную РНК решено было производить именно в хлоропластах, чтобы она дошла до насекомых-вредителей в неразрезанном виде (рис. 1, слева). Кроме того, локализация дцРНК в хлоропластах практически исключает возможность её появления в клетках цветов, а следовательно, и нанесения вреда насекомым-опылителям.
Рисунок 1. Схема защиты трансгенных растений от колорадского жука. Специфичность обеспечивается благодаря образованию в растении двухцепочечных РНК, соответствующих фрагменту жизненно важного гена определенного вредителя. Длинная дцРНК при попадании в клетку вызывает отключение соответствующего гена. Справа — двухцепочечная РНК синтезируется в ядре растительной клетки и режется на кусочки еще в самом растении. Такая короткая дцРНК не вызывает гибели существенного количества вредителей. Слева — ДНК, кодирующая двухцепочечную РНК, встроена в геном хлоропластов, и в этом случае РНК, оставшись невредимой, вызывает сильный ответ в клетках жуков, что приводит к их гибели. Рисунок из [4]. Чтобы РНК образовывалась в клетках в двухцепочечном виде, синтезировали фрагменты ДНК, кодирующие обе цепи — смысловую и антисмысловую. Эти фрагменты встраивались в ДНК хлоропластов благодаря последовательностям нуклеотидов, гомологичным определённым последовательностям в хромосомах пластид. После синтеза двух молекул одноцепочечной РНК они налипали друг на друга и образовывали дцРНК.
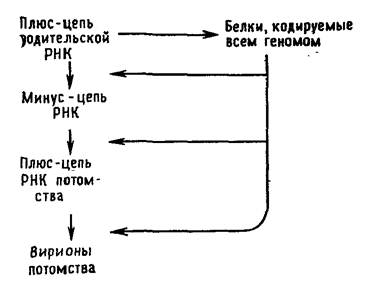
В эксперименте с трансгенным картофелем использовали дцРНК для двух генов колорадского жука: ACT, кодирующего β-актин (белок цитоскелета), и SHR, кодирующего субъединицу белкового комплекса, вовлеченного в мембранную перестройку при транспорте везикул [5]. Двухцепочечная РНК, как и было задумано, синтезировалась в хлоропластах и сохраняла длину до попадания в организм колорадских жуков. Оказалось, что наиболее эффективна в деле борьбы с вредителями дцРНК для гена АСТ: когда листьями такого картофеля кормили личинок колорадского жука, все они погибали уже в течение трёх дней. Анализ подтвердил, что у личинок, которые питались листьями трансгенного картофеля, подавлялась экспрессия целевого гена. Листья трансгенного картофеля, в котором двухцепочечная РНК образовывалась в хлоропластах, были повреждены вредителями намного меньше, чем листья растений, у которых дцРНК синтезировалась в ядре, а также чем листья обычного картофеля (рис. 2). Предложенный метод целенаправленной защиты растений от вредителей позволяет разработать различные варианты его применения. Например, последовательность нуклеотидов дцРНК можно подбирать таким образом, чтобы она действовала против нескольких видов насекомых, или производить в хлоропластах набор отдельных молекул двухцепочечной РНК для разных вредителей. Экспрессия и репликация вирусного генома Требования и ограничения В ходе эволюции вирусов сложилось несколько стратегий, обеспечивающих: а) организацию вирусных генов и их кодирующую функцию, б) экспрессию вирусных генов, в) репликацию вирусных геномов и г) сборку и созревание вирусного потомства. Прежде чем мы рассмотрим каждое из этих положений в деталях, стоит напомнить, что ключевым моментом в репликации вирусов является использование для синтеза вирусных белков хозяйских структур, синтезирующих белки клетки. Независимо от размеров, состава и организации своего генома вирус должен предоставить белоксинтезирующему аппарату эукариоти-ческой клетки информационную РНК, которую клетка должна распознать и транслировать. В этом отношении клетка навязывает вирусу два ограничения. Во-первых, клетка синтезирует в ядре свою собственную мРНК путем транскрипции своей ДНК и последующего постранскрипционного процессинга транскрипта. Поэтому в клетке: а) ни в ядре, ни в цитоплазме нет фер* ментов, необходимых для транскрипции мРНК с вирусного РНК-генома, и б) в цитоплазме нет ферментов, способных транскрибировать вирусную ДНК. В связи с этим клеточную транскриптазу для синтеза вирусных мРНК могут использовать только вирусы, содержащие ДНК и способные проникать в ядро. Все другие вирусы вынуждены создавать собственные ферменты для синтеза мРНК. Для удобства сначала лучше обсудить РНК-содержащие вирусы, фокусируя внимание прежде всего на функции геномной РНК. Вирусы с одноцепочечной РНК можно подразделить на три группы. В первую группу входят пикорнавирусы и тогавирусы. Их геномы выполняют две функции (рис. 5.2 и 5.3). Во-первых, они функционируют как мРНК. Вирусы, геном которых может служить в качестве мРНК, принято называть вирусами с позитивным геномом. РНК пикорнавирусов после проникновения в клетку связывается с рибосомами и полностью транслируется. Затем продукт этой трансляции — полипротеин — расщепляется. Во-вторых, геномные РНК выполняют функцию матрицы для синтеза на ней комплементарных минус-цепей при участии полимеразы, появившейся в результате расщепления полипротеина. Образуется двуспиральная репликативная форма. На ее минус-цепях синтезируются новые плюс-цепи, которые могут использоваться в качестве а) мРНК, б) матриц для синтеза новых минус-цепей и в) составной части вирусных частиц потомства.
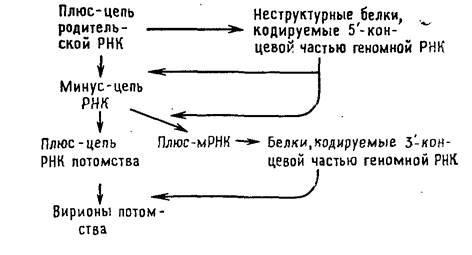
Тогавирусы и ряд других вирусов с позитивным геномом отличаются от пикорнавирусов в одном отношении: для трансляции в первом цикле синтеза белков доступна только часть их геномной РНК. Вероятной функцией образующихся при этом белков является способность транскрибировать геномную РНК. Они осуществляют синтез минус-цепи, которая в свою очередь служит матрицей для синтеза двух различных по размеру классов молекул плюс-РНК. В клетках, зараженных тогавирусами, РНК первого класса представлены небольшими молекулами мРНК, фланкирующими участок геномной РНК, который не транслировался в первом цикле. Образующиеся на них полипротеины расщепляются на белки, которые играют структурную роль в вирионах. Плюс-РНК второго класса состоит из полноразмерных цепей, которые упаковываются в вирионы.
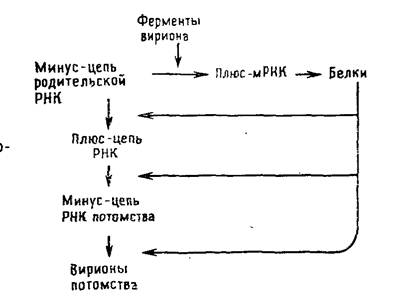
РНК-содержащие вирусы с негативным геномом: ортомиксовирусы, парамиксовирусы, буньявирусы, аренавирусы и рабдовирусы. Их геномная РНК выполняет две матричные функции: во-первых, для транскрипции и, во-вторых, для репликации. В связи с тем что для синтеза мРНК должен транскрибироваться вирусный геном, а в клетках соответствующие ферменты отсутствуют, все вирусы с негативным геномом содержат в вирионе кроме вирусного генома транскриптазу. Транскрипция вирусного генома — первое событие после проникновения вируса в клетку, в результате которого накапливаются функционально активные моноцистронные мРНК [позитивные, или плюс-цепи], кодирующие один белок. Репликацию начинают новосинтезированные вирусные белки, катализирующие образование полной плюс-цепи, которая служит матрицей для синтеза геномной минус-РНК (рис. 5.4).
Размножение ортомиксовирусов и парамиксовирусов. Ортомиксовирусы (вирусы гриппа А; В;С) генм представлен не одной а набором односпиральных РНК (грипп птиц и человека 8-7фрагментов). В структуре вириона: – РНК зависимая РНК полимераза (синтез +нитей, – две разновидности РНК полимераз РНК транскриптаза (синтез +нитей в начале инфекции, РНК репликаза ( – нитей в конце инфекции) Ретровирусы входят в третью группу РНК-содержащих вируссов. Характерно, что геномы ретровирусов монолитны, но имеют диплоидную структуру, и обе цепи либо частично соединены водородными связями друг с другом, либо спарены неизвестным до настоящего времени образом. Единственная известная функция геномной РНК — матричная функция для синтеза вирусной ДНК. Поскольку эукариотические клетки не имеют для этого соответствующих ферментов, вирион кроме генома содержит еще и РНК-зависимую ДНК-полимеразу (обратную транскриптазу 1), а также смесь тРНК хозяина, одна из которых служит в качестве затравки. В цикле репродукции можно выделить следующие ключевые ступени: а) связывание комплекса тРНК —обратная транскриптаза с геномной РНК; б) синтез ДНК-копии, комплементарной по отношению к РНК, с переходом полимеразы с одной молекулы РНК-матрицы на другую, что приводит к образованию кольцевой одноцепочечной молекулы ДНК, связанной водородными связями с линейной геномной РНК; в) расщепление геномной РНК нуклеазой, атакующей только РНК в ДНК—РНК-гибридах (рибонуклеазои Н, также содержащейся в вирионе), и г) синтез комплементарной копии вирусной ДНК. Затем кольцевая двухцепочечная ДНК перемещается в ядро, где интегрирует с геномом хозяина, но последующая экспрессия вирусных генов не обязательна. Если экспрессия происходит, то интегрированная.вирусная ДНК транскрибируется транскриптазой клетки-хозяина. Продуктами транскрипции являются молекулы РНК, как равные по длине молекуле генома, так и более короткие мРНК-транскрипты нескольких соседних генов, которые транслируются с образованием полипротеинов. Полипротеины затем расщепляются на отдельные вирусные белки. В состав вирионов включаются только транскрипты, содержащие весь геном.
| |||||||||