Экспресс диагностика вирусных инфекций достоинства и недостатки метода
Методы лабораторной диагностики вирусных инфекций подразделяются на несколько больших групп.
- Прямые методы, состоящие в выявлении непосредственно в биологическом материале самого вируса или антител к нему.
- Непрямые методы-заключаются в искусственной наработке вируса в значительных количествах, и его дальнейшем анализе.
К наиболее актуальным в повседневной практике методам диагностики относятся:
Серологические методы диагностики - выявление в сыворотке крови пациента определенных антител или антигенов в результате реакции антиген-антитело(АГ-АТ). То есть, при поиске у пациента определенного антигена используется соответствующее искусственно синтезированное антитело, и, соответственно, наоборот-при выявлении антител используют синтезированные антигены.
Реакция иммунофлуоресценции (РИФ)

Основана на использовании меченых красителями антител. При наличии вирусного антигена он связывается с мечеными антителами, и под микроскопом наблюдается специфическая окраска, которая говорит о положительном результате. При этом методе, к сожалению, невозможна количественная интерпретация результата, а только лишь качественная.
Возможность количественного определения дает иммуноферментный анализ(ИФА). Он похож на РИФ, однако в качестве маркеров используют не красители, а ферменты, превращающие бесцветные субстраты в окрашенные продукты, что и дает возможность количественной оценки содержания как антигенов, так и антител.

- Отмывают не связавшиеся антитела и антигены.
- Добавляют бесцветный субстрат, и в лунках с антигеном, который мы определяем, произойдет окрашивание, т.к. там будет связанный с антигеном фермент, после чего на специальном приборе оценивают интенсивность свечения окрашенного продукта.
По похожей схеме происходит и выявление антител.

Реакция непрямой(пассивной) гемаглютинации (РПГА).
Метод основан на способности вирусов связывать эритроциты. В норме эритроциты падают на дно планшета, образуя так называемую пуговку. Однако если в исследуемом биологическом материале находится вирус, он свяжет эритроциты в так называемый зонтик, который не упадет на дно лунки.


Теперь остановимся на методах диагностики непосредственно нуклеиновых кислот исследуемых вирусов, и прежде всего о ПЦР ( Полимеразная Цепная Реакция) .
Суть этого метода заключается в обнаружении специфического фрагмента ДНК или РНК вируса путём его многократного копирования в искусственных условиях. ПЦР можно проводить только с ДНК, то есть для РНК-вирусов предварительно необходимо произвести реакцию обратной транскрипции.
Непосредственно ПЦР проводят в специальном приборе, под названием амплификатор, или термоциклер, который поддерживает необходимый температурный режим. ПЦР-смесь состоит из добавленной ДНК, которая содержит интересующий нас фрагмент, праймеров (короткий фрагмент нуклеиновой кислоты, комплиментарный ДНК-мишени, служит затравкой для синтеза комплиментарной цепи), ДНК-полимеразы и нуклеотидов.
Стадии цикла ПЦР:
- Деннатурация-первая стадия. Температура повышается до 95 градусов, цепочки ДНК расходятся друг относительно друга.
- Отжиг праймеров. Температуру понижают до 50-60 градусов. Праймеры находят комплиментарный участок цепи и связываются с ним.
- Синтез. Температуру вновь повышают до 72, это рабочая температура для ДНК-полимеразы, которая, отталкиваясь от праймеров, строит дочерние цепи.

Цикл многократно повторяется. Через 40 циклов из одной молекулы ДНК получается 10*12 степени копий копий искомого фрагмента.

При проведении ПЦР в режиме реального времени синтезируемые копии фрагмента ДНК метятся красителем. Прибор регистрирует интенсивность свечения и по ходу реакции строит графики накопления искомого фрагмента.
Современные методы лабораторной диагностики с высокой достоверностью позволяют выявить присутствие вируса - возбудителя в организме, нередко, задолго до появления первых симптомов заболевания.
| Вирусы | Инфекция | Материал для исследования | Сроки забора материала | Методы экспресс- диагностики |
| Аденовирусы | Аденовирусная инфекция | Отделяемое носоглотки, конъюнктивы, кровь, кал, моча | Первые 7 дней болезни | РИФ, молекулярная гибридизация (МГ), ЭМ, ИФА, РИА, ПЦР |
| Парагриппа, РС-вирус | ОРВИ | Отделяемое носоглотки | Первые 3-5 дней болезни | РИФ, ИФА, МГ, ПЦР |
| Гриппа | Грипп | Отделяемое носоглотки | Первые 3-5 дней болезни | РИФ, ИФА, РИА, ЭМ, МГ, ПЦР, ИБ |
| Риновирусы | ОРВИ | Отделяемое носоглотки | Первые 3-5 дней болезни | РИФ, МГ, ПЦР |
| Простого герпеса | Herpes simplex | Содержимое везикулы | Первые 12 дней после появления сыпи | РИФ, ИЭМ, ИФА, РИА, МГ, ПЦР, ИБ |
| Ветряной оспы и опоясывающего герпеса | Ветряная оспа, опоясывающий герпес | Содержимое везикулы | Первые 7 дней после появления сыпи | ИФА, ИФ, ИЭМ, РИА, МГ, ПЦР |
Окончание табл. 4
| Вирусы | Инфекция | Материал для исследования | Сроки забора материала | Методы экспресс- диагностики |
| Цитомегалии | Цитомегаловирусная инфекция | Моча, слюна, кровь | Весь период заболевания | ЭМ, микроскопия мазков-отпечатков, МГ, РИФ, выявление IgM, РИА, ПЦР |
| Ротавирусы | Острый гастроэнтерит | Фекалии | Первые 3-5 дней болезни | ЭМ, ИЭМ, ИФА, РИА, МГ, ПЦР, электрофорез РНК в ПААГ |
| Энтеровирусы | Серозный менингит, ОРВИ, ОКИ, полиомиелит | Фекалии, кровь, отделяемое носоглотки | Весь период заболевания | РИФ, РИА, МГ, ПЦР |
| Гепатита А | Гепатит А | Фекалии, кровь | Первые 7-10 дней болезни | ИЭМ, ИФА, РИА, выявление IgM |
| Гепатита В | Гепатит В | Кровь, биопсийный материал | Весь период заболевания | ИФА, РИА, РОПГА, МГ, ПЦР, ВИЭФ |
| Гепатита С | Гепатит С | Кровь, биопсийный материал | Весь период заболевания | ИФА, МГ, ПЦР |
| ВИЧ | ВИЧ-инфекция | Кровь | Весь период заболевания | ИФА, ИБ, ПЦР |
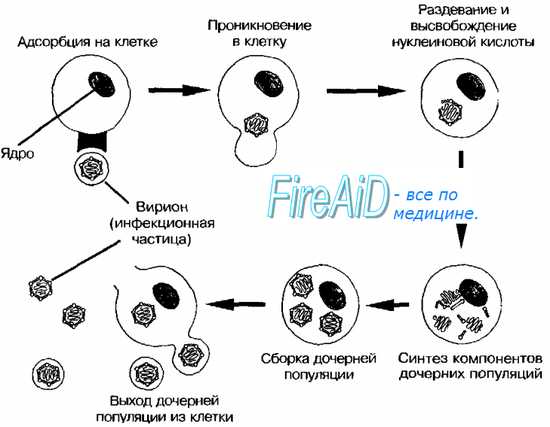
2 группа— выделение вируса из клинического материала, его индикация и идентификация (вирусологическая диагностика).
В большинстве случаев концентрация вируса в клиническом материале недостаточна для быстрого обнаружения вируса или его антигенов. В этих случаях используют вирусологическую диагностику. Эта группа методов требует продолжительного времени, трудоемка, часто является ретроспективной. Однако вирусологическая диагностика является необходимой для инфекций, вызванных новыми типами вируса, или когда невозможно провести диагностику другими методами.
Для вирусологической диагностики врач должен обеспечить взятие необходимых проб материала в соответствующую фазу заболевания, доставку их в лабораторию, снабдив диагностические лаборатории необходимой клинической информацией.
Материалом для вирусологического исследования при заболеваниях, сопровождающихся диареей или другими желудочно-кишечными расстройствами, предполагающими вирусную этиологию (гепатит А, рота- и энтеровирусные инфекции), являются свежие порции фекалий. При заболеваниях дыхательной системы (грипп, парагрипп, РС-инфекция, аденовирусная инфекция и др.) материал для исследования лучше всего получать путем аспирации слизи, смывов. Мазки из носоглотки менее информативны. При наличии везикулярной сыпи (герпетическая инфекция) материалом для исследования является жидкость, аспирированная иглой из везикул. При петехиальной и макуло-папулёзной сыпи — как пробы слизи из носоглотки, так и фекалии. При подозрении на нейровирусные инфекции (полиомиелит, арбовирусные инфекции) для вирусологического исследования следует забирать слизь из носоглотки, фекалии и спинномозговую жидкость. Для диагностики эпидемического паротита и бешенства материалом служит слюна. При подозрении на цитомегало- и паповавирусные инфекции материалом может быть моча. Попытку выделить вирус из крови можно предпринять при подозрении на инфекции, вызванные некоторыми арбовирусами, вирусами герпеса. Биопсия мозга может быть проведена при диагностике герпетического энцефалита, ПСПЭ, прогрессирующего краснушного панэнцефалита, болезни Крейтцфельдта-Якоба, лейкоспонгиоза и др.
Препараты слизи из носоглотки или фекалии помещаются в среду для транспортировки, состоящую из физиологического раствора с добавлением антибиотиков и небольшого количества белка или сыворотки животных. Материалы могут храниться при температуре 4°С не боле 48 часов. Более длительное хранение требует температуры –70°С.
Выделение вируса из клинического материала осуществляется путем его инокуляции в культуру клеток, куриные эмбрионы или заражения им лабораторных животных (см. Культивирование вирусов).
Вирус гриппа следует выделять путем инокуляции вируссодержащего материала в амниотическую или аллантоисную полость куриного эмбриона. Для выделения вируса Коксаки А, вируса бешенства, многих арбовирусов, аренавирусов рекомендуется интраперитонеальная и интрацеребральная инокуляция материала новорожденным мышам.
Индикация вирусов в культуре клеток проводится по ЦПД, РИФ, РГА, РГАдс. Многие энтеровирусы вызывают раннее ЦПД (через несколько часов). Цитомегаловирусы, аденовирусы, вирус краснухи вызывают ЦПД через несколько недель, а иногда необходимо прибегать к получению субкультуры. Присутствие синцития свидетельствует о наличии таких вирусов, как РС, кори, эпидемического паротита, герпесвирусов.
Идентификация вирусов, выделенных в этих системах, проводится с помощью серологических методов. Такие серологические реакции, как РТГА, РН, РТГАдс, используются только при вирусных инфекциях. РСК, РПГА, ИФА, РИА, ИФ, РП и др. используются для диагностики как вирусных инфекций, так и инфекций, вызванных другими возбудителями. В настоящее время широко используются методы молекулярной диагностики: МГ, ПЦР.
На схемах 2 и 3 представлена вирусологическая диагностика ОРВИ и кишечных инфекций.
3 группа— серологическая диагностика вирусных инфекций.
Однократно проведенное серологическое исследование лишь в редких случаях позволяет диагностировать вирусное заболевание (например, при ВИЧ-инфекции). В большинстве случаев для серологической диагностики требуются парные сыворотки, взятые в острой фазе заболевания и спустя 2-4 недели. Обнаружение четырехкратного и более повышения титра антител принято рассматривать в качестве диагностического признака острой вирусной инфекции.
| Слизь из носоглотки, обработанная антибиотиками | |||||
| Заражение куриных эмбрионов | Заражение мышей-сосунков | ||||
| РГА | гибель, специфические поражения ХАО | параличи, гибель | |||
| РСК, РТГА | РИФ, РН | Вирусы Коксаки, герпеса | |||
| Вирусы гриппа | Вирусы герпеса | ||||
| Заражение культур клеток | |||||
| ЦПД может отсутствовать | Образование синцития | Аденовирусный тип ЦПД | Пикорнавирусный тип ЦПД | Герпетичес-кий тип ЦПД | |
| интерференция | РТГАдс | РИФ, РН, РСК, МГ, ПЦР | РИФ, РН, РСК, РТГА, МГ, ПЦР | РСК, РН по цветной пробе, МГ, ПЦР | РИФ, РН, МГ, ПЦР |
| РИФ, ПЦР | РИФ, РН, РТГА, РТГАдс, ПЦР | ||||
| Вирус краснухи | Вирусы гриппа, парагриппа, эпидпаротита | РС-вирус, кори, парагриппа | Аденовирусы | Энтеровирусы, риновирусы | Вирусы простого герпеса, цитомегалии |
Схема 2. Выделение вирусов из отделяемого носоглотки, их индикация и идентификация при респираторных вирусных инфекциях
| Суспензия фекалий, обработанная антибиотиками, осветленная центрифугированием | |||
| Заражение культур клеток | Заражение мышей | ||
| Пикорнавирусный тип ЦПД | Реовирусный тип ЦПД | Аденовирусный тип ЦПД | Параличи, гибель |
| РСК, РН по цветной пробе, ПЦР | РИФ, РН, РТГА, МГ, ПЦР | РТГА, РСК, РН, МГ, ПЦР | РН, РСК, МГ, ПЦР |
| Энтеровирусы | Ротавирусы | Аденовирусы | Коксаки А, В, Ротавирусы |
Схема 3. Выделение вирусов из фекалий, их индикация и идентификация
при кишечных вирусных инфекциях
4 группа — молекулярно-биологические методы индикации, идентификации и клонирования вирусов. Проводятся с целью выявления вирусспецифических фрагментов генома вирусов в материале.
Молекулярно-биологическая индикация вирусов в биологическом материале (дот блоттинг, in sinu гибридизация, сэндвич гибридизация):
– Методы молекулярной гибридизации (метод микрогенов). Проводятся с целью выявления вирусспецифических фрагментов генома вируса в материале. Характеризуются высокой чувствительностью и специфичностью. Используются для выявления цитомегаловирусов, вирусов герпеса, вирусов гепатита.
– Полимеразная цепная реакция (ПЦР) и количественная ПЦР.
– Вестерн-блоттинг — основан на выявлении циркулирующих в крови специфических антител к антигенам вируса.
– Определение инфицированных вирусом клеток методом проточной цитофлюориметрии. Используется при ВИЧ-инфекции, инфекционном мононулеозе, гепатите С, цитомегаловирусной инфекции.
Методом ПЦР возможно проведение индикации вирусов в материале, идентификации, дифференциации с родственными инфекционными агентами, генотипирование изолятов вирусов и клонирование фрагментов их генома без необходимости культивирования в культуре клеток.
|