Экспрессия вирусного генома это
В ходе эволюции вирусов сложилось несколько стратегий, обеспечивающих: а) организацию вирусных геномов и их кодирующую функцию; б) экспрессию вирусных генов; в) репликацию вирусных геномов и г) сборку и созревание вирусного потомства. Прежде чем рассмотреть данные положения, следует напомнить, что фундаментальные биологические особенности вирусов делают реализацию их генетической информации процессом, не имеющим себе аналогов среди других форм жизни, включая микоплазмы, риккетсии и хламидии. Во-первых, это обусловлено тем, что вирусы содержат один тип нуклеиновой кислоты — РНК или ДНК. Во-вторых, у вирусов отсутствует собственный аппарат для реализации своей генетической информации. Вирусы не имеют ферментов, участвующих в производстве энергии, и белоксинтезирующих систем. Поэтому вирус должен представить информационную РНК, которую клетка должна распознавать и транслировать. Пути образования мРНК в процессе репликации РНК-вирусов представлены на рисунке. В клетке нет ферментов для транскрипции мРНК с вирусного РНК-генома, а в цитоплазме нет ферментов для транскрипции вирусной ДНК.
В связи с этим клеточную транскриптазу для синтеза вирусных мРНК могут использовать только вирусы, содержащие ДНК и способные проникать в ядро. Все другие вирусы вынуждены создавать собственные ферменты для синтеза мРНК.
Почти все РНК-геномы относят к линейным молекулам. Некоторые из них, например, геномы пикорнавирусов, содержат на 5'-конце РНК ковалентно связанные полипептиды. Геномы одноцепочечных РНК-вирусов могут быть либо монолитными (пикорна-, тога-, парамиксо-, рабдо-, корона-, ретровирусы), либо сегментированными (ортомиксо-, арена- и буньявирусы). Среди РНК вирусов с двухцепочечным сегментированным геномом наиболее изучены реовирусы.
Все известные ДНК-вирусы позвоночных имеют монолитный геном. Все они, за исключением парвовирусов, имеют полностью или частично двухспи-ральный геном. Отдельные представители парвовирусов содержат линейную оцДНК; у других (например, у аденоассоциированных вирусов) комплементарные цепи ДНК находятся в разных вирионах. ДНК папиллома- и полиомавиру-сов — кольцевая и сверхспиральная, в то время как ДНК герпесвирусов, аденовирусов и осповирусов — линейная.
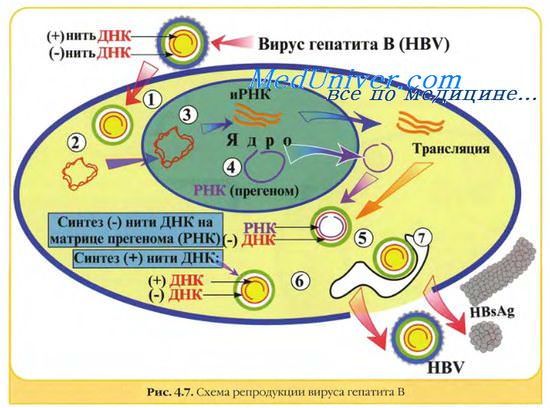
ДНК вируса гепатита В представляет собой кольцевую двуспиральную молекулу, на обеих цепях которой в разных областях обнаружены большой и малый одноцепочечные участки.
Репликация большинства ДНК-вирусов включает механизмы, которые хорошо известны в клеточной биологии: транскрипция мРНК на двуцепочечной ДНК и репликация ДНК. Для РНК-вирусов ситуация является уникальной и связана с генетической информацией, кодируемой РНК. РНК-вирусы с различным типом генома связаны с необходимостью использовать различные пути синтеза мРНК. Кроме (+) оцРНК вирусов, у которых геномная РНК функционирует как мРНК, все другие типы вирусной РНК, прежде всего, должны быть транскрибированы в мРНК. Так как клетки эукариотов не содержат РНК-зависимой РНК-полимеразы, (-) оцРНК вирусы и дцРНК вирусы должны содержать вирионную РНК-зависимую РНК-полимеразу
Эукариотические клетки не могут транслировать полицистронные мРНК частями в виде нескольких индивидуальных белков. ДНК-вирусы расщепляют свои полицисторные РНК-транскрипты на моноцисторные мРНК, используя клеточный механизм.
Большинство РНК-вирусов, размножающихся в цитоплазме, не имеют доступа к ферментам, осуществляющим РНК-процессинг и сплайсинг в ядре, и вынуждены по-разному решать эту проблему. У вирусов с сегментированным геномом каждый фрагмент является отдельным геном. Другие вирусы имеют полицистронный геном, но образуют моноцистронные РНК-транскрипты, разделяя окончание и реинициацию транскрипции.
Некоторые вирусы имеют полицистронную РНК, которая транслируется в полипротеин, который затем расщепляется протеолитически с образованием конечных продуктов.
Анализ данных о молекулярных механизмах репликации вирусов позвоночных позволил установить сходство и различия в способах реализации генетической информации вирусов, относящихся к различным таксономическим группам. Благодаря этому оказалось возможным выделить основные типы стратегии экспресии и репликации вирусных геномов. Семейства вирусов, реплицирующиеся по сходному пути, объединены в один тип. Репликация вирусов каждого типа начинается с инициирующих единиц, которыми являются проникшие в клетку вирусные геномы: вирионные РНК или ДНК или вирионные нуклеопротеины.
Вирусы, геном которых может служить в качестве мРНК, принято называть вирусами с позитивным (+) геномом. Вирусы с негативным (-) РНК геномом неспособность функционировать в качестве мРНК компенсируют наличием вирионной транскриптазы.
Лекция 5
ТРАНСКРИПЦИЯ
Транскрипция — это переписывание ДНК на РНК по законам генетического кода. Это означает, что РНК состоит из нуклеотидных последовательностей, комплементарных ДНК. Нити ДНК в участке транскрипции разделяются и функционируют как матрицы, к которым присоединяются комплементарные нуклеотиды благодаря спариванию комплементарных оснований (аденин связывается с тимином, урацил — с аденином, гуанин — с цитозином и цитозин - с гуанином). Транскрипция осуществляется с помощью специального фермента — РНК-полимеразы, который связывает нуклеотиды путем образования 3'-5'-фосфодиэфирных мостиков. Такое связывание происходит лишь в присутствии ДНК-матрицы.
Продуктами транскрипции в клетке являются иРНК. Сама клеточная ДНК, являющаяся носителем генетической информации, не может непосредственно программировать синтез белка. Передачу генетической информации от ДНК к рибосомам осуществляет РНК-посредник. На этом основана центральная догма молекулярной биологии, которая выражается следующей схемой:
ДНК - (транскрипция) –и РНК – (трансляция) - белок
где стрелки показывают направление переноса генетической информации.
Реализация генетической информации у вирусов. Стратегия вирусного генома в отношении синтеза иРНК у разных вирусов различна. У ДНК-содержащих вирусов иРНК синтезируется на матрице одной из нитей ДНК. Формула переноса генетической информации у них такая же, как и в клетке.
ДНК-содержащие вирусы, репродукция которых происходит в ядре, используют для транскрипции клеточную полимеразу. К этим вирусам относятся паповавирусы, аденовирусы, вирусы герпеса. ДНК-содержащие вирусы, репродукция которых происходит в цитоплазме, не могут использовать клеточный фермент, находящийся в ядре. Транскрипция их генома осуществляется вирусспецифическим ферментом — ДНК-полимеразой, которая проникает в клетку в составе вируса. К этим вирусам относятся вирусы оспы и иридовирусы.
К этой группе вирусов относятся пикорнавирусы, тогавирусы, коронавирусы. У них нет необходимости в акте транскрипции для синтеза вируспецифических белков. Поэтому транскрипцию как самостоятельный процесс у этих вирусов не выделяют. Иначе обстоит дело у вирусов, геном которых не может выполнять функцию иРНК. В клетке синтезируется комплементарная геному РНК, которая и является информационной. Передача генетической информации у этих вирусов осуществляется по схеме:
РНК– иPHK - белок
У этих вирусов транскрипция выделена как самостоятельный процесс в инфекционном цикле. К ним относятся две группы вирусов животных.
2. Вирусы, геном которых представлен двунитчатой РНК (диплорнавирусы). Среди вирусов животных к ним относятся реовирусы.
В клетке нет фермента, который может полимеризовать нуклеотиды на матрице РНК. Эту функцию выполняет вирусспецифический фермент — РНК-полимераза, или транскриптаза, которая находится в составе вирусов и вместе с ними проникает в клетку.
Среди РНК-содержащих вирусов животных есть семейство ретровирусов, которые имеют уникальный путь передачи генетической информации. РНК этих вирусов переписывается на ДНК, ДНК интегрирует с клеточным геномом и в его составе переписывается на РНК, которая обладает информационными функциями. Путь передачи генетической информации в-этом случае осуществляется по более сложной схеме:
РНК - ДНК - иРНК - белок
Ферменты, транскрибирующие вирусный геном. Транскрипция ряда ДНК-содержащих вирусов — паповавирусов, аденовирусов, вирусов герпеса, парвовирусов, гепадна-вирусов осуществляется в ядре клетки, и в этом процессе широко используются механизмы клеточной транскрипции — ферменты транскрипции и дальнейшей модификации транскриптов. Транскрипция этих вирусов осуществляется клеточной РНК-полимеразой II — ферментом, который осуществляет транскрипцию клеточного генома. Однако особая группа транскриптов аденовируса синтезируется с помощью другого клеточного фермента — РНК-полимеразы III. У двух других семейств ДНК-содержащих вирусов животных - вирусов оспы и иридовирусов — транскрипция происходит в цитоплазме. Поскольку в цитоплазме нет клеточных полимераз, транскрипция этих вирусов нуждается в специальном вирусном ферменте — вирусной РНК-полимеразе. Этот фермент является структурным вирусным белком.
У РНК-содержащих вирусов транскрипция осуществляется вирусспецифическими транскриптазами, т. е. ферментами, закодированными в вирусном геноме. Вирусспецифические транскриптазы могут быть как структурными белками, входящими в состав вириона (эндогенная транскриптаза), так и неструктурными белками, которые синтезируются в зараженной клетке, но не включаются в вирион.
Транскрипция в зараженной клетке. Синтез комплементарных РНК на родительских матрицах с помощью родительской транскриптазы носит название первичной транскрипции в отличие от вторичной транскрипции, происходящей на более поздних стадиях инфекционного цикла на вновь синтезированных, дочерних матрицах, с помощью вновь синтезированной транскриптазы. Большая часть иРНК в зараженной клетке является продуктом вторичной транскрипции.
Транскриптивные комплексы. У сложно устроенных РНК-содержащих вирусов животных транскрипция происходит не на матрице голой РНК, а в составе вирусных нуклеокапсидов или сердцевин (транскриптивные комплексы). Связанные с геномом капсидные белки не только не препятствуют транскрипции, но и необходимы для нее, обеспечивая правильную конформацию тяжа РНК, защиту его от клеточных протеаз, связь отдельных фрагментов генома друг с другом, а также регуляцию транскрипции.
Регуляция транскрипции. Транскрипция вирусного генома строго регулируется на протяжении инфекционного цикла. Регуляция осуществляется как клеточными, так и вирусспецифическими механизмами. У некоторых вирусов, в основном ДНК-содержащих, существует три периода транскрипций — сверхранняя, ранняя и поздняя. К этим вирусам относятся вирусы оспы, герпеса, паповавирусы, аденовирусы. В результате сверхранней и ранней транскрипции избирательно считываются сверхранние и ранние гены с образованием сверхранних или ранних иРНК. При поздней транскрипции считывается другая часть вирусного генома — поздние гены, с образованием поздних иРНК. Количество поздних генов обычно превышает количество ранних генов. Многие сверхранние гены являются генами для неструктурных белков — ферментов и регуляторов транскрипции и репликации вирусного генома. Напротив, поздние гены обычно являются генами для структурных белков. Обычно при поздней транскрипции считывается весь геном, но с преобладанием транскрипции поздних генов.
Фактором регуляции транскрипции у ядерных вирусов является транспорт транскриптов из ядра в цитоплазму, к месту функционирования иРНК — полисомам.
У РНК-содержащих вирусов синтез транскриптов также строго контролируется в отношении как количества каждого класса транскриптов, так и периода инфекции, когда определенные транскрипты синтезируются с максимальной скоростью. На ранней стадии инфекции преимущественно синтезируются транскрипты двух генов вируса гриппа — NP и NS, на поздней стадии инфекции — транскрипты генов М, НА и NA. Остальные три гена для Р-белков синтезируются примерно с одинаковой скоростью на протяжении всего периода инфекции. У реовирусов на ранней стадии инфекции преимущественно транскрибируется 4 из 10 фрагментов генома и лишь на поздней стадии транскрибируется весь геном. Однако если поместить геном вируса в бесклеточную РНК-синтезирующую систему, будет происходить равномерная транскрипция всех 10 фрагментов генома. Эти факты говорят о жестком контроле транскрипции со стороны клетки-хозяина и возможном наличии специфических клеточных регуляторов.
ТРАНСЛЯЦИЯ
Синтез белка в клетке происходит в результате трансляции иРНК. Трансляцией называется процесс перевода генетической информации, содержащейся в иРНК, на специфическую последовательность аминокислот. Иными словами, в процессе трансляции осуществляется перевод 4-буквенного языка азотистых оснований на 20-буквенный язык аминокислот.
Рибосомы. Синтез белка в клетке осуществляется на рибосоме. Рибосома состоит из двух субъединиц, большой и малой, малая субъединица примерно в два раза меньше большой. Обе субъединицы содержат по одной молекуле рибосомальной РНК и ряд белков. Рибосомальные РНК синтезируются в ядре на матрице ДНК с помощью РНК-полимеразы. В малой рибосомальной субъединице есть канал, в котором находится информационная РНК. В большой рибосомальной субъединице есть две полости, захватывающие также малую рибосомальную субъединицу. Одна из них содержит аминоацильный центр (А-центр), другая — пептидильный центр (П-центр).
Фазы трансляции. Процесс трансляции состоит из трех фаз: 1) инициации, 2) элонгации и 3) терминации.
Вначале с иРНК связывается малая рибосомальная субъединица. К комплексу иРНК с малой рибосомальной субъединицей присоединяются другие компоненты, необходимые для начала трансляции. Их по крайней мере три в прокариотической клетке и более девяти в эукариотической клетке. Инициаторные факторы определяют узнавание рибосомой специфических иРНК и, таким образом, являются определяющим фактором в дискриминации между различными иРНК, присутствующими в клетке, как правило, в избыточном количестве.
В результате формируется комплекс, необходимый для инициации трансляции, который называется инициаторным комплексом. В инициаторный комплекс входят: 1) иРНК; 2) малая рибосомальная субъединица; 3) аминоацил-тРНК, несущая инициаторную аминокислоту; 4) инициаторные факторы; 5) несколько молекул ГТФ.
В рибосоме осуществляется слияние потока информации с потоком аминокислот. Аминоацил-тРНК входит в А-центр большой рибосомальной субъединицы, и ее антикодон взаимодействует с кодоном иРНК, находящейся в малой рибосомальной субъединице. При продвижении иРНК на один кодон тРНК перебрасывается в пептидильный центр, и ее аминокислота присоединяется к инициаторной аминокислоте с образованием первой пептидной связи. Свободная от аминокислоты тРНК выходит из рибосомы и может опять функционировать в транспорте специфических аминокислот.
Терминация трансляции. Терминация трансляции происходит в тот момент, когда рибосома доходит до терминирующего кодона в составе иРНК. Трансляция прекращается, и полипептидная цепь освобождается из полирибосомы. После окончания трансляции полирибосомы распадаются на субьединицы, которые могут войти в состав новых полирибосом.
После проникновения вирусов в клетку и раздевания – вирусный геном и связанные с ним вирусные белки оказываются в цитоплазме. Внутри зараженной клетки происходят:
· репликация вирусного генома
· синтез структурных вирусных белков, из которых собираются новые вирусы
Существует определенный порядок транскрипции вирусных мРНК, которые затем транслируются с образованием белка. Репликация вирусного генома и сборка нуклеокапсидов большинства РНК-содержащих вирусов происходят в цитоплазме, а большинства ДНК-содержащих вирусов – в ядре.
2) 60 Структура молекулы антитела, основные свойства антител.
Антитела - специфические белки, иммуноглобулины, образующиеся в организме под воздействием антигена и обладающие свойством специфически с ним связываться и отличающиеся от обычных глобулинов наличием активного центра.Молекула антитела включает четыре полипептидные цепи, состоящие из аминокислот. Две из них тяжелые (м.м. 70000 дальтон) и две легкие (м.м. 20000 дальтон). Легкие и тяжелые цепи связаны между собой дисульфидными мостиками. Легкие цепи являются общими для всех классов и подклассов. Тяжелые цепи имеют характерные особенности строения у каждого класса иммуноглобулинов.Основные свойства антител. Специфичность антител – это способность антител отличать один антиген от другого. Серологические реакции более специфичны и чувствительны, чем химические. Антитела, за очень редким исключением, реагируют только с теми антигенами, против которых они выработаны и подходят к ним как отпечаток к пальцу. Это так называемая комплементарность антител – дополнение к детерминанте антигена.
Аффинность (сродство) – активность антител в расчете на активный центр антигена вне зависимости от числа активных центров на молекулу. Авидитет – способность антител связывать антигены. Он зависит от аффинности и числа активных центров антитела. При равной аффинности авидность IgM больше, чем авидность IgG, поскольку IgM функционально пятивалентен, а IgG двухвалентен.В молекуле антитела имеются активные центры, располагающиеся на концах полипептидных цепей и специфически реагирующие с антигеном. Неполные антитела одновалентны (антидетерминанта одна), полные имеют две, реже более анти детерминантны
3) 108.Семейство поксвирусов Семейство Poxviridae (от лат. pox — пустула, язва) объединяет большую группу вирусов, поражающих позвоночных и насекомых.Вирионы плеоморфные, чаще всего имеют форму параллелепипеда с размерами (220—450) х (140—260) нм, но возможна и овальная форма с размерами (250—300) х (160—190) нм. Снаружи они окружены липопротеидной мембраной (суперкапсид) толщиной 12 нм, имеющей белковые трубчатые структуры (филаменты). В центральной части вириона находится нуклеопротеидный комплекс (нуклеоид), имеющий двояковогнутую форму. Он состоит из ДНК и белков и окружен внутренней мембранами толщиной 9 нм. Между поверхностной и внутренней мембраной в вогнутостях расположены 1—2 латеральных тела. Масса частицы 5х10 -15 г, плавучая плотность в сахарозе 1,25 г/см 3 , в CsCl — 1,30 г/см 3 , коэффициент седиментации 500S.Геном представлен двуспиральной линейной молекулой ДНК размером 375 kb (килобаз), что составляет 3 % от массы вириона. Концы ДНК ковалентно связаны и образуют концевые шпильки (флип-флоп формы).Протеины вириона составляют около 90 % от массы частицы. Геном кодирует 150—300 белков, из которых структурных только около 100. С нуклеотидом вириона связаны 15 белков (ферменты), некоторые из которых участвуют в транскрипции иРНК и ее модификации.В состав вириона входят липиды и углеводы, которые составляют соответственно 4 и 3 % от массы вириона.Репродукция вирусов происходит в цитоплазме клеток и заканчивается формированием двух форм инфекционных вирусных частиц — внутриклеточной и внеклеточной (оболочечной). После адсорбции вирион проникает в клетку путем слияния с клеточной мембраной и последующего высвобождения нуклеоида в цитоплазму. В результате последовательных этапов раздевания с обеих цепей ДНК в присутствии вирусной РНК-полимеразы синтезируются иРНК-транскрипты (ранние, промежуточные, поздние). Вирусные структурные белки транслируются в основном с поздних иРНК и проходят посттрансляционную модификацию. Репликация вирусных ДНК происходит с образованием промежуточных репликативных форм, которые специфически разрезаются до одинаковых по размерам дочерних ДНК и ковалентно закрываются. Сборка вирионов происходит в несколько этапов. Сначала формируются незрелые вирусные частицы, которые созревают до внутриклеточных зрелых частиц. После их слияния с клеточной мембраной вирионы выходят из клетки путем почкования с образованием внеклеточных оболочечных вирионов. Во время естественной инфекции распространение вируса происходит в основном за счет вирусных частиц, высвобождающихся из клеток (внеклеточные вирионы).В процессе морфогенеза вирионов оспы в клетках образуются включения разных типов: ацидофильные (тип А), базофильные (тип B) или вироплазмы.Вирусы оспы распространяются аэрозольным и контактным путями, а также механически через переносчиков. В природе спектр патогенности узок (в пределах вида хозяина), хотя в лабораторных условиях спектр восприимчивости биологических систем значительно шире. Многие вирусы позвоночных вызывают папулезно-везикулярную сыпь.Семейство Poxviridae состоит из двух подсемейств: Chordopoxvirinae и Entomopoxvirinae. Подсемейство Chordopoxvirinae включает 8 родов: Orthopoxvirus, Parapoxvirus, Avipoxvirus, Capripoxvirus, Leporipoxvirus, Suipoxvirus, Molluskpoxvirus и Yatapoxvirus. Подсемейство Entomopoxvirinae включает 3 рода: Entomopoxvirus A, Entomopoxvirus В и Entomopoxvirus С. Подсемейство Chordopoxvirinae. Включает вирусы позвоночных, вирионы которых имеют форму параллелепипеда или овоида. В пределах родов имеется широкое биологическое родство, которое менее выражено у авипоксвирусов. Внутри каждого рода подсемейства отмечается значительная перекрестная реактивность. Нейтрализующие антитела специфичны только внутри одного рода. Антитела к белкам нуклеоидного комплекса обладают широкой перекрестной реактивностью. Ортопоксвирусы имеют гемагглютинирующие антигены, которые в других родах встречаются редко.Подсемейство Entomopoxvirinae. Входящие в него роды Entomopoxvirus А, В, С включают вирусы, поражающие насекомых. Вирионы различной формы со средним размером 70x250x300 нм и содержат 1—2 латеральных тела. Не имеют антигенного родства (в серологических реакциях) с хордопоксвирусами. Реплицируются в культурах клеток насекомых (жировые клетки, гемоциты) и формируют цитоплазматические включения — сфероиды с белком сфероидином.
- 6606
- 5,5
- 0
- 5

Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов [1]:
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?

Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA). Рисунок из Википедии.
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].

Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).

Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте. Рисунок из [12].
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами*.
Механизмы клеточной защиты против вирусов
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
- Деградация РНК (вирусных и клеточных) — РНК-интерференция;
- Угнетение синтеза белков (вирусных и клеточных);
- Ликвидация зараженных клеток — апоптоз (программируемая клеточная смерть);
- Воспаление.
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
- Угнетение синтеза клеточной РНК;
- Угнетение синтеза клеточных белков;
- Нарушение клеточной инфраструктуры и транспорта;
- Подавление/включение апоптоза и других видов клеточной смерти.
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.

Рисунок 5. Схема общей трансдукции. Фото с сайта vkjournal.ru.
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].

Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24]. Фото с сайта flickr.com.
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).

Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева. Рисунок из [26].
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.
Статья написана в соавторстве с Евгенией Щепенок.
Читайте также:


