Гепатит с и тромбоз
Портальная вена образуется слиянием селезеночной и верхней брыжеечной вен. Она несет венозную кровь, идущую от органов пищеварительного тракта (через верхнюю брыжеечную вену) и селезенки (через селезеночную вену) к сердцу.
Закрытие просвета ( обструкция ) портальной вены приводит к нарушению портального кровотока. Такое закрытие может быть вызвано закупоркой портальной вены опухолью или тромбом .
Обструкция и тромбоз портальной вены могут располагаться в различных ее отделах, но выше уровня слияния селезеночной и верхней брыжеечной вен.
-
Что необходимо знать об обструкции и тромбозе портальной вены?
Основными проявлениями обструкции и тромбоза портальной вены являются: боль в животе, тошнота, желудочно-кишечные кровотечения. В брюшной полости накапливается свободная жидкость (развивается асцит).
Причинами обструкции и тромбоза портальной вены являются: цирроз печени , злокачественные опухоли (печени, поджелудочной железы), хронический панкреатит .
У 50% пациентов причины возникновения обструкции и тромбоза портальной вены установить не удается.
Обструкция портальной вены обнаруживается у 5-18% пациентов с циррозом печени . Частота возникновения тромбоза портальной вены у пациентов с раком печени составляет 30%.
Диагноз основан на результатах допплеровского ультразвукового исследования, КТ и МРТ органов брюшной полости, ангиографии.
Лечение заключается в назначении препаратов, уменьшающих свертываемость крови и риск образования тромбов. Кроме того, проводится терапия заболеваний, вызвавших обструкцию и тромбоз портальной вены.
Портальная вена образуется слиянием селезеночной и верхней брыжеечной вен. Она несет венозную кровь, идущую от органов пищеварительного тракта (через верхнюю брыжеечную вену) и селезенки (через селезеночную вену) к сердцу.

Венозная система печени.

Венозная система брюшной полости.

Локализация тромбозов венозной системы брюшной полости.
Закрытие просвета (обструкция) портальной вены приводит к нарушению портального кровотока. Такое закрытие может быть вызвано закупоркой портальной вены тромбом. Обструкция и тромбоз портальной вены могут располагаться в различных ее отделах, но выше уровня слияния селезеночной и верхней брыжеечной вен.
Причинами обструкции и тромбоза портальной вены являются: цирроз печени , рак печени и поджелудочной железы, аппендицит, хронический панкреатит , хронические воспалительные заболевания кишечника ( язвенный колит , болезнь Крона ), холангит , полицитемия, травмы, ожоги, сепсис, беременность/послеродовый период, прием оральных контрацептивов, трансплантация печени.
У 50% пациентов причины возникновения обструкции и тромбоза портальной вены установить не удается.
Течение тромбоза портальной вены может быть острым и хроническим.
В некоторых случаях острая фаза заболевания может протекать бессимптомно.
Для хронического течения тромбоза портальной вены характерно длительное развитие клинической симптоматики (от нескольких месяцев до нескольких лет).
- Острое течение тромбоза портальной вены.
- У пациентов внезапно появляются боли в правом верхнем квадранте живота; беспокоит тошнота; может повышаться температура тела.
- Развивается асцит .
- Могут возникать желудочно-кишечные кровотечения.
- Хроническое течение тромбоза портальной вены.
- В хронической фазе тромбоз портальной вены может манифестировать симптомами портальной гипертензии .
- В 90% случаев в период 4-12 лет от начала формирования тромбоза возникает кровотечение из варикозно-расширенных вен пищевода, желудка и кишечника.
- При наличии цирроза печени и признаков печеночной недостаточности , у пациентов с тромбозом портальной вены наблюдаются симптомы печеночной энцефалопатии, развивается асцит . При этом асцит и печеночная энцефалопатия - редкие осложнения, если у больного нет цирроза печени.
- Если у пациента имеются злокачественные новообразования, то симптомами тромбоза портальной вены являются: асцит , анорексия, снижение массы тела, боли в эпигастральной области или в верхнем правом квадранте живота.
Важно установить наличие у пациента тех заболеваний, которые могут приводить к обструкции и тромбозу портальной вены.
Наиболее частыми причинами обструкции и тромбоза портальной вены у детей являются: аппендицит, воспаление пупочной ранки (омфалит), сепсис, врожденные аномалии сосудов печени и желчных протоков.
Наиболее частыми причинами обструкции и тромбоза портальной вены у взрослых являются: цирроз печени , рак печени и поджелудочной железы.
-
Лабораторные методы диагностики
- Общий анализ крови.
У больных циррозом печени наблюдается уменьшение количества тромбоцитов . Развитие анемии или других цитопений характерно для поздних стадий заболевания. При гиперспленизме развивается панцитопения (анемия, лейкопения, тромбоцитопения). Коагулограмма.
Выполняется для диагностики врожденных коагулопатий (мутация гена протромбина (G20210), мутация фактора V Лейдена, дефицит протеина С , дефицит протеина S , дефицит антитромбина II), которые могут стать причиной развития тромбоза портальной вены.
У пациентов с циррозом печени наблюдается снижение протромбинового индекса (отношение стандартного протромбинового времени к протромбиновому времени у обследуемого больного, выраженное и процентах). Референтные значения: 78 - 142 %.
Биохимический анализ крови.
У пациентов без цирроза печени и злокачественных новообразований может отмечаться незначительное увеличение показателей функции печени.
- Рентгенография органов брюшной полости.
С помощью этого исследования можно выявить гепатоспленомегалию, варикозно-расширенные непарную, паравертебральные вены и варикозно-расширенные вены пищевода.
Чувствительность эндоскопического УЗИ для диагностики тромбоза портальной вены составляет 81%, специфичность - 93%. Тромб в портальной вене визуализируется как эхогенное образование в просвете портальной вены. Недавно сформировавшийся тромб может быть гипо- или анэхогенным.
Допплеровское ультразвуковое исследование.
Чувствительность метода составляет 70-90%, специфичность - 99%. Ложно-позитивные результаты можно получить в 9% случаев у пациентов с циррозом печени из-за турбулентного кровотока в портальной вене.
Компьютерная томография - КТ.
Чувствительность метода составляет 65-85%.
С помощью этого исследования можно выявить тромб в просвете портальной вены, нарушения структуры печени, варикозно-расширенные вены пищевода и желудка.
При комбинировании этого метода с допплеровским ультразвуковым исследованием можно обнаружить обструкцию портальной вены.
Магнитнорезонансная томография - МРТ.
Чувствительность, специфичность и точность метода составляет 100, 98 и 99% соответственно.
Как правило, перед проведением шунтирующих операций или трансплантации печени, выполняются артериальная портография или спленопортография.
При наличии цирроза и злокачественных новообразований у пациента гистологическая картина биоптатов печени характерна для этих заболеваний.
Пациенты с риском возникновения обструкции и тромбоза портальной вены или с уже развившимися этими патологическими состояниями должны находиться под наблюдением гастроэнтеролога и гепатолога, так как у них высок риск появления желудочно-кишечных кровотечений.
При назначении лечения важно учитывать проявления основного заболевания, вызвавшего тромбоз или обструкцию портальной вены, и характер течения тромбоза или обструкции (острое или хроническое).
Для лечения остро возникшего тромбоза портальной вены применяются препараты, уменьшающие свертываемость крови и угнетающие процессы тромбообразования: гепарин ( Гепарин р-р д/ин. ) ; варфарин ( Варфарин Никомед , Варфарекс ) ;
алтеплаза (Актилизе).
Лечение тромбоза и обструкции портальной вены, имеющих хроническое течение (при циррозе печени, злокачественных опухолях) проводится с учетом основного заболевания.
Хирургическое лечение заключается в проведении шунтирующих операций, в ходе которых создаются обходные пути для обеспечения нормального кровотока в местах обструкции и тромбоза портальной вены.
Профилактика обструкции и тромбоза портальной вены состоит в своевременном выявлении и лечении болезней, которые могут стать причиной их возникновения. К ним, например, относятся: цирроз печени , рак печени и поджелудочной железы, аппендицит, хронический панкреатит , хронические воспалительные заболевания кишечника ( язвенный колит , болезнь Крона ).
Для профилактики возникновения желудочно-кишечных кровотечений назначаются бета-адреноблокаторы в течение длительного времени. Применяются, например, пропранолол ( Анаприлин , Обзидан ).
Пациентам, у которых имеется накопление свободной жидкости в брюшной полости (асцит) назначаются мочегонные препараты: спиронолактон ( Верошпирон , Верошпилактон ) или фуросемид ( Лазикс , Фуросемид табл. ).
Прогноз заболевания неблагоприятный, если причинами обструкции и тромбоза портальной вены являются цирроз печени или злокачественные опухоли (например, рак печени или поджелудочной железы).
Смерть в этих случаях наступает в результате возникновения желудочно-кишечных кровотечений.
Риск появления кровотечений в течение 2 лет у пациентов без цирроза печени составляет 0,25%, а смертность - 5%. Аналогичные показатели у больных циррозом печени: 20-30% и 30-70% соответственно.
У пациентов с обструкцией и тромбозом портальной вены, вызванными другими причинами, 10-летняя выживаемость составляет 70%, а показатели смертности - менее 10%.
Записаться на прием к врачу
Выберите свой город, необходимую специализацию врача (гепатолог, гастроэнтеролог. ), уточните район своего проживания.
Наша цель — сообщить о конкретном наблюдении за тромбозом воротной вены, возникающим при неосложненном аутоиммунном гепатите типа 1, о котором, насколько нам известно, ранее не сообщалось. Это хорошо известный 35-летний пациент с гистологически и иммунологически подтвержденным аутоиммунным буллезным дерматитом пемфигуса (DBAI), который был исследован для печеночной колики с высотами трансаминаз и эпизодом спонтанно разрешающей желтухи. Исследования позволили сохранить диагноз аутоиммунного гепатита типа 1. Лечившись системным лечением кортикостероидами в дозе 1 мг / кг / день для его DBAI, эволюция была благоприятной с одновременной стабилизацией повреждения печени во время 19 лет. Частичный тромбоз портального ствола, подтвержденный брюшной компьютерной томографией, обнаружен при ультразвуковом исследовании брюшной полости. Этиологическая оценка этого тромбоза оставалась отрицательной. Точно так же не было никаких клинических, биологических, эндоскопических или радиологических признаков цирроза или злокачественной дегенерации. Он был эффективно антиагонизирован антагонистами витамина К. В нашем наблюдении этиологическая оценка; насколько это возможно, этот тромбоз оставался отрицательным, устраняя, в частности, цирроз, злокачественную дегенерацию и синдром ассоциированных антифосфолипидов и позволяющий напрямую связываться с хронической аутоиммунной гепатопатией.
Аутоиммунный гепатит (HAI) является хроническим заболеванием печени дисиммунного происхождения. Их диагноз основан на критериях Международной группы аутоиммунного гепатита, созданной в 1993 году и пересмотренной в 1999 году [1, 2]; недавно были предложены более упрощенные критерии [3]. Из классифицируемых HAI тип 1 является наиболее распространенным. Особенно это касается детей и молодых женщин [4]. Иммунологически он характеризуется наличием антиядерных аутоантител и / или антиглаучной антиактинной специфичностью [4]. Возникновение тромбоза воротной вены (ТГВ) в ходе прогрессирующего наблюдения за HAI должно в первую очередь включать неопластическую трансплантацию печени с циррозом или другим связанным с ней тромбогенным заболеванием. Мы сообщаем о конкретном случае ТГВ, возникающем после простого несложного HAI с циррозом и раком, и никакой другой ассоциации тромботических рисков.
Известно, что 35-летняя женщина с семейной историей аутоиммунитета (волчанка и сестра с аутоиммунной гепатопатией) имеет диагноз аутоиммунного буллезного дерматоза (DBAI), диагностированного в 1991 году и подтвержденную биопсией кожи с прямой иммунофлюоресценцией. Он был исследован для печеночной колики с возвышенностями трансаминаз и эпизодом спонтанно разрешающей желтухи в антецедентах (три года назад). Биология показала печеночный цитолиз с ASAT при 8N и ALAT при 10N без холестаза или стигматизации гепатоцеллюлярной недостаточности. Она не сообщила о лекарствах или алкоголизме.
Серологии вирусного гепатита В и С были отрицательными. Ультрасонография печени показала дисморфическую печень с хроническим заболеванием печени без признаков портальной гипертензии или подозрительных очаговых поражений. Антиядерные антитела были отрицательными, а также антимитохондриальным типом M2 и анти-LKM1. Анти-гладкомышечные антитела были положительными и на значительных уровнях. Остальная часть биологической оценки была без аномалий, кроме поликлональной гипергаммаглобулинемии при 19 г / л, в основном из IgG. Таким образом, был сохранен диагноз аутоиммунного гепатита типа 1 (ALT> 5N, высокий IgG и положительная антиглазничная мышца). Обработанный с помощью системной терапии кортикостероидами в дозе 1 мг / кг / день для его DBAI, курс был благоприятным с одновременной стабилизацией печеночной недостаточности в течение 19 лет. Пациент отказался от лечения азатиоприном. В настоящее время ей 56 лет, и она бессимптомна с трансаминазами при 1,5 Н без признаков цирроза (без биологических стигматов гепатоцеллюлярной недостаточности, варикоз желудка при фиброскопии). Частичный тромбоз портального ствола (рис. 1), подтвержденный рентгенограммой, обнаружен на абдоминальной контрольной УЗИ (рис. 2). Альфа-фетопротеин был нормальным, не было никакого биологического воспалительного синдрома, грудных и абдоминополевых морфологических исследований (абдоминальное УЗИ, абдоминополевичное и грудное рентгеновское КТ), а рентгенологическое исследование головного мозга не объективированные опухоли и количество крови было нормальным. Маркеры опухолей: CA19-9, CA125, CA15-3, ACE, NSE (специфический нейронный антиген) не были повышены. Печеночная МРТ не проявляла признаков дегенерации. Полоса для анализа мочи была нормальной, как и HLM; Тест Хейма из стали был отрицательным, и цитогенетическое исследование не оспаривало клон HPN. Медуллярная миелограмма и кариотип не выявили никаких аномалий. У пациента не было клинических признаков болезни Бехчета; окулярное обследование не показало никаких аномалий, тест на паштет не обфускал неспецифическую кожную гиперчувствительность, и HLA-типизация была отрицательной для B51. Гинекологическое обследование было нормальным; завершен карцино-вагинальным мазком, ультразвуком в области таза и эхо-маммографией, которая не обнаружила никаких аномалий. Пищеварительная эндоскопия (общая колоноскопия и гастроскопия) не выявила подозрительных признаков злокачественности.
Тромбоз портальной вены в допплеровском ультразвуковом исследовании
Абдоминальная рентгеновская КТ, введенная в сагиттальную реконструкцию, демонстрирует частичный и обширный тромбоз портального ствола.
Доплеровские нижние конечности не проявляли венозного тромбоза на этом уровне или признаков хронической венозной недостаточности. Тромбофильный баланс был отрицательным (TCA, ANA, анти-нейтрофильные цитоплазматические антитела, криоглобулины, антифосфолипиды, антитромбин III, фактор Leiden V, белки C и S). Кроме того, пациент не сообщал о каких-либо лекарствах, которые могли бы вызвать гиперкоагуляцию крови или способствовать тромбообразованию.
Возникновение тромбоза воротной вены (ТГВ) у пациента с HAI может быть результатом двух механизмов: 1) связь с другими аутоиммунными состояниями, характеризующимися высоким тромбогенным риском; в частности системной красной волчанки или антифосфолипидного синдрома [5, 6]. Эти ассоциации обнаруживаются в 40-50% HAI [6], и присутствие антифосфолипидных антител остается наиболее частым: действительно, 17 случаев / 24 или 70,8% пациентов с HAI в серии Branger et al. имели положительные APLs с четырьмя случаями примитивного синдрома APL, определяемого как 28,6% [6]. С другой стороны, повреждение печени, включая ТГВ, остается наиболее распространенным абдоминальным проявлением первичного САПЛ [7]; 2) установка цирроза с или без раковой дегенерации [8]. Эта возможность остается редкой [9], поскольку циррогенная мощность HAI-типа 1 слаба по сравнению с HAI-типом 2 [4, 10]: Hakem et al. в их серии из 50 случаев HAI обнаружено только три неопластических трансплантата [10].
В дополнение к этим двум ситуациям HAID-ассоциированный ТГВ сообщалось только однажды у 73-летней женщины с HII типа 1, осложненной крайней атрофией правой доли печени [11].
Для нашего пациента этиологическая оценка; насколько это возможно, этот тромбоз оставался отрицательным, устраняя, в частности, цирроз, злокачественную дегенерацию и синдром ассоциированных антифосфолипидов и позволяющий напрямую связываться с хронической аутоиммунной гепатопатией.
Образование такого тромбоза можно объяснить локальными гемодинамическими нарушениями системы портала, последствием хронического заболевания печени; действительно, недавнее исследование показало, что снижение кровотока в воротной вене было единственным предиктором развития ТГВ при хроническом заболевании печени в многовариантном анализе [12], что указывает на большую роль местных гемодинамических факторов. системного дефицита, приобретенного в качестве антикоагулянтов в патогенезе ТГВ при хроническом заболевании печени [12].
Наше наблюдение, насколько нам известно, является первым, иллюстрирующим возможность развития ТГВ во время простого HAI за пределами любого цирроза, злокачественной дегенерации или другого связанного с ней тромбогенного заболевания.
Авторы не заявляют о каком-либо конфликте интересов.
Доктор Буомрани Салем: рукопись. Все авторы внесли свой вклад в управление пациента (клинический диагноз, радиологические исследования и терапевтическое управление)
Одно из ведущих мест в структуре этиологических причин поражения печени занимает хронический гепатит С. Часто именно у пациентов с хроническим гепатитом С наблюдается тромбоцитопения.
Клиническое значение тромбоцитопении при хроническом гепатите С определяется повышенным риском развития кровотечений при проведении инвазивных диагностических и лечебных манипуляций (пункционная биопсия печени, эндоскопия, трансплантация печени). Даже при тромбоцитопении менее 50х103/мкл спонтанные кровотечения и кровоточивость встречаются крайне редко. Однако у пациентов со сформированным циррозом печени в исходе гепатита С риск кровотечений при тяжелой тромбоцитопении выше, чем у пациентов с небольшим уровнем фиброза. Уровень тромбоцитов оценивается врачом для решения вопроса о назначении интерферонотерапии.
Тромбоцитопения у пациентов с хроническим гепатитом С возникает вследствие нарушенной продукции и повышенного разрушения тромбоцитов. При гиперспленизме происходит избыточный распад тромбоцитов в гипертрофированной селезенке. Аутоиммунный процесс поломки тромбоцитов связан с образованием антитромбоцитарных антител, которые связывают поверхностные антигены тромбоцитов и образованные иммунные комплексы разрушаются в печени и селезенке. Нарушение выработки тромбоцитов вызвано подавлением костномозгового кроветворения вследствие прямого цитотоксического действия. Кроме того, печень является основным органом, в котором происходит синтез тромбопоэтина, который регулирует созревание и дифференцировку мегакариоцитов в тромбоциты в костном мозге. С развитием фиброза в печени снижается выработка тромбопоэтина. Также нарушается синтез тромбоцитов вследствие действия на процесс кроветворения интерферона-α - основного препарата, который в комбинации с рибавирином используется для лечения вирусного гепатита С. Снижение уровня тромбоцитов происходит у 20-30% пациентов, получающих комбинированную противовирусную терапию. Обычно тромбоциты снижаются на 10-50% от исходного уровня.
Пороговым безопасным исходным значением уровня тромбоцитов для комбинированной противовирусной терапии пегилированными интерферонами и рибавирином является уровень тромбоцитов более 90х103/мкл для Пег-интерферонов более 100х103/мкл. На практике такая выраженная исходная тромбоцитопения встречается преимущественно у пациентов с декомпенсированным циррозом печени (класс С по системе Чайлда-Таркотта-Пью), при котором нельзя проводить противовирусную терапию в связи с риском осложнений.
Инфузии тромбомассы не приводят к желаемому уровню тромбоцитов, имеют высокую стоимость, в связи с чем их введение не используется для подготовки пациентов к противовирусной терапии.
Около 3-6% пациентов требуется модификация терапии пегилированным интерфероном. В соответствии с инструкциями к лекарственным препаратам (Пег-интерферон-α 2а и Пег-интерферон-α 2b) рекомендуется снижение дозы интерферона до половины терапевтической, если число тромбоцитов менее 50х103/мкл и прекращение приема интерферона, если число тромбоцитов менее 25х10з/мкл. Есть данные о том, что такое снижение дозы сопровождается снижением вероятности излечения гепатита С.
Для коррекции начальной и интерферон-индуцированной тромбоцитопении у пациентов с гепатитом С для проведения противовирусной терапии Федеральным агентством по контролю качества пищевых продуктов и лекарственных препаратов США одобрено применение фактора роста тромбоцитов - элтромбопага, который стимулирует пролиферацию и дифференцировку мегакариоцитов. Начальная дозировка элтромбопага - 25 мг перорально ежедневно, максимальная дозировка - 100 мг/сут. Рекомендуемый уровень тромбоцитов на фоне терапии элтромбопагом - (50-150)х10з/мкл. Прием препарата прекращается при прекращении противовирусной терапии.
ТРОМБОЗЫ СОСУДОВ ПЕЧЕНИ
Анатомия сосудов печени
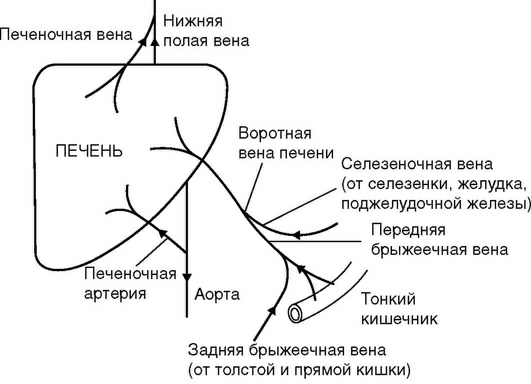
Печень снабжается кровью из двух сосудов: венозного - воротной вены и артериального - печеночной артерии. Воротная (или портальная) вена несет кровь от селезенки, желудка, поджелудочной железы, кишечника. Печеночная артерия ответвляется от чревного ствола, который является одной из основных ветвей аорты. Эти сосуды входят в печень в области ее ворот, где оба сосуда дают ветви к левой и правой долям печени. Венозная кровь от печени оттекает по печеночным венам от левой и правой долей печени, печеночные вены впадают в нижнюю полую вену (рис. 11).
Тромбозы при декомпенсированных заболеваниях печени
У пациентов с декомпенсированным циррозом печени и гепатоцеллюлярной карциномой склонность к венозным тромбозам повышена по сравнению со здоровыми пациентами. Однако в структуре венозных тромбозов непосредственно сосудов печени (воротной вены и печеночных вен) цирроз печени занимает всего 5%, тогда как при гепатоцеллюлярной карциноме тромбоз вен печени происходит в 30% случаев.
Артериальные тромбозы для пациентов с циррозом печени не характерны. Исключение составляют пациенты с неалкогольной жировой болезнью печени, у которых высок риск артериальных тромбозов в рамках метаболического синдрома (инфаркт миокарда, острое нарушение мозгового кровообращения). Тромбоз печеночной артерии может являться осложнением оперативных вмешательств на печени.
При декомпенсированных заболеваниях печени микроскопически часто выявляют тромбозы мелких сосудов печени. Микротромбозы паренхимы печени являются фактором, усугубляющим процесс фиброзирования путем местной ишемии.
Не разработаны эффективные рекомендации по ведению пациентов с тромбозами при декомпенсированных заболеваниях печени.
Тромбоз воротной вены
Тромбоз воротной вены возникает вследствие:
• спленэктомии и других хирургических вмешательств;
• гепатоцеллюлярной карциномы, реже - цирроза печени;
• беременности, длительного приема оральных контрацептивов.
Диагностику тромбоза воротной вены проводят с помощью ультразвукового исследования, которое выявляет в просвете воротной вены тромб, ультразвуковое исследование с допплером оценивает нарушение кровотока. Визуализацию тромба можно проводить с помощью компьютерной и магнитно-резонансной томографии печени с контрастированием, также в воротах печени выявляется сеть расширенных мелких вен. Ангиография выявляет дефект наполнения воротной вены.
В результате гиперспленизма развиваются лейкопения и тромбоцитопения, анемия не развивается (если не происходит кровотечения из варикозно-расширенных вен пищевода). Функциональные печеночные пробы (аланинаминотрансфераза, аспартатаминотрансфераза, γ-глютамилтранспептидаза, щелочная фосфатаза, билирубин, протромбиновый индекс, альбумин) обычно долго остаются в пределах нормы (кроме случаев тромбоза воротной вены на фоне заболевания печени). При выполнении коагулограммы повышены фибриноген и протромбиновый индекс.
При остром тромбозе портальной вены возможно проведение тромболизиса урокиназой, стрептокиназой в воротную вену или верхнюю брыжеечную артерию.
Всем пациентам должна проводиться антикоагулянтная терапия с целью предотвращения распространения тромбоза и, по возможности, восстановления кровотока в воротной вене. Раннее применение антикоагулянтов способствует реканализации воротной вены.
Антикоагулянтную терапию начинают с внутривенного введения нефракционированного гепарина в течение 2-3 нед под контролем АЧТВ.
Можно назначать НМГ (далтепарин, эноксапарин, надропарин), которые так же эффективны и более удобны в применении.
При стабилизации состояния пациента назначается непрямой антикоагулянт - антагонист витамина K - варфарин, доза которого подбирается индивидуально под строгим контролем и поддержанием МНО в пределах 2-3.
Нельзя начинать антикоагулянтную терапию у пациентов с хроническим тромбозом воротной вены, не проведя профилактику кровотечения из варикозно-расширенных вен пищевода.
При циррозах печени с тромбозом портальной вены гепарин или варфарин могут оказать непредсказуемое действие. Ввиду высокого риска кровотечения эти препараты не назначаются у этой группы пациентов. Кроме того, контролировать их дозировку невозможно: АЧТВ у пациентов с циррозом печени зачастую удлиняется, МНО при развитии печеночной недостаточности повышено вследствие низкого синтеза протромбина.
При оперативном лечении имеется большой риск осложнений, в связи с этим хирургическое шунтирование воротной вены выполняется только при продолжающихся кровотечениях из вен пищевода и неэффективности консервативной терапии.
Прогноз определяется основным заболеванием.
Тромбоз печеночной артерии
Тромбоз печеночной артерии встречается крайне редко. Возможные причины тромбоза печеночной артерии:
• осложнение хирургических вмешательств на печени.
Диагноз редко ставится при жизни больного. Работ с описанием клинической картины тромбоза печеночной артерии очень мало. Боль в эпигастрии сопровождается шоковым состоянием, лихорадкой. В результате инфаркта печени быстро нарастает желтуха, повышаются трансаминазы, наблюдается лейкоцитоз. Резко снижается протромбиновый индекс, появляется кровоточивость. При тромбозе крупных ветвей печеночной артерии пациент погибает в течение нескольких суток. Легкое течение тромбоза печеночной артерии, сопровождающееся несильной болью в правом подреберье, может остаться недиагностированным и случайно выявляется при патологоанатомическом вскрытии.
Рутинные исследования показывают гипокоагуляцию. Изменения системы гемостаза, связанные с активацией свертывающих механизмов, можно выявить только с помощью специальных методик, например откалиброванной автоматической тромбинографии.
При ультразвуковом исследовании можно визуализировать гипоэхогенные инфарктные очаги. Также инфаркт печени можно выявить при компьютерной томографии, магнитно-резонансной томографии. Необходимо проведение печеночной артериографии.
Есть скудные данные о применении аспирина для профилактики тромбоза печеночной артерии.
Основной целью является терапия печеночной недостаточности.
Синдром Бадда-Киари - это заболевание, характеризующееся нарушением оттока венозной крови от печени. Основная причина синдрома Бадда-Киари - тромбоз печеночных вен, а также печеночного отдела нижней полой вены.
Причинами синдрома Бадда-Киари могут служить:
• гематологические заболевания (истинная полицитемия, миело-пролиферативные заболевания, АФС);
• использование больших доз эстрогенов;
• гепатоцеллюлярная карцинома, редко - цирроз печени;
• метастатические поражения печени;
• инфекционные болезни печени (туберкулез, амебиаз, аспергиллез);
Клинически синдром Бадда-Киари проявляется надпеченочной портальной гипертензией: гепатомегалией, диуретико-резистентным асцитом, позже присоединяются спленомегалия и варикозное расширение вен пищевода. Поэтому кровотечения из вен пищевода - редкое осложнение синдрома Бадда-Киари. Как правило, гепатомегалия и асцит появляются быстро. Характерен полицитоз, высокий уровень гемоглобина из-за перемещения жидкой части крови в брюшную полость. Быстро прогрессирует печеночная недостаточность, и вследствие этого пациенты погибают. При появлении отеков на ногах следует искать тромбоз нижней полой вены.
Обычно дифференциальная диагностика проводится с печеночной формой портальной гипертензии.
Специфических гематологических тестов не существует. Для диагностики используются допплеровское ультразвуковое исследование, магнитно-резонансная томография и компьютерная томография с контрастированием, золотым стандартом диагностики является печеночная венография. Биопсия печени, использующаяся для дифференциальной диагностики и оценки стадии фиброза печени в случае длительного тромбоза, показывает венозный застой, атрофию печеночных клеток, редко - микротромбозы печеночных венул.
Медикаментозная терапия, направленная на лечение портальной гипертензии и отечно-асцитического синдрома, малоэффективна. Незначительный эффект показали антикоагулянтная (НМГ с переводом на варфарин) и тромболитическая терапия.
Основным методом лечения является хирургическое лечение - проводится портосистемное шунтирование. Некоторым пациентам выполняют трансъюгулярное внутрипеченочное портосистемное шунтирование. Также проводится трансплантация печени.
Дата добавления: 2018-05-02 ; просмотров: 1295 ;
Читайте также:


