Гликопротеины это вирус или
Детерминанты вирионных белков, к которым прикрепляются нейтрализующие антитела, называют нейтрализующими антигенными участками. Нейтрализующий антигенный участок может быть представлен несколькими нейтрализующими эпитопами, различающимися между собой. Например, модель антигенной структуры парамиксовирусов птиц выглядит следующим образом: каждый вирион содержит определенное число идентичных молекул HN, каждая молекула HN содержит 2 домена НА и NA, каждый домен содержит идентичные или отличные друг от друга антигенные детерминанты (эпитопы).
На молекуле гемагглютинина (НА) вируса гриппа находятся два типа нейтрализующих антигенных детерминант: непрерывный (линейный) антигенный участок и конформационная детерминанта. Антигемагглютинирующая активность и способность к нейтрализации инфекционности не обязательно связаны с одним и тем же типом моноклональных антител, но способность защищать мышей от смертельной инфекции флавивирусами обнаружена только у нейтрализующих антител. Различные белки одного и того же вируса различаются по антигенной активности, например, гликопротеин HN вируса парагриппа-3 вызывал более выраженный гуморальный ответ, чем гликопротеин F.
При некоторых вирусных инфекциях иммунитет связан, главным образом, с сенсибилизированными цитотоксическими Т-лимфоцитами. Мишенями для таких клеток чаще всего являются вирионные гликопротеины, а также ранние неструктурные белки, экспрессируемые на поверхности инфицированных клеток. Иммунизация неструктурным белком вызывала развитие протективного иммунитета.
Гликопротеины оболочечных вирусов выполняют ряд важных функций в инфекционном процессе. Они определяют клеточный тропизм (прикрепление к чувствительным клеткам), слияние вирусной и клеточной мембран (проникновение в клетку вирусного генома), участвуют в сборке и почковании дочерних вирионов и, наконец, являются основными детерминантами иммунного ответа в случае инфицирования или вакцинации. Взаимодействие между компонентами иммунной системы и вирусными гликопротеинами сложное и является, скорее всего, определяющим фактором исхода инфекции. Формируя пепломеры на поверхности оболочечных вирусов, гликопротеины являются важнейшими, если не единственными антигенами вирионов, отвечающими за образование нейтрализующих антител.

А так как гуморальный иммунитет при инфекциях, вызываемых оболочечными вирусами, как правило, является решающим фактором невосприимчивости, их роли придается большое значение. Информация о полипептидном скелете гликопротеинов закодирована в вирусных генах. Эти белки после синтеза экстенсивно гликозилируются клеточными ферментами (гликозилтрансферазами). Композицию углеводных остатков контролируют как клетки хозяина так и вирусный белок, т. е., в конечном счете, вирус. Гликопротеины, в отличие от внутренних белков оболочечных вирусов, обогащены Cys-остатками, обусловливающими образование дисульфидных мостиков и стабилизацию конформационной структуры.
Гликопротеины оболочечных вирусов относятся к обширному классу так называемых трансмембранных белков эукариот, объединяемых на основе формального признака специфической асимметрической ориентации, при которой часть молекулы погружена в липидный биослой. В структуре вирусных гликопротеинов различают три домена: экто-, трансмембранный и цитоплазматический. Большая часть молекул гликопротеина (примерно около 90% длины, N-концевая область) формирует пепломеры, расположенные на внешней стороне билипидного слоя (эктодомен). Небольшая часть молекулы (С-конец) расположена под липидным слоем и взаимодействует с нуклеокапсидом (цитоплазматический домен).
Часть молекулы, примыкающая к С-концу и представленная приблизительно 20-25 гидрофобными аминокислотами, пронизывает липидный бислой и обеспечивает якорный эффект (трансмембранный домен). Различные структурные домены обладают специфическими функциями. Эктодомен связан с рецептор ной и фузогенной функциями, с взаимодействием субъединиц и антител, нейтрализацией вируса. Трансмембранный домен обеспечивает взаимодействие с мембраной, а цитоплазматический — с нуклеокапсидом. Такова структура и организация гемагглютинина вируса гриппа, гликопротеинов G-вирусов везикулярного стоматита, бешенства, обоих гликопротеинов альфавирусов, гликопротеина В-вируса герпеса и многих других вирусных белков.
Относительно роли углеводного компонента в антигенности и иммуногенности вирусных гликопротеинов нет единого мнения. Гликопротеины S и М вируса леса Семлики как в гликозилированной, так и в негликозилированной формах равным образом защищали мышей от летальной инфекции при последующем заражении вирулентным штаммом гомологичного вируса. Дегликозилирование gpl герпесвируса типа 1 КРС сказывалось отрицательным образом на его антигенной активности, тогда как дегликозилирование gpIV того же вируса существенно не влияло на способность индуцировать синтез ВН-антител и антителозависимую цититоксичность. Корректное гликозилирование рекомбинантного белка Е1 вируса краснухи не являлось непременным условием его антигенности.
Введение такого антигена кроликам вызывало образование нейтрализующих антител, которые не подавляли гемагглютинацию вируса. Рекомбинантный аналог gpl20 вируса иммунодефицита человека, экспрессированный в Е. coli, не содержал углеводов, но индуцировал синтез антител, подавляющих репликацию гомологичного штамма вируса. Из этих данных следует, что гликозилирование этого белка не является необходимым для протективного иммунного ответа. В опытах с коронавирусом трансмиссивного гастроэнтерита свиней не установлено разницы в индукции ВН-антител и выраженности протективного иммунитета при использовании вируса с выраженной ГА-активностью и без нее, полученного в результате репродукции в различных клеточных системах. Возможно, что первичное (котрансляционное) гликозилирование вносит больший вклад в формирование конформационных антигенных сайтов гликопротеинов, чем вторичное гликозилирование.
Ученые нашли причину появления рака. Можно ли от него защититься?
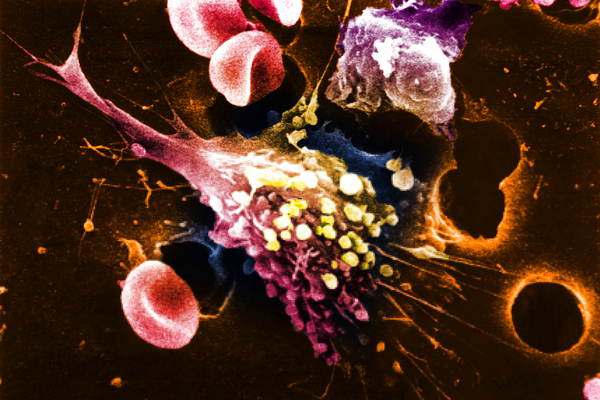
Известно, что основными причинами рака являются курение, нездоровое питание, а также воздействие инфекционных агентов, включая вирусы, бактерии и паразитов. Инфекции стоят на третьем месте среди лидирующих факторов развития опухолей и отвечают за 10 процентов смертей от этой болезни. В то же время на поверхности и внутри человеческого тела обитают миллионы микроорганизмов, чей состав уникален для каждого человека и составляет его микробиом. Микробиом влияет на здоровье человека, защищает его, но при нарушениях может спровоцировать развитие целого ряда заболеваний, включая онкологические. Микробы отвечают за уязвимость к раку, его прогрессирование и восприимчивость к лечению.
Важную роль в защите от бактерий играет слизистая оболочка, выстилающая внутреннюю поверхность пищеварительных, дыхательных и других органов. Она содержит гликопротеины — соединения, пронизывающие мембраны клеток эпителия. Эти молекулы формируют защитный слой. Степень гликозилирования (то есть уровень гликопротеинов) слизистой оболочки определяет уровень невосприимчивости к инфекциям. Однако во время заражения происходят изменения в гликопротеинах, затрагивающие как ту часть (домен), что находится внутри клетки, так и наружную. Это может либо способствовать ликвидации микроба, либо привести к инфекции и воспалению.
Когда наружная часть MUC1 связывается с бактерией, происходит отделение внутреннего домена. К нему присоединяются фосфорные остатки, что запускает целый ряд разных процессов: синтез провоспалительных факторов, адгезию (сцепление) эпителиальных клеток, их дифференциацию и программируемую клеточную смерть, называемую апоптозом.
Пока бактерии не рассматриваются как основная причина раковых заболеваний в отличие от тех же вирусов. Лишь для нескольких бактерий показано, что они могут спровоцировать развитие злокачественных опухолей через провоцирование воспалительных процессов, выделение токсинов и других повреждающих ДНК метаболитов или нарушение сигнальных путей клеток. Известны две широко распространенные бактериальные инфекции, которые могут вызывать рак. Это Helicobacter pylori, связанная с раком желудка и лимфомой, и Salmonella typhi, связанная с карциномой желчного пузыря у тех, кто страдает от хронического тифа. Но могут быть и другие инфекции, повышающие риск.
Campylobacter jejuni — одна из самых частых причин инфекционных отравлений, возбудитель кампилобактериоза. Бактерия проникает через слизистый слой в эпителиальную ткань пищеварительного тракта, провоцируя гастроэнтерит. Когда микроорганизм связывается с MUC1, гликопротеин высвобождается вместе с микробом в слой слизи. Пока неизвестно, предотвращает ли это развитие рака. Сама бактерия попадает в организм человека через загрязненную пищу и воду. В группу риска входят дети, пожилые люди, пациенты с ослабленным иммунитетом. Методом профилактики является правильное приготовление пищи.
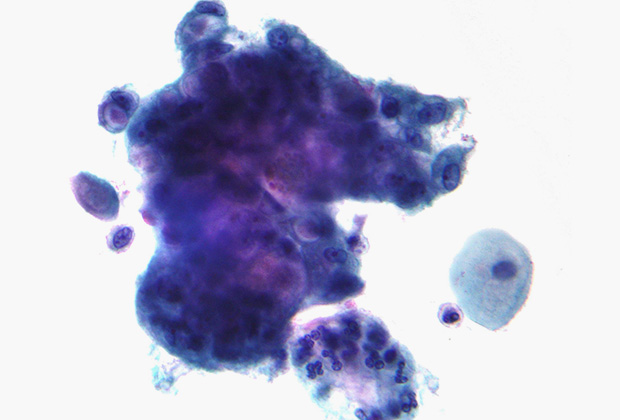
Хроническая инфекция Helicobacter pylori приводит к язвам и раку. Показано, что муцины являются важным препятствием для бактерии. Однако внутриклеточный домен MUC1 при связывании с бактерией способен взаимодействовать с NF-kB — транскрипционным фактором, который отвечает за регулирование апоптоза и клеточного цикла. Нарушение регуляции данного сигнального пути приводит к воспалениям, аутоиммунным заболеваниям и развитию опухолей. Для профилактики инфекции специалисты рекомендуют соблюдать гигиену рук. Заражение происходит через контакт с загрязненными предметами и людьми — носителями инфекции.
Haemophilus influenzae вызывает инфекции дыхательных путей, в том числе пневмонию. При хронической обструктивной болезни легких (ХОБЛ) дыхательные пути часто колонизируются этой бактерией. Кроме того, ХОБЛ является одним из факторов риска рака легких. Показано, что взаимодействие микроба с MUC1 вызывает изменения в регуляции специфических рецепторов, которые, в свою очередь, участвуют в прогрессировании легочных аденокарцином.
Еще одним потенциальным виновником опухолей является кишечная палочка Escherichia coli, возбудитель заболеваний кишечника. При взаимодействии микроба с MUC1 возникает воспалительный процесс. Показано, что инфекции связаны с колоректальным раком и раком мочевого пузыря, но пока не совсем понятно, могут ли они быть онкогенным фактором.
Среди онкогенных вирусов достаточно известны вирус Эпштейна-Барр (вирус герпеса) и вирус папилломы человека. Первый ассоциирован с крайне агрессивной назофарингеальной карциномой (рак носоглотки), лимфомой Ходжкина (рак лимфатической системы), лимфомой Беркитта, Т-клеточной лимфомой и раком желудка. Второй может вызвать рак шейки матки, а также опухоли на гениталиях, в заднем проходе, горле и голове. При отсутствии вируса рак шейки матки не развивается, то есть это заболевание четко связано с хронической инфекцией.
Опасность представляют и другие вирусы, в том числе возбудитель гриппа, однако при подобных инфекциях MUC1 эффективно защищает слизистую от патогена. Вирус гепатита часто становится причиной рака печени.
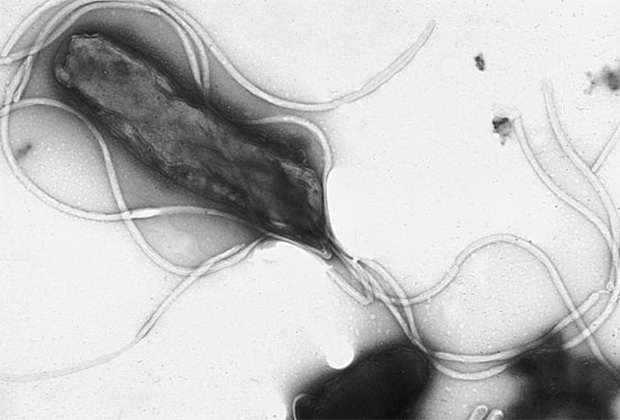
Что касается паразитов, то к онкологическим заболеваниям могут привести заражение кровяной шистосомой, которая проникает в организм человека через мочевыводящие пути. Червь провоцирует развитие плоскоклеточного рака мочевого пузыря, являясь второй ведущей причиной этого заболевания. Заражение обычно происходит в тропических регионах планеты при купании в естественных водоемах. Часто жертвами паразита становятся туристы и жители развивающихся стран с неблагополучной санитарной обстановкой. По подсчетам, во всем мире инфицировано более 207 миллионов человек.
Еще одним онкогенным паразитом является червь Opisthorchis viverrini, заражающий желчный пузырь и способствующий развитию холангиокарциномы. Этот тип опухолей редко встречается в западных странах, но распространен в Юго-Восточной Азии.
Некоторое время назад исследователи из Американского онкологического общества (ACS) пришли к выводу, что причиной половины случаев заболевания раком является нездоровый образ жизни. В целом внешние факторы среды отвечают за львиную долю онкологических заболеваний, неподконтрольными остаются лишь генетические факторы и просто случайные мутации в ДНК, на которые мы никак не можем повлиять.
Многие из воздействий можно исключить, другие — снизить до минимума. Среди этих мер обычно называют поддержание здорового веса, физические упражнения, отказ от курения и алкоголя, избегание длительного воздействия солнечных лучей и контакта с различными химическими загрязнителями. Однако теперь к этому можно добавить прививки (особенно, от ВИЧ и гепатита) и другие типы профилактики инфекционных и паразитарных заболеваний.
Гликопротеины – сложные белки, содержащие, помимо простого белка или пептида, группу гетероолигосахаридов. В настоящее время их принято называть гликоконъюгатами. В состав гликоконъюгата входит углеводный компонент (гликановая фракция), ковалентно связанный с неуглеводной частью (агликановая фракция), представленной белком, пептидом, аминокислотой или липидом.
Помимо гликопротеинов, различают также протеогликаны, состоящие из белка и гликозаминогликанов (прежнее название мукополиса-хариды); последние состоят из цепей сложных углеводов: аминосахаров, уроновых кислот, серной кислоты и отдельных моносахаридов. Типичными гликозаминогликанами являются гиалуроновая кислота, хондроитинсерная кислота и гепарин, химический состав, структура и функция которых подробно рассматриваются в главе 21.
К типичным гликопротеинам относят большинство белковых гормонов, секретируемые в жидкие среды организма вещества, мембранные сложные белки, все антитела (иммуноглобулины), белки плазмы крови, молока, овальбумин, интерфероны, факторы комплемента, группы крови, рецеп-торные белки и др. Из этого далеко не полного перечня гликопротеинов видно, что все они выполняют специфические функции: обеспечивают клеточную адгезию, молекулярное и клеточное узнавание, антигенную активность опухолевых клеток, оказывают защитное и гормональное, а также антивирусное действие.
Химический состав гликопротеинов более или менее установлен, структура определена только у ряда из них. К полипептиду присоединяются гетероолигосахаридные цепи, содержащие от 2 до 10, реже 15 мономерных остатков гексоз (галактоза и манноза, реже глюкоза), пентоз (ксилоза, арабиноза) и конечный углевод, чаще всего представленный N-ацетилга-лактозамином, L-фукозой или сиаловой кислотой; в отличие от про-теогликанов гликопротеины не содержат уроновых кислот и серной кислоты.
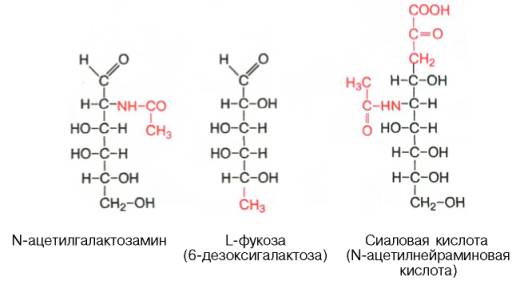
Типы связей между углеводными компонентами и белками определены только у ряда гликопротеинов, аминокислотный состав и структура которых известны (иммуноглобулины, гормоны); они включают О-гликозидные связи (с ОН-группами серина, треонина и оксилизина), N-гликозидные связи (с амидными группами аспарагина, реже глутамина или ω-NH2-группами лизина и аргинина) и эфирные гликозидные связи со свободными СООН-группами глутаминовой и аспарагиновой кислот.
Синтез гликопротеинов осуществляется в рибосомах эндоплазматиче-ского ретикулума (в цистронах), затем присоединяются сахарные цепи (постсинтетическое гликозилирование), и далее белок транспортируется до биомембран клетки и включается в состав мембранных белков или секре-тируется.
Углеводные компоненты соединены ковалентно с азотом аспарагина молекулы белка. Однако предварительно олигосахаридная часть соединяется с липидным переносчиком – долихолфосфатом (липид, содержащий от 15 до 20 изопреновых остатков) и переносится на полипептидную цепь в эндоплазматическом ретикулуме, при этом транспортер освобождается:
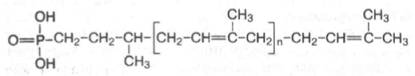
Долихолфосфат (n = 15-30)
Синтезированные гликопротеины далее переносятся в аппарат Гольджи, где осуществляются окончательное гликозилирование и сортировка по назначению.
Структура одного из нескольких гетероолигосахаридных остатков в молекуле гликопротеинов, в частности иммуноглобулинов, может быть представлена в виде следующей схемы (использованы сокращения: Глю – глюкоза, NАцГлюА – N-ацетилглюкозамин; Гал – галактоза; Ман – манно-за; NАцНейр – N-ацетилнейраминовая кислота):
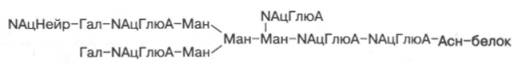
Рассмотрим известные к настоящему времени данные о синтезе, строении (структуре) и свойствах ряда гликопротеинов.
Следует отметить, однако, что до сих пор не раскрыты молекулярные механизмы, при помощи которых интерфероны тормозят размножение вирусов. Известно только, что интерфероны ингибируют биосинтез всех белков (и хозяйских, и вирусных), вероятнее всего, на уровне процесса трансляции. Возможно, что интерферон индуцирует синтез особого белка-ингибитора, который затем связывается с рибосомами и блокирует трансляцию, или интерферон переводит один из активных эукариотических белковых факторов инициации в неактивный фактор путем фосфорилиро-вания.
Иммуноглобулины. Иммуноглобулины, или антитела, также относятся к классу гликопротеинов, выполняют защитную функцию, обезвреживая поступающие в организм чужеродные вещества – антигены любой химической природы. Синтезируются иммуноглобулины плазматическими клетками, образовавшимися из лимфоцитов. Учение об иммунитете оформилось в самостоятельную науку – иммунологию , изучающую структуру и функции антител вообще и иммуноглобулинов в частности. Мы представим современные сведения о некоторых физико-химических свойствах и структуре иммуноглобулинов человека (табл. 2.4). Различают 5 классов иммуноглобулинов: IgG, IgM, IgA, IgD и IgE. Детально изучены структура и функция IgG.
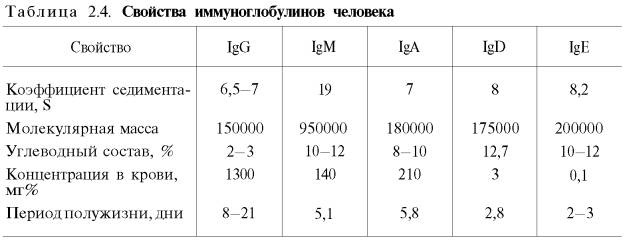
Разные классы иммуноглобулинов сильно различаются не только по молекулярной массе, но и по концентрации в крови; имеются данные, что различаются они и по биологическим свойствам.
Подробно изучена структура IgG. Он имеет Y-образную форму и тет-рамерное строение; состоит из двух идентичных легких L-цепей (от англ. light) и двух идентичных тяжелых Н-цепей (от англ. heavy) с мол. массой 23000–24000 и 50000–70000 соответственно. Известно также, что каждая из этих цепей имеет 2 типа доменов – вариабельные (V) участки, состоящие из 108 аминокислотных остатков, и константные (С) участки, состоящие из 110 и 350 аминокислотных остатков соответственно в L- и Н-цепях (рис. 2.5).
Из других гликопротеинов, выполняющих ряд важнейших биологических функций, следует отметить все белки плазмы крови (за исключением альбуминов), трансферрин, церулоплазмин, гонадотропный и фолликуло-стимулирующие гормоны, некоторые ферменты, а также гликопротеины в составе слюны (муцин), хрящевой и костной тканей и яичного белка (овомукоид). Углеводные компоненты, помимо информативной функции, значительно повышают стабильность молекул, в состав которых они входят, к различного рода химическим, физическим воздействиям и предохраняют их от действия протеиназ, определяя тем самым биологическую роль гликопротеинов. Являясь составной частью клеточной мембраны, гликопротеины участвуют, кроме того, в иммунологических реакциях, ионном обмене, процессах межклеточной адгезии и т.д.
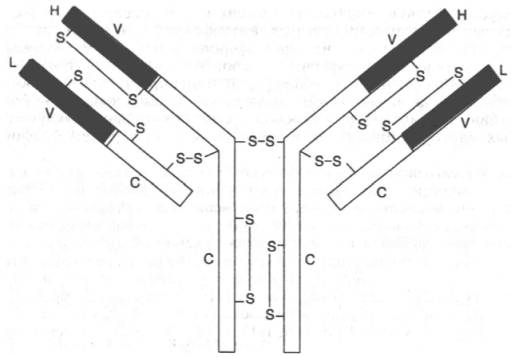
Рис. 2.5. Структура IgG человека. Показаны легкие (L) и тяжелые (Н) цепи, дисульфидные связи и вариабельные V (красные) и константные С (светлые) участки.
Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
Распространение и функции гликопротеинов
Распространение и функции гликопротеинов. Гликопротеины имеющиеся в большинстве организмов - от бактерий до человека. Многие вирусы также содержат гликопротеины. Особенно много их в крови, на клеточной мембране и внутри клеток.
Гликопротеины - это многочисленная группа сложных белков с различными функциями, главными из которых являются:
1) функция выборочной взаимодействия, высокоспецифического узнавания, например: клетка-клетка; вирус-клетка; бактерия-клетка; гормональные рецепторы. В состав поверхностных мембран наряду с другими компонентами входят гликопротеины, участвующие в очень тонких процессах биологического узнавания и межклеточного взаимодействия, виконуюючы роль рецепторных систем для определенных соединений и клеток. Такого типа рецептор для инсулина существует на поверхности клеток печени, жировой ткани и лимфоцитов. Гормоны из предварительно отщепленным конечными сиаловой кислоты при введении в кровотока не достигают клеток-мишеней. Эпителиальные клетки слизистой оболочки кишечника содержат рецепторы, которые специфически связывают клетки инфицирующих организм бактерий и вирусов.
Бесспорно важна также роль углеводного компонента гликопротеинов в определении специфичности многих антигенов. Это касается, прежде всего, групповых веществ крови и растворимых веществ биологических жидкостей (слюна, молоко, семенная жидкость). Антигенность этих гликопротеинов определяется строением олигосахаридних цепей. Замена одной моносахаридных звенья молекулы существенно влияет на специфичность всего гликопротеина, определяющий группу крови.
2) Транспортная функция. Многие гликопротеинов, которые циркулируют в кровяном русле человека и животных, являются транспортными белками. Они осуществляют транспорт гидрофобных веществ и ионов металлов. Например, функцию переносчика железа выполняет трансферрин, меди-церулоплазмин, стероидных гормонов - транскортина и т.д. Главный интегральный белок эритроцитарной мембраны участвует в транспорте анионов и, возможно, глюкозы.
3) Каталитическая функция. Углеводный компонент был найден в составе некоторых ферментов, например, энтерокиназы, пероксидазы, гликозидазы, гидролазы, холинэстеразы сыворотки (которая расщепляет ацетилхолин и участвует в передаче нервного возбуждения), РНКазы В и др..
4) Структурно-механическая функция. Эту функцию выполняют у разных видов живых организмов в основном протеогликаны. У позвоночных животных они входят в состав межклеточного вещества соединительной ткани, содержащиеся в коже, хрящах, синовиальной жидкости суставных сумок, сухожилиях, клапанах сердца, стекловидном теле, роговице глаза и других тканях. Протеогликаны придают им эластичность и устойчивости относительно сжатия. Функцию защитного масла выполняют гликопротеины - основные составляющие вещества муцинов слюны, желудочного и кишечного муцинов. Гликопротеины - это широко распространенные структурные компоненты различных клеточных мембран.
5) гидроосмотична и ионрегулююча функция. Так, ионообменная активность гликозаминогликанов как полианионов приводит активную роль в основном протеогликанов в распределении ряда катионов в соединительной ткани. Например, накопление кальция в очагах осифи-фикации связано с одновременным накоплением хондроитин сульфатов, активно фиксируют катионы кальция. Такие функции протеогликанов, как функция связывания экстрацеллюлярного воды и регуляция процессов диффузии, также в значительной мере зависят от их свойств.
Кроме перечисленных, гликопротеины выполняют в организме и ряд других функций. Например, в гликопротеинов относятся фибриноген, протромбин и некоторые другие факторы свертывания крови. Гликопро-теин являются иммуноглобулины, некоторые гормоны - гонадотропные, тиреот-ропин, кортикотропин, тиреоглобулин, ингибитор размножения вирусов - интерферон.
В сыворотке крови и мышцах антарктических рыб найдено гликопротеины - антифризы, которые защищают клетки от замерзания.
У микроорганизмов, живущих в водоемах горячих источников, клеточная мембрана содержит гликопротеины. В капсулах спороносных бактерий, устойчивых к внешней химической и термической действия, также гли-копротеины и гликолипопротеины.
К гликопротеинов относится белок яиц авидин. Он взаимодействует с витамином Н (биотин), мешает его всасыванию из кишечника. Авидин используется в опытах in vitro как ингибитор биотинвми-менных ферментов.
Вирусы – неклеточная форма жизни, обладает собственным геномом, способностью к самовоиспроизведению (репродукции) в клетках живых организмов или клеточных культурах, адаптационными свойствами и изменчивостью.
Выделены в отдельное царство – Vira.
- нет клеточной организации: не имеют цитоплазмы и ядра, митохондрий, рибосом и других органелл
- содержат только одну из двух нуклеиновых кислот – ДНК или РНК, выполняющих функции генома.
- не имеют собственных белоксинтезирующих и генерирующих энергию систем и являются абсолютными внутриклеточными паразитами на генетическом уровне, полностью зависят от клетки-хозяина
- размножаются не обычным бинарным делением, а репродуцируются в чувствительной клетке, согласно генетической программе в нуклеиновой кислоте вируса, при этом используют биосинтетические системы и ресурсы
Различают две формы существования вирусов – внеклеточную и внутриклточную.
Внеклеточный вирус = вирион. Это покоящаяся (зрелая) форма вируса. Не проявляет жизедеятельности. Функции: сохранение вируса во внешней среде и перенос его из организма в другой организм или из клетки в другую клетку.
Внутриклеточный вирус - вегетативный вирус - репродуцируется в инфицированной клетке, вызывая репродуктивную инфекцию, заканчивающуюся образованием дочернего поколения вирионов и, как правило, гибелью клетки. Процесс репродукции может быть незавершенным, без образования вирионов – возникает абортивная инфекция.
Некоторые вирусы способны встраивать свой генетический материал в хромосомы клетки-хозяина в виде провируса, которые реплицируется вместе с этой хромосомой в процессе деления и переходит в дочерние клетки. Это – интегративная инфекция, она модет существовать длительное время или переходить обратно в продуктивную.
строение вирусов (вирионов). Размеры вирусов находятся в диапазоне 20-350 нм.
Могут иметь палочковидную, многогранную, пулевидную, сферическую, нитевидную, булавовидную формы.
Различают: простые (безоболочечные) и сложные (оболочечные) вирусы. У них в центре – молекула нуклеиновой кислоты (ДНК/РНК), окруженная белковой оболочкой – капсидом. Вся структура носит название – нуклокапсид.
Простые вирусы – нуклеиновая кислота, ассоциированная с внутренними белками и капсидом (т.е. представляют собой нуклеокапсид).
Защитная белковая оболочка – капсид – состоит из множества однородных белковых субъединиц. Т.к. на такое строение капсида расходуется мало генетической информации, оно важно для вирусов, обладающих небольшим геномом. Капсиды построены по спиральному или кубическому типу симметрии, в зависимости от расположения белковых субъединиц.
Химический состав вируса.Основные компоненты вируса – нуклеиновая кислота и белки. Простые вирусы состоят только из них. В состав сложных вирусов входят углеводы и липиды клеточного происхождения.
В зависимости от типа нуклеиновой кислоты вирусы делят на ДНК- и РНК-геномные.
Вирусные ДНК – обычно двунитевые, редко – однонитевые.
Двунитевые ДНК: линейные с незамкнутыми концами, линейные с замкнутыми концами, кольцевидные, кольцевидные с одной неполной цепью ДНК.
Вирусные РНК – однонитевые, бывают двунитевые с фрагментированным геномом.
Однонитевые РНК: цельные линейные, фрагментированные (сегментированные) линейные, кольцевые сегментированные.
Различают РНК с положительным геномом – +РНК (одновременно геном и информационная РНК (и-РНК), служит матрицей для дочерних геномов);
и РНК с отрицательным геномом – –РНК (только геномная функция, т.е. матрица для синтеза генома и и-РНК).
Важнейшая особенность вирусных нуклеиновых кислот – инфекционность (способность инициировать в клетке –хозяине продуктивную инфекцию без участия других компонентов вируса). Ей обладает большинство вирусных ДНК и +РНК.
Вирусные белки.
# структурные – входят в состав вириона:
- капсидные белки- формируют капсид
- внутренние белки – геномные белки и ферменты (полимеразы), участвующие в процессе репродукции и ассоциации генома с капсидом.
- матриксные белки сложных вирусов, образуют М-слой под суперкапсидом. Участвуют в заключительных этапах самосборки вирионов и их стабилизации.
- суперкапсидные поверхностные белки – гликопротеины, протективные Аг, участвуют в прикреплении вирионов к клеточным рецепторам и их проникновении в клетку.
# Неструктурные белки – синтезируются в инфицированной клетке для обеспечения процессов репродукции, в состав вирусов не входят.
- вирусиндуцированные ферменты, обслуживают транскрипцию и трансляцию вирусного генома.
- регуляторные белки
- нестабильные белки – предшественники, из которых формируются структурные белки вириона
- ферменты, модифицирующие вирусные белки (протеазы, протеинкиназы)
Липиды. Переходят в состав вирионов из клеточных, ядерных, других внутренних мембран инфицированной клетки при почковании. Являются основным компонентом суперкапсид, способствуют стабильности вириона. При обработке эфиром суперкапсид разрушается из-за потери липидов.
Углеводы. Клеточное происхождение. Входят в состав поверхностных белков – гликопротеинов. Их гликолизирование осуществляется клеточными ферментами во время транспортировки белков на наружную поверхность суперкапсида, при этом клеточные белки вытесняются из мембран.
Последнее изменение этой страницы: 2017-01-19; Нарушение авторского права страницы
Читайте также:


