Хранение вирусов при температуре
(1).jpg)
Об актуальных изменениях в КС узнаете, став участником программы, разработанной совместно с ЗАО "Сбербанк-АСТ". Слушателям, успешно освоившим программу выдаются удостоверения установленного образца.

Программа разработана совместно с ЗАО "Сбербанк-АСТ". Слушателям, успешно освоившим программу, выдаются удостоверения установленного образца.
Методические указания МУК 4.2.2136-06 “Организация и проведение лабораторной диагностики заболеваний, вызванных высоковирулентными штаммами вируса гриппа птиц типа А (ВГПА), у людей” (утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом РФ 9 ноября 2006 г.)
В справке нет пункта 3!
Дата введения: с момента утверждения
ВГПА - вирус гриппа птиц типа А
Биобезопасность - биологическая безопасность
ЛПУ - лечебно-профилактические учреждения
МФА - метод иммунофлуоресцирующих антител
ОТ-ПЦР - метод обратной транскрипции - полимеразной цепной реакции
1.1 В настоящих методических указаниях определены порядок сбора, упаковки, хранения, транспортирования и выполнения лабораторных исследований биологического материала от больных (и умерших) пациентов при лабораторной диагностики заболеваний, вызванных высоковирулентными штаммами вируса гриппа птиц типа А (ВГПА).
1.2 Методические указания предназначены для специалистов органов и учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, лечебно-профилактических и других организаций, независимо от организационно-правовой формы.
3.1 При эпизоотическом неблагополучии в России и за рубежом по ВГПА и при отсутствии лабораторно подтвержденных случаев заболевания людей на данной территории:
3.1.1 Забор материала от пациентов (или умерших) с подозрением на инфекцию ВГПА проводят в лечебно-профилактических учреждениях (ЛПУ).
Применяемые на этом этапе тест-системы должны обеспечивать первичную идентификацию возбудителя как вируса гриппа типа А и дифференциацию штаммов этого вируса по типу гемагглютинина (например Н5).
3.1.4 При получении положительных результатов подтверждающего тестирования референс-лаборатория проводит изоляцию вируса, изучение его свойств и депонирование.
Максимальное внимание должно уделяться случаям ВГПА с предположительной передачей от человека человеку. Регистрация подобных случаев требует незамедлительного проведения комплекса противоэпидемических мероприятий и изучения генетических особенностей изолята ВГПА.
3.2 При наличии лабораторно подтвержденных случаев заболевания людей ВГПА на данной территории:
3.2.1 Забор материала проводят в ЛПУ при подозрении на заболевание ВГПА.
3.2.3 Обязательное подтверждающее тестирование в референс-лаборатории не проводится. Направление материала в референс-лабораторию осуществляется в случаях возникновения противоречивых результатов при первичном тестировании.
4.3 Для исследования забирают следующие виды клинического материала:
- смывы из полости носа и ротоглотки (для ОТ-ПЦР-анализа);
- мазки из полости носа (для МФА и ОТ-ПЦР-анализа) и ротоглотки (для ОТ-ПЦР-анализа);
- носоглоточное отделяемое (для выделения вируса, ОТ-ПЦР-анализа).
- фекалии (для ОТ-ПЦР-анализа).
Перечисленные выше процедуры по забору клинического материала врачи осуществляют в противочумных костюмах IV типа (или длинном хирургическом халате, с завязками на спине, шапочках), дополненных ватно-марлевыми повязками или респираторами типа ШБ-1 (или РБ) “Лепесток-200”. На руки надевают резиновые перчатки.
Целесообразно также включать в исследование аспираты из трахеи, бронхоальвеолярный лаваж и биоптаты легких при возможности их забора. Данные процедуры осуществляет врачебный персонал, одетый в противочумный костюм I типа (или длинный хирургический халат, с завязками на спине, дополненный фартуком, бахилами, косынкой, очками, ватно-марлевой повязкой или респиратором типа ШБ-1 (или РБ) “Лепесток-200” и перчатками).
Выбор времени забора клинического материала очень важен, так как наиболее высокое содержание вируса в дыхательных органах человека регистрируется в течение первых четырех дней после появления признаков заболевания. Образцы должны быть собраны в течение 3 сут. после появления клинических признаков, указанных в п. 6.1.
Для постмортальной диагностики используют аутоптаты легких, трахеи и селезенки.
От одного больного должно забираться не менее трех видов клинического материала. Обязательно следует забирать мазки из полости носа и роторлотки и носоглоточное отделяемое. Каждый образец материала помещают в отдельную транспортную емкость.
4.4 Сбор материала производят в пробирки со стабилизирующей средой, приготовленной согласно приложению 4, и/или в пробирки с транспортной средой, предоставляемой (или рекомендуемой) фирмой-производителем тест-систем.
4.5 Отправку материала в лабораторию осуществляют в транспортной таре со стабилизирующей средой (приложение 4).
1) в транспортную емкость (плотно закрывающиеся пластмассовые пробирки или флаконы с завинчивающимися крышками); плотно закрытый верхний конец транспортной емкости вместе с крышкой герметизируют различными пластификаторами (парафин, парафильм и др.); емкость маркируют;
2) в полиэтиленовый пакет подходящего размера с ватой (или другим гигроскопичным материалом) в количестве достаточном для адсорбции всего образца в случае его утечки; полиэтиленовый пакет следует герметично заклеить или запаять;
5.1.1 Образцы от одного пациента могут быть упакованы в один полиэтиленовый пакет. Не допускается упаковывать образцы материалов от разных людей в один и тот же пакет.
5.1.2 В полиэтиленовый пакет вкладывают бланк направления с указанием: наименование направляющего учреждения, ФИО больного, возраст, место жительства, предварительный диагноз, эпидемиологический анамнез, вид материала, дата и время взятия материала.
5.2 Герметично закрытые полиэтиленовые пакеты помещают в термоизолирующий плотнозакрывающийся контейнер (термос), приспособленный для транспортирования биологических материалов.
5.2.1 В термоконтейнеры и термосы помещают охлаждающие элементы или пакеты со льдом. К наружной стенке термоконтейнера или термоса прикрепляют этикетку с указанием вида материала, условий транспортирования, названия пункта назначения. Сроки и условия транспортирования упакованных проб клинического материала указаны в приложении 2.
5.3 Транспортирование проб клинического материала в референс-лабораторию, вирусологические лаборатории и лаборатории учреждений противочумной системы Роспотребнадзора осуществляется нарочным(и), информированным о правилах доставки материала в соответствии с п. 3.4. СП 1.2.036-95.
6.1 При отсутствии лабораторно подтвержденных случаев заболевания людей на данной территории лабораторные исследования с целью диагностики ВГПА следует проводить у пациентов с респираторными заболеваниями тяжелого течения и неясной этиологии при наличии как минимум двух из перечисленных (следующего комплекса - убрать) симптомов:
- фебрильная лихорадка с температурой тела выше 380C;
- затрудненное дыхание или дыхательная недостаточность;
- водянистая диарея при отсутствии слизи и крови в фекалиях;
в комбинации хотя бы с одним из следующих эпидемиологических признаков в период 1-7 дней перед появлением симптомов :
- посещение мест регистрации заболевания ВГПА у птиц или людей;
- тесный контакт (в радиусе 1 метра) с лицом, являющимся подозрительным, вероятным или подтвержденным случаем ВГПА;
- контакт с погибшими или больными птицами, уход, убой, ощипывание, разделка тушек, подготовка к употреблению домашней или дикой птицы или контакт с их останкам или объектами окружающей среды, контаминированными их фекалиями на территории, где в течение последнего месяца были заподозрены или подтверждены случаи инфекции ВГПА у животных или людей;
- манипуляции с образцами клинического материала (от животных или людей), подозрительным на зараженность ВГПА в лаборатории или в иной обстановке;
- употребление сырых или недостаточно приготовленных продуктов из домашней птицы на территории, где в течение последнего месяца были заподозрены или подтверждены случаи инфекции ВГПА у животных или людей.
- Тесный контакт с подтвержденно инфицированным ВГПА животным, но не домашними или дикими птицами (например, кошка или свинья).
Данный случай расценивается как подозрительный случай ВГПА.
Вероятный случай ВГПА - лицо, умершее от необъясненного острого респираторного заболевания, которое расценивается как эпидемиологически связанное по времени, месту и экспозиции с вероятным или подтвержденным случаем ВГПА, а также лицо, отвечающее критериям для подозрительного случая, и одному из дополнительных критериев:
a. инфильтраты или признаки острой пневмонии на рентгенограмме грудной клетки плюс признаки дыхательной недостаточности (гипоксемия, выраженное тахипноэ) или
b. положительный результат лабораторного подтверждения инфекции, вызванной вирусом гриппа А, но недостаточное лабораторное подтверждение инфекции.
6.2 При наличии лабораторно подтвержденных случаев заболевания людей ВГПА на данной территории показанием к обследованию являются клинические симптомы, приведенные в п. 6.1. Дополнительные эпидемиологические признаки являются необязательными.
6.3 Исследование секционного материала от умерших на наличие вируса ВГПА проводят при:
- сходстве клинической картины заболевания, приведшего к летальному исходу, с описанной в п. 6.1 или невозможности исключения такой клинической картины в анамнезе и при наличии в анамнезе хотя бы одного из перечисленных в п.п. 6.1 дополнительных эпидемиологических признаков.
6.4 Исследования проводят с использованием диагностических тест-систем, разрешенных к применению в установленном порядке. Для выявления ВГПА методом ОТ-ПЦР предпочтение должно отдаваться диагностическим тест-системам, которые обеспечивают максимальную контаминационную безопасность исследований.
6.5 При проведении первичного тестирования на наличие вируса ВГПА должны исследоваться не менее 2 видов клинического материала (например: мазки из полости носа и из ротоглотки) с использованием как минимум двух методов - ОТ-ПЦР и МФА.
6.6 При получении отрицательных результатов исследования всех образцов выдается окончательный отрицательный ответ.
При отсутствии регистрации заболевания людей, вызванных ВГПА, на данной территории при получении хотя бы одного положительного результата при МФА исследовании или использовании ОТ-ПЦР выдается предварительный положительный ответ и образцы направляют для подтверждающего тестирования в референс-лабораторию.
В период регистрации заболевания людей, вызванных ВГПА на данной территории, обязательное подтверждающее тестирование не проводят, и при получении хотя бы одного положительного результата при вирусологическом исследовании или использовании ОТ-ПЦР выдается окончательный положительный ответ.
6.7 При подтверждении в референс-лаборатории положительного результата первичного тестирования, при исследовании хотя бы одного вида клинического материала выдается окончательный положительный ответ.
При получении в референс-лаборатории отрицательных результатов исследования двух видов клинического материала проводится повторное тестирование. При получении аналогичного результата выдается окончательный отрицательный ответ.
7.1 Первичное исследование материала от больного, подозрительного на зараженность вирусом ВПГА, проводят в лабораториях, имеющих разрешение на работу с ПБА III-IV групп патогенности.
Подтверждающее тестирование осуществляется в референс-лаборатории.
7.2 Проведение работ, не связанных с накоплением вируса, образованием аэрозолей инфицированного материала (окраска и просмотр мазков, постановка серологических реакций с необеззараженным, диагностическим материалом, серологические исследования с необеззараженным материалом) осуществляют в противочумном костюме IV типа, дополненном ватно-марлевой повязкой или респиратором типа ШБ-1 (или РБ) “Лепесток-200 и резиновыми перчатками. Работы проводят в боксе биологической безопасности II класса.
7.3 Проведение работ по заражению культур клеток или куриных эмбрионов, а также связанных с возможностью образования аэрозоля осуществляют в боксах безопасности III класса. Работы проводят в противочумном костюме IV типа, дополненном ватно-марлевой повязкой или респиратором типа ШБ-1 (или РБ) “Лепесток-200 и резиновыми перчатками.
7.4 Аптечка экстренной профилактики лабораторий, проводящих диагностику заболеваний, вызванных ВГПА, должна быть укомплектована в соответствии с СП 1.3.1285-03 и дополнена двумя из следующих противовирусных препаратов: Циклоферона и Амиксина, Ремантадина, Альгирема, Арбидола и Озельтамивира (Тамифлю).
7.5 Режимы обеззараживания различных объектов при лабораторной диагностике ВГПА (в соответствии с СП 1.3.1285-03).
7.5.1 Обеззараживание поверхностей помещения (пол, стены, двери), оборудования, рабочих столов и др. - двукратным протиранием с интервалом 15 мин 6% раствором перекиси водорода или 3% раствором хлорамина (экспозиция 120 мин), либо любым дезинфицирующим средством, обладающим вирулицидной активностью, с последующей обработкой УФ в течение 60 мин.
Запрещено одновременное использование 6% раствора перекиси водорода и 3% раствора хлорамина в пределах одной лаборатории в связи с опасностью взрывоподобного характера протекания химической реакции при смешении этих растворов.
7.5.2 Обеззараживание защитной одежды осуществляют:
а) кипячением в 2% растворе соды в течение 30 мин с момента закипания;
б) замачиванием на 30 мин при 50. С в 3% растворе перекиси водорода с 0,5% моющего средства.
7.5.3 Обеззараживание перчаток - замачиванием на 60 мин в 6% растворе перекиси водорода с 0,5% моющего средства или в 3% растворе хлорамина.
7.5.4 Обеззараживание лабораторной посуды, автоклавируемых дозаторов, наконечников, вируссодержащих жидкостей, агарозного геля, инструментария из металла проводится методом автоклавирования - давление 2,0 кГс/см2 (0,2 Мпа), температура 132+-2. С, время 45 мин.
7.5.5 Обеззараживание дозаторов - двукратным протиранием поверхностей дозатора с интервалом 15 мин 6% раствором перекиси водорода, с последующей обработкой в парах формалина в течение 60 мин.
| Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации | Г.Г. Онищенко |
Рекомендуется использование следующей стабилизирующей среды для хранения и транспортировки материала от людей для дальнейших вирусологических исследований.
Среда готовится в стерильных условиях, автоклавирование не допускается, можно стерилизовать фильтрованием через нитроцеллюлозный стерильный фильтр в стерильную же посуду.
- среда для культур клеток N199, содержащая 0,5% BSA;
- пенициллин 2 х 10(6) ед./л, стрептомицин 200 мг/л, полимиксин В 2 х 10(6) ед./л, гентамицин 250 мг/л, нистатин 0,5 х 10(6) ед./л.
Методические указания МУК 4.2.2136-06 “Организация и проведение лабораторной диагностики заболеваний, вызванных высоковирулентными штаммами вируса гриппа птиц типа А (ВГПА), у людей” (утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом РФ 9 ноября 2006 г.)
Текст методические указания официально опубликован не был
2. Утверждены и введены в действие Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 9 ноября 2006 г.

Китайские ученые провели исследование пиков распространения коронавируса в разных странах и доказали, что оптимальной для передачи патогена является температура от 5 до 8,72 градуса, а влажность воздуха — от 35 до 50%. Таким образом, рано наступившая в средней полосе России весна может создать для распространения инфекции COVID-19, вызываемой вирусом SARS-CoV-2, практически идеальные условия.

И главное — сухо
Ученые из университета Сунь Ятсена (Чжуншань) в своем исследовании доказывают, что новый коронавирус лучше передается в условиях низких температур — от 5°C до 8,72°C и относительно низкой влажности — от 35 до 50%. Прежде чем сделать такой вывод, они проанализировали пики заболеваемости в период с 20 января по 4 февраля 2020 года. В это время в Китае и еще 26 странах было зарегистрировано в общей сложности 24 139 подтвержденных случаев заболевания. 68,01% пациентов были выходцами из провинции Хубэй. Ученые учли инкубационный период COVID-19, а также карантинные меры, которые постепенно вводились в разных городах.
Гипотеза ученых заключалась в том, что различная температура могла бы значительно повлиять на передачу конденсата, в котором содержатся коронавирусы. Также исследователи приняли во внимание, что подобные корреляции были найдены и при предыдущих заражениях вирусами MERS и SARS.

В частности, лабораторный эксперимент, проведенный в 2011 году с SARS, доказал, что этот патоген может сохраняться в течение пяти дней на гладкой поверхности в окружающей среде при температуре 22°C и влажности 40–50%. Как только температура поднималась до 38°C, а влажность увеличивалась до 95%, штамм терял свою активность.
В данном случае было проведено статистическое исследование, которое также показало, что новый коронавирус избирателен. Как только температура достигала отметки 8,72°C, его активность сразу шла на спад. А при 30°C его инфекционная скорость равнялась нулю.
— Действительно, такие отличия между разными вирусами существуют, и это связано со стойкостью оболочки, которая определяется их генами, — пояснил pyководитeль Научно-образовательного центра геномных исследований СФУ, профессор Гёттингенского университета (Германия) Константин Крутовский. — Некоторые вирусы, например оспы, очень устойчивы к высыханию и могут сохраняться многие месяцы, а гепатит В уцелеет даже при кратковременном кипячении, так как имеет очень стойкую оболочку. Наименее устойчивы патогены, имеющие липопротеидную оболочку, к которым относится SARS-CoV-2 и все другие уже известные коронавирусы. Между ними много общего, и сравнительный генетический анализ должен значительно помочь в их изучении и борьбе с ними.

Потепление климата
— Возможно, такая закономерность будет прослеживаться и для нового штамма, но гарантии нет. Однако в случае если температура повысится выше 8°C, это не будет означать, что вирус сразу станет менее интенсивно распространяться. Скорее всего, значительные изменения в плане передачи патогена могут произойти, если температура повысится выше 20°C, — отметил эксперт.

— Приближается похолодание. В ближайшие дни мы свалимся в мешок полярного холода. Уже в эту субботу начнутся заморозки, средняя температура марта составит минус 1–6°C. Ожидается мокрый снег и гололедица. А вот апрель и май будут достаточно благополучными, с показателями в рамках климатической нормы.
Это говорит о том, что температура в средней полосе будет достаточно часто колебаться в пределах от 5 до 8°C, — наиболее благоприятном диапазоне для распространения патогена.

— Вирус спокойно живет в наших организмах при температуре 36,6 градуса и большой влажности. Обычно чем выше влажность, тем выше уровень инфекции. В хорошо вентилируемых помещениях, как известно, меньше уровень возможной инфекции. На улице же огромные объемы воздуха, там заразиться гораздо сложнее, — пояснил ученый.
Активное распространение коронавируса при температуре 8–9°C связано с тем, что в Китае на большинстве территорий отсутствует системное отопление, отметил Павел Волчков. Жители вынуждены платить за него сами, поэтому они экономят электричество и редко открывают окна. Как известно, в плохо проветриваемых помещениях патогены распространяются быстрее. С наступлением тепла, китайцы начинают чаще проветривать помещения, поэтому, как и сказано в исследовании, возможность распространения коронавируса снижается.

Пандемия COVID-19, охватившая почти всю планету, не случайно выбрала зимне-весеннее межсезонье. Уже миновали зимние морозы, а до настоящего тепла еще далеко, и этот диапазон температуры окружающей среды оказался наиболее благоприятным для выживания и столь быстрого распространения инфекции.
Изучением нового вида коронавируса сегодня занимаются все научно-исследовательские институты и лаборатории мира, и уже есть достаточно подтвержденных данных о том, при какой температуре он выживает, а при какой погибает. Эта информация играет огромную роль для ограничения распространения вируса и предупреждения инфицирования.
Что представляет собой COVID-19
Новоявленный COVID-19 отличается наиболее крупной молекулой РНК (рибонуклеиновой кислоты), содержащей мощный геном – носитель информации и продолжения рода. Попадая на клетку организма, шипы вируса повреждают ее оболочку, РНК проникает внутрь, происходит ее репликация – деление, образуются новые вирусы, вызывая гибель клетки. Этот процесс требует определенных температурных условий, поэтому важно знать, при какой температуре коронавирус прекращает свою активность и погибает.
При каких температурах погибает коронавирус в воздухе
Следует понять, что коронавирус не имеет органов передвижения, не способен летать по воздуху, а передается контактным путем – через руки, предметы пользования, с капельками слюны, слизи. Он проявляет активность только на живой клетке тела, а, оказавшись вне ее, быстро погибает. Это дает возможность предупредить заражение и обезвредить вирус.
Учеными-вирусологами из Китая, США и Европы проведены многочисленные исследования и определены диапазоны температур, благоприятных и неблагоприятных для вируса, а также время его выживания:
- оптимальная температура выживания от +4 до +8°, при которой он может сохранять жизнеспособность до 2 недель;
- при температуре +22-24 ° и влажности 40-65% вирус может быть активен 5-7 дней;
- повышение температуры до +37° резко снижает активность COVID, снижается вероятность заражения, он погибает в течение 2 дней;
- +56° по Цельсию убивает вирус в течение получаса, а +70° и выше – мгновенно.
Закономерность очевидна: высокие температуры губительны для коронавируса. Имеет значение и влажность, оптимальный ее уровень 40-50%, слишком сухой и влажный воздух снижают жизнеспособность вируса, но не вызывают его гибель при оптимальных для него температурах. А самым благоприятным для его выживания является микроклимат жилых и служебных помещений, плюсовая весенняя температура на улице.
Как реагирует COVID-19 на повышение температуры тела
Коронавирусная инфекция также не является исключением. Если организм борется с инфекцией повышением температуры, то это – хороший признак и вполне нормальное явление. Только не следует думать, что организм сам в состоянии победить вирус. Такое случается, но крайне редко. За медицинской помощью нужно обращаться в любом случае.
Как влияют на вирус горячие напитки
В период карантина врачи рекомендуют как можно чаще пить горячие напитки – чай, травяные отвары, горячее молоко, бульон или просто воду. Это может помочь в случае, если вирус только попал на слизистые оболочки рта, верхних дыхательных путей, ведь температура 70° не оставляет ему никаких шансов. Особенно это важно, если вы посетили людные места – магазин, аптеку, городской транспорт. Придя домой и тщательно вымыв руки, нужно сразу попить горячего.
Интересно, что китайские медики рекомендуют именно зеленый чай, он содержит мощные антиоксиданты, защищающие клетки от разрушения вирусом. Они утверждают, что эти выводы сделаны на основании опыта уже спадающей в Китае эпидемии.
Тепловые процедуры: поможет ли баня от коронавируса

При этом не стоит забывать, что есть противопоказания к тепловым процедурам:
- гипертоническая болезнь;
- заболевания сердца – ИБС, пороки клапанов, миокардит;
- болезни нервной системы – атеросклероз мозговых сосудов, менингоэнцефалит, арахноидит, эпилепсия, миастения, перенесенный инсульт;
- болезни органов дыхания с недостаточностью функции легких;
- хронические болезни печени, почек;
- язвенная болезнь с кровотечениями;
- все кожные заболевания – острые и хронические;
- повышенная температура тела;
- все острые заболевания и обострение хронических;
- любые опухоли, независимо от локализации;
- возраст старше 50-55 лет.
Если же у вас уже положительный тест на коронавирус, даже без наличия явных симптомов болезни, париться не следует. Температура тела после бани может повыситься всего на 0,5-1°, и на вирус внутри организма это не окажет должного влияния.
COVID-19 на сегодняшний день еще не до конца изучен. Поступают сведения о том, что он может выдерживать градусы ниже нуля, а отдельные мутировавшие виды неплохо себя чувствуют и при высоких температурах. Но пока нужно ориентироваться на достоверные результаты и общепринятые правила, придерживаться их. Ведь распространение коронавируса полностью зависит от нас, и остановить его в наших силах.
Температурные границы и температурный оптимум размножения вирусов контролируется вирусным геномом, хотя в известной степени они зависят и от клеточной системы. Принято считать, что оптимальная температура для размножения большинства вирусов 36—37°С. Однако из этого правила имеются исключения. Например, для риновирусов температурный оптимум размножения равен 33—34°С. Герпесвирус 2 крупного рогатого скота максимально накапливается в первичной культуре клеток телят при 32°С. Вирус гриппа С, в отличие от вирусов гриппа А и В, лучше размножается при 32—33°С, хотя накапливается медленнее. Ряд альфавирусов накапливается в постоянной линии клеток комаров при 34,5°С в значительно большем титре, чем при оптимальной температуре, требующейся для размножения этих клеток.
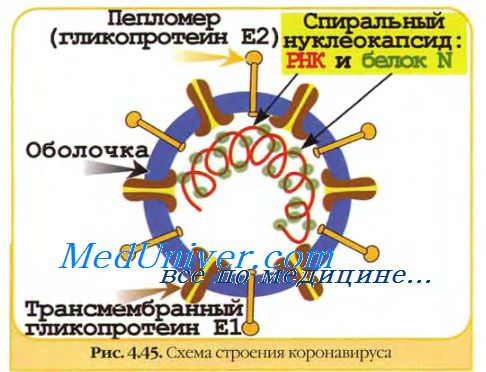
В случаях, когда при высокой множественности заражения наблюдается торможение репродукции вируса за счет аутоинтерференции (феномен Магнуса), прибегают к удалению дефектных интерферирующих частиц (ДИЧ) или других ингибирующих субстанций. Применительно к безоболочечным вирусам хорошие результаты получают с помощью простой обработки вирусного инокулята фреоном или хлороформом.
При медленном накоплении вируса и невозможности обеспечения высокой множественности заражения вирус часто вносят в культуру одновременно с посевом клеток.
Иногда с целью повышения выхода применяют повторные сборы вируса путем смены среды в период выраженного накопления. Этот прием особенно эффективен при культивировании постоянных клеточных линий, хронически инфицированных вирусом (например ВЛ КРС) и экскретирующим его в культуральную среду. Кроме сохранения зрелого внеклеточного вируса, такая операция может способствовать его репродукции за счет уменьшения концентрации ингибиторов в культуре. Заметное влияние на репродукцию вирусов оказывает рН поддерживающей среды. Так, вирус бешенства гораздо интенсивнее размножался в культуре клеток КЭ при повышении рН поддерживающей среды от 7,4 до 8,2. Как показало изучение структуры вирусной популяции, при щелочном рН не происходит накопления ДИЧ и отсутствует аутоинтерференция.
Вирус Сендай не продуцировал инфекционных частиц в культурах клеточных линий. Обработка инфицированных клеток трипсином восстанавливала его биологическую активность благодаря расщеплению гликопротеина F (65 кД) на две субъединицы FI (51 кД) и F2 (15 кД). Для изоляции и культивирования парамиксовирусов человека весьма эффективной оказалась линия клеток NCI-H292 при использовании поддерживающих сред с добавлением трипсина (1,5 мкг/мл). Установлено, что вирус ньюкаcлской болезни содержит два предшественника гликопротеинов HNo и Fo, которые в результате протеолиза превращаются соответственно в гликопротеины HN и F С ними связана гемолитическая, гемагглютинирующая, нейраминидазная и инфекционная активность вируса. Существенные различия штаммов вируса ньюкаелской болезни по патогенности определяются структурными особенностями гликопротеинов наружной оболочки вириона, которые отличаются способностью активироваться протеолитическими ферментами. Наличие трипсина в поддерживающей среде стимулировало репродукцию вируса осповакцины. Протеолитический процессинг вирусных гликопротеинов зависит от природы вируса, а также от клеточных факторов культуральной системы. В наибольшей степени от протеолитической активизации зависит репродукция оболочечных вирусов, клетками-мишенями которых in vivo являются энтероциты. К таким вирусам прежде всего относятся ротавирусы млекопитающих и птиц, кишечные коронавирусы свиней и некоторые аденовирусы. Классическим примером протеолитической активации могут служить ротавирусы, выделение и культивирование которых стало возможным благодаря применению трипсина.
Обработка трипсином значительно способствует выделению и репродукции вируса трансмиссивного гастроэнтерита свиней, и обеспечивает размножение в культуре клеток Vero вируса эпизоотической диареи поросят. Вирус эпизоотической диареи свиней (ВЭДС) размножался в культуре клеток Vero только в присутствии трипсина (10 мкг/мл) в поддерживающей среде. ЦПЭ проявлялся образованием синцития. После ряда пассажей в клетках Vero в присутствии трипсина удалось адаптировать вирус к культурам клеток МА 104, СРК и ESK при добавлении трипсина. Попытка адаптировать вирус к шести типам первичных культур клеток эмбриона свиньи не увенчалась успехом. Использование этой, ставшей теперь рутинной, методики позволило размножить астровирус человека в первичной культуре клеток почки эмбриона человека и обезьян. После 11 пассажей вируса в культуре его размножение оставалось трипсинзависимым. Аналогичным образом удалось адаптировать астровирус крупного рогатого скота (штамм US2, серотипа 2) к размножению в культуре клеток новорожденного теленка. Вирус размножался в серийных пассажах только в присутствии трипсина. На ранних пассажах вирус накапливался в культу-ральной среде через семь суток, а в последующем — через трое. Количество инфицированных клеток в культуре было невысоким и не превышало 10—20%. Значение штамма, клеточного субстрата и протеолитической активации в репродукции вирусов можно проследить на примере ротавирусов птиц и кишечных аденовирусов человека. Ротавирус птиц с трудом культивируется в присутствии трипсина, вызывая ЦПЭ в культуре клеток печени и почек КЭ. После трех пассажей вирус терялся в культуре клеток печени, но полностью адаптировался к клеткам почек.
После шести пассажей вирус приобрел способность реплицироваться без обработки трипсином, а после 10 пассажей в почечных клетках — легко культивировался в печеночных клетках и фибробластах КЭ. Однако размножение ротавируса сопровождалось ЦПЭ только в культуре почечных клеток КЭ. Протеолитическая активация была необходима для выделения и репродукции в культуре клеток KB только некоторых серотипов кишечных аденовирусов человека. Добавление трипсина повышало выход инфекционного вируса гриппа С.
Имеются и другие сообщения о том, что обработка клеток трипсином благоприятно сказывается на размножении ряда вирусов.
Читайте также:



