Иммунный ответ организма на проникновение в организм вируса
ПАТОГЕНЕЗ ВИРУСНЫХ ИНФЕКЦИЙ
Под патогенезом следует понимать совокупность процессов, вызывающих заболевание и определяющих его развитие и исход. Патогенез вирусного заболевания определяется следующими факторами: 1) тропизмом вируса; 2) скоростью репродукции вируса и количеством инфекционных частиц в потомстве; 3) реакцией клетки на инфекцию; 4) реакцией организма на вызванные инфекцией изменения клеток и тканей.
Тропизм вируса к определенным клеткам и органам характерен для большинства вирусных инфекций. В зависимости от поражения тех или иных органов и тканей различают нейроинфекции, инфекции дыхательных путей, кишечные и др.
В основе тропизма вирусов лежит чувствительность к вирусу определенных клеток, а, следовательно, тканей и органов. Это свойство вирусов заражать лишь определенные клетки называется зависимым от хозяина ограничением. Патогенность вируса является генетическим признаком, обусловленным соотношением (констелляцией) вирусных генов. Фенотипическим проявлением патогенности является вирулентность. Этот признак значительно варьирует в разных системах. Вирулентность неидентична зависимому от хозяина ограничению, однако при некоторых инфекциях причины, обусловливающие вирулентность вируса, могут определить и возникновение инфекции. Например, вирулентность вируса гриппа в разных клеточных системах обусловлена степенью нарезания гемагглютинина-предшественника на две субъединицы — большую и малую, которое осуществляют клеточные протеазы. Нарезание зависит как от величины, структуры и конформации участка белка, так и от наличия и концентрации специфических клеточных протеаз. При отсутствии нарезания инфекция не возникает, а разная степень его определит вирулентность вируса в данной клеточной системе.
Вирус проникает в организм разными путями, которые определяются локализацией чувствительных клеток в организме и механизмом передачи вирусов от одного хозяина к другому. Одни вирусы используют строго определенный путь проникновения в организм. Например, ортомиксовирусы, ряд парамиксовирусов, коронавирусов, аденовирусов, риновирусы способны репродуцироваться только в клетках слизистых оболочек дыхательных путей человека и животных, и, следовательно, единственным путем проникновения в организм является воздушно-капельный. Другие вирусы способны к репродукции в разных клеточных системах. Например, вирусы герпеса и оспы способны вызвать заболевание при внутрикожном, внутривенном, интраназальном, внутримозговом введении. В естественных условиях возможны следующие пути проникновения вируса в организм.
Воздушно-капельный. Вирус проникает в дыхательные пути в составе капель, попавших в воздух из дыхательных путей больного. Чем меньше капли, тем легче и глубже они туда проникают. Вирусные частицы могут попадать также с частицами пыли. Крупные частицы пыли оседают на слизистой оболочке носа, а мелкие (не более 2 мкм) могут проникнуть глубоко в дыхательные пути и достичь альвеол.
Воздушно-капельным путем в организм попадают две группы вирусов: 1) респираторные вирусы, которые репродуцируются в эпителии слизистых оболочек дыхательных путей, вызывают местную (реже генерализованную) инфекцию и затем выводятся из организма; 2) вирусы, для которых дыхательные пути являются только входными воротами инфекции. Не вызывая местных поражений ткани, эти вирусы обусловливают генерализованную инфекцию, часто со вторичным поражением дыхательных путей. К таким вирусам относятся вирусы натуральной и ветряной оспы, кори, свинки,
Пищевой (алиментарный). Этим путем в пищеварительный тракт попадают энтеровирусы, реовирусы, многие альфа-вирусы, аденовирусы, некоторые парвовирусы и др.
Трансмиссивный. Вирус проникает в организм при укусе кровососущего насекомого (возбудители трансмиссивных инфекций — арбовирусы и некоторые вирусы семейства рабдовирусов).
Раневой (через кожу). Некоторые вирусы проникают в организм через поврежденную или даже неповрежденную кожу, например, вирусы бешенства (при укусе животных), коровьей оспы, папилломы.
Половой. Таким путем в организм проникают вирусы герпеса, бородавок человека (семейство паповавирусов).
Парентеральный. Этим путем в организм попадает вирус гепатита В. Заражение вирусом может произойти при всякого рода парентеральных манипуляциях — хирургических вмешательствах, переливании крови, стоматологических операциях, при маникюре и педикюре и т. д.
Вертикальный. Этот путь передачи встречается, в частности, при интеграционных инфекциях, когда в дочерние клетки попадает клеточный геном с интегрированными последовательностями вирусного генома, и при инфекциях с внутриутробным заражением плода, что характерно для вируса краснухи при заболевании женщин, особенно в первые 3 месяца беременности. Поражения плода могут вызывать вирусы цитомегалии, простого герпеса, Коксаки и др.
У РНК-содержащих ретровирусов сначала происходит обратная транскрипция генома в ДНК, затем ее интеграция в клеточные хромосомы и лишь после этого транскрипция генов.
Цитопатические эффекты при вирусных инфекциях разнообразны, они определяются как вирусом, так и клеткой и сводятся к разрушению клетки (цитолитический эффект), сосуществованию вируса и клетки без гибели последней (латентная и персистирующая инфекция) и трансформации клетки.
Вовлеченность организма в инфекционный процесс зависит от ряда обстоятельств - количества погибших клеток, токсичности вирусов и продуктов распада клеток, от реакций организма, начиная от рефлекторных и заканчивая иммунными. Количество погибших клеток влияет на тяжесть инфекционного процесса. Например, будут ли поражены при гриппе только клетки носа и трахеи или вирус поразит клетки эпителия альвеол, зависит тяжесть и исход болезни.
Хотя вирусы и не образуют типичных токсинов, однако и вирионы, и вирусные компоненты, накапливающиеся в пораженных тканях, выходя в кровоток, оказывают токсическое действие. Неменьшее токсическое действие оказывают и продукты распада клеток. В этом случае действие вирусной инфекции столь же неспецифично, как и действие патогенных организмов, убивающих клетки и вызывающих их аутолиз. Поступление токсинов в кровь вызывает ответную реакцию - лихорадку, воспаление, иммунный ответ. Лихорадка является преимущественно рефлекторным ответом на поступление в кровь и воздействие на ЦНС токсичных веществ.
Если лихорадка - общий ответ организма на вирусную инфекцию, то воспаление - это местная многокомпонентная реакция. При воспалении происходят инфильтрация пораженных тканей макрофагами, утилизация продуктов распада, репарация и регенерация. Одновременно развиваются реакции клеточного и гуморального иммунитета. На ранних стадиях инфекции действуют неспецифические киллеры и антитела класса IgM. Затем вступают в действие основные факторы гуморального и клеточного иммунитета. Однако гораздо раньше, уже в первые часы после заражения, начинает действовать система интерферона, представляющая семейство секреторных белков, вырабатываемых клетками организма в ответ на вирусы и другие стимулы. Описанные явления относятся к так называемой острой репродуктивной вирусной инфекции. Взаимодействие вируса и клеток может происходить, как отмечалось выше, без гибели последних. В этом случае говорят о латентной, т.е. бессимптомной или персистирующей хронической вирусной инфекции. Дальнейшая экспрессия вируса, образование вирусспецифических белков и вирионов вызывает синтез антител, на этой стадии латентная инфекция переходит в персистирующую и появляются первые признаки болезни.
Репродукция вируса в клетках сопровождается развитием цитопатических процессов, специфичных для разных вирусов и для разных типов инфекционных процессов. Цитопатические процессы при вирусных инфекциях разнообразны, они определяются как вирусом, так и клетками, причем специфика их больше "задается" клеткой, нежели вирусом, и сводится в основном к разрушению клеток, сосуществованию вируса и клеток без гибели последних и трансформация клеток. Несмотря на значительные различия цитоцидного действия разных вирусов, в общем, они сходны. Подавление синтеза клеточных макромолекул - нуклеиновых кислот и белков, а также истощение энергетических ресурсов клетки ведут к необратимым процессам, заканчивающимся гибелью пораженной клетки. Повреждение клеток вирусами, их отмирание и распад переносят вирусную инфекцию с клеточного уровня на уровень организма в целом.
При встрече организма с вирусной инфекцией продукция интерферона (растворимого фактора, вырабатываемого вирус-инфицированными клетками, способного индуцировать антивирусный статус в неинфицированных клетках) становится наиболее быстрой реакцией на заражение, формируя защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунитета, стимулируя клеточную резистентность, - делая клетки непригодными для размножения вирусов.
Продукция и секреция цитокинов относятся к самым ранним событиям, сопутствующим взаимодействию микроорганизмов с макрофагами. Этот ранний неспецифический ответ на инфекцию важен по нескольким причинам: он развивается очень быстро, поскольку не связан с необходимостью накопления клона клеток, отвечающих на конкретный антиген; ранний цитокиновый ответ влияет на последующий специфический иммунный ответ.
Интерферон активирует макрофаги, которые затем синтезируют интерферон-гамма, ИЛ-1, 2, 4, 6, ФНО, в результате макрофаги приобретают способность лизировать вирус-инфицированные клетки.
Интерферон-гамма является специализированным индуктором активации макрофагов, который способен индуцировать экспрессию более 100 разных генов в геноме макрофага.
Продуцентами этой молекулы являются активированные Т-лимфоциты (Тh1-тип) и естественные киллеры (NK-клетки). Интерферон-гамма индуцирует и стимулирует продукцию провоспалительных цитокинов (ФНО, ИЛ-1, 6), экспрессию на мембранах макрофагов, антигенов МНС II; гамма-интерферон резко усиливает антимикробную и противовоспалительную активность путем повышения продукции клетками супероксидных радикалов, а усиление иммунного фагоцитоза и антителоопосредованной цитотоксичности макрофагов под влиянием гамма-интерферона связано с усилением экспрессии Fc-рецепторов для JgG. Активирующее действие интерферона-гамма на макрофаги опосредовано индукцией секреции этими клетками ФНО -альфа. Этот пик наблюдается совместно с ФНО-альфа. Максимум продукции ИЛ-4 наступает через 24-48 ч с момента активации клеток. При этом ИЛ-4 рассматривается как цитокин, ограничивающий иммуновоспалительные реакции и снижающий ответ организма на инфекцию, угнетая при этом экспрессию гамма-интерферона. Интерферон-гамма ин витро усиливает фагоцитарную активность нейтрофилов, что обусловлено усилением экспрессии Fc-рецепторов и поверхностных белков семейства интегринов на нейтрофилы. Это позволяет нейтрофилам осуществлять цитотоксические функции и фагоцитоз. В качестве основных эффекторных клеток воспалительного процесса, они обеспечивают элиминацию инфекта из организма.
Взаимодействие цитокина с клеткой определяется универсальной биологической системой, специфическим механизмом которой является рецепторный аппарат, связанный с восприятием метаболического кода. Для проявления биологической активности цитокина необходимо присутствие на поверхности чувствительных клеток специфических рецепторов, которые могут экспрессироваться параллельно с синтезом цитокина. Рецепторы цитокинов представляют собой комплексы, состоящие из двух и более рецепторных молекул, которые объединяются на мембране клетки-мишени и образуют высокоаффинный рецепторный комплекс. Большинство рецепторов состоит из отдельных молекул, связывающих цитокины, которые ассоциируются после связывания лиганда с сигналпередающим рецепторным компонентом; часть рецепторов существует как растворимые изоформы, способные связывать и растворять цитокины, а часть функционирует как многокомпонентные блоки; механизм комплексирования субъединиц рецепторов объясняет плейотропные и дублирующие эффекты цитокинов, имеющих большое структурное сходство. Рецепторы ИЛ-10 имеют гомологию рецепторов интерферона, и подобно ИЛ-10 индуцирует экспрессию в моноцитах гена Fc- рецептора. Для полного функционирования цитокиновой системы необходимы повышение уровня цитокина в ответ на инфект и экспрессия нормального количества рецепторов к ним на клетках. Изменение рецепторов после их связывания с цитокином заключается в интернализации комплексов цитокин - рецептор внутрь клетки. На поверхности клеток рецептор появляется заново, постепенно синтезируясь в течение 24-36 ч (время появления рецепторов интерферон-альфа). В этот период клетки остаются чувствительными к последующим дозам цитокина, чем объясняется эффективность введения препаратов интерферона и их индукторов три раза в неделю.
Пик продукции цитокинов после стимуляции макрофагов наблюдается через 1-2,6,18-48 ч, а пик продукции интерферон-гамма наступает через 20 ч после первого выхода цитокина из клетки. Поскольку интерферон-гамма ингибирует миелопоэз, то нормализация числа нейтрофилов после элиминации инфекта связана с системой регуляции нейтропоэза. Через 6 ч после стимуляции интерферон-альфа для выполнения своих функций NK-rклетки (активность которых регулируется ИЛ-1, 4, 2) продуцируют гамма-интерферон, в результате чего происходит лизис инфицированных клеток.
При антигенной стимуляции клеток трансдукция сигнала с активированного рецептора на генетический аппарат осуществляется с помощью внутриклеточных регуляторных систем, компоненты которых (белки мембран, ферментов, хроматина) связываются с чувствительными к ним последовательностями ДНК. После связывания цитокина (интерферон) с поверхностными клеточными мембранными рецепторами происходит активация ферментов протеинкиназы-С (ПКС), тирозинкиназы, ц-АМФзависимой протеинкиназы, серин-треонинкиназы. Интерферон-альфа активирует tyk 2 и jak 1-киназы, а интерферон-гамма активирует jak 1 и 2-киназы. Далее факторы транскрипции перемещаются в ядро клетки и связывают гены раннего ответа.
Первый ответ клеток на цитокин - это быстрая индукция генов раннего ответа ("immediate early" генов), в число которых и входит ген интерферон-гамма. Стимуляция экспрессии этих генов важна для выхода клеток из Go-стадии и перехода в Gi-стадию и дальнейшей прогрессии клеточного цикла. Их индукция происходит после активации рецепторов роста на клеточной мембране и активации протеин-киназной системы. Гены раннего ответа являются ключевыми регуляторами клеточной пролиферации и дифференцировки, кодируют белки, регулирующие репликацию ДНК.
Таким образом, при активации клеток происходит стимуляция генов раннего ответа, что ассоциируется с изменением фаз клеточного цикла. Основная протективная роль в иммунном ответе, направленном против внутриклеточных паразитов (грибы, простейшие, вирусы, микобактерии туберкулеза), принадлежит клеточным механизмам. Способность перечисленных возбудителей переживать и размножаться внутри клеток делает их защищенными от действия антител и системы комплемента. Резистентность к антимикробным факторам макрофагов позволяет им длительно переживать внутри этих клеток. Для элиминации возбудителя необходим специфический клеточно-опосредованный ответ. Его специфичность определяется антигенраспознающими СД8+-Т-лимфоцитами, которые пролиферируют, активируются и формируют клон эффекторных цитотоксических лимфоцитов. Решающий момент специфического иммунного ответа - это ответ СД4+Т-лимфоцитов с хелперной направленностью на распознавание антигена. На этом этапе определяется форма иммунного ответа: либо с преобладанием гуморального иммунитета, либо с преобладанием клеточных реакций (ГЗТ). Направление дифференцировки СД4 + -лимфоцитов, от которого зависит форма специфического иммунного ответа, контролируется цитокинами, образующимися в ходе воспалительной реакции. Так, в присутствии ИЛ-12 и интерферон-гамма СД4 + -лимфоциты дифференцируются в воспалительные Тh1-клетки, начинают продуцировать и секретировать интерлейкин-2, интерферон-гамма, ФНО и определяют клеточный характер специфического иммунного ответа. Присутствие ИЛ-12 обеспечивается его продукцией макрофагами, а интерферон-гамма - естественными киллерами, активированными в раннюю фазу ответа на внутриклеточно паразитирующие бактерии и вирусы. В отличие от этого, в присутствии ИЛ-4 СД4 + -лимфоциты дифференцируются в хелперы Тh 2, которые начинают продуцировать и секретировать ИЛ-4, ИЛ-5, ИЛ-6 и запускают гуморальный иммунный ответ, т.е. синтез специфических антител - иммуноглобулинов. Воспалительные Тh 1-лимфоциты нужны для борьбы с внутриклеточными паразитами, а Тh 2 хелперы нужны для элективной защиты от внеклеточных паразитов.
Вирусная инфекция может вызывать быстрое подавление экспрессии ряда клеточных генов (из которых наиболее изучены интерфероновые гены и гены, кодирующие дс-РНК-зависимые ферменты -2,5-ОАС и ПК-дс), принимающих участие в антивирусном действии. Специальные исследования механизма антивирусного действия интерферонов и дс-РНК в клеточных и бесклеточных системах показали ключевую роль в этом процессе вышеуказанных ферментов. ПК-дс, взаимодействуя с дс-РНК, фосфорилируется и в активной форме фосфорилирует регуляторные факторы транскрипции и трансляции, из которых наиболее изучен инициирующий фактор трансляции (eIF2).
ПК-дс выполняет регуляторную роль в системе клеточной пролиферации на уровне факторов трансляции и активации ряда генов цитокинов. Вероятно, существует связь между подавлением транскрипции мРНК и ПК-дс, угнетением общего синтеза клеточного белка при вирусных инфекциях и накоплением в ядрах клеток белка нуклеокапсида и белка NSP2. Фрагментация клеточных хромосом, наблюдающаяся на ранних сроках вирусной инфекции, может быть одной из причин подавления экспрессии генов, участвующих в противовирусном ответе.
Есть основания предполагать участие белков NSP2 в регуляции активности генов цитокинов - низкомолекулярных белковых регуляторных веществ, продуцируемых клетками и способных модулировать их функциональную активность. Нарушения в системе цитокинов приводят к нарушению кооперативных взаимодействий иммунокомпетентных клеток и нарушению иммунного гомеостаза.
В последние годы показано, что ИЛ- 12, относящийся к провоспалительным цитокинам, является ключевым для усиления клеточно-опосредованного иммунного ответа и инициации эффективной защиты против вирусов.
Средства терапии гриппа и ОРЗ можно разделить на этиотропные, иммунокорригирующие, патогенетические и симптоматические. Приоритет принадлежит этиотропным препаратам, действие которых направлено непосредственно на возбудитель инфекции. Все препараты этиотропного действия целесообразно рассматривать с учетом их точек приложения в цикле репродукции вирусов гриппа и других ОРЗ.
Применение химиопрепаратов для профилактики и лечения гриппа и ОРЗ относится к базовой терапии и является общепризнанным мировым стандартом. Многолетние клинические исследования достоверно выявили их высокую лечебно-профилактическую значимость. Химиотерапевтические средства представлены тремя основными группами: это блокаторы М2-каналов (амантадин, ремантадин); ингибиторы нейраминидазы (занамивир, озельтамивир) и ингибиторы протеаз (амбен, аминокапроновая кислота, трасилол). Препараты оказывают прямое антивирусное действие, нарушая различные фазы репликативного цикла вирусов. Несколько особняком стоит группа вирулицидных препаратов, применяемых местно для предотвращения адсорбции и проникновения вирионов в клетки.
- Грипп и другие респираторные вирусные инфекции / под ред. О.И. Киселева, И.Г. Мариничева, А.А. Сомининой. - СПб, 2003.
- Дриневский В.П., Осидак Л.В., Цыбалова Л.М. Острые респираторные инфекции у детей и подростков // Практическое руководство под редакцией О.И. Киселева. - СПб, 2003.
- Железникова Г.Ф., Иванова В.В., Монахова Н.Е. Варианты иммунопатогенеза острых инфекций у детей. СПб, 2007. - 254 с.
- Ершов Ф.И. Грипп и другие ОРВИ // Антивирусные препараты. Справочник. - М., 2006. - С.226-247.
- Ершов Ф.И., Романцов М.Г. Антивирусные средства в педиатрии. - М., 2005. - С.159-175.
- Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). М., 2005. - С.287-292.
- Иванова В.В. Острые респираторно-вирусные заболевания // Инфекционные болезни у детей. - М., 2002.
- Онищенко Г.Г., Киселев О.И., Соминина А.А. Усиление надзора и контроля за гриппом как важнейший элемент подготовки к сезонным эпидемиям и очередной пандемии. - М., 2004. - С.5-9.
- Об утверждении стандарта медицинской помощи больным гриппом, вызванным идентифицированным вирусом гриппа (грипп птиц) // Приказ Минздравсоцразвития №460 от 07.06.2006 г.
- Романцов М.Г., Ершов Ф.И.Часто болеющие дети: Современная фармакотерапия. - М., 2006. - 192 с.
- Стандартизированные принципы диагностики, лечения и экстренной профилактики гриппа и других острых респираторных инфекций у детей / под ред. О.И. Киселева. - Санкт-Петербург. - 2004. - С.82-95.
- Лекарственные средства в фармакотерапии патологии клетки / под ред. Т.Г.Кожока. - М., 2007.
30 декабря 2019 года в Ухане (武汉, wǔhàn — административная столица провинции Хубэй) были обнародованы 27 случаев госпитализации пациентов с симптомами тяжелой пневмонии неизвестного происхождения. 9 января 2020-го Центр по изучению инфекционных заболеваний распространил информацию о выделении у первого пациента ранее не описанного штамма коронавируса, подозреваемого в качестве причины этой пневмонии. К этому времени, а точнее за первые три дня 2020 года, в Ухане был зарегистрирован 41 случай острых респираторных инфекций с подозрением на ту же самую причину и один летальный исход — 61-летняя женщина с тяжелой формой пневмонии. Большинство случаев инфицирования связали с посещением продуктового базара с рыбной спецификой (华南海鲜批发市场), который сразу же закрыли на карантин 1 января 2020-го. 8 января в Бангкоке была госпитализирована женщина с симптомами острой респираторной инфекции, прилетевшая из Уханя. Согласно данным ВОЗ, у нее был выделен и генетически секвенирован тот же самый штамм коронавируса. Однако 61-летняя пациентка, которая, по сообщению таиландских источников, выздоровела, не посещала закрытый рынок морепродуктов. Дальнейшая история развития эпидемии и детали доступны в совместном отчете ВОЗ и представителей КНР [1].
- передача вируса происходит капельным и контактным путями (точнее, оба способа являются контактными, подразумевается, что вирус распространяется как прямым контактом с инфицированным, так и непрямым — через капли в воздухе и предметы) [2, 3,4], аэрогенный путь до сих пор не подтвержден [5];
- заболеваемость не имеет четкой возрастно-половой направленности, болеют все, однако у пожилых и ослабленных людей течение тяжелое, а у мужчин в целом манифестации инфекции встречаются чаще, чем у женщин [6, 7];
- инкубационный период от 3 до 7 дней, заразность сохраняется в течение 14 дней. возможно асимптоматическое течение и инфицирование во время инкубационного периода [8, 9, 10, 11, 12, 13, 14], сообщается о соинфицировании с вирусом гриппа [15];
- происхождение вируса, предположительно, отслеживается до китайских подковоносых летучих мышей, однако передача к человеку, скорее всего, произошла через другой вид [16, 17];
- генетический и протеомный анализ семи образцов коронавируса выявил сродство рецепторам ACE2 (ангиотензин-превращающий фермент 2 типа), который принимает активное участие в регуляции сердечно-сосудистой деятельности и широко представлен в эндотелиальных клетках сосудов организма [18];
- распространение инфекции эффективно контролируется только карантинными мероприятиями [19, 20].
Стоит ли паниковать и бояться коронавирусной пневмонии?
Для профилактики респираторных инфекций достаточно соблюдать базовые правила гигиены:
- мыть руки, лицо и промывать нос регулярно и особенно после похода на улицу и посещения общественных мест;
- избегать тесного и длительного контакта с людьми, проявляющими симптомы простуды;
- мыть и термически обрабатывать пищу;
- проводить регулярные дезинфекционные мероприятия в местах общего пользования [21, 22,23];
- выполнять рекомендации международных, национальных и региональных экспертных организаций в сфере здравоохранения.
Что такое коронавирусы?
Коронавирусы — распространенная семья микроорганизмов. Это — +РНК-вирусы с внешней липопротеиновой оболочкой, напоминающей по форме солнечную корону, откуда и название. Коронавирусы способны вызывать широкий набор патологических процессов у птиц, домашних и не очень млекопитающих, в том числе у человека. Обычно поражаются слизистые дыхательных путей и желудочно-кишечного тракта, легочная и нервная ткани. На сегодняшний день описаны семь штаммов коронавируса у человека. Большинство вызывает острые поражения верхних дыхательных путей, то есть обычную простуду, или расстройства пищеварения. Ранее были описаны два штамма, вызвавшие серьезные эпидемии.
В 2002–2003 годах около 8000 человек были госпитализированы с тяжелым острым респираторным синдромом (Severe acute respiratory syndrome, SARS), вызванным вирусом SARS-CoV. Эпидемия началась в провинции Гуандун, откуда и распространилась по всему миру с 775 летальными случаями, преимущественно на юге КНР и в Гонконге. Позже китайские эпидемиологи установили, что промежуточным источником вируса были циветты (азиатские родственники кошек), а первичным резервуаром — подковоносые летучие мыши в провинции Юньнань.
Свежевыявленный уханьский вирус сначала получил временное название 2019-nCoV, позже был переименован в SARS-CoV-2.

А что с лечением?
Почему так часто эпидемии начинаются в Китае?
Потому что высокая плотность населения в совокупности с высокой же концентрацией домашних животных, особенностями рациона и жилищных условий, посредственной экологической обстановкой, слабой гигиеной, климатическими и другими факторами способствуют быстрому распространению инфекций внутри Южной и Восточной Азии и Китая в частности. А значительный прогресс в сфере мобильности и коммуникаций современного Китая со всем миром позволил эпидемиям быстрее выходить за пределы региона.
Многие, скорее всего, уже слышали или читали о том, что новый коронавирус пытаются лечить всем подряд — от народных средств до дорогостоящих высокотехнологичных препаратов и экстракорпоральной мембранной оксигенации. Поэтому в качестве очередной профилактической меры на пути к здравомыслию и перед тем, как перейти к самой замысловатой, политэкономической части о противовирусных препаратах, считаю необходимым разобрать механизмы взаимодействия вируса с организмом. Поскольку только так можно адекватно оценить перспективы каждого предлагаемого фармакологического средства.
Как работает коронавирус: продвинутое объяснение
Коронавирусы распространяются как прямым (прямой контакт с инфицированным), так и непрямым (капельным, фекально-оральным, через предметы) контактными способами [26, 27]. Новый коронавирус (SARS-CoV-2) показал сродство клеточному рецептору ACE2 (ангиотензин-превращающий фермент 2 типа), что указывает на наибольшую вероятность взаимодействия с клеткой по тому же механизму, что и у бета-коронавируса SARS [28, 29, 30, 31]. По сути, даже если в дальнейших исследованиях выяснится, что SARS-CoV-2 проникает в клетку, связываясь с другим рецептором, кардинально картину это не изменит, как показывает пример аналогичного репродуктивного цикла коронавируса MERS-CoV. Поэтому разбирать патогенез уханьского вируса уместно на подробно изученной модели SARS [32].
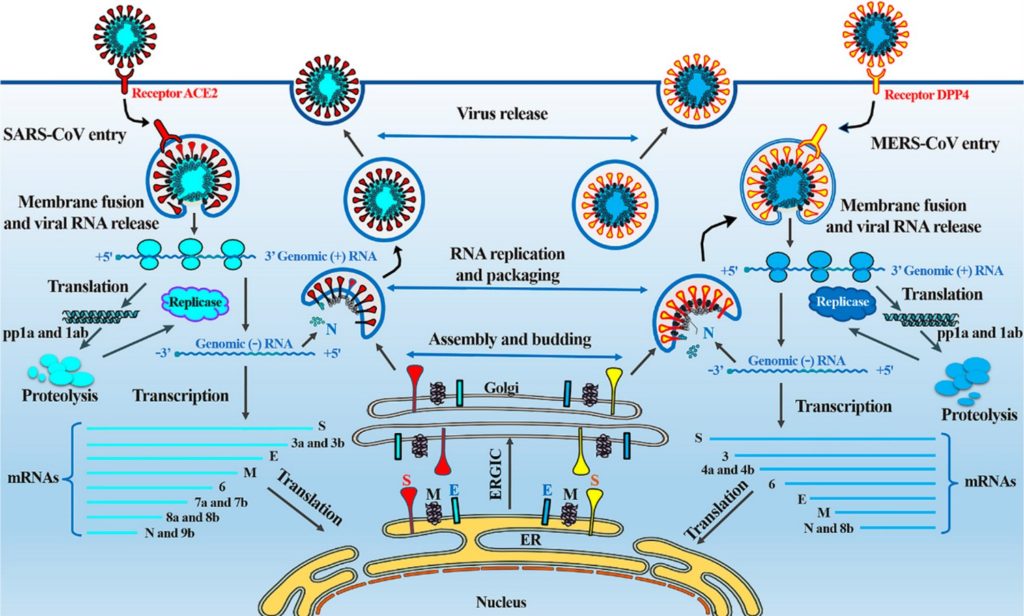
Механизм действия коронавирусов SARS и MERS. Источник
В ответ на проникновение вируса и опосредованные его размножением изменения организм отвечает каскадом иммунных реакций. Однако, как в случае с SARS и MERS, реакция иммунной системы часто неадекватна. Не вдаваясь в детали: она сопровождается нарушением регуляции цитокинов [38, 39]. Как следствие — высокая вероятность развития осложнений у лиц из групп риска (пожилых, курящих, с наличием хронических патологий и т. п.), быстрое повреждение легочной ткани и высокая опасность летального исхода.
Мы выяснили, что на вирус, который уже попал в организм, напрямую внешними факторами воздействовать никак нельзя, но пытаться воздействовать на инфицированный им организм, исходя из патогенеза коронавирусных инфекций, можно по трем направлениям: неспецифическая активация иммунной системы, специфическая иммунизация, она же вакцинация компонентами вируса, и вмешательства в жизненный цикл вируса, обеспечивающие невозможность его воспроизводства.
Как можно влиять на иммунную систему?
1) не трогать, не влиять;
2) активно поддерживать в работоспособном состоянии;
3) угнетать, ухудшать.
С первым вариантом, думаю, всё понятно — как есть, так есть.
Второй способ — тот, который дается с трудом, — здоровый образ жизни [40]. Да-да, это те самые принципы сохранения максимально возможного функционального состояния организма в конкретных условиях среды, в которых он находится:
— сбалансированное рациональное питание;
— адекватная и регулярная двигательная активность;
— психоэмоциональная стабильность;
— соблюдение режимов;
— избегание вредностей.
Третий вариант, наоборот, активно используется многими людьми, причем настойчиво даже тогда, когда уже проявились проблемы в состоянии организма. Как можно догадаться, это — прямая противоположность второму пункту.
Главной проблемой тяжелых вирусных инфекций является неадекватный иммунный ответ, в частности, недостаточная активация или ее полное отсутствие со стороны CD4+ T-клеток — наиважнейшего звена в защите организма от инфекций. Так как регуляция внутри иммунной системы осуществляется посредством сигнальных молекул — хемокинов и цитокинов, введением этих веществ в кровоток можно повлиять на активацию или подавление отдельных звеньев механизма иммунного ответа. С опорой на эти предположения производятся контролируемые эксперименты на зараженных вирусами клеточных культурах и животных моделях. Результаты оцениваются по снижению цитопатического эффекта (CPE) вируса, оказываемого на клетки-мишени, которые демонстрируют потенциальную возможность использования этих активных веществ в клинической практике. В основном в качестве перспективных препаратов рассматриваются различные подтипы и комбинации интерферонов α, β, λ, γ [41, 42, 43, 44, 45].
Еще один вариант воздействия на иммунную регуляцию — подавление активности клеток (иммуносупрессия). Для этого используются цитостатики, глюкокортикоидные гормоны, моноклональные антитела и другие молекулы, связывающие регуляторные белки — иммунофилины [47, 48, 49, 50]. Опять же, использование некоторых этих веществ в экспериментальных моделях показало обнадеживающие результаты и гипотетически может помочь в терапии у человека, однако приводит к ряду серьезных побочных эффектов и в реальности работает лишь у некоторых пациентов.
Выводы
На современном этапе развития науки не существует достоверного и безопасного метода неспецифического воздействия на иммунитет для противодействия коронавирусным инфекциям, за исключением здорового образа жизни, который работает не сиюминутно, а только в долгосрочной перспективе.
Единственный способ воздействовать на иммунитет специфически, то есть конкретно против этого инфекционного агента, — вакцинация. Но разработка таких препаратов, как упоминалось выше, процесс долгий и дорогой, поэтому в ближайшем будущем ожидать появления вакцин против коронавирусов не стоит.
Заявления гигантов фарминдустрии о намерениях по разработке вакцин, на мой взгляд, лишь рекламный ход для привлечения дополнительных инвестиций на волне ажиотажа [51, 52, 53, 54]. Впрочем, и для мелких биотехнологических компаний это возможность точно так же засветиться перед потенциальными источниками финансирования [55, 56, 57, 58, 59, 60].
Скорее всего, нет. Напомню, что против SARS и MERS вакцины до сих пор не разработаны, и для этого, среди прочего, есть биологические основания, обеспечивающие потенциально низкую эффективность в том числе будущих проектов [61, 62, 63, 64, 65, 66].
Кроме того, к коронавирусным инфекциям не формируется стойкого иммунитета. Теоретически даже перенесшие инфекцию могут заражаться повторно [67, 68, 69, 70].
Для предотвращения распространения инфекции оптимальными стратегиями для всех без исключения являются самоизоляция, дистанционная коммуникация, соблюдение индивидуальной и общественной гигиены, здоровый образ жизни, непрекращающееся образование.
Читайте также:


