Иммуноферментный анализ вирусов картофеля
Диагностика вирусов и бактерий картофеля методом ИФА
И ммуноферментный а нализ (ИФА, англ. enzyme-linked immunosorbent assay, ELISA) – лабораторный метод качественного и количественного определения разнообразных молекул, вирусов, бактерий и т.п. В основе метода лежит высокоспецифичная иммунологическая реакция антитела и антигена.
Антителами являются сложные белковые молекулы (иммуноглобулины), синтезируемые клетками иммунной системы человека и прочих теплокровных животных в ответ на проникновение в организм антигенов – вирусов, бактерий, молекул и прочих чужеродных объектов. Высокая специфичность взаимодействия между антителом и антигеном обусловлена тем, что активный центр антитела способен связываться с уникальным фрагментом антигена. Именно это свойство реакции антитело-антиген определяет специфичность, надёжность, достоверность и чувствительность ИФА при проведении диагностики патогенов картофеля. При наличии целевого патогена в исследуемом образце формируется комплекс соответствующих антител и антигена, детекцию которого определяют по активности фермента, связанного с антителами.
Существует широкое разнообразие методов проведения ИФА, различающихся природой антигена, принципом связывания, условиями проведения, способами детекции результатов ферментативной реакции и т.п. Для диагностики патогенов сельскохозяйственных культур традиционно используется “сэндвич”-метод с использованием двух типов антител (DAS-ELISA – double antibody sandwich enzyme-linked immunosorbent assay). В качестве фермента, обычно, используется щелочная фосфатаза.
Реакция проводится в 96-луночных полистирольных микропланшетах, характеризующихся высокой эффективностью связывания белковых молекул, в т.ч. иммуноглобулинов (антител), на своей поверхности.
На первом этапе антитела захвата (capture antobodies) разводят в необходимой концентрации в покровном буфере (coating buffer), вносят в лунки микропланшетов и инкубируют от нескольких часов при температуре +30-37°С до нескольких дней при температуре +4°С. Во время инкубирования антитела неспецифически адсорбируются на поверхности лунок микропланшета. По окончании инкубирования планшеты промывают несколько раз промывочным буфером (wash buffer) для удаления антител захвата, которые не связались с поверхностью микропланшета.

Сорбция антител захвата на поверхности лунки микропланшета
На следующем этапе в лунки микропланшета, поверхность которых покрыта антителами захвата, вносят сок, экстракт, или гомогенат растений, исследуемых на наличие антигенов – патогенных бактерий или вирусов и инкубируют 14-16 часов при температуре +4°С. При необходимости, растительный материал можно развести экстракционным буфером (extraction buffer). По окончании инкубирования лунки несколько раз промывают промывочным буфером.
При наличии целевого патогена в образце происходит взаимодействие специфичного фрагмента антигена с соответствующим антигенсвязывающим центром антител захвата.
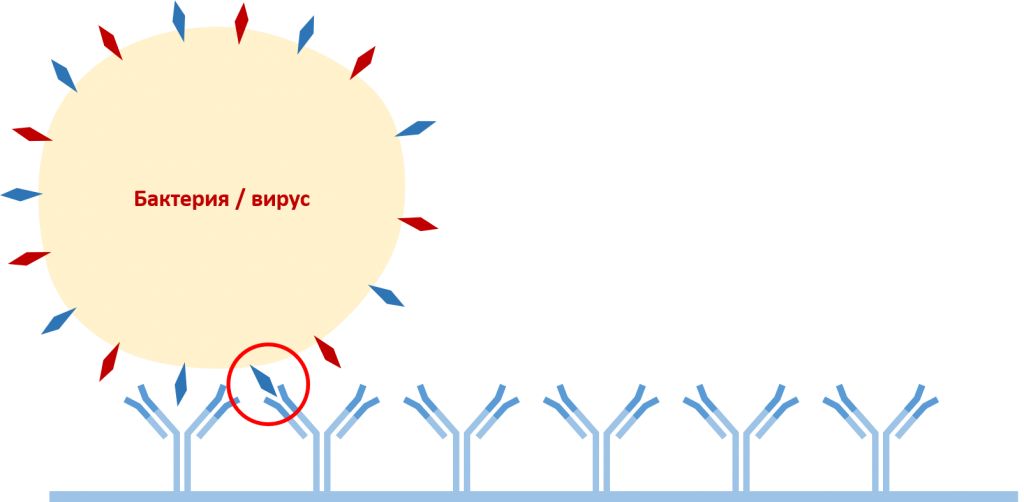
Связывание антигена с антителами захвата
В промытые лунки наносят антитела детекции, конъюгированные с ферментом щелочная фосфатаза (Ф). Антитела разводят в необходимой концентрации в конъюгатном буфере (conugation buffer). Микропланшеты инкубируют при температуре +30°С в течение 5 часов. По окончании инкубирования микропланшеты несколько раз промывают промывочным буфером для удаления антител детекции, не связавшихся с антигенами.
На данном этапе происходит взаимодействие специфичного фрагмента антигена с соответствующим антиегнсвязывающим центром антител детекции. Антигенсвязывающие центры антител захвата и антител детекции различны и специфично связываются с разными фрагментами антигена.
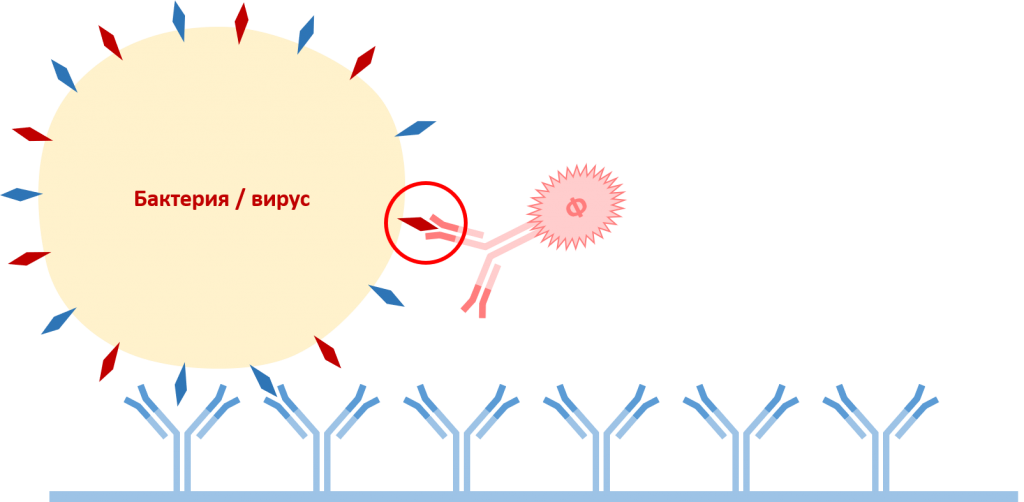
Связывание антител детекции с антигеном
На заключительном этапе в лунки добавляют пара-нитрофенилфосфат, являющийся субстратом для фермента щелочная фосфатаза. При наличии в растительном образце целевых патогенов формируется комплекс антитело захвата-антиген (вирус или бактерия)-антитело детекции, конъюгированное с ферментом щелочная фосфатаза. Фермент (Ф) катализирует превращение бесцветного пара-нитрофенилфосфата (субстрат, С) в жёлтый пара-нитрофенол (продукт, П), в результате чего происходит окрашивание реакционной смеси в жёлтый цвет. Интенсивность окраски реакционной смеси можно оценивать как визуально, так и с помощью спектрофотометра.
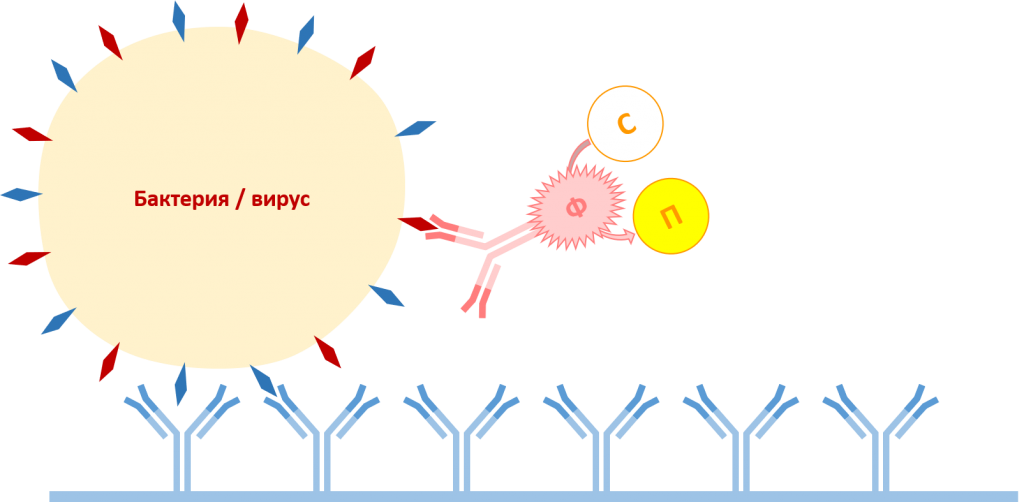
Фермент, конъюгированный с антителами детекции, катализирует реакцию превращения бесцветного субстрата в жёлтый продукт

Картофель во всем мире является вторым хлебом и считается одним из важнейщих сельскохозяйственных продуктов для употребления в пищу человечеством. Среди изученных до ХХ в. из 400 видов фитопатогенных вирусов [1] около 20 видов вирусов [2, 3] поражают картофель. Исследования, проведенные в последующие годы, показали, что картофель поражается более 52 видами фитопатогенных вирусов [1, 4]. К ним относятся такие вирусы, как вирус скручивания листьев картофеля – ВСЛК (potato leaf roll virus, PLRV); Y вирус картофеля – YВК (Potato virus Y, PVY); X вирус картофеля – ХВК (Potato virus X, PVX); S вирус картофеля – SBK (Potato virus S, PVS); M вирус картофеля – МВК (Potato virus M, PVM) [5]. Каждая из них имеет своеобразный симптом поражения: ВСЛК вызывает симптом скручивания листьев картофеля, YВК – мозаичное скручивание, а ХВК – крапчатую мозаику. Признаки поражения проявляются в различных симптомах в зависимости от вида вируса, экологических условий а также от сорта картофеля [4, 6]. Из перечисленных вирусов ВСЛК снижает урожайность картофеля до 80 %, а в случае ХВК поражение, не проявляя видимых симптомов из года в год, через клубеньки передаётся следующему поколению, урожайность снижается до 10–25 %, а при смешанных инфекциях (S + X + A), снижая урожайность до 40 %, приносит большой ущерб сельскому хозяйству [7, 8].
ВСЛК относится к семейству Luteoviridae, роду Polerovirus, форма вириона сферическая, передаётся с помощью Myzus persicae, во всем мире распространена во всех хозяйствах, выращивающих картофель, и является вирусом, приносящим большой вред картофелеводству [4, 8].
ХВК относится к семейству Alphaflexiviridae, роду Potexvirus, является одним из широко распространённых вирусов во всех континентах, легко передаётся механически, контактным путём, а также почвенными грабами [1]. Является одним из фитопатогенных вирусов, приносящим большой вред картофелеводству. Основой разработки мер борьбы против этого вируса является изучение его распространения в определённых регионах и определение его естественных растений-резерваторов в этом регионе. Исследования, проведённые в последние годы, указывают на широкое распространение этих вирусных заболеваний картофеля в Узбекистане [9].
Исходя из вышеизложенного, целью исследований является изучение распространения и естественных растений-резерваторов ВСЛК и ХВК в некоторых районах Самаркандской области.
Материалы и методы исследования
Основные материалы для проведения ИФА: антитела к ХВК (IgG), конъюгат (IgG + фермент), полистироловые платы и химические реактивы, полученные из организaции Internotional Centre of Potato (CIP). Для выявления вируса методом ИФА, первоначально листья картофеля с симптомами поражения и листья индикаторных растений, зараженных с препаратом ХВК, который очищен из смещенных инфекций, были собраны в отдельные полиэтиленовые мешочки. Затем, добавляя фосфатный буфер (Ф.Б.) в соотношении 1:1 (состав для 1 литра – NaСl, KH2PO4, Na2HPO4, KCl, NaN3, рН-7,4), их гомогенизировали и приготовили гомогенат. В полистироловые платы иммобилизировали АТ вируса (IgG) в течение 5–6 ч при 37 °С, не связавшиеся антитела (АТ) смыли с помощью Ф.Б. с твином (на 1 литр Ф.Б. добавили 20 капель (0,5 мл) твина PBS-T). Затем налили гомогенат антигена (АГ), приготовленный из листьев определяемого растения, и инкубировали в течение 3–4 часов при 37 °С. Не связавшиеся АГ смыли Ф.Б. с твином. Затем в полистироловые платы налили конъюгат (IgG + фермент), поместили их в полиэтиленовые мешочки и хранили 3–4 ч при 37 °С. Не связавшиеся конъюгаты смыли Ф.Б. с твином. Затем в каждую полистироловую плату налили по 80 мкл субстрата (состав: диэтаноламин, 37 % HCl, дистиллированная вода и таблетки субстрата – р-нитрофенилфосфат) и наблюдали за проявлением реакции. Реакция проявлялась в течение 30–60 мин в виде изменения окраски. Результаты зафиксировались.
Результаты исследования и их обсуждение
Для диагностики вирусных болезней применяются макро- и микроскопические, биологические, физические, химические, индикаторный и серологический методы. Наиболее распространены визуальный и серологический методы.
Визуальный метод – определение заболевания по внешним признакам (хлороз, деформации, чрезмерное ветвление, язвы, некрозы, мозаики) непосредственно в поле (скручивание листьев, полосчатая мозаика,бактериоз стеблей, бурая бактериальная гниль, аукуба – мозаика, морщинистая мозаика, столбур). Этот метод часто не дает надежных результатов при определении вирусов Х,S,M,A, вызывающих слабозаметные симптомы или находящихся в латентном состоянии.
Эффективность визуального метода оценки выше, если учитывать комплекс основных и второстепенных признаков в динамике. Например, слабые признаки обыкновенной мозаики лучше заметны на молодых растениях до цветения, затем они ослабевают или исчезают; закручивание листьев сильно проявляется во время бутонизации, позднее исчезает; признаки полосчатой мозаики проявляются после цветения и усиливаются с возрастом растений.
Наиболее типичные проявления вирусной инфекции на картофеле - мозаики, деформации, хлорозы, некрозы, желтая мозаика.
При тяжелых формах вирусных болезней отмечаются следующие признаки.
Для морщинистой мозаики (вирус У, часто – вместе с вирусами Х,S и А) характерны мозаичность и морщинистость листьев, торможение роста жилок долей в длину, края листьев загибаются книзу, на листьях – некрозы, нижние листья засыхают.
При полосчатой мозаике (чаще вирус У) обнаруживаются темные штрихи (некрозы) и пятна на нижней стороне листа, а также на черешках листьев и стеблях.
При закручивании листьев (вирус М) проявляются мозаичность, искривления и волнистость верхних листьев, края их долей загнуты вверх или доли слегка сложены вдоль средней жилки. Признаки болезни хорошо различаются только на молодых растениях.
Складчатая мозаика (вирус А) характеризуется разнообразными деформациями долей листа, часто сопровождающимися мозаичностью.
К группе желтух относится скручивание листьев (вирус L): нижние листья скручиваются в трубочки, становятся жесткими и шуршат, что особенно заметно во время цветения.
Крапчатость и обыкновенная мозаика (вирусы Х и S) проявляются на листьях в виде размытых светлых пятен различной величины, иногда наблюдается слабая деформация листьев.
Для выявления поражения картофельного растения вирусом скручивания листьев применим гистохимический анализ (выявляются патологические изменения в структуре клеток и тканей, биохимическом составе растений). Во флоэме стебля отмечается отмирание клеток (некроз), а в ситовидных трубках клубней – накопление полисахарида каллозы, выявляемое по окрашиванию тканей фуксином и резорцином.
Серологический метод – выявление скрытой инфекции с помощью диагностических сывороток. Основан на антигенных свойствах вирусов: при смешивании диагностических сывороток с соком проверяемых растений, листьев, клубней, ростков, вытяжек из них, семян в случае их зараженности одним или несколькими вирусами наблюдается хлопьевидный осадок. Метод широко применяется в первичном семеноводстве и селекции картофеля. Дает возможность выявить растения, зараженные латентными формами вирусов Х,S, М,У,А и скручивания листьев. Оптимальные сроки анализа для вирусов Х и М – во время бутонизации, вируса У – через 20-25 суток после всходов, вируса S – во время цветения. Серологическую оценку рекомендуется проводить не менее 2х раз. Для этого у полевых растений отбирают концевые доли 3-х полностью развитых листьев (верхнего, среднего и нижнего) и выдерживают при t 3-5 0 С не менее 2 ч, а при анализе растений, полученных из глазков в теплице, берут 2-3 листа целиком с верхней частью стебля. Для получения более достоверных серологических реакций следует: химические обработки посевов, подлежащих проверке, прекращать за 2-3 недели до начала анализов; проверять только молодые растения; отбирать листья с разных ярусов; брать сок из свежесорванных листьев; между отжатием сока и смешиванием его с сывороткой не допускать перерыва более 30 мин; анализы проводить при t 18…22 0 C; смешанные капли выдерживать не менее 20 мин.
Разновидность этого метода – иммуноферментный анализ ,основанный на использовании сывороток, глобулины которых соединены с ферментом (Элиза – тест). Вначале материал проверяют с помощью капельного серологического, индикаторного и других методов и только после этого для окончательной проверки используют данный метод.
Сущность иммуноферментного анализа заключается в следующем: на стадии выделения иммуноглобулинов добавляют небольшое количество фермента пероксидазы или кислой фосфатазы, что позволяет резко повысить чувствительность метода благодаря цветной реакции. При этом дается не только качественная характеристика , но и количественная. В настоящее время освоены методы получения конъюгата (иммуноглобулины, меченые указанными выше ферментами) для выявления вирусов Х,У, S, М.
Среди модификаций ИФА предпочтение отдается Сэндвич – методу. Им можно одновременно определить растения на зараженность Х,S, М,У, F,L – вирусами.
Оборудование для ИФА: автоматические пипетки от 50 до 200 мкл, полистироловые пластины с 96 лунками; фотометр, холодильник на -20 0 С, термостат на +37 0 С, сушильный шкаф, диагностические наборы на вирусы, которые заказывают в НИИКХ. Анализ проводят при t 18…25 0 С. Весь процесс определения длится 1,5 дня и состоит из следующих этапов:
1. Нанесение антител. Специфические антитела разбавляют в буфере и наливают по 100 мкл (0,1 мл) в лунки платы, накрывают крышкой и инкубируют в течение ночи при + 4 0 или 2 часа при + 37 0 С в термостате.
Промывка. Раствор удаляют из платы. Для этого нужно резко перевернуть плату и вытряхнуть содержимое. Промывают лунки 3 раза промывочным буфером. Избыточную влагу удаляют из лунок фильтровальной бумагой.
2. Нанесение анализируемых образцов. Буфером экстрагируют сок из растения картофеля и наливают по 0,1 мл суспензии исследуемого материала, а также контрольные растворы в лунки платы. Закрывают плату крышкой и инкубируют в течение ночи при + 4 0 С или 1 ч при + 37 0 С.
В качестве отрицательного контроля используют сок листьев или ростков заведомо здоровых растений и клубней или вносят в лунку вместо него буфер для проб и коньюгата в объеме не больше 0,1 мл ( во избежание появления неспецифической реакции).
При взятии проб необходима тщательная промывка проточной водой инструментов и посуды с последующей дезинфекцией.
3. Нанесение коньюгата. Наливают в лунки по 0,1 мл рабочего раствора коньюгата (специфическое антитело, меченое ферментом), накрывают плату крышкой, инкубируют 1 ч при +37 0 С. Промывку проводят аналогично п.1.
4. Проведение ферментативной реакции. Наливают по 0,1 мл субстрата и инкубируют при комнатной t 0 в течение 30…40 мин для окрашивания.
Оценка результатов. Наличие или отсутствие вируса может быть определено визуально или спектрофотометрически. При визуальной оценке, дающей информацию типа “да” “или нет”, интенсивность окраски в лунках с анализируемыми пробами сравнивают с интенсивностью окраски в лунках с отрицательным контролем. Результаты анализа можно фиксировать условными обозначениями: - - вирус отсутствует; + - материал заражен; ++- материал сильно заражен.
Антитела, нанесенные на планшет и высушенные на воздухе, рекомендуется хранить при – 20 0 С. В этих условиях они в течение нескольких месяцев не теряют способности взаимодействовать с вирусом.
Контроль пробирочных растений методом Элиза – теста (ИФА) осуществляют при черенковании растений.
Метод электронной микроскропии. Объект, приготовленный для просмотра на электронном микроскопе, должен быть монтирован на очень тонких (толщиной 20 нм) пленках формваровых или коллодиевых.
Для получения пленки готовый коллодий дополнительно высушивают в вакууме и растворяют в амилацетате (1-1,5 % раствор).
На сетки (диски 3 мм с отверстиями, изготовленные из меди) наносят плёнку.
Для нанесения объекта на сетку с пленкой готовят предметное стекло с наклеенной тонкой полоской пластыря посередине, по обе стороны которого по краям слегка прикрепляют по 10 сеток с пленкой.
Край исследуемого листа отрезают лезвием и место среза погружают на 1-2 сек. в каплю дистиллированной воды, помещенную на сетку с пленкой. Каждый новый срез делают чистым лезвием. После высыхания и напыления препарат готов для просмотра.
Контрастирование напылением производят в вакуумной установке. Для достоверности готовят по два препарата исследуемого объекта и просматривают по 10 полей каждого препарата. Для напыления применяют металлы. Препараты просматривают при увеличении в 40-60 тыс. раз.
Метод индексации. Для выявления вирусных болезней в зимний период применяют метод индексации, т.е. определение зараженности клубней вирусами по их частям (индексам). Он основан на способности некоторых вирусов давать внешнее проявление заболевания за короткое время в условиях повышенной температуры. Для чего в зимний период после естественного начала прорастания клубней или искусственного прерывания периода покоя путем обработки стимуляторами в верхушечной части клубня вырезают глазок (индекс) вместе с мякотью диаметром до 1,5 см. Индексы высаживают в горшочки с торфокрошкой и выращивают из них растения в условиях теплиц. При этом номер каждого глазка (индекса) такой, как у клона, из которого взят клубень для проведения анализа.
При высоте растений 18-20 см растения тщательно осматривают на выявление внешних признаков заболеваний. Все больные растения бракуют и записывают в журнал их номера. Внешне здоровые проверяют на выявление скрытой инфекции серологическим или иммуноферментным методами. При анализе растений, полученных из глазков в теплице, берут целиком 2-3 листа с верхней части стебля. Все растения с положительной реакцией бракуют, а их номера отмечают в журнале. По данным визуальной и серологической оценок растений, выращенных из глазков (индексов), проводят браковку клонов. По результатам оценки бракуют целиком все клоны, номера которых совпадают с номерами выбракованных растений в теплице.
Задания для самостоятельной работы.
1. Ознакомиться с методикой и техникой визуальной диагностики вирусных болезней, учитываемых в семеноводстве картофеля, и получить практические навыки.
2. Ознакомиться с методикой и техникой проведения анализов по диагностике болезней в скрытой форме и получить практические навыки.
3. Получить практические навыки по освоению методов иммуноферментного анализа и метода индексации.
Еще два десятилетия назад методы диагностики инфекций у растений были довольно трудоемкими и занимали много времени. Использование растений-индикаторов для идентификации вирусов, специальных сред для выявления бактерий и другие традиционные методы анализа занимали дни, а, в ряде случаев, недели и месяцы.
Основной прорыв произощел с внедрением в диагностику метода иммуно-ферментного анализа (ИФА), одним из наиболее распространенных вариантов которого является так называемый ELISA-тест (Enzyme-Linked Immunosorbent Assay, ELISA). Метод позволил не только увеличить чувствительность анализа, но и сократить время тестирования до нескольких часов. ELISA и по сей день является наиболее распространенным и широко используемым методом анализа растительного материала для диагностики и идентификации патогенов. При постановке ИФА тестов используется целый ряд технологий и модификаций с использованием биотиниликованных и конъюгированных с щелочной фосфатазой или пирофосфотазой антител в так называемых прямом методе, двойном и тройном сандвичах и др.
Диагностика фитопатогенов методом ИФА хорошо зарекомендовала себя в широкомасштабных рутинных тестированиях растительного материала, однако метод обладает не всегда удовлетворительной специфичностью, диагностируя зачастую не отдельные патогены, а целые группы и не позволяет четко идентифицировать конкретные изоляты и штаммы. Следует иметь в виду и тот факт, что от партии к партии качество и специфичность получаемых антител может довольно существенно разниться. В настоящее время специфичность ИФА в значительной степени увеличена за счет использования моно-клональных и рекомбинантных антител. Использование модификации метода ИФА - процедуры иммуноферментного анализа отпечатков образцов растительных тканей на нитроцелдюлозной мембране (tissue print-ELISA) - также обеспечивает высокую специфичность, хотя чувствительность этого метода недостаточна для использования в случае детекции ряда латентных бактериальных инфекций.
Дрзтим серологическим методом, применяемым для диагностики фитопатогенов, в частности бактерий, является метод проточной фотометрии (Alvarez, 2001), хотя высокая стоимость используемой в этой процедуре аппаратуры существенно ограничивает его использование в реальной практике.
В настоящее время при анализе растительного материала возникает необходимость применения высокочувствительных и специфичных методов детекции, позволяющих диагностировать патогены в низкой концентрации, что особенно важно в случае контроля растительного материала на наличие карантинных патогенов. Поэтому в помощь, а сегодня все чаще на смену традиционным и серологическим методам, в практику контроля фи-тосанитарного состояния сельскохозяйственных растений и продуктов их переработки приходят молекулярные технологии. Это позволяет значительно повышать специфичность анализов и обеспечивать чувствительность, в 10 - 100 раз превышающую чувствительность ИФА.
Современный метод высокоэффективного тестирования патогенов, в том числе и фитопатогенов, основан на полимеразной цепной реакции (ПЦР) (Bartlett, Stirling, 2003). Простота, высокие чувствительность и специфичность, хорошая воспроизводимость результатов анализов быстро превратили этот подход в один из наиболее перспективных диагностических методов. В отличие от традиционных и серологических методов анализа, дающих только опосредованное свидетельство наличия инфекции (например, сведения о наличие белков-антигенов диагностируемых патогенов), метод ПЦР напрямую доказывает присутствие возбудителя инфекции, специфически выявляя наличие конкретной последовательности нуклеиновой кислоты (ДНК или РНК) обнаруживаемого патогена. Кроме того, метод ПЦР, благодаря своей высокой чувствительности, позволяет выявлять единичные копии геномов патогенов, обнаруживая тем самым их наличие тогда, когда другими методами (иммунологическими, бактериологическими, микроскопическими) это сделать практически невозможно. Особенно эффективен метод ПЦР для диагностики трудно культивируемых, некультивируемых и скрыто существующих форм микроорганизмов, с которыми часто приходится сталкиваться при латентных и хронических инфекциях: ПЦР-технологии, как правило, позволяют избежать сложностей, связанных с выращиванием таких микроорганизмов в лабораторных условиях. Кроме того, использование метода ПЦР позволяет значительно сократить время анализа образца. За счет автоматизации процесс амплификации занимает всего 1 - 2 часа, а с учетом предшествующей пробоподготовки и регистрации результатов анализа, весь процесс занимает не более 4 часов. Помимо всего выше перечисленного, существенным достоинством метода является возможность осуществлять количественное определение возбудителя в модификации метода ПЦР в реальном времени.
Высокая чувствительность ПЦР является как преимуществом, так и недостатком метода, создавая ряд проблем, одной из которых является высокая вероятность появления ложноположитель-ных и ложноотрицательных данных. Кроме того, корректность проводимых ПЦР-тестов в значительной степени зависит от адекватности методов выделения нуклеиновых кислот из растительного материала; чувствительность детекции зависит от влияния присутствующих в растительном материале ингибиторов ПЦР.
Все это усложняет процедуру ПЦР-детекции, требуя постановки дополнительных контрольных тестов или использования модификаций метода ПЦР. При молекулярной диагностике фитопато-генных грибов, вирусов и бактерий применяют следующие модификации ПЦР: метод конкурентной ПЦР (Mauchline et al., 2002), кооперативной ПЦР (Co-PCR) (Olmos et al., 2002), ПЦР-гибри-дизация in situ с использованием флуоресцентных зондов (Lopez et al., 2003), мультиплексная ПЦР (Rigotti, Gugerli, 2007), метод множественной (или групповой) мультиплексной ПЦР (multiplex nested RT-PCR) (Morris et al., 2001, Ciapina et al., 2004), метод ПЦР в реальном времени (real-time PCR) (Norman et al, 2002).
Наиболее перспективным для диагностических лабораторий, проводящих рутинные анализы, являются методы ПЦР в формате FLASH (FLuorescent Amplification-based Specific Hybridization) (Лаптинов, 2004) или в формате реального времени (Norman et al., 2002). Оба формата основаны на флуоресцентной детекции продуктов амплификации. Оба формата позволяют регистрировать результаты ПЦР непосредственно во время (ПЦР в формате реального времени) или после проведения реакции (ПЦР в формате FLASH), без открывания пробирок, благодаря чему решается проблема контаминации помещения продуктами ПЩ', упрощаются требования к организации ПЦР-лаборатории, значительно снижается трудоемкость и время проведения стадии детекции. Методы обеспечивают также возможность простой и эффективной документации и хранения результатов ПЦР в компьютерной базе данньгх. Следует отметить, что ПЦР в формате реального времени требует довольно дорогого оборудования, тогда как стоимость оборудования для ПЦР в формате FLASH сопоставима с оборудованием для гель-электрофореза и в 5 - 8 раз дешевле оборудования для ПЦР в реальном времени.
Другим примером применения молекулярных методов для диагностики фитопатогенов, основанных на ПЦР и включающих гибридизацию, является весьма перспективный, но пока только развивающийся метод биочипов (Schultz, 1996). Преимущества использования биочипов состоят в следующем: биочип дает возможность проведения множественного параллельного исследования биологических объектов (тысячи ячеек на 1 см 2 ); он миниатюрен, что обеспечивает удобство эксплуатации, экономию реактивов и т д.; биочип универсален и дешев, так как одна технологическая схема обеспечивает производство различных микрочипов; в биочипе можно использовать в качестве иммобилизованных зондов
фрагменты ДНК, РНК, белков (с сохранением ферментативных и антигенных свойств), а также клеток - биосенсоров.
Резюмируя вышесказанное, следует отметить, что современные, доступные для широкого круга потенциальных потребителей технологии диагностики и идентификации фитопатогенов базируются, в основном, на двух технологиях - ИФА и ПЦР, которые постоянно совершенствуются в плане чувствительности, надежности и простоты применения. Кроме того, в настоящее время существует тенденция использования комплекса методов (ring tests), включающих как традиционные (микроскопия, избирательные среды, патогенность и т.п.), так и современные серологические и молекулярные тесты. Диагностика фитопатогенов, как собственно и любых других объектов, приобретает черты динамичной и постоянно эволюционирующей системы.
Метод визуальной диагностики
В большинстве случаев определить вирусную природу болезни не трудно. Обычно ее определяют по внешним признакам, таким как линейные хлоротичные узоры или кольцевые узоры на молодых листьях. Однако, их идентификация часто затруднена, так как вирусы имеют бессимптомный (латентный) характер развития. Симптоматика зависит от состояния организма, агрессивности штамма патогена, внешних условий и продолжительности пребывания вируса или вироида в клетках хозяина. Например, симптомы заболевания отчетливо выражены у растений, росших на ярком свету и при умеренной температуре, при высокой температуре и недостаточном освещении симптоматика заболевания может быть совсем не выражена.
Посветление жилок самых молодых листьев нередко является одним из первых признаков системной вирусной инфекции. Жилки становятся жёлтыми и полупрозрачными. Листья, образующиеся позже, могут быть мозаичными, крапчатыми или совсем жёлтыми (хлоротичными).
Инкубационный период заболевания зависит от вида вируса, растения-хозяина и условий среды, но в любом случае он составляет несколько дней или недель.
Если первые симптомы вироза заметны на рассаде, то источник инфекции находился либо в семенах, либо заражение произошло при посредстве переносчика. Если заражённые растения расположены в культуре совершенно случайно или же только в рядках, посаженных из одной партии, то это говорит о том, что, скорее всего, был заражен посадочный материал. Если на отдельных участках поля обнаруживаются заболевшие растения, причём появление заражённых участков связано с почвенными различиями, имеются все основания предполагать распространение вирусов через почву.
Следует отметить также, что существуют симптомы, свойственные вирозам, но вызванные другими причинами (поражения фитоплазмами, некоторыми бактериями и сосущими вредителями). К появлению симптомов, сходных с вирусной инфекцией, часто приводят нарушения минерального питания, например, связанные с дефицитом железа (рис. 1). Различные деформации органов могут вызывать регуляторы роста и гербициды различной природы (рис. 2).
Таким образом, при помощи метода визуальной диагностики, точной идентификации по внешним признакам поражения вирусами и вироидами невозможна, однозначный ответ может быть получен только с использованием инструментальных методов (иммуноферментный анализ, ПЦР-анализ и т. д. ).
Метод индикаторный растений
Метод индикаторных растений — является очень распространенным методом диагностики вирусных и вироидных болезней и идентификации их возбудителей. В основу метода индикаторных растений положено использование растений-индикаторов, которые, в большинстве случаев дают четкие и специфичные симптомы, характерные для определённого вида патогена. Травянистые растения-индикаторы заражают механической инокуляцией соком, в результате заражение может проявляться в виде местных некрозов, изменением окраски и угнетением роста.
Для вируса аспермии томата в качестве индикатора используют молодые растения табака (Nicotiana glutinosa), для диагностики Х-вируса картофеля — амарант шаровидный (Gomphrena globosa). Для выявления заражённости томата вироидом веретеновидности клубней картофеля в качестве индикаторов используют скополию (Scopolia sinensis) или чувствительные сорта томата. В ряде случаев для заражения можно использовать отдельные изолированные листья растений-индикаторов. Соконепереносимые вирусы прививают на индикаторные растения различными методами. В редких случаях, чтобы для передачи вируса используют насекомых-преносчиков и растение-паразит повилику.
Серологически метод диагностики
Метод основан на реакции преципитации (образование осадка) между специфичными антителами и белками (антигенами) возбудителя заболевания. Метод серологической диагностики неприменим для идентификации вироидов из-за отсутствия белкового компонента, а также для ряда соконепереносимых вирусов со слабыми иммуногенными свойствами. Для идентификации вирусов в растении могут использоваться следующие модификации серологической диагностики:
1) Иммуноферментный анализ (ИФА) — наиболее высокочувствительный метод, который позволяет получать количественные оценки. В его основе лежит специфическое распознавание поверхностных антигенов вируса антителами, в присутствии ферментов. Данный метод широко используется на практике для идентификации вирусов сельскохозяйственных культур, подходит для серийных анализов.
2) Капельный метод. Проводится следующим образом. На предметном стекле каплю сока растения смешивают с каплей антисыворотки. Через пару минут проводят оценку реакции под микроскопом при малом увеличении в темном поле или даже визуально, без микроскопа.
3) Метод двойной диффузии — проводится в агаровом геле, для определения сферических и других мелких вирусов. Проводится по такой методике, в одни лунки, которые вырезаны в слое агаровой среды, добавляют антисыворотку, а в другие – очищенный сок растения. В геле вирусные частицы и антитела дифундируют друг другу на встречу, и в месте встречи образуют отчетливые линии преципитации в случае их комплиментарной специфичности.
4) Метод радиальной иммунодиффузии. При использовании данного метода антисыворотку добавляют непосредственно в агаровую среду, при этом лунки заполняют соком растений. Реакция является положительной, если вокруг лунок образуются преципитаны в форме колец.
5) Метод адсорбции. Метод основан на том, что перед реакцией с антигеном антитела связывают каким-либо инертным материалом с крупными частицами, например, латексом. При реакции с антигеном происходит хорошо заметная агглютинация всего комплекса.
Метод электронной микроскопии
На ультратонких срезах пораженных тканей растений, при помощи электронных микроскопов можно определить строение, форму и даже размеры вирусов или вироидов. Электронный микроскоп нередко используют в сочетании с серологическими методами (иммуноэлектронная микроскопия), при этом можно обнаруживать вирусные частицы с наслоившимися антителами. Метод электронной микроскопии используется крайне редко из-за высокой стоимости оборудования и реактивов, сложности выделения вирусов и вироидов, окисления срезов растений и ряда других факторов.

Электронный микроскоп фото
Метод электрофореза
Этот метод основан на разделении предварительно очищенных нуклеиновых кислот вируса (вироида) или его белков в геле под действием электрического тока, с последующим окрашиванием зон. Метод электрофореза позволяет определить массу и размеры вирусных или вироидных структур. Метод широко используют для визуального исследования конечного продукта полимеразной цепной реакции. Для регистрации полученных результатов делают фотографии геля в проходящем или отражённом свете.
Молекулярно-биологические методы основаны на знании строения молекулы РНК (ДНК) вируса или вироида. Наиболее распространённым тестом является амплификация (умножение) видоспецифичных последовательностей РНК в ходе полимеразной цепной реакции (ПЦР). Выделенные из исследуемых растений отдельные фрагменты РНК, специфичные только для одного вида или рода вирусов, многократно умножают с помощью ферментов в присутствии праймеров (соответствующих олигонуклеотидов). При этом их количество в конечном продукте реакции превышает исходное число копий выбранного фрагмента РНК в миллионы раз. Далее вирусные РНК (ДНК) обнаруживают методом электрофореза в геле или методом иммунофлуоресценции. Метод получает широкое распространение в практических вирусологических работах.
Метод ДНК-зондов также основан на принципе комплиментарности нуклеиновых кислот. Синтезируют специфичные зонды, которые гибридизуются только с определёнными нуклеотидными последовательностями РНК вируса или вироида. В зависимости от выбора зондов можно дифференцировать группы, виды и даже штаммы вирусов и вироидов.
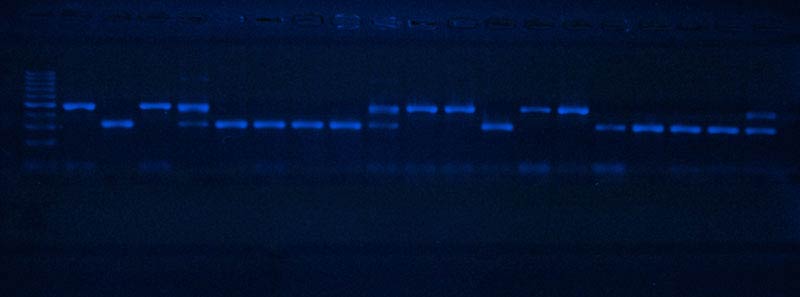
Электрофорез фото
Метод включений
В последствии развития вирусов, в клетках растений образуются скопления вирусных частиц, (включений), называемых кристаллами Ивановского, которые видны с помощью обычного светового микроскопа. Каждый вирус имеет свою форму вирусных включений, которые образуются, чаще всего, в клетках эпидермиса листьев или в клетках волосков. Например, вирус табачной мозаики имеет гексагональные и игловидные кристалы; Х-вирус картофеля типично образование сферических аморфных тел. Для выявления вируса зелёной крапчатой мозаики огурца, скручивания листьев картофеля и некоторых других применяют химические аналитические методы диагностики.
Читайте также:


