Иммунохроматографический анализ на вирусы
Из наблюдений и опыта тысячелетий, передававшегося из поколения в поколение, рождалось рациональное врачевание. Тот факт, что какие-либо случайно примененные средства или приемы приносили пользу, устраняя боль и т. п. Читать дальше


Вирусы - мельчайшие возбудители многочисленных инфекционных заболеваний человека и животных. Являются внутриклеточными паразитами, не способными к жизнедеятельности вне живых клеток. Читать дальше

Острые респираторные вирусные инфекции - большая группа заболеваний, которые очень широко распространены. В этой группе выделяются аденовирусная, парагриппозная, риновирусная и сиицитиально-вирусная инфекции.Читать дальше

Вирусы способны жить и развиваться только в клетках других организмов. Вне клеток живых организмов вирусы жить не могут, и многие из них во внешней среде имеют форму кристаллов. Читать дальше

В 19 веке выяснели, что пищевая ценность продуктов определяется содержанием в основном следующих веществ: белков, жиров, углеводов, минеральных солей .

Иммунология - молодой раздел науки, но уже первые результаты ее применения в профилактике и лечении открывают широкие перспективы .

Большое значение для внешнего облика человека имеет чистая, гладкая, приятного оттенка кожа лица. К сожалению, не всегда за ней обеспечен правильный уход .
Иммунохроматографический анализ
В современной медицинской практике с каждым годом возрастает роль лабораторной диагностики как основного инструмента постановки диагноза и мониторинга терапии. Одним из бурно развивающихся и востребованных методов лабораторной диагностики является иммунохроматографический анализ.
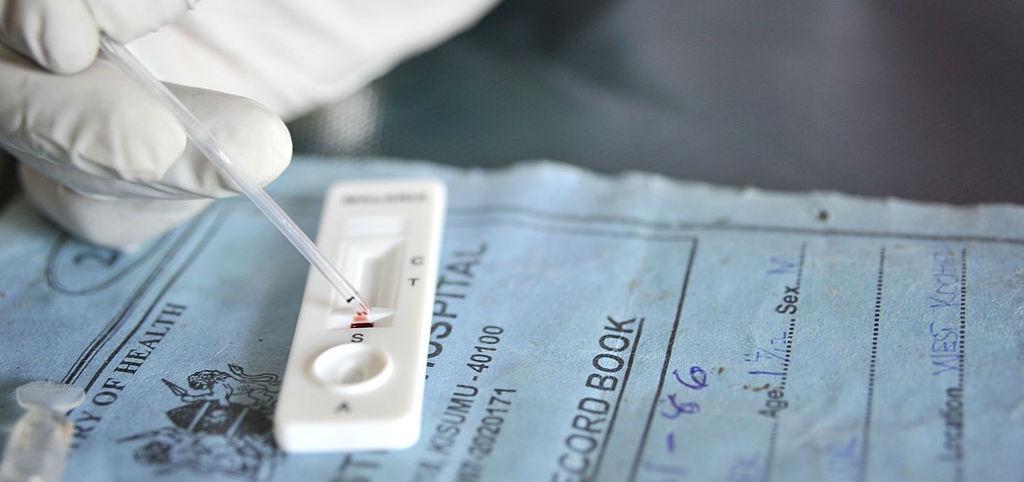
ИММУНОХРОМАТОГРАФИЧЕСКИЙ АНАЛИЗ (ИХА) - это метод определения наличия определенных концентраций веществ в биологических материалах (моча, цельная кровь, сыворотка или плазма крови, слюна, кал и т.д.). Данный вид анализа осуществляется при помощи индикаторных полосок, палочек, панелей или тест-кассет, которые обеспечивают быстроту проведения тестирования. ИХА - сравнительно молодой метод анализа, он часто обозначается в литературе также как метод сухой иммунохимии, стрип-тест, QuikStrip cassette, QuikStrip dipstick, экспресс-тест или экспресс-анализ. Эти названия связаны с быстротой проведения этого метода анализа.
Принцип действия иммунохроматографического теста состоит в том, что при погружении теста в физиологическую жидкость она начинает мигрировать вдоль полоски по принципу тонкослойной хроматографии. Подвижной фазой в данном случае является физиологическая жидкость. Вместе с жидкостью движутся и антитела с красителем. Если в этой жидкости присутствует исследуемый антиген (гормон, инфекционный или онкологический маркер), то происходит его связывание, как с первым, так и со вторым типом антител, что является уже иммунологическим методом анализа. При этом происходит накопление антител с красителем вокруг антител, жестко иммобилизованных в тест-зоне ИХА-полоски, что проявляется в виде яркой темной полосы. Несвязавшиеся антитела с красителем мигрируют далее вдоль полоски и неизбежно взаимодействуют со вторичными антителами в контрольной зоне, где и наблюдается вторая темная полоса. Взаимодействие (и темная полоса) в контрольной зоне должны проявляться всегда (если анализ проведен правильно), независимо от присутствия исследуемого антигена в физиологической жидкости (см.рис.1). Результаты определяются визуально или компьютерной обработкой отсканированного изображения.
1. Растворимые моноклональные антитела к исследуемому антигену или антителу, конъюгированные ("сшитые") с коллоидным золотом - красителем, который можно легко идентифицировать даже в самых малых концентрациях. Эти антитела нанесены вблизи участка погружения тест-полоски в физиологическую жидкость (мочу, кровь).
2. Поликлональные антитела к исследуемому антигену или антителу, жестко иммобилизованные в тест-зоне полоски.
3. Вторичные антитела к моноклональным антителам, жестко иммобилизованные в контрольной зоне тест-полоски.
Принцип работы тестов на наркотики несколько отличается от других тест-систем. Устройство ИХА-полоски отличается тем, что в тест-зоне иммобилизованы искусственные антигены, способные специфически связываться со свободными антителами. Если исследуемый антиген (наркотик) НЕ присутствует в физиологической жидкости, участки связывания антител (эпитопы) остаются свободными, и они способны связываться с искусственными антигенами в тест-зоне, образуя темную полосу за счет конъюгированного красителя. Соответственно если исследуемый антиген присутстствует в жидкости, то антитела, связавшись с ним, уже не могут взаимодействовать с антигенами в тест-зоне и образования темной полосы там не происходит. Но в обоих случаях (если анализ проведен правильно) происходит связывание "окрашенных" антител со вторичными антителами в контрольной зоне и образование там темной полосы. Возможные варианты при проведении анализа: одна полоса - положительный результат, две полосы - отрицательный результат, нет полос - анализ проведен неправильно.
Электропунктурная рефлексотерапия
Электропунктурная рефлексотерапия – метод рефлекторного лечения воздействием постоянного тока низкого напряжения на экстеро- и проприорецепторы зоны акупунктуры организма. По способу во .
Питание
Необходимо обеспечить парентеральное и, в ряде случаев, энтеральное питание. В ближайшие сутки с момента перенесенного терминального состояния начинаем восстанавливать нарушенную энергетику организ .
Полынь горькая
Заготовка сырья, первичная обработка и сушка. Заготавливают два вида сырья: траву и листья полыни горькой. Траву заготавливают в начале цветения в июне - августе, состоящую из цветущих облиственных .
Многие вирусы могут очень долго присутствовать в организме и циркулировать в крови, до поры до времени не вызывая никаких неприятностей. Однако это вовсе не значит, что они безопасны. Лабораторные анализы на вирусы позволяют выявить наличие последних, даже если никаких симптомов нет.
Анализы на вирусы: какие инфекции они выявляют
Для выявления вирусов лаборатории проводят исследования крови несколькими методами. Наибольшее распространение на сегодня получили ПЦР и иммуноферментный (ИФА) анализы.
Иммуноферментный анализ крови определяет наличие антител к вирусам (или антигенов к ним) в крови — иммуноглобулины (lgA, lgG, lgM) вырабатываются при заражении вирусами и являются своеобразными маркёрами инфекции.
Анализ на ДНК вируса, или ПЦР-исследование, позволяет выявить тип инфицирующего агента.
В качестве биоматериала для исследования обычно берут кровь. Анализ крови может подтвердить гепатит, герпес и вирус Эпштейна-Барра, аденовирус, различные половые инфекции (в том числе и сифилис), вирус иммунодефицита человека (ВИЧ) и другие инфекции. Однако кровь не единственный биоматериал, пригодный для выявления вирусных поражений. В зависимости от заболевания и симптомов, для анализа на вирусы сдают соскоб слизистой оболочки, кал, мочу, мазок, слюну.
Как мы уже отмечали, исследование крови на вирусы можно проводить двумя разными способами. Расскажем о них подробнее.
Иммуноферментный метод анализа на вирусы позволяет установить форму болезни, вызванной вирусом (хроническая, острая или бессимптомная), а также оценить эффективность противовирусной терапии. Это один из самых распространенных и точных методов для выявления половых инфекций, в частности ВИЧ и ВПЧ, гепатита В.
Для анализа на вирусы чаще всего сдается кровь. Обязательно предупредите врача, если вы недавно проводили вакцинацию, — этот факт может отразиться на точности анализов. Рекомендуется не принимать пищу на протяжении 8-ми часов перед забором биоматериала, а также воздержаться от употребления алкоголя и от курения.
Время ожидания результатов зависит от типа вируса, на который проводится анализ, и от методики работы лаборатории. Обычно результаты готовы через 1–3 дня, но иногда приходится ждать и 2 недели.
Рассказать о том, каким образом следует трактовать результаты анализов на все виды вирусов, в рамках одной статьи невозможно. Далее мы поговорим лишь о наиболее известных заболеваниях и о часто назначаемых исследованиях.
В случае проведения анализа методом ИФА наличие IgG в крови на гепатит говорит о том, что этот вирус в организме присутствовал, но иммунная система выработала к нему антитела. Присутствие одновременно антител класса IgM и IgG говорит о заболевании в острой форме. Иммуноглобулины только класса IgM — признак первичного инфицирования.
При проведении исследования методом ПЦР определяется РНК вируса. Результаты могут быть приведены в следующем формате:
- РНК вируса не выявлена.
- РНК вируса выявлена в концентрации ниже предела количественного определения (менее15 МЕ/мл). Сомнительный результат.
- РНК вируса гепатита С выявлена (от 15 и выше 100000000 МЕ/мл).
Для выявления этого вируса гепатита чаще всего назначается ИФА. Если в крови присутствуют антитела IgG и IgM, это значит, что вирус очень активен или же заражение произошло недавно.
В случае проведения ПЦР-анализа определяется концентрация фрагментов ДНК вируса гепатита В. Пациент получает результат с одной из приведенных трактовок:
- Не обнаружено.
- Сомнительный результат (результат положительный с концентрацией ДНК вируса гепатита В на границе точности метода).
- Обнаружено.
Если говорить о трактовке ИФА, то наличие антител, обозначаемых как Anti-HSV-IgG, говорит не об иммунитете к вирусу, а о том, что вы уже были когда-то инфицированы. Этот маркёр наблюдается у большинства пациентов. Если показатель anti-HSV-IgG в пробах, взятых в динамике за 2-недельный период, заметно растет, это значит, что заражение произошло недавно. О рецидиве говорит высокий показатель IgG.
Расшифровка анализа крови на ВИЧ очень проста — если результат отрицательный, это значит, что вирус не обнаружен, если положительный — увы, вирус в крови есть. Но следует знать, что сегодня даже самые надежные методы точны лишь на 98–99%, то есть всегда остается шанс, что результат будет, например, ложноположительным.
При анализе на аденовирус, вызывающий респираторные заболевания, применяется в основном ИФА. В ходе анализа подсчитываются IgG-антитела. Если показатель менее 0,8 условных единиц — результат отрицательный, более 0,8 — положительный.

Не пренебрегайте профилактическими анализами на вирусы. Раннее выявление инфекции позволяет отсрочить или подавить развитие заболевания. В случае же беременности сдача биоматериала на анализ с целью выявления вирусных инфекций является обязательной процедурой. Поводом для прохождения исследования также может стать повышенный уровень лейкоцитов в крови, сдвиг лейкоцитарной формулы, увеличение количества нейтрофилов (палочкоядерных), миелоцитов и метамиелоцитов, снижение числа лимфоцитов при высокой СОЭ в результатах клинического анализа крови.
Что представляет собой иммунохроматографический анализ (ИХА)? Разберемся подробнее в этом вопросе.
ИХА – иммунохимический способ анализа, который основан на методе тонкослойной хроматографии. Он включает реакцию между соответствующим антителом и антигеном в биологических материалах. Осуществляется посредством особых тест-полосок, тест-кассет или панелей. ИХА – это экспресс-тест.
Сущность данного метода исследования
Действие его основывается на том, что при погружении в биологическую жидкость (либо другой жидкий образец) теста она начинает двигаться вдоль полоски по методу тонкослойной хроматографии. Движутся вместе с ней нанесенные на нее специфические меченые антитела, которые связываются аффинно с анализируемым компонентом.
Различаются два формата анализа: прямой и конкурентный метод.
Прямой метод
В формате сэндвичного (прямого) иммунохроматографического анализа крови используется конъюгат антитела-метки, который наносится для конъюгата на мембрану. Иммобилизованные антитела на полоске, обладающие конкретным аналитом, на контрольной линии – антитела антивидовые, специфические к антителам первичным.

Прямой ИХА применяется для определения возбудителей инфекционных патологий, вирусов – высокомолекулярных соединений, включая разные гормоны, ВИЧ.
Конкурентный метод исследования
Способ конкурентного иммунохроматографического анализа применяется для установления низкомолекулярных соединений. Основан он на конкуренции иммобилизованного конъюгата аналит и аналита: носитель-белок за ограниченное число центров связывания периферических антител, которые содержатся в конъюгате Ат-метка. Когда наносится образец, содержащий аналит, то последний связывается на мембране с конъюгатом с конъюгатом Ат-метка. Иммунокомплекс в дальнейшем проходит через тестовую зону, в которой иммобилизуется конъюгат аналит, то есть белок-носитель.
С этим конъюгатом не может связаться иммунокомплекс из-за стерических сложностей: низкомолекулярные соединения чаще всего обладают одной антигенной детерминантой, таким образом, у иммуноглобулинов есть один центр связи с антигеном, который уже занят до этого аналитом. Иммунный комплекс впоследствии связывается антивидовыми иммуноглобулинами, которые находятся на контрольной линии. Если в тестовой области отсутствует окрашенная полоса и есть окраска в контрольной зоне, это говорит о том, что содержание определяемого компонента в исследуемом образце выше порогового значения для такого теста. Если в аналите отсутствует анализируемое вещество в образце, то происходит связь конъюгата Ат-метка с конъюгатом Аг: носитель-белок, иммобилизованный в области тестовой линии. Ат-метка свободный конъюгат попадает в сферу контрольной линии, где связывается с антивидовыми антителами. Если есть две окрашенные линии (контрольная и тестовая), то можно говорить об отрицательном результате теста.

Метод конкурентного ИХА применяется для определения низкомолекулярных соединений, включая тканевые экстракты.
Преимущество такого способа – легкость и быстрота использования, возможность применения неприборных методов ИХА с оценкой результата визуально. Не требуется дополнительное оборудование, и анализ может провести человек без медицинского образования в любое время.
Какие применяются метки в ИХА?
В иммунохроматографическом анализе в качестве меток применяются разные частицы и вещества.
- Красители (частицы крашеного латекса, или наночастицы углерода, или коллоидного золота). Такой вариант позволяет визуально отслеживать результат или определить колориметрическим прибором. Применение красящих меток, которые присоединяются к носителю, позволяет делать мультианализ, где разноцветные линии соответствуют разным аналитам. Используемой меткой чаще всего выступают наночастицы золота коллоидного.

- Связанные ковалентно с латексными частицами биолюминесцентные, фосфоресцентные и флуоресцентные метки. Применяются лишь в приборных способах ИХА, в которых регистрируется результат особым ридером. Наиболее распространенными являются флуоресцентные метки.
- Парамагнитные метки, закрепленные на латексных частицах. Метод применяется в ИХА с использованием приборов, которые регистрируют силу магнитного поля.
- Липосомы, используемые в качестве носителей разных меток (электроактивных, ферментативных, флуоресцентных, красящих и т. д.) Это новое направление среди разновидностей анализа.
- Ферментные метки, применяемые по принципу ИФА. Регистрация реакции проводится посредством окрашивания субстратов. В итоге получается визуальный результат, либо считывается ридером.
Преимущества данного метода исследования
Главными преимуществами применения метода иммунохроматографического анализа становятся:
- Удобство и простота – позволяет получить результат (первичное представление и анализ причины болезни) без специальных навыков и оборудования.
- Надежность – достоверность тестов достигает 99,8 %, каждый тест при этом имеет внутренний встроенный контроль.
- Анонимность – это особенно важно при определении болезней, передаваемых половым путем, прочих инфекционных болезней, а также установлении употребления наркотических веществ.
- Экономичность – приобрести тест может каждый, экономится время на проведение анализа.
- Независимость – не нуждается в предварительной консультации и рецепте врача.

Тест на наркотики как проводится: особенности и недостатки ИХА-метода
Самой популярной услугой становится анализ мочи на наркотики посредством метода иммунохроматографического анализа. Это позволяет исследовать мочу на 14 видов нарковеществ.
Иммунохроматографический анализ на наркотики также считается экспресс-методом диагностики. Результат теста можно узнать спустя 15 минут. Для проведения данного исследования используют особые тест-полоски, которые пропитаны веществами-индикаторами. Если в моче имеются следы наркотического вещества, цвет полоски меняется. Основной недостаток такого анализа – невозможность определить, какова концентрация вещества и степень наркотического опьянения, таким образом, результаты иммунохроматографического анализа в качестве доказательства в суде использовать не получится.
Каков результат такого анализа?
Если на индикаторах появились две розовые полосы, то делается заключение, что в моче не содержится наркотик, или же его концентрация недостаточна для определения иммунохроматографическим методом. При возникновении одной розовой полосы можно говорить о наличии наркотического вещества: марихуаны, производных эфедрона, опиатов, производных барбитуровой кислоты, амфетаминов, кокаина, фенциклидина, бензодиазепинов, экстази.

Какие можно сделать выводы?
Иммунохроматографический анализ (экспресс-тест) является эффективным средством диагностики, он позволяет визуально на протяжении нескольких минут выявить и оценить концентрацию антигенов, гормонов, антител и других диагностически важных компонентов в человеческом организме. Экспресс-тесты имеют высокую степень точности и чувствительности, обнаруживается более ста видов болезней, а также весь спектр наркотических веществ, и достоверность анализа очень высокая.
ИХА (предложен в начале 1980-х гг.) можно отнести к группе реакций с мечеными антителами. В качестве метки используют окрашенный латекс или частицы коллоидного золота.
Типичный тест представляет собой пластиковую пластинку и содержит окно для внесения материала, окно для учета результата и одно или несколько окон для внутреннего контроля/контролей (рис. 15).
В реакции используют:
· первые антитела к искомому антигену, иммобилизованные в виде полосы на хроматографическом носителе в окне для учета результата (выше окна для внесения материала);
· вторые антитела к тому же антигену, адсорбированные на микрочастицах золота или латекса (размещаются в окне для внесения материала).
Внутренний контроль/контроли включают:
· выявляемый антиген, нанесенный после окна для учета результата (положительный контроль, контроль протекания всех этапов основной реакции);
· антивидовые антитела против вторых (меченых) антител, закрепленные в виде полосы на носителе (отрицательный контроль, контроль переноса ингредиентов по носителю, адекватность внесения материала);
· неспецифические первые антитела (того же происхождения) (контроль специфичности связывания вторых антител).
Постановка теста на примере системы для диагностики инфекционного мононуклеоза(рис. 16):
Подготовленный исследуемый материал в небольшом количестве (5-7 капель) вносится в стартовое окно тест-системы. Здесь происходит взаимодействие антигена с антителами, адсорбированными на частицах, и начинается движение образовавшихся комплексов за счет капиллярности носителя. Дойдя до антител, расположенных на носителе в окне учета результата, эти комплексы связываются, при этом частицы латекса или коллоидного золота проявляются в виде линии голубого (латекс) или (коричневого) цвета. Поскольку частицы, нагруженные, антителами берутся в избытке, часть их движется дальше и связывается в окне (окнах) внутреннего контроля реакции. Полоса в этом окне свидетельствует о правильной работе тест-системы.
В настоящее время разработаны тест-системы для установления овуляции и беременности, выявления стрептококков группы А в мазках из зева, вирусов грипа А и В и РС-вируса в соскобах и смывах из носоглотки, возбудителей туберкулеза в мокроте, хламидий в соскобах из уретры и шейки матки, токсина C.dificile в испражнениях, вируса Эпштейн-Барр в крови, определения маркеров повреждения миокарда (инфаркт миокарда), патологического свертывания крови (тромбоз), нарушения обмена кальция (остеопороз) и др.
ИХА может использоваться как для экспресс-индикации антигенов в пробе, так и для идентификации выделенных культур. Например, ИХА позволяет проводить обнаружение листерий в исследуемом материале непосредственно в среде обогащения, без выделения чистой культуры. Это позволяет сократить время исследования до 48 часов.
Таким образом, ИХА тест-системы обладают несомненными достоинствами:
· скоростью получения результата,
· доступны, легко интерпретируются,
· не требуют медицинской или лабораторной квалификации,
· могут применяться пациентами самостоятельно в любых условиях.
Однако по чувствительности ИХА системы уступают другим методам иммуноанализа, что позволяет применять их лишь в качестве ориентировочного теста. Существует также проблема документирования результатов и ряд этических проблем, связанных с самостоятельным применением тестов пациентами.
Антитела. Методы. В 2-х кн. Кн. 2: Пер. с англ./Под ред. Д.Кэтти. – М.: Мир, 1991. – 384 с.
Иммуноферментный анализ: Пер. с англ./Под ред. Т. Нго и Г. Ленхоффа.- М.: Мир, 1988. – 446 с.
Манолов А. Твердофазные радиоиммунные методы для количественного экспресс-анализа в микробиологии //ЖМЭИ, 1985, N:4, с.100-107.
Теория и практика иммуноферментного анализа/ А.М. Егоров, А.П. Осипов, Б.Б. Дзантиев, Е.М. Гаврилова – М.: Высш. шк., 1991. – 288 с.
Тертон М., Бангхем Д.Р., Колкотт К.А. и др. Новые методы иммуноанализа: Пер с англ. – М.: Мир, 1991. – 280 с.
Birjis Chinoy, Edgar Yee, Sami L Bahna Skin testing versus radioallergosorbent testing for indoor allergens//Clinical and Molecular Allergy2005, 3:4.
C. Harwanegg, R. Hiller Protein microarrays for the diagnosis of allergic diseases: State-of-the-art and future development// J Lab Med 2005, 29(4): 272–277.
C. L. Morgan, D. J. Newman, C. P. Price Immunosensors: technology and opportunities in laboratory medicine//Clinical Chemistry 1996,42:2.- P.193-209.
Clinical chemistry, 1990,36/8, 1408-1427.
Immunoassay of infectious agents/ P. E. Andreotti, G. V. Ludwig, A. H. Peruski //BioTechniques 2003,35: P. 850-859.
J. P. GoslIng A Decade of Development in Immunoassay Methodology// Clinical Chemistry, 1990, Vol.36, No. 8, P. 1408.
L. J. Kricka Miniaturization of analytical systems//Clinical Chemistry, 1998,44:9, P. 2008–2014.
L. J. Kricka Selected Strategies for Improving Sensitivity and Reliability of Immunoassays//Clinical chemistry, 1994, 40/3, P. 347-357.
Immunochemical staining methods / S.J.Naish, T.Boenisch, A.J.Farmilo, R.H.Stead//DAKO Corporation, Carpinteria, California, 1989. – P.41.
Microarrayed recombinant allergens for diagnostics of allergy/Harwanegg C., Laffer S., Hiller R et al. //Clin. Exp. Allergy 2003, 33: 7- 13.
R Spiewak ELISpot: Principles of the technique//www.ELISpot.biz
R. P. EkinsLigand assays: from electrophoresis to miniaturized microarrays//Clinical Chemistry, 1998; 44: 2015-2030.
Radioallergosorbent Test (RAST) Methods for Allergen-Specific Immunoglobulin E (IgE) 510(k)s; Final Guidance for Industry and FDA / U.S. Department of Health and Human Services Food and Drug Administration;Center for Devices and Radiological Health.- August 22, 2001.
Radioimmunometric Assay for a Monoclonal Antibody-Defined Tumor Marker, CA 19-9/ Villano B. C., Brennan S., Bucher C. et al.// Clinical Chemistry,1983, Vol. 29, No. 3, 1983 549-552.
| Введение |
| 1. Методы иммуноанализа с применением радиоактивной метки |
| 1.1. Радиоиммунный анализ (РИА) |
| 1.2. Иммунорадиометрический анализ (ИРМА) |
| 2. Методы иммуноанализа с применением флуоресцентной метки |
| 2.1. Реакция иммунофлуоресценции (РИФ) |
| 2.2. Флуоресцентный иммуноанализ с временным разрешением (ФИА ВР) |
| 2.3. Проточная цитофлуориметрия |
| 3. Методы иммуноанализа с применением ферментной метки |
| 3.1. Иммуноферментный анализ (ИФА) |
| 3.1.1. Гетерогенные методы иммуноферментного анализа |
| Гетерогенный твердофазный ИФА (ELISA) |
| Элиспот (ЭС, ELIspot) |
| Иммуноблот (ИБ, вестернблот) |
| Иммуногистохимия, иммуноцитохимия (ИГХ) |
| 3.1.2. Гомогенные методы иммуноферментного анализа |
| 4. Люминесцентный иммуноанализ (ЛИА) |
| 4.1. Биолюминесцентный иммуноанализ |
| 4.2. Хемолюминесцентный иммуноанализ |
| 5. Некоторые перспективные технологии иммуноанализа |
| 5.1. Иммуносенсоры (ИС) |
| 5.2. Микроэррей (МЭ) |
| 5.3. Иммунохроматографический анализ (ИХА) |
| Список литературы |
Черношей Дмитрий Александрович, Канашкова Татьяна Александровна
В современной медицинской практике с каждым годом возрастает роль лабораторной диагностики как основного инструмента постановки диагноза и мониторинга терапии. Одним из бурно развивающихся и востребованных методов лабораторной диагностики является иммунохроматографический анализ.
ИММУНОХРОМАТОГРАФИЧЕСКИЙ АНАЛИЗ (ИХА) - это метод определения наличия определенных концентраций веществ в биологических материалах (моча, цельная кровь, сыворотка или плазма крови, слюна, кал и т.д.). Данный вид анализа осуществляется при помощи индикаторных полосок, палочек, панелей или тест-кассет, которые обеспечивают быстроту проведения тестирования. ИХА - сравнительно молодой метод анализа, он часто обозначается в литературе также как метод сухой иммунохимии, стрип-тест, QuikStrip cassette, QuikStrip dipstick, экспресс-тест или экспресс-анализ. Эти названия связаны с быстротой проведения этого метода анализа.
Принцип действия иммунохроматографического теста состоит в том, что при погружении теста в физиологическую жидкость она начинает мигрировать вдоль полоски по принципу тонкослойной хроматографии. Подвижной фазой в данном случае является физиологическая жидкость. Вместе с жидкостью движутся и антитела с красителем. Если в этой жидкости присутствует исследуемый антиген (гормон, инфекционный или онкологический маркер), то происходит его связывание, как с первым, так и со вторым типом антител, что является уже иммунологическим методом анализа. При этом происходит накопление антител с красителем вокруг антител, жестко иммобилизованных в тест-зоне ИХА-полоски, что проявляется в виде яркой темной полосы. Несвязавшиеся антитела с красителем мигрируют далее вдоль полоски и неизбежно взаимодействуют со вторичными антителами в контрольной зоне, где и наблюдается вторая темная полоса. Взаимодействие (и темная полоса) в контрольной зоне должны проявляться всегда (если анализ проведен правильно), независимо от присутствия исследуемого антигена в физиологической жидкости (см.рис.1). Результаты определяются визуально или компьютерной обработкой отсканированного изображения.
1. Растворимые моноклональные антитела к исследуемому антигену или антителу, конъюгированные ("сшитые") с коллоидным золотом - красителем, который можно легко идентифицировать даже в самых малых концентрациях. Эти антитела нанесены вблизи участка погружения тест-полоски в физиологическую жидкость (мочу, кровь).
2. Поликлональные антитела к исследуемому антигену или антителу, жестко иммобилизованные в тест-зоне полоски.
3. Вторичные антитела к моноклональным антителам, жестко иммобилизованные в контрольной зоне тест-полоски.
Принцип работы тестов на наркотики несколько отличается от других тест-систем. Устройство ИХА-полоски отличается тем, что в тест-зоне иммобилизованы искусственные антигены, способные специфически связываться со свободными антителами. Если исследуемый антиген (наркотик) НЕ присутствует в физиологической жидкости, участки связывания антител (эпитопы) остаются свободными, и они способны связываться с искусственными антигенами в тест-зоне, образуя темную полосу за счет конъюгированного красителя. Соответственно если исследуемый антиген присутстствует в жидкости, то антитела, связавшись с ним, уже не могут взаимодействовать с антигенами в тест-зоне и образования темной полосы там не происходит. Но в обоих случаях (если анализ проведен правильно) происходит связывание "окрашенных" антител со вторичными антителами в контрольной зоне и образование там темной полосы. Возможные варианты при проведении анализа: одна полоса - положительный результат, две полосы - отрицательный результат, нет полос - анализ проведен неправильно.
Основными преимуществами использования иммунохроматографических тест полосок являются:
1) Простота и удобство - позволяет получить результат (анализ и первичное представление о причине заболевания) без оборудования и специальных навыков
2) Надежность - достоверность тестов достигает 92-99,8%, при этом каждый тест имеет встроенный внутренний контроль
3) Экономичность - минимальные затраты на приобретение теста и экономия времени на проведение обследования. В рознице стоимость одного ИФА-исследования в 5-10 раз дороже ИХА и получение результата минимум на следующий день
4) Анонимность - что особенно важно при выявлении заболеваний, передаваемых половым путем, других инфекционных заболеваний, а также выявлении фактов употребления наркотических веществ
5) Независимость - не требует предварительной медицинской консультации и рецепта врача
Являясь эффективным средством диагностирования, экспресс-тесты позволяют визуально в течение нескольких минут определить и оценить содержание антигенов, антител, гормонов и других диагностически важных веществ в организме человека. Экспресс-тесты отличаются высокой степенью чувствительности и точности, обнаруживая более 100 видов заболеваний, включающих такие распространённые болезни как туберкулёз, сифилис, гонорею, хламидиоз, различные виды вирусных гепатитов, и др., а также всю гамму применяемых наркотических веществ при высокой достоверности определения. Важным преимуществом данного вида тестов является их применение в диагностике in vitro, не требующей непосредственного присутствия обследуемого пациента.
Однако иммунохроматографические тест-полоски не лишены недостатков. Касается это надежности, чувствительности и экономичности тестов. Надежность и чувствительность зависит, во-первых, от качества используемых в тесте моноклональных антител и, во-вторых, от концентрации антигена в биоматериале. Качество моноклональных антител зависит от способов их получения, очистки и фиксации на носителе. Концентрация антигена – от стадии заболевания и количества биоматериала. Количество биоматериала особенно важно при использовании цельной крови. При этом существенную роль играет гематокрит, т.е. соотношение плазмы и форменных элементов. При высоком гематокрите снижается количество плазмы с антигеном, мигрирующей вдоль полоски. Температура, от которой зависит скорость взаимодействие антитела с антигеном, важна только для времени постановки теста. Понятно, что использовать полоски при температуре ниже точки замерзания воды, составляющей основную часть биоматериала, не имеет смысла.
Вызывает большие сомнения экономичность использования экспресс-тестов в бюджетных медицинских организациях, которые занимаются массовой диспансеризацией населения и которым как раз-то удобны и необходимы комплексные стрип-системы из тест-полосок для скринингового выявления различных заболеваний. Обусловлено это низкой стоимостью анализа по бюджетным расценкам. При этом себестоимость тест-полоски в некоторых случаях в 10 раз превосходит оплату анализа.
1) Wennig R, Moeller MR, Haguenoer JM et al. (1998) Development and evaluation of immunochromatographic rapid tests for screening of cannabinoids, cocaine, and opiates in urine // J. Anal. Toxicol. - V.22 - P.148-155
2) Coons, S.J. A look at the purchase and use of home pregnancy-test kits. Am.Pharm. NS29:46-48, 1989.
3) Bastian, L.A., Nanda, K., Hasselblad, V., and Simel, D.L. Diagnostic efficiency of home pregnancy test kits. A meta-analysis. Arch.Fam.Med. 7:465-469, 1998.
4) Latman, N.S. and Bruot, B.C. Evaluation of home pregnancy test kits. Biomed.Instrum.Technol. 23:144-149, 1989.
5) Hicks, J.M. and Iosefsohn, M. Reliability of home pregnancy-test kits in the hands of laypersons [letter] [published erratum appears in N Engl J Med 1989 Jul 20;321(3):193] [see comments]. N.Engl.J.Med. 320:320-321, 1989.
6) Torlesse, H., Wurie, I.M., and Hodges, M. The use of immunochromatography test cards in the diagnosis of hepatitis B surface antigen among pregnant women in West Africa. Br.J.Biomed.Sci. 54:256-259, 1997.
7) Sato, K., Ichiyama, S., Iinuma, Y., Nada, T., Shimokata, K., and Nakashima, N. Evaluation of immunochromatographic assay systems for rapid detection of hepatitis B surface antigen and antibody, Dainascreen HBsAg and Dainascreen Ausab. J.Clin.Microbiol. 34:1420-1422, 1996.
8) Lein, M., Jung, K., Schnorr, D., Henke, W., Brux, B., and Loening, S.A. Rapid screening of PSA: evaluation of an immunochemical membrane strip test [letter]. Clin.Chem. 41:1545-1547, 1995.
9) Anderson, J.C., Cheng, E., Roeske, M., Marchildon, P., Peacock, J., and Shaw, R.D. Detection of serum antibodies to Helicobacter pylori by an immunochromatographic method. Am.J.Gastroenterol. 92:1135-1139, 1997.
10) Schrier, W.H., Schoengold, R.J., Baker, J.T., Norell, J.L., Jaseph, C.L., Okin, Y., Doe, J.Y., and Chandler, H. Development of FlexSure HP--an immunochromatographic method to detect antibodies against Helicobacter pylori. Clin.Chem. 44:293-298, 1998.
11) Cognein, P., Costa, A., and Giacosa, A. Serodiagnosis of Helicobacter pylori: evaluation of a rapid, miniaturized immunochromatographic test. Eur.J.Cancer.Prev. 3:457-463, 1994.
12) Shirin, H., Bruck, R., Kenet, G., Krepel, Z., Wardi, Y., Reif, S., Zaidel, L., Geva, D., Avni, Y., and Halpern, Z. Evaluation of a new immunochromatographic test for Helicobacter pylori IgG antibodies in elderly symptomatic patients [see comments]. J.Gastroenterol. 34:7-10, 1999.
13) Kagen, L. J. 1973 Myoglobin: Biochemical, physiological and clinical aspects. New York and London Colombian University Press.
14) Drexel, H. et al. 1983 Myoglobinaemia in the early diagnosis of acute myocradial infarction. A m. Heart J. 105: 642-651.
15) McComb, J. M. et al. 1983 Myoglobin in the very early phase of acute myocardial infaretion. Ann Clin. Biochem, 22:152-155.
16) Grenardier, E., Keidar, S., Kahana, L., Alpan, G., Marmur, A., Palant, A. 1983 The roles of serum myoclobin, total CPK, and CK-MB isoenzyme in the acute phase of myocardial infarction. Am. Heart J. 105:408-416.
Читайте также:



