Иммунохроматографический метод выявления вирусов

Назначение
Краткая информация
Возбудителем гриппа является вирус, который поражает, главным образом, верхние дыхательные пути – нос, горло, бронхи, реже – легкие. Заболевание обычно длится одну-две недели и характеризуется высокой температурой, миалгией, головной болью, недомоганием, сухим кашлем, болью в горле и ринитом.
Для детей, пожилых людей и людей, страдающих заболеваниями легких, почек, сердца, диабетом, раком, грипп представляет серьезную опасность. Эта инфекция может вызвать осложнения основных заболеваний, пневмонию и смерть.
Заболевание человека вызывают, как правило, два типа гриппа – тип А (подтипы H3N2 и H1N1) и тип В. Причиной смертей от гриппа чаще всего является вирус А подтипа H3N2.
Принцип метода
Определение основано на принципе иммунохроматографического анализа. Анализируемый образец жидкого биологического материала абсорбируется поглощающим участком тест-полоски. При наличии в образце вируса гриппа А и/или вируса гриппа В они вступают в реакцию с нанесенными на стартовую зону специфическими моноклональными антителами против вируса гриппа А и специфическими моноклональными антителами против вируса гриппа B, меченными окрашенными частицами, и продолжают движение с током жидкости. В соответствующих аналитических зонах тест-полоски происходит взаимодействие со специфическими моноклональными антителами против вируса гриппа А и/или вируса гриппа В, иммобилизованными на поверхности мембраны, с образованием окрашенных иммунных комплексов.
В контрольной зоне тест-полоски специфический окрашенный иммунный комплекс образуется независимо от наличия в тестируемом биологическом материале вируса гриппа А и/или вируса гриппа В.
В том случае, если в анализируемом образце присутствует вирус гриппа А и вирус гриппа В, на тест-полоске образуются три параллельные окрашенные линии (красная и синяя аналитические, обозначенные буквой Т, и зеленая контрольная, обозначенная буквой С), что указывает на положительный результат анализа по вирусам обоих типов. В случае отсутствия в анализируемом образце вируса гриппа А и вируса гриппа В на тест-полоске образуется одна зеленая контрольная линия (С), что указывает на отрицательный результат анализа по вирусам обоих типов.
Состав
Кассеты с тест-полосками и одноразовые пластиковые пипетки упакованы в индивидуальные вакуумные упаковки из фольги алюминиевой, содержащие пакетики с силикагелем.
Необходимые оборудование и материалы, не входящие в состав набора
- одноразовые резиновые или пластиковые перчатки;
- часы или таймер.
Аналитические характеристики
Меры предосторожности
При проведении определения следует надевать одноразовые резиновые или пластиковые перчатки, т.к. исследуемые образцы биологического материала следует рассматривать как потенциально инфицированные.
Использованные тесты и остатки биологического материала должны быть помещены в специальный контейнер для санитарных отходов.
Анализируемые образцы
Свежесобранный биологический материал (респираторные выделения из носовой полости человека), не содержащий консерванты.
Образцы респираторных выделений до определения можно хранить при температуре 2–4°С не более 8 ч.
Перед анализом образцы респираторных выделений должны быть доведены до комнатной температуры.
Подготовка образцов
1. Ввести стерильный ватный тампон на зонде приблизительно на 3 см в одну ноздрю и, вращая его, взять мазок со стенок носового хода (рис. 1-1).
2. Внести в одноразовую пластиковую пробирку из флакона с крышкой-капельницей 15 капель буфера для растворения образца (рис. 1-2).
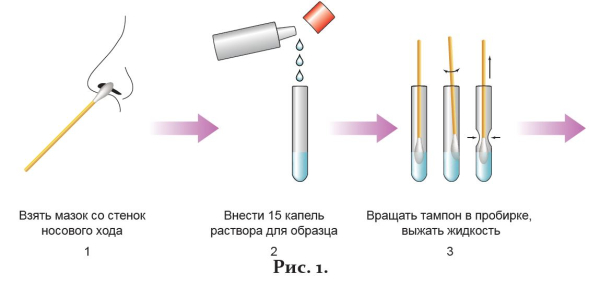
3. Поместить тампон с образцом в пробирку, смыть образец, вращая тампон по стенкам пробирки минимум 10 раз. Выдавить жидкость из тампона, сдавливая его стенками пробирки (рис. 1-3). Выбросить тампон.
Проведение анализа
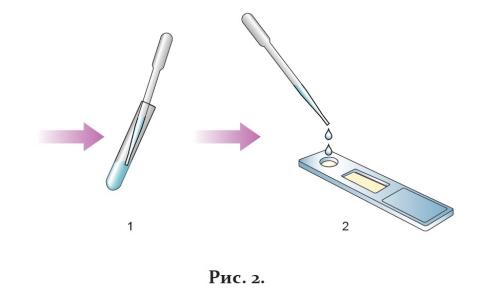
6. Через 10 мин визуально оценить результат реакции.
Интерпретация результатов
Выявление в тестовом окошке кассеты одной зеленой контрольной линии (С) свидетельствует об отрицательном результате анализа по обоим типам вируса, т.е. указывает на отсутствие в анализируемом образце респираторных выделений вирусов гриппа А и В (рис. 3-1).
Выявление в тестовом окошке кассеты трех параллельных окрашенных линий (зеленой, красной и синей) свидетельствует о положительном результате анализа по обоим типам вируса, т.е. указывает на наличие в анализируемом образце респираторных выделений вирусов гриппа А и В (рис. 3-2).

Выявление в тестовом окошке кассеты двух параллельных окрашенных линий (зеленой и красной) свидетельствует о положительном результате анализа по вирусу гриппа А, т.е. указывает на наличие в анализируемом образце респираторных выделений вируса гриппа А и отсутствие вируса гриппа В (рис. 3-3). Выявление в тестовом окошке кассеты двух параллельных окрашенных линий (зеленой и синей) свидетельствует о положительном результате анализа по вирусу гриппа В, т.е. указывает на наличие в анализируемом образце респираторных выделений вируса гриппа В и отсутствие вируса гриппа А (рис. 3-4). Интенсивность окраски красной и синей аналитических линии может меняться в зависимости от концентраций, соответственно, вируса гриппа А и вируса гриппа В в образце.
Условия хранения и эксплуатации
Москва, Кулакова ул., 20, Телефоны: , 757-99-15, 757-96-96, 8 (800) 600-54-27, e-mail: tender@bioworld.ru
ИХА (предложен в начале 1980-х гг.) можно отнести к группе реакций с мечеными антителами. В качестве метки используют окрашенный латекс или частицы коллоидного золота.
Типичный тест представляет собой пластиковую пластинку и содержит окно для внесения материала, окно для учета результата и одно или несколько окон для внутреннего контроля/контролей (рис. 15).
В реакции используют:
· первые антитела к искомому антигену, иммобилизованные в виде полосы на хроматографическом носителе в окне для учета результата (выше окна для внесения материала);
· вторые антитела к тому же антигену, адсорбированные на микрочастицах золота или латекса (размещаются в окне для внесения материала).
Внутренний контроль/контроли включают:
· выявляемый антиген, нанесенный после окна для учета результата (положительный контроль, контроль протекания всех этапов основной реакции);
· антивидовые антитела против вторых (меченых) антител, закрепленные в виде полосы на носителе (отрицательный контроль, контроль переноса ингредиентов по носителю, адекватность внесения материала);
· неспецифические первые антитела (того же происхождения) (контроль специфичности связывания вторых антител).
Постановка теста на примере системы для диагностики инфекционного мононуклеоза(рис. 16):
Подготовленный исследуемый материал в небольшом количестве (5-7 капель) вносится в стартовое окно тест-системы. Здесь происходит взаимодействие антигена с антителами, адсорбированными на частицах, и начинается движение образовавшихся комплексов за счет капиллярности носителя. Дойдя до антител, расположенных на носителе в окне учета результата, эти комплексы связываются, при этом частицы латекса или коллоидного золота проявляются в виде линии голубого (латекс) или (коричневого) цвета. Поскольку частицы, нагруженные, антителами берутся в избытке, часть их движется дальше и связывается в окне (окнах) внутреннего контроля реакции. Полоса в этом окне свидетельствует о правильной работе тест-системы.
В настоящее время разработаны тест-системы для установления овуляции и беременности, выявления стрептококков группы А в мазках из зева, вирусов грипа А и В и РС-вируса в соскобах и смывах из носоглотки, возбудителей туберкулеза в мокроте, хламидий в соскобах из уретры и шейки матки, токсина C.dificile в испражнениях, вируса Эпштейн-Барр в крови, определения маркеров повреждения миокарда (инфаркт миокарда), патологического свертывания крови (тромбоз), нарушения обмена кальция (остеопороз) и др.
ИХА может использоваться как для экспресс-индикации антигенов в пробе, так и для идентификации выделенных культур. Например, ИХА позволяет проводить обнаружение листерий в исследуемом материале непосредственно в среде обогащения, без выделения чистой культуры. Это позволяет сократить время исследования до 48 часов.
Таким образом, ИХА тест-системы обладают несомненными достоинствами:
· скоростью получения результата,
· доступны, легко интерпретируются,
· не требуют медицинской или лабораторной квалификации,
· могут применяться пациентами самостоятельно в любых условиях.
Однако по чувствительности ИХА системы уступают другим методам иммуноанализа, что позволяет применять их лишь в качестве ориентировочного теста. Существует также проблема документирования результатов и ряд этических проблем, связанных с самостоятельным применением тестов пациентами.
Антитела. Методы. В 2-х кн. Кн. 2: Пер. с англ./Под ред. Д.Кэтти. – М.: Мир, 1991. – 384 с.
Иммуноферментный анализ: Пер. с англ./Под ред. Т. Нго и Г. Ленхоффа.- М.: Мир, 1988. – 446 с.
Манолов А. Твердофазные радиоиммунные методы для количественного экспресс-анализа в микробиологии //ЖМЭИ, 1985, N:4, с.100-107.
Теория и практика иммуноферментного анализа/ А.М. Егоров, А.П. Осипов, Б.Б. Дзантиев, Е.М. Гаврилова – М.: Высш. шк., 1991. – 288 с.
Тертон М., Бангхем Д.Р., Колкотт К.А. и др. Новые методы иммуноанализа: Пер с англ. – М.: Мир, 1991. – 280 с.
Birjis Chinoy, Edgar Yee, Sami L Bahna Skin testing versus radioallergosorbent testing for indoor allergens//Clinical and Molecular Allergy2005, 3:4.
C. Harwanegg, R. Hiller Protein microarrays for the diagnosis of allergic diseases: State-of-the-art and future development// J Lab Med 2005, 29(4): 272–277.
C. L. Morgan, D. J. Newman, C. P. Price Immunosensors: technology and opportunities in laboratory medicine//Clinical Chemistry 1996,42:2.- P.193-209.
Clinical chemistry, 1990,36/8, 1408-1427.
Immunoassay of infectious agents/ P. E. Andreotti, G. V. Ludwig, A. H. Peruski //BioTechniques 2003,35: P. 850-859.
J. P. GoslIng A Decade of Development in Immunoassay Methodology// Clinical Chemistry, 1990, Vol.36, No. 8, P. 1408.
L. J. Kricka Miniaturization of analytical systems//Clinical Chemistry, 1998,44:9, P. 2008–2014.
L. J. Kricka Selected Strategies for Improving Sensitivity and Reliability of Immunoassays//Clinical chemistry, 1994, 40/3, P. 347-357.
Immunochemical staining methods / S.J.Naish, T.Boenisch, A.J.Farmilo, R.H.Stead//DAKO Corporation, Carpinteria, California, 1989. – P.41.
Microarrayed recombinant allergens for diagnostics of allergy/Harwanegg C., Laffer S., Hiller R et al. //Clin. Exp. Allergy 2003, 33: 7- 13.
R Spiewak ELISpot: Principles of the technique//www.ELISpot.biz
R. P. EkinsLigand assays: from electrophoresis to miniaturized microarrays//Clinical Chemistry, 1998; 44: 2015-2030.
Radioallergosorbent Test (RAST) Methods for Allergen-Specific Immunoglobulin E (IgE) 510(k)s; Final Guidance for Industry and FDA / U.S. Department of Health and Human Services Food and Drug Administration;Center for Devices and Radiological Health.- August 22, 2001.
Radioimmunometric Assay for a Monoclonal Antibody-Defined Tumor Marker, CA 19-9/ Villano B. C., Brennan S., Bucher C. et al.// Clinical Chemistry,1983, Vol. 29, No. 3, 1983 549-552.
| Введение |
| 1. Методы иммуноанализа с применением радиоактивной метки |
| 1.1. Радиоиммунный анализ (РИА) |
| 1.2. Иммунорадиометрический анализ (ИРМА) |
| 2. Методы иммуноанализа с применением флуоресцентной метки |
| 2.1. Реакция иммунофлуоресценции (РИФ) |
| 2.2. Флуоресцентный иммуноанализ с временным разрешением (ФИА ВР) |
| 2.3. Проточная цитофлуориметрия |
| 3. Методы иммуноанализа с применением ферментной метки |
| 3.1. Иммуноферментный анализ (ИФА) |
| 3.1.1. Гетерогенные методы иммуноферментного анализа |
| Гетерогенный твердофазный ИФА (ELISA) |
| Элиспот (ЭС, ELIspot) |
| Иммуноблот (ИБ, вестернблот) |
| Иммуногистохимия, иммуноцитохимия (ИГХ) |
| 3.1.2. Гомогенные методы иммуноферментного анализа |
| 4. Люминесцентный иммуноанализ (ЛИА) |
| 4.1. Биолюминесцентный иммуноанализ |
| 4.2. Хемолюминесцентный иммуноанализ |
| 5. Некоторые перспективные технологии иммуноанализа |
| 5.1. Иммуносенсоры (ИС) |
| 5.2. Микроэррей (МЭ) |
| 5.3. Иммунохроматографический анализ (ИХА) |
| Список литературы |
Черношей Дмитрий Александрович, Канашкова Татьяна Александровна
Методы лабораторной диагностики вирусных инфекций подразделяются на несколько больших групп.
- Прямые методы, состоящие в выявлении непосредственно в биологическом материале самого вируса или антител к нему.
- Непрямые методы-заключаются в искусственной наработке вируса в значительных количествах, и его дальнейшем анализе.
К наиболее актуальным в повседневной практике методам диагностики относятся:
Серологические методы диагностики - выявление в сыворотке крови пациента определенных антител или антигенов в результате реакции антиген-антитело(АГ-АТ). То есть, при поиске у пациента определенного антигена используется соответствующее искусственно синтезированное антитело, и, соответственно, наоборот-при выявлении антител используют синтезированные антигены.
Реакция иммунофлуоресценции (РИФ)

Основана на использовании меченых красителями антител. При наличии вирусного антигена он связывается с мечеными антителами, и под микроскопом наблюдается специфическая окраска, которая говорит о положительном результате. При этом методе, к сожалению, невозможна количественная интерпретация результата, а только лишь качественная.
Возможность количественного определения дает иммуноферментный анализ(ИФА). Он похож на РИФ, однако в качестве маркеров используют не красители, а ферменты, превращающие бесцветные субстраты в окрашенные продукты, что и дает возможность количественной оценки содержания как антигенов, так и антител.

- Отмывают не связавшиеся антитела и антигены.
- Добавляют бесцветный субстрат, и в лунках с антигеном, который мы определяем, произойдет окрашивание, т.к. там будет связанный с антигеном фермент, после чего на специальном приборе оценивают интенсивность свечения окрашенного продукта.
По похожей схеме происходит и выявление антител.

Реакция непрямой(пассивной) гемаглютинации (РПГА).
Метод основан на способности вирусов связывать эритроциты. В норме эритроциты падают на дно планшета, образуя так называемую пуговку. Однако если в исследуемом биологическом материале находится вирус, он свяжет эритроциты в так называемый зонтик, который не упадет на дно лунки.


Теперь остановимся на методах диагностики непосредственно нуклеиновых кислот исследуемых вирусов, и прежде всего о ПЦР ( Полимеразная Цепная Реакция) .
Суть этого метода заключается в обнаружении специфического фрагмента ДНК или РНК вируса путём его многократного копирования в искусственных условиях. ПЦР можно проводить только с ДНК, то есть для РНК-вирусов предварительно необходимо произвести реакцию обратной транскрипции.
Непосредственно ПЦР проводят в специальном приборе, под названием амплификатор, или термоциклер, который поддерживает необходимый температурный режим. ПЦР-смесь состоит из добавленной ДНК, которая содержит интересующий нас фрагмент, праймеров (короткий фрагмент нуклеиновой кислоты, комплиментарный ДНК-мишени, служит затравкой для синтеза комплиментарной цепи), ДНК-полимеразы и нуклеотидов.
Стадии цикла ПЦР:
- Деннатурация-первая стадия. Температура повышается до 95 градусов, цепочки ДНК расходятся друг относительно друга.
- Отжиг праймеров. Температуру понижают до 50-60 градусов. Праймеры находят комплиментарный участок цепи и связываются с ним.
- Синтез. Температуру вновь повышают до 72, это рабочая температура для ДНК-полимеразы, которая, отталкиваясь от праймеров, строит дочерние цепи.

Цикл многократно повторяется. Через 40 циклов из одной молекулы ДНК получается 10*12 степени копий копий искомого фрагмента.

При проведении ПЦР в режиме реального времени синтезируемые копии фрагмента ДНК метятся красителем. Прибор регистрирует интенсивность свечения и по ходу реакции строит графики накопления искомого фрагмента.
Современные методы лабораторной диагностики с высокой достоверностью позволяют выявить присутствие вируса - возбудителя в организме, нередко, задолго до появления первых симптомов заболевания.

Морозова В. С., Габрильянц О. А., Мягкова М. А.,
К преимуществам ИХА следует отнести:
● быстроту и легкость в использовании;
● малые объемы образца, отсутствие пробоподготовки;
● дешевизну для производителя и потребителя;
● возможность производства тестов в больших объемах;
● простоту чтения и интерпретации результата;
● высокую чувствительность и вопроизводимость;
● возможность количественного определения;
● возможность использования портативных ридеров, совместимых с компьютером;
В связи с большим количеством преимуществ по сравнению с другими скрининговыми методами, ИХА получил широкое применение
и находится на первом месте на мировом рынке диагностики. ИХА применяется в различных областях медицины и народного хозяйства:
● банки крови и плазмы;
● промышленность (контроль качества, безопасности, идентификация продукта, эко-контроль);
● сельское хозяйство, агрономия;
Тест-полоски для ИХА являются чрезвычайно удобными и простыми в использовании, однако они имеют сложное строение и процесс разработки каждого вида ИХА является чрезвычайно трудоемким и высокотехнологичным.

Рис. 13. Схематическое изображение иммунохроматографической тест-полоски
Метод ИХА, так же как и ИФА, имеет несколько форматов. Наиболее распространены 2 схемы: прямой (сэндвичный) и непрямой конкурентный метод.

Рис. 14. Схема прямого (сэндвичного) ИХА
Метод прямого ИХА используется для выявления высокомолекулярных соединений – вирусов, в т.ч. ВИЧ; различных гормонов (например, в тестах на беременность), возбудителей инфекционных заболеваний.
Схема сэндвичного ИХА не подходит для определения низкомолекулярных веществ, т.к. для образования сэндвича Ат-Аг-Ат антиген должен иметь по крайней мере две антигенные детерминанты (т.е. центра связывания с антителами). Кроме того, из-за стерических затруднений образование такого двойного комплекса с низкомолекулярным антигеном маловероятно. Поэтому для анализа небольших молекул, в том числе наркотических веществ, используется другая схема – непрямой конкурентный ИХА.
Метод конкурентого ИХА основан на конкуренции аналита и иммобилизованного конъгата аналит:белок-носитель за ограниченное количество центров связывания специфических антител, содержащихся в конъюгате Ат-метка. При нанесении образца, содержащего аналит, он связывается с конъюгатом Ат-метка на мембране с конъюгатом (рис. 15). Далее иммунокомплекс проходит через тестовую зону, где на иммобилизован конъгат аналит:белок-носитель. Иммунокомплекс не может связаться с этим конъюгатом из-за стерических затруднений: низкомолекулярные соединения обычно имеют одну антигенную детерминанту и, соответственно, антитела имеют один центр связывания с антигеном, который уже является занятым аналитом. Далее иммунный комплекс связывают антивидовые антитела, находящиеся на контрольной линии. В результате, отсутствие окрашенной полосы в контрольной зоне свидетельствует о том, что концентрация определяемого вещества в исследуемом образце превышает его пороговое значение для данного теста.
При отсутствии анализируемого вещества в образце конъюгат Ат-метка связывается с конъюгатом Аг:белок-носитель, иммобилизованным в зоне тестовой линии. Несвязавшийся конъюгат Ат-метка попадает в зону контрольной линии и связывается там с антивидовыми антителами. Таким образом, наличие двух окрашенных линий (тестовой и контрольной) является отрицательным результатом анализа (рис. 15). Формат конкурентного ИХА используется для выявления низкомолекулярных соединений, в том числе метаболитов наркотических соединений в моче, жидкости ротовой полости, экстрактах тканей.
Схема оценки результатов ИХА наркотических веществ представлена на рис. 16. Результат теста является недействительным при отсутствии контрольной линии, т.к. этот факт может свидетельствовать о незавершенной процедуре анализа, либо о том, что иммунохимическая реакция не прошла должным образом по какой-либо причине (из-за испортившихся иммунореагентов или несоблюдения инструкции по применению теста).

Рис. 15. Схема конкурентного ИХА

Рис. 16. Схема оценки результатов ИХА метаболитов наркотических веществ
Часто, особенно в случаях когда недоступны большие количества биообразца для анализа, например, для определения наркотических веществ в слюне, используются тест-полоски в пластиковой кас-
сете (рис. 17).

Рис. 17. Пластиковый корпус иммунохроматографического теста
В качестве меток в ИХА используются различные частицы, обладающие следующими свойствами:
1. Красящие вещества (нано-частицы коллоидного золота или углерода, или частицы окрашенного латекса). В этом случае используется визуальная детекция результата, либо приборное рефлектометрическое определение (например, сканирование). Использование различных красящих меток, присоединенных к частицам латекса, позволяет проводить мильтианализ, в котором линии разного цвета соответствуют различным аналитам. Наиболее часто используемой меткой является нано-частицы коллоидного золота, которые образуют линии темно-бурого (или темно-розового) цвета.
2. Флуоресцентные, фосфоресцентные и биолюминисцентные метки, ковалентно связанные с частицами латекса. Эти метки используются только в приборных вариантах ИХА, когда результат регистрируется специальным ридером. Среди вышеуказанных наиболее распространены флуоресцентные метки.
3. Парамагнитные метки (также закрепленные на частицах латекса). Данный вид меток используется в ИХА с применением приборов, регистрирующих силу магнитного поля.
4. Ферментные метки используются по тому же принципу, что и в ИФА. Ферментативная реакция регистрируется с помощью окрашивания субстратов, и результат анализа является визуальным, или считывается с помощью ридера.
5) Новым направлением в разработке различных разновидностях ИХА является использование липосом в качестве носителей различного рода меток (красящих, флуоресцентных, ферментативных, электроактивных и пр.) [17].
Разработка технологических стадий иммунохроматографического анализа является наукоемким, высокотехнологичным и многостадийным процессом: он включает в себя подбор материалов, реагентов и условий проведения анализа на нескольких этапах разработки ИХА. Перечислим основные этапы разработки:
● выбор материалов для производства тест-полосок;
● подбор оптимальных концентраций иммунореагентов: конъюгатов Ат-метка, конъюгатов антиген-белок-носитель, антивидовых антител;
● подбор дополнительных реагентов для предобработки компонентов тест-полоски (позволяет улучшить свойства потока, и тем самым обеспечить лучшую чувствительность теста);
● оптимизация условий проведения анализа реальных образцов;
● изучение стабильности тест-системы, выбор условий хранения и упаковки для увеличения срока хранения тестов.
На рис. 18 представлена схема производства иммунохроматографических тестов. На каждом этапе данной технологической схемы должна быть произведен выбор материалов и реагентов, оптимизация условий проведения технологической стадии.
Все компоненты тест-полоски (фильтр, мембрана с конъюгатом, хроматографическая мембрана, мембрана абсорбции, см. рис. 13) приклеиваются на пластиковую подложку. Подложка – это лист, состоящий из пластика и имеющий клейкое покрытие. При выборе подложки необходимо обращать внимание на качество клея (это может напрямую влиять на характеристики хроматографической мембраны, которая будет приклеена на подложку) и удобство покрывающей пленки (что обеспечивает точность приклеивания компонентов полоски на подложку).
При выборе материала фильтра для образца необходимо руководствоваться теми функциями, которые должен выполнять фильтр:
● впитать достаточное количество образца и доставить его в мембрану для конъюгата;
● довести рН образца до оптимального;
● увеличить или уменьшить вязкость образца для достижения оптимальной скорости прохождения образца по хроматографической мембране;
● увеличить способность образца растворить конъюгат;
● уменьшить забивку мембраны за счет добавления забивки в прокладку для образца.

Рис. 18. Схема стадий производства иммунохроматографических тестов
Хроматографическая мембрана – самый важный элемент иммунохроматографической полоски. Именно на ней проходит иммунохимическая реакция, происходит разделение и связывание иммунореагентов в тестовой и контрольной зонах. Мембрана является самой длинной зоной тест-полоски, именно здесь иммунореагенты проходят максимальный путь в латеральном потоке. При выборе материала для хроматографической мембраны необходимо руководствоваться следующими свойствами, которыми должна обладать мембрана:
1. Гидрофильность – необходима для возможности прохождения потока (а это водная среда) через мембрану. Обеспечивается выбором материала, а также использованием ПАВ.

Рис. 19. Диполи нитроцеллюлозы и белков
При производстве мембран для ИХА используются следующие материалы: нитроцеллюлоза (наиболее распространенный материал, используется в 99 % выпускаемых тест-полосок); нейлон; поливинилиденфторид; полиэфирсульфон; стекловолокно.
При выборе материала мембраны необходимо руководствоваться следующими ее физическими параметрами, которые характеризуют свойства латерального потока, проходящего через данную мембрану:
● толщина мембраны, ее объем слоя;
● пористость, размер и распределение пор;
● номинальная скорость потока;
● прочность (предел прочности на разрыв);
● качество поверхности: неровности, порошок и пыль, оставшиеся на поверхности после производства материала.
Все перечисленные характеристики формируют в конечном итоге главный параметр иммунохроматографической мембраны – скорость латерального потока, определяющий все основные параметры ИХА (рис. 20).

Рис. 20. Влияние скорости потока на характеристики анализа
Все вышеописанные подробности приведены для того, чтобы дать представление о сложности процесса разработки и производства на первый взгляд простых тест-полосок. Для того чтобы получить действительно работающий качественный тест, необходимо очень тщательно пройти все стадии разработки и наладки производства. К сожалению, не все нынешние производители это делают на должном уровне, экономя средства для достижения минимальных цен на рынке. В результате мы имеем общепринятое мнение о неточности ИХА тестов. В то же время качественный ИХА тест может иметь характеристики не хуже, чем тест-система для приборного метода ИФА [17].
Современные материалы и возможности тщательного подбора условий при производстве ИХА тестов позволяют разработать даже количественные варианты ИХА. В этом случае детекция результата осуществляется с помощью специальных считывающих устройств – ридеров для ИХА. В зависимости от типа метки, данные устройства осуществляют различные способы детекции: рефрактометрический, флуоресцентный, магнитный (рис. 21).


Рис. 21. Считывающие устройства для детекции результатов ИХА

Рис. 22. Автоматическая платформа для производства ИХА полосок
Количественный формат ИХА характеризуется гораздо большими требованиями к качеству тест-полосок, и, следовательно, к контролю качества каждой стадии производства тестов. Кроме качества материалов и реагентов, на каждой стадии производства необходимо четко, с высокой точностью, контролировать температуру, влажность, концентрацию реагентов, скорость подачи материалов, давления прессов и т.д. Только в этом случае можно получить количественный ИХА тест. Столь высокие требования возможно выполнить только с использованием специальных закрытых, полностью автоматизированных платформ, в которых каждый из параметров контролируется и поддерживается с высокой точностью (рис. 22).
Читайте также:


