Ингибировании репродукции вируса это
ИНГИБИТОРЫ ВИРУСОВ (лат. inhibere удерживать, останавливать) — вирусотропные вещества, образующиеся в организме человека или животного и обладающие способностью в результате взаимодействия с вирусами подавлять их инфекционную активность. Кроме того, И. в. могут подавлять и отдельные функции вирусов, напр, гемагглютинацию, обусловливаемую вирусом гриппа. В отличие от антител (см.), к-рым присуща строгая специфичность, ингибиторы обладают более широким спектром активности в отношении различных видов вирусов, что дало основание называть их неспецифическими факторами иммунитета.
Впервые И. в. были обнаружены в сыворотке крови. В 1910 г. С. Флекснер и Льюис (J. Lewis) описали способность нормальной сыворотки овец нейтрализовать вирус полиомиелита. В последующем ингибиторы к различным вирусам были найдены в сыворотках крови обезьян, кроликов, собак, птиц, коров, лошадей и других животных. В 1942 г. Херст (G. К. Hirst) обнаружил ингибиторы к вирусу гриппа в сыворотке крови здорового человека. Результаты большого числа исследований, проведенных в различных лабораториях, позволяют сделать вывод, что в сыворотках человека и животных содержатся ингибиторы, активные по отношению ко многим как РНК-, так и Д H K-со держащим вирусам. Установлено также, что И. в., выявляемые в сыворотках крови разных животных, различаются как качественно, так и количественно. Так, в сыворотке крови человека содержатся ингибиторы вирусов гриппа А и В, но отсутствуют ингибиторы вируса гриппа С, в сыворотке же крыс содержатся в большом количестве ингибиторы вирусов гриппа С, но мало ингибиторов вирусов гриппа А и В.
Помимо видовых различий в содержании И. в., характерных для различных животных, наблюдаются как индивидуальные колебания у отдельных особей, так и изменения количества И. в. у одного и того же животного в зависимости от возраста и времени года: содержание И. в. в сыворотке лабораторных животных резко уменьшается в зимне-весенние месяцы и возрастает летом и осенью. Аналогичные закономерности возрастной и сезонной динамики установлены и для человека. Сыворотки крови детей первых 2—5 мес. жизни обладают высокой вируснейтрализующей активностью (в этом случае имеют место И. в. материнского происхождения). Затем содержание И. в. резко падает и до 1,5—2 лет сыворотка крови детей характеризуется низким содержанием ингибиторов. Количество И. в. начинает возрастать после 3 лет, достигая высоких показателей к 9—10 годам. У стариков содержание И. в. в сыворотке крови также невелико.
Изучение хим. природы И. в. различных животных и человека позволило прийти к заключению об их неоднородности и достаточно сложном строении. Оказалось, напр., что вирусингибирующая активность сыворотки крови морской свинки В отношении вирусов гриппа А и ECHO связана с липопротеидами, входящими в состав глобулиновой фракции белков сыворотки, а ингибитор вируса Сендай был обнаружен в составе альбуминовой фракции.
Гетерогенность И. в. обусловила появление различных классификаций. В основу одной из них положено распределение И. в. по принципу устойчивости к прогреванию при различной температуре. Так, для ингибиторов миксовирусов и респираторных вирусов Т. Я. Лузяниной предложена следующая классификация. 1. Термолабильныe ингибиторы, которые разрушаются после прогреваний при t° 62—65° в течение часа (бета-ингибиторы). Большинство из них относится к бета-липопротеидам.
2. Термостабильные ингибиторы, которые в свою очередь делятся на две группы — ингибиторы умеренной термостабильности и ингибиторы высокой термостабильности.
И. в. умеренной термостабильности разрушаются после прогревания при t° 75° в течение часа (ингибитор Франсиса, альфа-ингибитор). Они относятся к мукопротеинам, простетической группой которых являются нейраминовая к-та и ее производные.
И. в. высокой термостабильности не разрушаются при t° 100° (гамма-ингибитор). По хим. структуре они относятся к гликопротеинам, преимущественно связаны с альфа2-глобулиновой фракцией сывороток, но обнаруживаются также и среди альбуминовой и бета-глобулиновой фракций.
Помимо сыворотки крови, И. в. найдены также в тканях, секретах и экскретах человека и позвоночных животных. Они обнаружены в экстрактах из тканей легкого, печени, селезенки, почки, мозга, в слюне, моче и т. д. В частности, в слюне здоровых людей найдены ингибиторы, подавляющие репродукцию вируса полиомиелита в различных культурах клеток. Следует заметить, что в ряде случаев ингибиторам, выделяемым из тканей, присуща более сложная структура, чем И. в., получаемых из сывороток крови. Установить какую-либо зависимость между содержанием ингибиторов в сыворотке крови и тканях не удалось.
По мнению В. М. Жданова, П. Н. Косякова, 3. И. Ровновой и др., муко- и липопротеиновые И. в., выявляемые в различных тканях, секретах и экскретах организма, а также некоторые виды термостабильных сывороточных ингибиторов следует считать рецепторами клеток или веществами, тождественными по своему составу этим рецепторам.
Механизм действия
Несмотря на то, что антивирусная активность И. в. порой бывает достаточно высокой (показано, напр., что сыворотки крови морских свинок могут нейтрализовать до 10 млн. DL50 для мышей некоторых штаммов вируса гриппа), судьба их в процессе заболеваний, обусловленных вирусами, изучена крайне недостаточно. Тем не менее установлено, что развитие вируса гриппа в эмбрионах кур, в мозге и легких мышей приводит к падению титров ингибиторов. Подобное понижение ингибирующей активности смывов из верхних дыхательных путей человека, наблюдавшееся в остром периоде гриппозной инфекции, было предложено использовать в качестве метода ранней диагностики гриппа. В процессе выздоровления от вирусной инфекции (в частности, от гриппа) количество ингибиторов вновь увеличивается. При этом титры сывороточных ингибиторов начинают нарастать примерно в те же сроки, когда появляются и антитела к вирусам. Повышение содержания И. в. и антител обычно идет параллельно. В последующем увеличение неспецифических И. в. сменяется снижением их количества, к-рое наступает раньше, чем начинает снижаться титр антител.
Наблюдавшаяся порой высокая антивирусная активность И. в. дала основание для попыток использовать их в качестве профилактического и леч. средства при некоторых экспериментальных вирусных инфекциях. Однако несмотря на полученные положительные результаты в ряде таких экспериментов И. в. не нашли практического применения в терапии вирусных инфекций.
Библиография: Косяков П. Н. и Ровно в а 3. И. Противовирусный иммунитет, М., 1972; Л у з я н и н а Т. Я. Особенности взаимодействия термолабильных сывороточных ингибиторов с различными вирусами, Acta virologica, т. 6, № 6, с. 498, 1962; Проблемы патогенеза и иммунологии респираторных вирусных инфекций, под ред. А. А. Смо-родинцева и др., т. 1, с. 35, Л., 1969.
Для вирусов характерен дизъюнктивный (от disjuncus — разобщенный) способ репродукции-размножения. Потомство вируса возникает в результате сборки нуклеиновых кислот и белковых субъединиц, которые синтезируются раздельно клеткой хозяина.
Проникновение вируса в клетку и воспроизведение себе подобных проходит в несколько фаз:
1.проникновение в клетку хозяина,
2.синтез ферментов, необходимых для репликации вирусных нуклеиновых кислот,
3.синтез вирусных частей,
4.сборка и композиция зрелых вирионов,
5.выход зрелых вирионов из клетки.
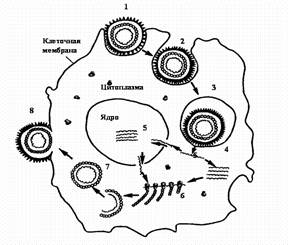
Стадии репродукции вирусов.
1 - адсорбция вириона на клетке; 2 - проникновение вириона в клетку путем виропексиса;
3 - вирус внутри вакуоли клетки; 4 - `раздевание вириона вируса; 5 - репликация вирусной нуклеиновой кислоты; 6 - синтез вирусных белков на рибосомах клетки; 7 - формирование вириона; 8 - выход вириона из клетки путем почкования.
Фаза I — адсорбция вириона на поверхности клетки.
Протекает в две стадии: первая — неспецифическая, когда вирус удерживается на поверхности клетки при помощи электростатических сил, т. е. благодаря возникновению противоположных зарядов между отдельными участками мембраны клеток и вируса. Эта фаза взаимодействия вируса с клеткой обратима, на нее оказывают влияние такие факторы, как рН и солевой состав среды.
Вторая стадия — специфическая, когда взаимодействуют специфические рецепторы вируса и рецепторы клетки, комплементарные друг другу. По химической природе рецепторы клетки могут быть мукопротеидами (или мукополисахаридами) и липопротеидами. Разные вирусы фиксируются на разных рецепторах: вирусы гриппа, парагриппа, аденовирусы — на мукопротеидах, а вирусы клещевого энцефалита, полиомиелита — на липопротеидах.
Фаза II — проникновение вируса в клетку. Электроноскопические наблюдения за процессом проникновения вирусов в чувствительные к ним клетки показали, что оно осуществляется посредством механизма, напоминающего пиноцитоз, или, как чаще называют, виропексис. В месте адсорбции вируса клеточная стенка втягивается внутрь клетки, образуется вакуоль, в которой оказывается вирион. Параллельно клеточные ферменты (липазы и протеазы) вызывают депротеинизацию вириона — растворение белковой оболочки и освобождение нуклеиновой кислоты.
Фаза III — скрытый период (период эклипса — исчезновения). В этот период в клетке невозможно определить наличие инфекционного вируса ни химическими, ни электронно-микроскопическими, ни серологическими методами. О сущности этого явления и его механизмов пока известно мало. Предполагается, что в скрытой фазе нуклеиновая кислота вируса проникает в хромосомы клетки и вступает с ними в сложные генетические взаимоотношения.
Фаза IV — синтез компонентов вириона. В этой фазе вирус и клетка представляют единое целое, вирусная нуклеиновая кислота выполняет генетическую функцию, индуцирует образование ранних белков и изменяет функцию рибосом. Ранние белки подразделяются на:
а) белки-ингибиторы (репрессоры), подавляющие метаболизм клеток
б) белки-ферменты (полимеразы), обеспечивающие синтез вирусных нуклеиновых кислот.
Синтез нуклеиновых кислот и белков протекает неодновременно и в разных структурных частях клетки. У вирусов, содержащих ДНК или РНК, эти процессы имеют некоторые различия и особенности.
Процесс формирования вирионов начинается спустя определенное время после того, как начал осуществляться синтез составляющих их компонентов. Продолжительность этого периода довольно вариабельна и предопределяется природой вируса — для РНК-содержащих обычно короче, чем для ДНК-вирусов. Например, продукция полных вирусных частиц осповакцины начинается приблизительно спустя 5—6 ч после инфицирования клеток и продолжается в течение последующих 7—8 ч, т. е. после того как синтез вирусной ДНК уже завершен.
Между нуклеиновой кислотой и соответствующим белковыми субъединицами образуются очень прочные связи, о чем свидетельствуют трудности отделения белка от вирусной нуклеиновой кислоты. Большую прочность вирусной частице придают входящие в ее состав углеводы и особенно липиды.
Формирование вирионов, так же как и синтез компонентов вируса, происходит в разных местах клетки, при участии различных клеточных структур. После завершения процесса формирования образуется зрелая дочерняя вирусная частица, обладающая всеми свойствами родительского вириона. Но иногда наблюдается образование так называемых неполных вирусов, которые состоят или только из нуклеиновой кислоты, или из белка, или из вирусных частиц, формирование которых остановилось в какой-то промежуточной стадии.
Фаза VI — выход зрелых вирионов из клетки. Существуют два основных механизма выхода зрелых вирионов из клетки:
1) выход вириона с помощью почкования. В этом случае наружная оболочка вириона происходит из клеточной мембраны, она содержит как материал клетки хозяина, так и вирусный материал;
2) выход зрелых вирионов из клетки через бреши в мембране. Эти вирусы не имеют наружной оболочки. При таком механизме выхода вирусов клетка, как правило, погибает и в среде появляется большое количество вирусных частиц.
Причиной гибели зараженной клетки могут быть три механизма:
2.защитная реакция клетки, запускающая генетическую программу ее гибели (апоптоз);
3. иммунная система организма, уничтожающая зараженную клетку.
Кроме продуктивного типа взаимодействия вируса и клетки возможно интегративное сосуществование или вирогения. Вирогения характеризуется интеграцией (встраиванием) нуклеиновой кислоты вируса в геном клетки, а также репликацией и функционированием вирусного генома как составной части генома клетки. Для интеграции с клеточным геномом необходимо возникновение кольцевой формы двунитевой ДНК вируса. Встроенная в состав хромосомы клетки вирусная ДНК называется провирусом. Провирус реплицируется в составе хромосомы и переходит в геном дочерних клеток, т.е. состояние вирогении наследуется. Под влиянием некоторых физических или химических факторов провирус может переходить в автономное состояние с развитием продуктивного типа взаимодействия с клеткой. Дополнительная генетическая информация провируса при вирогении сообщает клетке новые свойства, что может быть причиной развития опухолей, аутоиммунных и хронических заболеваний. На способности вирусов к интеграции с геномом клетки основаны персистенция (от лат. persisto - постоянно пребывать, оставаться) вирусов в организме и развитие персистентных вирусных инфекций. Например, вирус гепатита В способен вызывать персистирующие поражения с развитием хронического гепатита и часто опухолей печени.
Способ основан на использовании нескольких тандемов коротких производных антисмысловых олигодезоксинуклеотидов, несущих гидрофобные и реакционноспособные группировки, которые обладают ингибирующим эффектом на процесс репродукции ВИЧ первого типа. Способ может найти применение в вирусологии или медицине при разработке новых противовирусных препаратов. 2 ил., 1 табл.
Изобретение относится к вирусологии, медицине, а именно к разработке новых противовирусных препаратов, способных ингибировать репродукцию вируса иммунодефицита человека (ВИЧ).
Одним из подходов к решению проблемы эффективного ингибирования репродукции патогенных вирусов является использование антисмысловых олигонуклеотидов [1,2].
В литературе описан ряд антисмысловых олигонуклеотидов и их различных производных, эффективно блокирующих размножение ВИЧ в культуре клеток 3. Известны способы ингибирования ВИЧ с помощью антисмысловых олигонуклеотидов, имеющих в структуре не менее 15 нуклеотидов [6].
Однако природные немодифицированные олигонуклеотиды довольно плохо проникают в клетку и быстро гидролизуются клеточными нуклеазами. Более устойчивы к действию клеточных нуклеаз производные олигонуклеотидов, несущие на 5'-конце защитную группировку [7].
Анти-ВИЧ активность неприродных (фосфоротиоатных) олигонуклеотидов, характеризующихся высокой стабильностью в клетках, связана с блокированием стадии адсорбции вируса и де зависит от нуклеотидной последовательности олигонуклеотидов [4].
Авторами [7] была выбрана уникальная последовательность в структуре РНК ВИЧ и синтезирован антисмысловой 20-звенный олигонуклеотид структуры pGCATCAAGCAGCTCCAGGCA, комплементарный области начала трансляции открытой рамки считывания на (+) - цепи ДНК ВИЧ-1 (нуклеотиды 7516-7535). Полученные различные его производные, модифицированные по 5'-концу, несущие в этом положении молекулы алифатические остатки различной длины либо остаток холестерина, проявляют высокую анти-ВИЧ активность в культуре клеток, причем наиболее эффективным ингибитором ВИЧ является холестериновое производное [7].
Способ ингибирования ВИЧ такими производными является наиболее близким аналогом предлагаемому способу (прототип) [7].
Необходимо отметить, что недостатком применения длинных олигонуклеотидов и их производных для ингибирования репродукции ВИЧ является то, что они образуют стабильные комплементарные комплексы с нуклеиновой кислотой (НК) - мишенью при достаточно высокой температуре 60-80 o C, а в клеточной системе (при 37 o C) такие олигонуклеотиды могут образовывать несовершенные комплементарные комплексы и тем самым снижать специфическое действие.
Таким образом, разработка подходов, позволяющих повышать эффективность специфического воздействия олигонуклеотидов и их производных на нуклеиновые кислоты в физиологических условиях, остается актуальной задачей.
Технической задачей изобретения является расширение спектра производных антисмысловых олигонуклеотидов, обладающих специфической анти-ВИЧ активностью.
Поставленная задача решается применением тандема производных коротких олигонуклеотидов как ингибитора репродукции вируса иммунодефицита человека на модели первично инфицированных ВИЧ лимфоидных клеток МТ-4.
Тандем модифицированных коротких олигонуклеотидов представляет собой сочетание олигонуклеотида-реагента и олигонуклеотидов-эффекторов, стабилизирующих комплекс олигонуклеотидной части реагента с мишенью. Используя олигонуклеотид-эффектор с определенной последовательностью, можно направить олигонуклеотид-реагент в один выбранный участок НК-мишени, комплементарный используемому тандему. Для того, чтобы такой набор олигонуклеотидов мог эффективно действовать на НК внутри клетки, необходимо повысить способность его компонентов проникать через клеточную мембрану, что может быть достигнуто введением в олигонуклеотиды остатков стероидов. Авторами [8] была продемонстрирована способность 5'-холестерил(Chs)-3'-феназиний(Phnl) содержащих эффекторов - октануклеотидов и 3'-эстрон(Est) содержащего алкилирующего производного тетрануклеотида (реагента) эффективно и сайт-специфично взаимодействовать с 20-звенным участком ДНК-мишени в системе in vitro даже при 37 o C. Это позволило предположить, что подобный тандем коротких производных олигонуклеотидов (8+4+8) может быть эффективен для воздействия на НК внутри клетки, так как все его компоненты сочетают в себе повышенную способность проникать в клетки и обладают высокой устойчивостью к действию нуклеаз.
Таким образом, учитывая вышеуказанные факты, и на основе уже испытанной структуры для ингибирования репродукции ВИЧ в культуре клеток было получено несколько тандемов коротких производных олигонуклеотидов, несущих гидрофобные (Chs и Est), полициклические (Phnl) и реакционноспособные группировки (алкилирующие (RCl) либо металлсвязывающие (Blm), представленные в конце описания.
Сущность изобретения заключается в том, что, используя олигонуклеотид-эффектор с определенной последовательностью, направляют олигонуклеотид-реагент в один выбранный участок НК-мишени, комплементарный используемому тандему.
Способ ингибирования репродукции ВИЧ включает культивирование первично инфицированных ВИЧ лимфоидных клеток МТ-4 в присутствии препаратов описанных тандемов производных коротких олигонуклеотидов, конечная концентрация которых в культуральной среде составляет 5,0 - 0,1 мкМ, на протяжении одного пассажа - в течение 4 суток.
Об ингибировании репродукции ВИЧ в клетках судят по снижению накопления суммарного вирусного антигена и вирусспецифического белка p24 (по данным иммуноферментного анализа), а также по увеличению жизнеспособности клеток, определяемой методом исключения трипановым синим, на 4-e сутки культивирования по сравнению с контролем.
Полученные экспериментальные данные приведены в таблице, из которой видно, что четко выраженной ингибирующей способностью обладает тандем коротких олигонуклеотидов 5, все три фрагмента которого несут защитные и/или реакционные группировки как на 3'-, так и на 5'- концах. Ингибирующий эффект остальных исследованных олигонуклеотидов (и их комбинаций) не превышает 10-30%.
Таким образом, впервые установлена способность тандема производных коротких олигонуклеотидов ингибировать репродукцию вируса иммунодефицита человека 1 типа в культуре клеток, не известная ранее.
Важно подчеркнуть, что подобные структуры - тандемы производных коротких олигонуклеотидов в отличие от многозвенных олигонуклеотидов (15 и более нуклеотидов в структуре молекулы), значительно дешевле и доступнее и, кроме того, способны образовывать только совершенные комплексы с НК-мишенью, что позволяет воздействовать на мишень высокоспецифично и более эффективно. Наличие защитных либо реакционных группировок как на 5'-, так и на 3'- концах коротких олигонуклеотидов делает их менее уязвимыми для клеточных нуклеаз, а значит, более стабильными в клеточной системе. В добавок к этому введенные модификации позволяют таким конструкциям легче проникать в клетку.
На фиг. 1 представлена цитотоксичность тандемов производных коротких олигонуклеотидов в концентрации 50 мкМ в культуре клеток МТ-4; на фиг. 2 - анти-ВИЧ активность тандема модифицированных по 3'- и 5'- концам коротких олигонуклеотидов.
-. - защита ВИЧ-инфицированных клеток от гибели в присутствии различных концентраций тандема; -+- ингибирование накопления p24 в культуральной среде в присутствии различных концентраций тандема; -*- 50%-ная контрольная прямая.
Пример 1. Оценка цитотоксичности соединений.
По окончании инкубации подсчитывают долю жизнеспособных клеток в камере Горяева после окрашивания трипановым синим.
При оценке цитотоксичности тандемов коротких олигонуклеотидов все они оказались нетоксичными даже в максимальной из исследованных концентраций 50 мкМ (фиг.1).
Пример 2. Изучение влияния тандема производных коротких олигонуклеотидов на репродукцию ВИЧ-1 в культуре клеток.
Анти-ВИЧ активность препаратов оценивают по снижению накопления суммарного вирусного антигена или вирусспецифического белка p24, а также исходя из степени защиты инфицированных клеток от гибели в результате вирусной инфекции, подсчитывая долю жизнеспособных клеток после окрашивания трипановым синим в камере Горяева.
Полученные экспериментальные данные приведены в таблице. На основании этих данных строят дозозависимую кривую и определяют концентрацию соединений, на 50% снижающую накопление суммарного вирусного антигена или вирусспецифического белка p24 (ID50). Кроме того, на основании рассчитанной согласно [7] степени защиты инфицированных клеток от гибели в результате вирусной инфекции на 4-е сутки культивирования в присутствии препаратов в различных концентрациях строят дозозависимую кривую и определяют концентрацию соединений, на 50% защищающую клетки от гибели (ID50). Дозозависимые кривые и количественные характеристики ингибирования репродукции ВИЧ-1 для тандема 4 - наиболее эффективного ингибитора ВИЧ представлены на фиг. 2.
Положительный эффект, заключающийся в высокой степени подавления размножения ВИЧ в культуре клеток тандемом коротких олигонуклеотидов 5, выражен количественными показателями ингибирования: ID50 = 3,5 мкМ (по снижению накопления p24) и ID50 = 1,65 мкМ (по защите инфицированных клеток от гибели).
Таким образом, показано, что тандемы производных коротких олигонуклеотидов обладают способностью ингибировать репродукцию вируса иммунодефицита человека 1 типа в культуре клеток.
Полученные данные указывают на необходимость дальнейшего углубленного исследования комбинаций олигонуклеотидов с целью определения перспектив клинического использования таких препаратов для лечения вирусных инфекций.
Список литературы 1. Zamecnik P. C. , Stephenson M.L. Inhibition of Rous sarcoma virus replication and cell transformation by a specific oligodeoxynucleotide. Proc. Natl. Acad. Sci. USA 75, 280-284, 1978.
2. Wright J.A., Anazodo M. Antisense molecules and their potential for the treatment of cancer and AIDS. The cancer journal vol. 8, N 4, 185-189, 1995.
3. Agrawal S. , Goodchild J. , Civeira M., Sarin P.S., Zamecnik P.C. Phosphoroamidate, phosphorothioate and methilphosphonate analogs of oligodeoxynucleotide: inhibitors of human immunodeficiency virus. Nucleosides & Nucleotides vol. 8, p. 819-823, 1988.
4. Agrawal S., Goodchild J., Civeira M.P., Thornton A.H., Sarin P.S. and Zamecnik P.C. Oligodeoxynucleoside phosphoramidates and phosphorothioates as inhibitors of human immunodeficiency virus // Proc. Natl. Acad. Sci. USA. 1988. V. 85. P. 7079-7083.
6. Goodchild J., Zamecnik P. Inhibition of HTLV-III by exogenous oligonucleotides. United States Patent N 4806463, C 12 Q 1/70, 1989.
7. Svinarchik F.P., Konevetz D.A., Pliasunova O.A., Pokrovsky A.G., Vlassov V. V. Inhibition of HIV proliferation in MT-4 cells by antisense oligonucleotide conjugated to lipophilic groups. Biochimie, v. 75, p. 49-54, 1993.
8. Д. В. Пышный, И.А. Пышная, С.Г. Лохов, Е.М. Иванова, В.Ф. Зарытова. Взаимодействие производных коротких олигонуклеотидов с нуклеиновыми кислотами. I. Влияние различных типов эффекторов на алкилирование ДНК-мишеней. Биоорганическая химия, т. 21, N 9, с. 709-716, 1995.
Способ ингибирования репродукции вируса иммунодефицита человека (ВИЧ) 1 типа в первично инфицированных лимфоидных клетках, включающий внесение антисмыслового олигодезоксинуклеотида, отличающийся тем, что в качестве олигодезоксинуклеотида используют тандемы коротких олигонуклеотидов, несущих гидрофобные и реакционноспособные группировки.
Размножение вирусов не осуществляется бинарным делением. Еще в 50-х годах прошлого века было установлено, что размножение осуществляется методом репродукции (в переводе с англ. reproduce – делать копию, воспроизводить), то есть путем воспроизведения нуклеиновых кислот, а также синтеза белка с последующим сбором вирионов. Данные процессы происходят в различных частях клетки так называемого хозяина (к примеру, в ядре или цитоплазме). Данный разобщенный метод репродукции вирусов называется дизъюнктивным. Именно на этом мы и остановимся подробнее в нашей статье.

Процесс репродукции
Данный процесс имеет свои особенности репродукции вирусов и отличается последовательной сменой некоторых стадий. Рассмотрим их по отдельности.
Вирусы не могут размножаться в питательной среде, так как они представляют собой строгие внутриклеточные паразиты. Кроме того, в отличие от хламидий или риккетсий, во время репродукции вирусы в клетке хозяина не способны расти и не размножаются методом деления. Все составные части данного вируса включают в себя нуклеиновые кислоты, а также белковые молекулы, которые синтезируются в "хозяйской" клетке раздельно, в различных частях клетки: в цитоплазме и в ядре. Помимо этого, белоксинтезирующие клеточные системы подчиняются одному вирусному геному, а также его НК.

Вирусная репродукция в клетке осуществляется в несколько фаз, которые описаны ниже:
Адсорбция
Под этой стадией репродукции вирусов подразумевается проникновение вирусной частицы в клетки. Адсорбция начинается на клеточной поверхности при помощи взаимодействия клеточных, а также вирусных рецепторов. В переводе с латинского слово "рецепторы" означает "принимающий". Они представляют собой специальные чувствительные образования, которые воспринимают раздражения. Рецепторы - это молекулы либо молекулярные комплексы, расположенные на поверхности клеток, а также способны распознавать химические специфические группировки, молекулы либо другие клетки, связывать их. У наиболее сложных вирионов такие рецепторы располагаются с внешней оболочки в виде шиповидного выроста или ворсинки, у простых вирионов они находятся, как правило, на поверхности капсида.

Механизм адсорбции на поверхности восприимчивой клетки основывается на взаимодействии рецепторов с так называемыми комплементарными рецепторами "хозяйской" клетки. Рецепторы вириона и клетки являются некими специфическими структурами, которые расположены на поверхности.
Аденовирусы и миксовирусы адсорбируются непосредственно на мукопротеиновых рецепторах, а арбовирусы и пикорнавирусы ― на липопротеиновых рецепторах.
У вириона миксовирусов нейраминидаза разрушает мукогфотеиновый рецептор и отщепляет N-ацетилнейраминовые кислоты от олигосахарида, который содержит в себе галактозу и галактозамин. Их взаимодействия на данном этапе обратимы, ведь на них значительно влияет температура, реакция среды и солевые компоненты. Адсорбции вириона препятствуют гепарин и сульфатированные полисахариды, несущие при этом отрицательный заряд, однако их ингибирующее воздействие снимается некоторыми поликарионами (экмолин, ДЭАЭ-декстран, протаминсулъфат), нейтрализующие отрицательный заряд от сульфатированных полисахаридов.
Попадание вириона в "хозяйскую" клетку
Путь внедрения вируса в чувствительную к нему клетку не всегда будет одним и тем же. Многие вирионы способны проникать в клетки методом пиноцитоза, что в переводе с греческого означает "пить", "выпивать". При данном методе пиноцитозная вакуоль будто бы втягивает вирион непосредственно внутрь клетки. Остальные вирионы могут проникать в клетку напрямую сквозь ее оболочку.

Контакт фермента нейраминидаза с клеточными мукопротеидами способствует попаданию вирионов в клетку среди миксовирусов. Результаты исследований последних лет доказывают, что ДНК и РНК вирионов от внешней оболочки не отделяются, т. е. вирионы проникают целиком в чувствительные клетки путем пиноцитоза или виропексиса. На настоящий момент это подтверждено в отношении вируса оспы, осповакцины, а также других вирусов, выбирающих средой обитания организм животных. Если говорить о фагах, они заражают нуклеиновой кислотой клетки. Механизм заражения основывается на том, что те вирионы, которые содержатся в вакуолях клеток, гидролизуются ферментами (липаз, протеаз), в процессе чего от оболочки фага освобождается ДНК и попадает в клетку.
Для проведения эксперимента выполнялось заражение клетки с помощью нуклеиновой кислоты, которая была выделена от некоторых вирусов, и вызывается один полный цикл репродукции вирионов. Однако в естественных условиях инфицирования при помощи такой кислоты не происходит.
Дезинтеграция
Следующий этап репродукции вирусов – дезинтеграция, которая представляет собой освобождение НК от капсида и внешней оболочки. После попадания вириона в клетки, капсид переживает некоторые изменения, приобретая чувствительность к клеточному протеазу, затем он разрушается, параллельно освобождая НК. У отдельных бактериофагов в клетки попадает свободная НК. Фитопатогенный вирус проникает через повреждение в клеточной стенке, а затем он адсорбируется на внутреннем клеточном рецепторе с одновременным высвобождением НК.
Репликация РНК и синтез вирусного белка
Следующим этапом репродукции вирусов является синтез вирусоспецифичного белка, который происходит с участием так называемых информационных РНК (у отдельных вирусов они находятся в составе вирионов, а у некоторых синтезируются только в зараженных клетках непосредственно на матрице вирионной ДНК или РНК). Происходит репликация вирусной НК.

Существует 2 вида РНК-полимераз. К таковым относятся: РНК-полимераза I, которая катализирует формирование репликативной формы непосредственно на матрице плюс-цепи, а также РНК-полимераза II, которая принимает участие в синтезе однонитчатой вирусной РНК на матрице репликативного типа. Синтез нуклеиновых кислот у мелких вирусов происходит в цитоплазме. Что касается вируса гриппа, то в ядре синтезируется внутренний белок и РНК. РНК выделяется затем из ядра и проникает в цитоплазму, в которой совместно с рибосомами начинает синтезировать вирусный белок.
После попадания вирионов в клетки, в них подавляется синтез нуклеиновой кислоты, а также клеточных белков. При репродукции вирусов, ДНК содержащих, на матрице в ядре синтезируется еще и-РНК, которая несет в себе информацию для синтеза белка. Механизм синтеза вирусного белка осуществляется на уровне клеточной рибосомы, а источником построения будет аминокислотный фонд. Активизация аминокислот осуществляется ферментами, при помощи и-РНК переносятся непосредственно в рибосомы (полисомы), в которых они располагаются уже в синтезированной молекуле белков.
Таким образом, в зараженных клетках синтез нуклеиновых кислот и белков вириона осуществляется в составе репликативно-транскриптивного сложного комплекса, который регулируется некой системой механизма.

Морфогенез вириона
Образование вирионов может произойти только в случае строго упорядоченного соединения структурных вирусных полипептидов, а также их НК. А это обеспечивается так называемой самосборкой молекул белка около НК.
Формирование вириона
Формирование вириона происходит с участием некоторых структурных компонентов, входящих в состав клетки. Вирусы герпеса, полиомиелита и осповакцины образуются в цитоплазме, а аденовирусы ― в ядре. Синтез вирусной РНК, а также формирование нуклеокапсида происходит непосредственно в ядре, а гемагглютинин формируется в цитоплазме. После этого нуклеокапсид перебирается из ядра в цитоплазму, в которой осуществляется образование оболочки вириона. Нуклеокапсид покрывается снаружи вирусными белками, а в состав вириона при этом включаются гемагглютинины и нейраминидазы. Именно таким образом происходит образование потомства, например, вируса гриппа.
Высвобождение вириона из "хозяйской" клетки
Из "хозяйской" клетки частицы вируса выделяются одновременно (во время разрушения клеток) либо постепенно (без каких-либо разрушений клеток).
Именно в таком виде и происходит репродукция вирусов. Вирионы высвобождаются из клеток, как правило, двумя способами.
Первый метод
Первый способ подразумевает следующее: после абсолютного созревания вирионов непосредственно внутри клетки они округляются, там образуются вакуоли, а затем разрушается и клеточная оболочка. По завершению этих процессов вирионы выходят все одновременно и полностью из клеток (пикорнавирусы). Данный способ принято называть литическим.

Второй метод
Второй способ подразумевает процесс освобождения вирионов по мере их созревания в течение 2―6 часов на цитоплазматической мембране (миксовирусы и арбовирусы). Выделению из клетки миксовирусов способствует нейраминидазы, разрушающие клеточную оболочку. Во время этого способа 75-90 % вирионов выходят спонтанно в культуральную среду, а клетки постепенно погибают.
Читайте также:


