Интерлейкин-28в и лечение гепатита с
OMIM - *607402
Локализация гена на хромосоме - 19q13.2
Ген IL28B кодирует белок интерферон-лямбда-3, который является лигандом цитокинового рецептора II класса. IL28B запускает JAK/STAT-сигнальный каскад, передающий информацию от внеклеточных полипептидных сигналов к промоторам генов-мишеней, блокируя синтез вирусных белков.
Генетический маркер rs12979860
Участок ДНК в регуляторной области гена IL28B, в котором происходит замена нуклеотида цитозина (С) на тимин (Т), обозначается как генетический маркер g.39738787C>T или rs12979860.
rs12979860 – обозначение однонуклеотидного полиморфизма по базе данных NCBI.
Возможные генотипы
Встречаемость в популяции
Встречаемость минорного (Т) аллеля в европейской популяции составляет 32 %.
Ассоциация маркера с заболеваниями
Маркер связан с генетической резистентностью к вирусным инфекциям и эффективностью лечения хронического гепатита С препаратами рибавирин ("Ребетол") и PEG-интерферон ("ПегИнтрон"). Полиморфизм IL28B определяет как вероятность самопроизвольной элиминации вируса, так и ответ на противовирусную терапию. Анализ назначается:
- перед началом терапии хронического гепатита С – прогнозирование ответа на лечение;
- при выборе тактики лечения хронического гепатита С.
Общая информация об исследовании
Вирус гепатита С в основном передается через кровь. Им поражено около 3 % населения мира. Инфекция вызывает острый гепатит и характеризуется отсутствием достаточного иммунного ответа. В 50-80 % случаев он переходит в хроническую форму и приводит к циррозу печени и гепатоцеллюлярной карциноме.
В настоящее время в качестве противовирусной терапии (ПВТ) гепатита С наиболее часто применяется сочетание двух препаратов – интерферона-альфа ("PEG-интерферона") и рибавирина, что подтверждается международными исследованиями и клинической практикой.
Основной задачей противовирусной терапии является профилактика цирроза печени и гепатокарциномы. Курс лечения хронического вирусного гепатита С продолжается 16-72 недели. При таком длительном применении данных препаратов развивается ряд выраженных побочных эффектов, так что в некоторых случаях лечение приходится прекратить. Эффективность противовирусной терапии зависит от многих факторов: генотипа вируса, исходной вирусной нагрузки, длительности инфицирования, обмена железа в организме, активности трансаминаз, избыточной массы тела, стеатоза печени, инсулинорезистентности, возраста, пола, алкогольной и наркотической зависимости, сопутствующих заболеваний, наличия выраженного фиброза.
Достижение устойчивого вирусологического ответа, а также определение риска побочных реакций при приеме противовирусных препаратов очень важны для больного. В последнее время, чтобы оценить эффективность начальной или повторной ПВТ, используют индивидуальный генетический фактор – статус гена IL28B. Наибольшее диагностическое значение он имеет при лечении ХГС, вызванного 1-м генотипом вируса. При ХГС, вызванном 2-м и 3-м генотипами вируса, полиморфизм гена IL28B значим только для пациентов, у которых не достигнут быстрый вирусологический ответ (отсутствие РНК вируса гепатита С на 4-й неделе лечения).
Распределение генотипов IL28B отличается в различных популяциях по всему миру и объясняет разную эффективность противовирусной терапии PEG-интерфероном и рибавирином в этнических группах.
Генетическое исследование рекомендуется выполнять перед началом противовирусной терапии для прогноза эффективности терапии и при выборе тактики лечения.
При выявлении у пациента генотипа СС наблюдается:
- двух-трехкратное увеличение вероятности формирования УВО на ПВТ;
- вирусная нагрузка (количество вируса в крови) до лечения выше, чем у носителей аллелей ТТ и СТ.
Генотип СС преимущественно выявляется среди людей со спонтанным разрешением инфекции.
Для пациентов с генотипами С/Т и Т/Т характерно снижение вероятности ответа на ПВТ, т. е. низкая эффективность лечения.
Роль полиморфизмов гена интерлейкина 28В в прогнозах лечения вирусного гепатита С
Вирусный гепатит С был объявлен европейской ассоциацией по изучению печени излечимым заболеванием. Это означает, что ограниченный по времени курс лечения противовирусными препаратами назначается пациенту один раз. В результате лечения достигается элиминация вируса из крови (устойчивый вирусологический ответ – УВО), нормализация биохимических показателей крови, улучшение состояния печени по данным УЗИ и эластометрии (снижение показателей фиброза вплоть до нормальных значений).
Однако, УВО достигается не всегда. Кроме того, среди пациентов, прошедших курс стандартной противовирусной терапии, возможны рецидивы заболевания. В этих случаях назначаются повторные курсы лечения, которые часто приводят к достижению УВО.
Отсутствие адэкватного анализа, позволяющего подтвердить выздоровление, а именно удаление вируса не только из крови, но и из печеночных клеток, заставляет гепатологов искать те факторы, которые влияют на прогноз эффективности лечения. К ним относятся факторы вируса – его генотип, и факторы хозяина. Среди этих факторов есть те, на которые нельзя влиять (пол, возраст, длительность заболевания, состояние печени на момент начала лечения), а также факторы, которые можно изменить (например, масса тела и особенности метаболизма).
Как показали исследования последних лет, особое влияние на результат лечения, а также возможность самостоятельного выздоровления при заражении вирусом гепатита С, оказывают генетические факторы, особенно полиморфизмы гена интерлейкина 28В.
Интерлейкин 28В является представителем интерферонов-лямбда, или интерферонов 3 типа, обладающих сильным противовирусным действием и подавляющих репликацию вируса гепатита С. Были изучены полиморфизмы гена интерлейкина 28В, связанные с устойчивым вирусологическим ответом. При определенных генотипах достижение устойчивого вирусологического ответа достигается в 2 раза чаще.
Для оценки прогноза гепатита С чаще всего используются два основных полиморфизма: rs12979860 и rs8099917. В зависимости от нуклеотидов в этих локусах, выделены аллели C (цитозин), T (тимин), G (гуанин) и соответствующие генотипы: для аллели rs12979860 — СС, СТ, ТТ, а также ТТ, ТG, GG для аллелей rs8099917. Получены данные, что генотип интерлейкина 28В является независимым и наиболее достоверным фактором, влияющим на частоту раннего и устойчивого вирусологического ответа на ПВТ среди других факторов прогноза. При этом полиморфизмы rs12979860 отвечают за получение ответа, а полиморфизмы rs8099917 тесно связаны с отсутствием ответа на ПВТ.
Более успешные результаты ПВТ получены у больных с генотипами СС rs1297960 и ТТ rs8099917 – более 70 %, по сравнению с генотипами rs1297960 СТ и ТТ и генотипами rs8099917 GT и GG – около 30 %. Определение полиморфизмов интерлейкина 28В позволяют прогнозировать вероятность достижения УВО с чувствительностью более 60 % и специфичностью около 80 %. Благоприятными аллелями являются rs1297960 CC и rs8099917 ТТ. Все другие генотипы определяют отрицательный прогноз.
Благоприятные генотипы часто ассоциируются с большей воспалительной активностью и стадией фиброза. Кроме того, отмечена связь полиморфизма rs12979860 Т с возникновением гепатоцеллюлярной карциномы. Носительство этого аллеля расценивается как независимый фактор риска в сочетании с другими известными факторами риска.
Определение генотипа интерлейкина 28В и учет других неблагоприятных факторов прогноза противовирусной терапии позволяет искать пути повышения эффективности лечения сразу при назначении терапии. Было показано, что увеличение дозы интерферона в 2 раза у пациентов с неблагоприятным генотипом интерлейкина 28В увеличивало эффективность лечения и снижало количество рецидивов значительно в меньшей степени, чем увеличение длительности лечения до 72 недель. Более того, у больных с благоприятным генотипом и быстрым вирусологическим ответом возможно укорочение сроков лечения до 24 недель.
Таким образом, связь генотипов интерлейкина 28В с достижением устойчивого вирусологического ответа достоверна. Изучение полиморфизма гена интрлейкина 28В наряду с другими факторами прогноза дает возможность более четко определить прогноз течения инфекции и эффективности лечения. Это важный шаг к индивидуализированной противовирусной терапии, позволяющий индивидуально определять сроки лечения и дозы препаратов, и не только увеличивая их, но и уменьшая. (Лечение гепатита С)
Аннотация научной статьи по клинической медицине, автор научной работы — Фазылов Вильдан Хайруллаевич, Ткачева Светлана Васильевна, Манапова Эльвира Равилевна, Созинова Юлия Михайловна
Похожие темы научных работ по клинической медицине , автор научной работы — Фазылов Вильдан Хайруллаевич, Ткачева Светлана Васильевна, Манапова Эльвира Равилевна, Созинова Юлия Михайловна
The identification of options interleukin 28b gene polymorphism as a predictor of effective antiviral therapy for chronic hepatitis C
определение варианта полиморфизма гена интерлейкина 28в как предиктора эффективности противовирусной терапии хронического гепатита с
ЭльвирА рАВилЕВнА МАнАпоВА, канд. мед. наук, ассистент кафедры инфекционных болезней
Ключевые слова: гепатит С, ген ИЛ-28В, противовирусная терапия, интерферон-а, рибавирин.
THE iDENTiFicATioN oF opTioNs iNTERLEuKiN 28B GENE polymorphism as a predictor of effective antiviral therapy for chronic hepatitis c
VILDAN кн. FAzuloV, SVETLANA V. TKACHEVA, ELVIRA г. MANApoVA, JuLIA M. SoHNoVA
Key words: hepatitis C, the gene IL-28B, antiviral therapy, interferon-а, ribavirin.
Комбинированная противовирусная терапия (ПВТ) хронического гепатита С (ХГС) пегилиро-ванными интерферонами-а (ПегИФН-а) и рибавирином (РИБ) остается стандартом лечения моноинфициро-ванных наивных пациентов, но является дорогостоящей и малодоступной [1, 2]. Индукционное введение стандартных ИФН-а, хотя и не относится к современным международным стандартам, но часто и не без успеха используется в практической медицине [3, 4]. В ежедневной схеме лечения стандартными ИФН-а сохраняется оптимальный баланс между противовирусной активностью и длительностью периода их по-лувыведения. Проведенные исследования показывают удовлетворительную переносимость приема индукционных доз стандартных ИФН-а, а при возникновении побочных реакций — возможность модификации доз, а также сопоставимость результатов по достижению стойкого вирусологического ответа (СВО) при использовании ПегИФН-а [3]. В последние годы ведется поиск предикторов эффективности ПВТ. Наряду с вирусной нагрузкой, генотипом вируса, стадией фиброза все большее внимание клиницистов привлекает возможность персонифицированного подхода к лечению заболевания, основанного на проведении генотипиро-вания самого хозяина и, таким образом, определения предрасположенности к исходу терапии. Полиморфизм ге12979860 и ге8099917 генов интерлейкина 28В (ИЛ-28В) оказывает существенное влияние на частоту достижения устойчивого вирусологического ответа. У пациентов белой расы — носителей генотипа СС (т.е. гомозиготы по аллели С) регистрируется 2-кратная разница (95%, ДИ 1,8-2,3) в частоте достижения СВО по сравнению с носителями генотипов СТ и ТТ полиморфизма М2979860 гена ИЛ-28В [5]. Данные пилотного ретроспективного исследования в группе больных ХГС в России [6] также продемонстрировали предварительные результаты, свидетельствующие о существенном значении вариантов полиморфизма гена ИЛ-28В как ^12979860, так и ге8099917 в достижении СВО в результате ПВТ.
Цель исследования — оценить эффективность индукционного метода введения стандартных интер-феронов при проведении комбинированной противовирусной терапии ХГС с учетом генотипирования пациента по ИЛ-28В.
Материал и методы. Под наблюдением находилось 89 больных (53% женщин и 47% мужчин) ХГС в возрасте (30,4±1, 1) года, ранее не получавшие ПВТ, с длительностью инфицирования (4,7±0,49) года; средний ИМТ составил (24,12±0,12) кг/м2. Исходные показатели активности НС^инфекции определялись высокой вирусной нагрузкой (РНК Н^>400 000 МЕ/ мл) у 55 (62%) больных, 1-м генотипом (НС^1) у 50 (56,1%) пациентов и уровнем аланинаминотрасферазы (АлАТ), который составил (68,6±7,90) Ед/л [у мужчин — (81,85±13,07) Ед/л; у женщин — (51,32±7,99) Ед/л при N=(22,6^1,26) и (19,23±1,27) Ед/л соответственно].
Пациенты получали ПВТ отечественными препаратами: а-ИФН2Ь индукционным методом по 5 млн ЕД/сут в течение 12 нед, затем по 3 млн ЕД/сут до окончания лечения в сочетании с рибавирином (дозы зависели от массы тела: 800—1200 мг/сут). Длительность ПВТ составляла 24—48 нед в зависимости от генотипа НСУ В случае отсутствия вирусологического ответа на 24-й нед лечения у больных НС^1 терапия отменялась.
В исследование не включались лица с аутоиммунными и другими хроническими декомпенсированными системными заболеваниями; пациенты с микст-гепатитами; с циррозом печени, а также имеющие степень фиброза больше F3 (по результатам пункционной биопсии печени или фиброэластометрии по шкале METAVIR); больные с алкогольной болезнью или принимающие алкоголь, психоактивные вещества (ПАВ); с нейтропенией Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
ВО, 48-я нед., n=11 6 (100%) — 5 (55,6%) — 9 (81,8%) — 2 (66,7%) —
СВО, n=20 5 (83,3%) 3 (75%) 4 (44,4%) 8 (80%) 6 (54,5%) 6 (75%) 2 (66,7%) 6 (85,7%)
1-м генотипом — 7 (77,8%). При анализе распределения больных по генотипам ИЛ-28 оказалось, что благоприятные варианты генотипов СС полиморфизма rs12979860 и ТТ полиморфизма rs8099917 в 1-й группе зарегистрированы у 8 (40%) и 12 (60%) пациентов, а во
Частота достижения БВО, РВО, ВО на 24-й и 48-й нед ПВТ, СВО в зависимости от полиморфизма генотипов rs12979860 и rs8099917 гена ИЛ-28В и генотипов HCV представлена в таблице. Максимальная частота вирусологического ответа получена у пациентов с HCV-1, имеющих генотипы СС rs12979860 и ТТ rs8099917 ИЛ-28В (БВО — 66,7 и 54,5%; РВО — 100 и 100%; СВО — 83,3 и 54,5% соответственно).
Заключение. На основании вышеизложенного, индукционный метод применения стандартных с(-ИФН2Ь в сочетании с рибавирином для противовирусной терапии ХГС является эффективным: СВО получен у 70,8% пациентов (у 52,9% больных с 1-м генотипом и 95,8% с 2-м и 3-м генотипами) c достижением биохимического ответа у 100% больных, ответивших на лечение, к 24-й нед диспансерного наблюдения. Наиболее эффективной терапия была у пациентов с HCV-1 при благоприятных генотипах СС rs12979860 и ТТ rs8099917 по ИЛ-28В. Необходимо подчеркнуть, что данные о ПЕН rs12979860 и rs8099917 не могут быть инструментом решения вопроса о назначении ПВТ или отказе от ее проведения, они позволяют лишь более точно определить шанс больного на излечение от ХГС при использовании конкретной схемы терапии. Результаты исследований генотипов по ИЛ-28 в сочетании с финансовой доступностью отечественных препаратов при индукционном методе ПВТ снижают экономические затраты на лечение больных ХГС.
1. Абдурахманов, Д.Т. Противовирусная терапия хронического гепатита С: этапы развития / Д.Т. Абдурахманов // Клиническая гепатология. — 2009. — № 2. — С. 26—33.
2. Моисеев, С.В. Лечение хронического гепатита С: результаты рандомизированных контролируемых исследований / С.В. Моисеев // Инфекционные болезни. — 2010. — Т. 8, № 3. — С.52—57.
3. Еналеева, Д.Ш. Хронические вирусные гепатиты В, С и D / Д.Ш. Еналеева, В.Х. Фазылов, А.С. Созинов. — М.: Медпресс-информ. — 2011. — 463 с.
4. Никитин, И.Г. Человеческий лейкоцитарный альфа-интерферон в комбинированной терапии больных хроническим гепатитом С, инфицированных не 1-м генотипом вируса/ И.Г. Никитин, Л.М. Гогова, И.Е. Байкова [и др.] // Клинические перспективы гастроэнтерологии и гепатоло-гии. — 2009. — № 1. — С.33—37.
5. Genetic factors and hepatitis C virus infection/ A.J. Thompson // Gastroenterology. — 2012. — Vol. 142. — P.1335—1339.
6. Козина, А.Н. Возможности персонифицированного подхода к лечению гепатита С на основании разработанных генетических тестов определения варианта полиморфизма гена ИЛ-28 / А.Н. Козина, Д.Д. Абрамов, Е.А. Климова [и др.] // Лечащий врач. — 2011. — №10. —

Определение генетического полиморфизма этого маркера имеет наибольшее значение для пациентов с генотипом 1 HCV, учитывая более низкую частоту ответа на стандартную противовирусную терапию. В некоторых исследованиях не было выявлено четкой связи между полиморфизмом IL28В и частотой устойчивого вирусологического ответа у таких пациентов [7]. Определение генотипа IL28В имеет большое значение для оценки потенциального ответа на противовирусную терапию и отбора пациентов, у которых возможны более короткие курсы лечения. В целом полиморфизм IL28В – это один из факторов, позволяющих индивидуализировать лечение хронического гепатита С [10]. В литературе есть данные о том, что полиморфизм гена IL28В ассоциирован развитием с гепатоцеллюлярной карциномы, индуцированной HCV [5]. Таким образом, представляется интересным изучение взаимосвязи полиморфизма этого гена с тяжестью поражения печени, в частности, с нарушениями функциональных печеночных проб, лабораторными тестами фиброза и регенерации печени, что поможет уточнить роль полиморфизма IL28В в патогенезе и прогрессировании ХГС.
Цель исследования – изучить взаимосвязь лабораторных маркеров цитолиза, холестаза, гиалуроновой кислоты (ГК), альфа-фетопротеина (АФП), уровня вирусной нагрузки (ВН) и генетического полиморфизма IL28B в участке rs12979860 у больных ХГC.
Материалы и методы исследования
Обследовано 100 пациентов с ХГС в фазе реактивации, госпитализированных в Пермскую краевую инфекционную клиническую больницу для начала проведения комбинированной противовирусной терапии. Средний возраст больных составил 38,3 ± 10,4 года, из них 48 мужчин и 52 женщины. Этиологическая верификация диагноза проводилась качественным и количественным определением в крови у пациентов РНК HCV с помощью полимеразной цепной реакции (ПЦР), а также серологических маркеров HCV. По генотипу HCV пациенты с ХГС разделились следующим образом: генотип 1 определен у 56 % больных, генотип 2 и 3 – у 44 %. Сопоставимая по полу контрольная группа включала 90 практически здоровых (доноров) лиц со средним возрастом 36,3 ± 7,9 лет, не имеющих заболеваний печени.
В настоящем исследовании мы проанализировали однонуклеотидную замену (SNP) в гене IL-28В (rs12979860) у 190 человек (90 доноров без хронических заболеваний печени и 100 пациентов с ХГС).
Распространенности гомозигот по аллелю С (СС) в группе здоровых и больных ХГС достоверно не отличались (χ2 = 0,61; р = 0,44) и составили соответственно 42 и 36 % (рисунок). Встречаемость патологических гомозигот ТТ в группе здоровых и больных ХГС составила соответственно 6 и 8 % (χ2 = 0,35; р = 0,55). В обеих группах преобладали гетерозиготы СТ (χ2 = 0,79; р = 0,67). Соотношение частот аллелей изучаемого маркера в исследуемых группах также не характеризовалось различием. Встречаемость патологического минорного аллеля Т в группе с ХГС составила 36 %, в группе контроля 32 % (χ2 = 0,64; р = 0,42). Полученные результаты по встречаемости генотипов и аллелей IL-28В (rs12979860) как для здоровых лиц, так и в группе ХГС среди популяции Пермского края практически не отличаются от данных других авторов. В частности, в России распространенность протективного аллеля С в популяции составляет 61–64 %, в наших исследованиях – 64 % у больных ХГС и 61 % в группе контроля [5, 10]. Таким образом, в ходе исследования не было установлено статистически значимого отличия частот генотипов и аллелей маркера IL-28В (rs12979860) между группами здоровых индивидуумов и лиц с ХГС. В группе больных ХГС частота аллеля риска Т составила 0,359, что достоверно не отличалось от его частоты 0,319 среди здоровых. Из 56 больных, инфицированных HCV-1, у 40 человек было выявлено неблагоприятное сочетание генотипов rs12979860 СТ и ТТ (35 и 5 соответственно), что значимо отличалось от группы контроля (χ2 = 4,55; р = 0,03). Таким образом, потенциальный риск развития неустойчивого вирусологического ответа при 1 генотипе HCV составил 71,4 %.
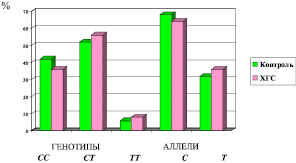
Распространенность генотипов и аллелей полиморфизма гена IL-28В (rs12979860) у больных ХГС и в группе контроля
При корреляционном анализе минорный аллель Т гена IL-28В (rs12979860) продемонстрировал достоверные взаимосвязи с функциональными печеночными тестами: АЛТ, АСТ, общим и прямым билирубином, что указывает на взаимосвязь полиморфизма гена и тяжести поражения печени. Эти данные также свидетельствуют о неблагоприятном влиянии выраженности цитолиза и холестаза на прогноз противовирусной терапии (табл. 2). Полученные результаты согласуются с данными исследования Agundez J.A. и соавт. (2009), которые выявили взаимосвязь генного полиморфизма с АЛТ, гамма-глютамилтранспептидазой, соотношением АСТ/АЛТ [3].
Взаимосвязи минорного аллеля Т гена IL-28В (rs12979860) с функциональными печеночными пробами, гиалуроновой кислотой и альфа-фетопротеином при ХГС
Воронежская государственная медицинская академия им. Н.Н. Бурденко
Хронический вирусный гепатит С продолжает оставаться актуальной проблемой современной инфектологии. По данным Всемирной организации здравоохранения (ВОЗ), около 3% населения планеты, или около 300 миллионов человек, инфицировано гепатитом С.
Уровень инфицированности в различных регионах мира колеблется от 0,6–1,4% в США, до 4–5% в африканских странах. В России регистрируется до трех миллионов инфицированных (около 2% населения) [2]. По частоте вирусный гепатит С (ВГС) стоит на одном из первых мест среди всех инфекций, передающихся парентеральным путем [2, 3, 11]. Хронический гепатит С (ХГС) является одной из причин формирования цирроза печени и гепатоцеллюлярной карциномы [11, 12]. В последние годы в России регистрируют более 6,5 тысяч случаев первичного рака печени, причиной которого, является гепатит С [2, 7]. По этой причине ХГС - ведущая причина трансплантации печени в России и в мире [1, 11]. Проблема усугубляется тем, что в течение длительного времени для большинства инфицированных типично длительное бессимптомное течение, вплоть до цирроза печени [9].
Цель работы: изучить влияние полиморфизма гена IL-28В (rs12979860 и rs8099917) на эффективность проводимой комбинированной ПВТ у больных ХГС.
Материалы и методы. За период с 2010 по 2011 г. на базе БУЗ Областной клинической инфекционной больницы г. Воронежа обследовались и лечились 36 пациентов (19 мужчин и 17 женщин) с диагнозом ХГС. Все пациенты обследовались согласно общепринятым стандартам. Этиологическая верификация диагноза проводилась на основании обнаружения в сыворотке крови РНК вируса гепатита С с помощью полимеразной цепной реакции (ПЦР). ПЦР-диагностика проводилась в режиме real-time, чувствительность использованных тест-систем (РНК HCV Амплисенс) составляла 50 копий/мл. Всем больным проводилось определение генотипа НСV. Из числа обследованных больных генотип 1в обнаруживался у 25 пациентов, 3а был зафиксирован у 11 человек. При необходимости у больных проводилось количественное определение РНК HCV в крови. Количество вируса в сыворотке крови наблюдалось в широких пределах от 2,9х103 до 3,7х106.Также определялись серологические маркеры (а-HCV-IgG, а-HCV-IgM) с использованием иммуноферментного анализа (ИФА).
Средний возраст больных составил 54,1±18,7 лет. Продолжительность болезни, по данным эпидемиологического анамнеза, составил от 1 до 13 лет.
В биохимическом исследовании крови у всех больных ХГС показатели сывороточных аминотрансфераз были выше нормы. Большинство пациентов (72,2%) имели уровень аланинаминотрансферазы (АЛТ) до 3 норм. Показатели АЛТ до 5 норм выявлены у 22,2% пациентов. Высокая активность АЛТ (более 5 норм) была обнаружена только у 5,5% пациентов. У всех исследуемых больных регистрировались различные сопутствующие соматические заболевания. Чаще всего отмечалась патология желудочно-кишечного тракта (хронический панкреатит, дуоденит, гастрит, язвенная болезнь желудка и двенадцатиперстной кишки). Эта группа заболеваний выявлена у 83,3% больных ХГС. Патология желчевыводящих путей, такие как, дискинезия желчевыводящих путей и хронический холецистит наблюдались у 75% пациентов. Болезни сердечно-сосудистой и эндокринной систем встречалась у 58,3% и 11,1% соответственно. При ультразвуковом исследовании у всех больных наблюдались гепатомегалия и диффузные изменения печени.
Всем больным была выполнена пункционная биопсия печени (ПБП) по Mengini дважды (до и после лечения противовирусными препаратами). Проводился морфологический анализ полученных гистологических препаратов, оценивая параметры активности гепатита по R.G. Knodell с соавторами (1981) [10] и фиброза по V. Desmet (1995) [6] с использованием систем METAVIR. Минимальная степень активности (1–3 балла) была зарегистрирована у 66,7% пациентов, низкая степень активности (4–8 баллов) наблюдалась у 27,8% больных, умеренная степень активности (9–12 баллов) выявлялась реже – в 5,5% случаев. Гистологическая активность более 13 баллов выявлено не было. У большинства больных фиброз отсутствовал или был слабо выражен. С фиброзом 0 баллов наблюдалось 52,8% пациентов. Слабый фиброз был выявлен у 22,2%, умеренный и тяжелый фиброз наблюдался в 8,3% случаев. Цирроз печени выявлен у 16,6% исследуемых больных. Помимо этого, у 30,6% (11 пациентов) дополнительно была проведена фиброэластометрия ткани печени на аппарате Fibroscan FS-502 (Echosens, Франция) с выявлением стадии фиброза по шкале Metavir. Из них степень фиброза F0 была выявлена у 63% пациентов, F2 – у 27,3%, F4 – у 9% больных.
Помимо общеклинических методов обследования, у всех больных проводилось полное серологическое обследование на маркеры вирусных гепатитов В, D, HIV с использованием методов ИФА, проводилось определение содержания α-фетопротеина, концентрации железа и меди в сыворотке крови. У всех больных в анамнезе была проведена комбинированная ПВТ (20 пациентов получали лечение с использованием препаратов интерферона короткого действия и 16 человек – пегилированные интерфероны). Обе схемы лечения включали в комплексную терапию рибавирин. Длительность терапии составила 24 и 48 недель в зависимости от генотипа HCV. Достижение устойчивого вирусологического ответа (УВО) оценивалось как показатель эффективности терапии. УВО – неопределяемый уровень РНК HCV в сыворотке крови через 24 недели после прекращения терапии [5]. Всем пациентам было проведено определение полиморфизма гена IL-28В (rs12979860 – генотипы CC, CT, TT и rs8099917 – генотипы TT, TG, GG) с помощью ПЦР в режиме реального времени. Все больные исследуемых групп были рандомизированы по основным клинико-лабораторным показателям.
При статистической обработке результатов исследования, имеющих нормальное распределение, количественные признаки выражались как М±s (среднее ± стандартное отклонение). Во всех выборках проверяли гипотезу нормальности распределения по критерию Колмогорова-Смирного. Для оценки достоверности различий выборок использовали непараметрический критерий Манна-Уитни. Все различия считались достоверными при значении р
Список использованных источников:
1. Влияние полиморфизма интерлейкина 28В на раннюю кинетику HCV у больных, получающих противовирусную терапию после ортотопической трансплантации печени/ В.Е. Сюткин и др.// Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2011. - №6. – С. 49–55.
2. Дерябин П.Г. Распространение гепатита С в России становится социальной проблемой// СанЭпидемКонтроль. – 2009. - №4. – С. 34-38.
3. Исаков В.А. Современная терапия хронического вирусного гепатита С: какая длительность комбинированной терапии оптимальна и почему?// Клиническая гастроэнтерология и гепатология. – 2009. - №2. – С. 9-12.
4. Роль полиморфизма гена интерлейкина 28В в оценке эффективности противовирусной терапии хронического гепатита С / Т.Н. Лопаткина, И.С. Кудлинский// Клиническая гепатология. – 2011. - №2. – С. 28-38.
5. Современные схемы лечения больных хроническим гепатитом С/ В.Т.Ивашкин и др. - Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2012. - №1. – С. 36–44.
6. Классификация хронического гепатита: диагностика, определение степени тяжести и стадии течениям V. Desmet, M. Gerber, J.H. Hoofnagle / Российский журнал гастроэнтерологии, гепатологии, колопротологии. – 1995. № 2. - Р. 38-45.
7. Deuffic–Burban S. Impact of pegylated interferon and ribavirin on morbidity and mortality in patients with chronic hepatitis C and normal aminotransferases in France// Hepatology. – 2009. - №50. – P. 1351-1359.
8. Development of novel treatment for hepatitis C D.P. Webster et al. / Lancet. – 2010. - №45. – P. 349-355.
9. Empirically calibrated model of hepatitis C virus infection in the United States J. Salomon et al.// Am J Epidemiol. – 2002. - №156. – P. 761-773.
10. Formulation and application of numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis/ R.G. Knodell, K.G. Ishak// Hepatology. – 1981. - №1. - Р. 431-435.
11. Global epidemiology of hepatitis C virus infection/ C. Shepard, L. Finelli, M. Alter// Lancet. – 2005. №5. – P. 558-567.
12. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide/ J. Perz, G. Armstrong, L. Farrington// Hepatology. – 2006. - №45. – P. 529-538.
Симанкова Т.В., Гармаш И.В., Аришева О.С., Манухина Н.В.
Кафедра факультетской терапии РУДН, Москва
Хроническая инфекция ВГС снижает производительность труда, повышает риск развития серьезных депрессий, увеличивает использование медицинских ресурсов здравоохранения, увеличивает процент смертности. Анализ 17000 страховых случаев показал, что в группе больных с вирусным гепатитом С, по сравнению с неинфицированными, риск развития депрессии выше в 2 раза, гепатоцеллюлярной карциномы – в 25 раз, необходимости трансплантации печени – в 60 раз, развития цирроза печени – в 80 раз [5].
Рис. 1 Частота достижения УВО при комбинированной терапии хронического гепатита С препаратами пегилированного интерферона и рибавирином в зависимости от генотипа HCV

Индивидуальный подход к лечению (подбор оптимальных доз препаратов и длительности терапии в зависимости от прогностических факторов), повышение приверженности пациентов к лечению, своевременная профилактика и коррекция нежелательных явлений обеспечивают повышение эффективности лечения, но, в целом, почти в 40% случаев противовирусная терапия оказывается неэффективной [2].
Таким образом, существует необходимость в повышении эффективности, безопасности, переносимости и доступности противовирусной терапии, в первую очередь для пациентов следующих категорий:
- с наличием противопоказаний к применению интерферона альфа и/или рибавирина
- плохой переносимостью интерферона альфа,
- с генотипом 1 и высокой вирусной нагрузкой,
- с декомпенсированным циррозом печени,
- с рецидивом инфекции после трансплантации печени,
- с коинфекцией ВИЧ и HBV,
- с генетическим полиморфизмом ТТ/ТС гена ИЛ-28В(для ПНП rs12979860) и ТG/GG (для ПНП rs8099917) [2].
Современные подходы к терапии вирусного гепатита С
До настоящего момента основной терапией хронического гепатита С является комбинация препаратов пегилированного интерферона и рибавирина. Однако, терапия интерфероном для многих больных оказывается неэффективной или сопряжена с рядом серьезных побочных эффектов. Современные научные достижения привели к разработке десятков новых препаратов для лечения вирусного гепатита С. Значительное количество новых соединений с различным механизмом действия (иммуномодуляторы, терапевтические вакцины, новые молекулы интерферонов, ингибиторы репликации вируса, блокаторы проникновения вируса в клетку) либо находятся на стадии разработки, либо проходят обширные клинические испытания [7,8].
Особый интерес вызывают так называемые противовирусные препараты прямого действия, которые подавляют или блокируют ключевые внутриклеточные этапы репликации вируса, прежде всего ингибиторы протеазы и полимеразы вируса. Полагают, что ингибиторы протеазы NS3/4aблокируют расщепление вирусного полипротеина на различные структурные компоненты, а ингибиторы полимеразы NS5B нарушают процесс синтеза вирусной РНК [2].
Обсуждаются две стратегии модернизации базисного лечения хронического гепатита С: добавление одного или двух препаратов прямого противовирусного действия к стандартной на сегодняшний день терапии пегилированным интерфероном и рибавирином, или применение комбинации только пероральных препаратов прямого действия для подавления вируса гепатита С на разных этапах его жизненного цикла. Последний подход успешно применяется с целью контроля (но не лечения) ВИЧ-инфекции. Тройная терапия (препарат прямого действия плюс стандартная терапия) представляется более эффективной по сравнению с таковой без включения препарата прямого действия, и может позволить сократить длительность лечения. Однако, тройная терапия имеет ряд недостатков, таких как увеличение количества побочных эффектов и повышение стоимости лечения. Известно, что стандартная терапия, включающая пегилированный интерферон и рибавирин, оказывает наряду с противовирусным иммунологический эффект за счет модуляции имунного ответа организма и уничтожения инфицированных вирусом клеток. Препараты прямого действия способны подавлять репликацию вируса, но никто на данный момент не знает, сможет ли комбинированная терапия препаратами прямого действия оказывать иммунологический эффект, подобный пегинтерферону. Результаты исследования, в рамках которого оценивается эффект от различных схем лечения хронического гепатита С, в том числе схем без включения пегилированного интерферона, ожидаются в 2012 г. [9,10,11].
Эффективность препаратов прямого действия может быть значительно ограничена ввиду лекарственной устойчивости. Она обусловлена появлением мутаций в процессе репликации вируса. Резистентность может наблюдаться к одному или нескольким классам препаратов прямого действия даже у лиц, никогда ранее их не получавших. В ряде случает генетические мутации, приводящие к лекарственной устойчивости, появились непосредственно во время клинических испытаний, даже когда препарат прямого действия был использован с пегинтерфероном и рибавирином. Так, например, мутации в позиции A156 или R155 придают устойчивость ВГС почти ко всем ингибиторам протеаз [9,10,11].
Прогнозирование результатов лечения вирусного гепатита С
Наряду с генотипом вируса выделяют ряд факторов, оказывающих влияние на эффективность противовирусной терапии. Это факторы хозяина (возраст, расовая принадлежность, масса тела, выраженность фиброза печени, наличие сопутствующих заболеваний, в частности сахарного диабета или инсулинорезистентности, генетический полиморфизм ИЛ-28В, приверженность пациента к лечению) и вирусные факторы (исходный уровень виремии и ее динамика в процессе лечения, генотип вируса гепатита С) [7,10] Табл. 1.
Табл. 1. Предикторы ответа на стандартную (Пегинтерферон в комбинации с Рибавирином) противовирусную терапию хронического вирусного гепатита С.
Предикторный фактор
Благоприятное значение
Неблагоприятное значение
Генотип вируса гепатита С
(в частности сахарный диабет, инсулинорезистентность)
РНК HCV>400000 МЕ/мл
Наличие раннего вирусологического ответа (РВО), устойчивого вирусологического ответа (УВО)
Адекватная длительность ПВТ
Своевременная коррекция нежелательных явлений, связанных с ПВТ
Приверженность пациентов к лечению
-полинуклеотидная последовательность rs12979860
- полинуклеотидная последовательность rs8099917;
Следует подробнее рассмотреть роль такого предикторного фактора, как генетический полиморфизм ИЛ-28В, являющегося в настоящий момент объектом прицельного изучения. В ближайшем будущем, вероятно, использование данных о полиморфизме ИЛ-28В будет иметь большое значение в выборе стратегии лечения ВГС, особенно в контексте новых методов лечения с применением препаратов прямого противовирусного действия.
Открытие полиморфизма гена ИЛ-28B
Хорошо известно, что различные генетические вариации в структурах генов оказывают влияние на проявление, течение и восприимчивость к терапии того или иного заболевания. Для поиска простых нуклеотидных полиморфизмов (ПНП), связанных с развитием определенных заболеваний или с различиями в их клинических проявлениях, проводятся полногеномные исследования связей (genome-wideassociationstudies – GWAS). По результатам таких исследований создаются базы данных наиболее распространенных гаплотипов (ПНП, встречающихся более чем у 5% населения), ответственных за болезнь и ее проявления (фенотип). Более 10 лет ведется поиск генетических факторов, определяющих спонтанный или индуцированный лечением клиренс HCV-инфекции у больных хроническим гепатитом С [3, 13,14].
В 2009 г. D. Ge и соавторы определили в 19 хромосоме простую нуклеотидную последовательность на расстоянии 3 килобаз от гена ИЛ-28В, которая, с учетом локализации, была обозначена как rs12979860. В зависимости от нуклеотида, располагающегося в данном локусе, выделены 2 аллеля: rs12979860 С (цитозин) и rs12979860 Т (тимин). Исходя из комбинации аллелей, возможны 3 варианта генотипа ИЛ-28В: СС, СТ и ТТ. В зависимости от частоты встречаемости в популяции аллели rs12979860 С являются мажорными, т.е. встречаются чаще, а аллели rs12979860 Т – минорными [3, 16].
Первые работы по изучению полиморфизма ИЛ-28В, результаты которых были опубликованные ассоциацией исследователей генома, проводились исключительно на группе пациентов с 1 генотипом ВГС. В дальнейшем, большинство из этих пациентов, четверть из которых являлись либо афроамериканцами, либо латиноамериканцами, были включены в исследование IDEAL. В целом, у пациентов с CC генотипом скорость УВО была в 2 раза выше, по сравнению с пациентами с генотипом ТТ. Эта зависимость была прослежена среди разных этнических групп, независимо от приверженности к лечению (Рис. 2). Генотип СС оказался сильным предиктором УВО, независимо от вирусной нагрузки, стадии фиброза и этнической принадлежности. Дальнейшие исследования с участием европейской и американской когорт пациентов подтвердили ранее сделанные выводы. Наличие Т аллеля являлось прогностическим фактором неудачи лечения [3, 17, 18, 19].
Кроме этого, в 2009 г. Y. Tanaka и соавторы в ходе исследования азиатской когорты пациентов с 1 генотипом HCV обнаружили в 19 хромосоме вблизи гена ИЛ-28В дополнительную полинуклеотидную последовательность rs8099917, среди аллелей которой Т аллель являлся мажорным, а G аллель - минорным. В результате данного исследования было выявлено, что эффект от проводимой ПВТ был выше у пациентов с генотипом ТТ, по сравнению с генотипами GT и GG. В случае генотипов GT и GG наблюдалось отсутствие ответа на ПВТ у 82% и 100% пациентов. Таким образом, наличие аллеля rs8099917 G явилось неблагоприятным фактором в лечении хронического гепатита С, вызванного 1 генотипом HCV [17, 18].
Рис. 2 Частота УВО в зависимости от полиморфизма гена ИЛ-28В в различных этнических группах [16, 19]

В 2010 г. S.Li и сооавторами был проведен мета-анализ 7 исследований, проведенных в 2009 г. с участием 4791 пациента с хроническим гепатитом С. Полученные данные позволили подтвердить связь УВО с различными полиморфизмами гена ИЛ-28В. Наилучший ответ на проводимую противовирусную терапию наблюдался у пациентов с генотипами rs12979860 СС (УВО у 70,5%) и rs8099917 ТТ (УВО у 73,0%) по сравнению с генотипами rs12979860 СТ и rs12979860 ТТ (УВО у 32,0% и 23,3% ) и генотипами rs8099917 GT и GG (УВО у 35,8% и 32,5% соответственно) Рис.3.
Рис. 3 Частота достижения УВО в зависимости от полиморфизмов гена ИЛ-28В для ПНП rs12979860, rs8099917

Эпидемиология
Среди разных этнических групп распределение аллелей различается. D.Thomas и соавторы (2009 г.) на основании большого популяционного исследования с участием более 2000 пациентов из разных районов мира пришли к выводу, что аллель С с высокой частотой обнаруживается у представителей Восточной Азии, чуть реже – в Европе, Центральной и Южной Америки, и реже всего в Африке. Таким образом, разницей частоты встречаемости благоприятного аллеля С может быть объяснена разница в частоте УВО между афроамериканцами и пациентами европейского происхождения [19, 20] Рис. 4.
Рис. 4 Частота встречаемости генетических вариаций гена ИЛ-28В в различных этнических группах

Полиморфизм гена ИЛ-28В и генотип вирусного гепатита С
Определение генетических вариаций наиболее ценно для пациентов с генотипом 1 ВГС, учитывая наиболее низкую частоту ответа на стандартную противовирусную терапию. Исходя из этого, большинство работ, посвященных изучению генетического полиморфизма ИЛ-28 В включают пациентов именно с генотипом 1 ВГС. В отличие от данных, касающихся влияния полиморфизма ИЛ-28В на эффективность противовирусной терапии у пациентов с генотипом 1, предикторная роль ИЛ-28В у пациентов с генотипом 2 или 3 противоречива. В проведенных исследованиях не было продемонстрировано четкой связи между полиморфизмом ИЛ-28В и УВО у пациентов с генотипом 2 и 3, в отличие от пациентов с генотипом 1 [21].
Полиморфизм гена ИЛ-28В и ранний вирусологический ответ (РВО)
Наиболее важным прогностическим фактором во время курса противовирусной терапии является изменение в сыворотке крови уровня РНК ВГС. Наличие раннего вирусологического ответа (РВО) прогнозирует достижение УВО у 90% пациентов с генотипом 1 ВГС. Напротив, отсутствие РВО – отрицательный предиктор в отношении УВО практически в 100% случаев. В ряде работ также показана роль полиморфизма ИЛ-28B в прогнозировании этих параметров. Исследования по оценке ранней вирусной кинетики в течение терапии показали, что у пациентов с СС снижение уровня РНК ВГС в крови происходит значительно быстрее. Кроме того, достижение РВО тесно связано с полиморфизмом ИЛ-28В независимо от этнической принадлежности пациентов [19].
Полиморфизм гена ИЛ-28В и спонтанная вирусологическая элиминация
Отмечено, что наличие аллеля С встречается реже у пациентов с 1 генотипом HCV. Исследователи предположили, что наличие С аллеля может быть связано со спонтанным выздоровлением. Тот же вывод был сделан на основании крупномасштабного исследования с участием более 1000 человек, где частота спонтанного выздоровление была выше у пациентов с СС генотипом, нежели у пациентов с СТ и ТТ генотипами. Кроме того, прочная связь между CC генотипом и спонтанным клиренсом присутствует и в белой и черной расах [22].
В 2010 г. D. Grebely и соавторы оценили роль генетического полиморфизма ИЛ-28В в спонтанном и индуцированном лечением клиренсе ВГС. В исследование были включены 163 пациента с хроническим гепатитом С. 132 пациента из них не принимали ПВТ. Первоначально исследовали возможность спонтанного клиренса без генотипирования ИЛ-28В. Спонтанная элиминация наблюдалась в 23% случаев (у 30 из 132 пациентов). После генотипирования в rs8099917 спонтанный клиренс выявлен у 0%, 11% и 32% пациентов с генотипами GG, GT, и TT. У пациентов, сохранивших приверженность к лечению, был достигнут УВО в отношении генотипа ТТ (62%), GG/GT генотипа (64%). Таким образом, генотип rs8099917 ТТ стал единственным предиктором спонтанного выздоровления. Важно отметить, что в данном исследовании обнаружена связь полиморфизма ИЛ-28В со спонтанным клиренсом, а не с выздоровлением, индуцированным приемом противовирусной терапии. Для пациентов с генотипами rs8099917 GG или rs8099917 GT, учитывая низкую вероятность спонтанного клиренса, допустимо назначение противовирусной терапии до начала клинических проявлений [26].
Полиморфизм гена ИЛ-28В и тройная терапия вирусного гепатита С
В настоящее время проводится ряд исследований, целью которых является определение эффективности тройной терапии с включением одного из ингибиторов протеаз ВГС (Телапревира или Боцепревира) в сравнении со стандартной терапией пегилированным интерфероном и рибавирином. В качестве прогностического фактора у части больных, включаемых в исследования, определяется генотип ИЛ-28В.
В исследовании ADVANCE пациенты с 1 генотипом ВГС получали телапревир в сочетании с пегилированным интерфероном и рибавирином 8 или 12 недель, а затем комбинированную терапию пегилированным интерфероном и рибавирином 24 или 48 недель. 90% больных с генотипом СС, получающих тройную терапию, достигли УВО, а у 78% из них была возможность сократить сроки лечения до 24 недель. Эти результаты были сопоставимы с УВО в 64% случаев при стандартной ПВТ пегилированным интерфероном и рибавирином в течение 48 недель [23].
В 3 фазу исследования REALISE были включены пациенты, не ответившие на стандартную терапию и больные с рецидивом инфекции после ПВТ. В данной группе пациентов носительство генотипа СС оказалось сниженным до 18%, а носительство генотипа СТ достигло 63%. Тройная терапия с телапревиром проводилась по схеме, аналогичной в исследовании ADVANCE. В группе больных, получающих тройную терапию частота УВО оказалась в 3 раза выше по сравнению с группой контроля, включающей пациентов, получающих комбинированную терапию пегилированным интерфероном и рибавирином [24].
Эффективность тройной терапии с применением боцепривира у больных вирусным гепатитом С определялась в исследованиях SPRINT-2 (группа ранее не леченных пациентов) и RESPOND-2 (группа пациентов, не ответивших на ранее проводимую терапию). В обоих исследованиях в группе сравнения проводилась стандартная ПВТ пегилированным интерфероном и рибавирином. В основных группах к стандартной терапии после 4 недели добавлялся боцепревир в течение 24 (SPRINT-2), 32 или 44 недель (RESPOND-2). При отсутствии репликации HCV на 24 неделе лечение прекращалось. Среди пациентов с генотипом СС 90% (SPRINT-2) и 80% (RESPOND-2) пациентов получили 24-недельную ПВТ. При этом у ранее не леченных пациентов с генотипом СС УВО был достигнут в 78-82% не зависимо от режима терапии. У ранее не леченных пациентов при наличии аллеля Т, а также у пациентов не ответивших ранее на ПВТ, УВО при тройной терапии достигался в среднем в 2-2,5 раза чаще, чем при стандартной терапии [25].
Таким образом, в исследованиях с участием телапревира и боцепревира в составе трехкомпонентной терапии, генотип ИЛ-28В явился сильным предиктором УВО как у пациентов, ранее не получающих противовирусную терапию, так и у пациентов-неответчиков на стандартную терапию.
Полиморфизм гена Ил-28В и стратегия лечения хронического гепатита С
Полиморфизм Ил-28В является предиктором эффективности противовирусной терапии, независимым от других прогностических факторов, в том числе этнической принадлежности, стадии фиброза, пола, вирусной нагрузки. Генотип Ил-28В достаточно чувствителен и специфичен в отношении УВО, когда оценивается изолировано. Определение генотипа ИЛ-28В наряду с клиническими предикторами может внести значительный вклад в оценку способности пациента реагировать на противовирусную терапию. Также ИЛ-28B может играть важную роль в отборе лиц, которые могут быть пролечены более короткими курсами ПВТ.
В настоящее время становятся доступными препараты прямого противовирусного действия для лечения хронической вирусного гепатита С. Генотип ИЛ-28B может играть важную роль в определении необходимости включения в схему противовирусной терапии препаратов прямого противовирусного действия или целесообразности использования стандартной схемы. В целом, ИЛ-28В должен быть одним из факторов, определяющим индивидуальный подход к лечению ВГС. Текущие и планируемые клинические исследования будет способствовать дальнейшему влияния генетического полиморфизма ИЛ-28B на эффективность ПВТ, что существенно повлияет на стратегию лечения ВГС, особенно в контексте внедрения препаратов прямого противовирусного действия.
Читайте также:


