Ires-элемент мрнк вируса паралича сверчка



1.1. Структу ра I
1.1.1. Структу ра домена II
1.1.2. Структура домена III.
1.1.3. Структура соединения ШаЬс.
1.2. Стадии Iзависимой инициации трансляции РНК ГС и факторы необходимые для этого процесса.
1.2.1. Образование бинарного комплекса.
1.2.2. Образование инициаторного комплекса.
1.2.3. Образование инициаторного комплекса.
1.3. Альтернативный способ I зависимой инициации трансляции у ВГС
1.4. Функциональная роль доменов I ВГС в инициации трансляции
1.4.1. Функциональная роль домена III
1.4. 1. 1. Влияние мутаций I ВГС па эффективность инициации трансляции.
1.4.1.2. Участие домена III в связывании I ВГС с субчастицей
1.4.1.3. Участие домена III I ВГС в его связывании с I3.
1.4.1.4. Участие домена III I в формировании и комплексов инициаци.
1.4.2. Функциональная роль домена II.
1.4.2.1. Участие домена И в высвобождении фактора 2
1.4.2.2. Влияние структуры домена И на функционирование I ВГС.
1.4.2.3. Взаимосвязь домена II и рибосомпого белка
1.4.3. Функциональная роль других районов
1.5. Структура комплексов инициации I ВГС поданным криоЭМ и сшивок
1.5.1. Взаимодействие I с субчастицсй рибосомы
1.5.2. Комплекс I ВГС с фактором инициации I3.
1.5.3. Структур пая модель II3 комплекса.
1.5.4.8инициаторный комплекс
1.5.4.1. Конформационные перестройки субчастиц, вызванные связыванием I ВГС с рибосомой
1.5.4.2. Структура I ВГС в комплексе
1.5.4.3. Контакты I ВГС в вОЯкомплексе
1.6. Дополнительные факторы, влияющие на эффективность трансляции мРЫК вируса гепатита С.
1.7. Заключение.
ГЛАВА 2. Экспериментальная часть.
2.1. Материалы.
2.2. Выделение рибосомных субчасгиц из плаценты человека.
2.3. Наработка и выделение плазмиды X2
2.4. Получение I ВГС с помощью Т7транскрипции
2.4.1. Получение статистически Рмсченого I ВГС.
2.4.2. Получение биотинилированого слабомеченого I ВГС.
2.5. Фосфорилирование олигонуклеотидов по 5концу.
2.6. Получение 4ГчхлорэтилЫметиламинобензил5фосфамидов олигодсзоксирибонуклсотидов
2.7. Сайтнаправленное введение фотоактивируемой группы в I ВГС
2.7.1. Комплементарноадресованная модификация I ВГС
2.7.2. Гидролиз фосфамидной связи
2.7.3. Введение перфторфенилазидогруппы
2.8. Гидролиз ковалентных аддуктов I ВГС с помощью РНКазы Н
2.9. Определение модифицированных нуклеотидов в I ВГС с помощью метода обратной транскрипции
2 Получение бинарных комплексов рибосомных субчастиц с I ВГС и его фотоактинируемыми производными.
2 Определение степени связывания I ВГС и его производных с субчастицами.
2 Фотоаффинная модификация субчастиц производными I ВГС.
2 Выделение бинарных комплексов субчастиц с 1 ВГС и его фотактивируемыми производными с помощью сахарозного градиента.
2 Разделение модифицированных субчасгиц на РНК и белки с помощью сахарозного градиента
2 Выделение суммарной РНК из модифицированных субчастиц
2 Анализ модификации рРНК электрофорезом в агарозе.
2 Выделение рибосомных белков из комплексов субчастиц с производными I ВГС
2 Выделение рибосомных белков, сшитых с производными биотинилированного I
2 Выделение суммарного белка субчастицы экстракцией уксусной кислотой
2 Определение модифицированных рибосомных белков с помощью одномерного гельзлектрофореза
2 Определение модифицированных рибосомных белков с помощью двумерного гельэлектрофореза
2 Анализ модифицированных белков с помощью иммунопреципитации
ГЛАВА 3. Молекулярное окружение Iэлсмента ГНК вируса гепатита С на субчастице рибосомы человека.
3.1. Исследование роли различных доменов I ВГС в связывании с
субчастицей
3.1.1. Критерии выбора олигодезоксирибопуклеотидов для
комплементарноадресованной модификации.
3.1.2. Получение ковалентных аддуктов Рмеченого I ВГС с производными олигодезоксирибонуклсотидов
3.1.3. Анализ связывания аддуктов I ВГС с рибосомными субчастицами.
3.2. Получение и характеризация производных I ВГС.
3.2.1. Введение фотактивируемых групп в определенные положения I ВГС.
3.2.2. Определение модифицированных нуклеотидов I ВГС
3.2.3. Связывание фотоактивируемых производных I ВГС с субчастицами
3.3. Определение компонентов субчастнцы, сшивающихся
с производными 1 ВГС
3.3.1. Сшивка производных I ВГС с субчастицей и анализ модификации
3.3.2. Определение белков, сшитых с производными I ВГС
в бинарном комплексе
3.3.2.1. Особенности идентификации сшитых белков.
3.3.2.2. Определение белков субчастицы, сшитых с РНК IV и VII.
3.3.2.3. Определение белков, сшитых с РНК III, V и VIII.
3.4. Рибосомные компоненты, окружающие I ВГС субчастице
3.5. Соотнесение полученных данных с данными криоэлектронной микроскопии
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ.
ПРИНЯТЫЕ СОКРАЩЕНИЯ
I одномерный 2 двумерный
бактериальная малая рибосомная субчастица
, и эукариотические малая, большая рибосомные субчастицы и рибосома
5 и ЗНТО 5 и Знетранслирусмые области мРНК
, и т.д. общепринятые обозначения 5трифосфатов нуклеозидов
бромфеноловый синий
I 4М2хлорэтилМметиламинобензиламин
димстилсульфоксид
1,4дитио0,Ьтреитол
зтилсндиаминтетрауксусная кислота
гуанилилимидодифосфат
Ы2гидроксиэтилпиперазинЫ2этансульфоовая кислота НАс уксусная кислота
1 внутренний сайт посадки рибосомы от англ. I i i
ацетат натрия
2Мморфолиноэтансульфоновая кислота I пипсразинЫ,Гбис2этансульфоновая кислота промин киназа от англ. i i
додецилсульфат натрия
X метод систематического отбора лигандов путем экспоненциального обогащения от англ. i vi i xi i
1 инициаторная метиониновая аминоацилтРНК
X ксиленцианол
аминокислотный остаток
ЬСА бычий сывороточный альбумин
ЕГС вирус гепатита С
ДНК дезоксирибонуклеиновая кислота
Аучасток аминоацильный или акцепторный участок связывания тРНК на рибосоме
Ручасток пептидильный или донорный участок связывания тРНК на рибосоме
Еучасток специфический участок на рибосоме для связывания деацилированной тРНК
ИХБФМ СО РАН Институт химической биологии и фундаментальной медицины
Сибирского отделения Российской академии наук
кДНК комплементарная ДНК
криоЭМ криоэлектронная микроскопия
МГ У Московский государственный университет
мРНК матричная рибонуклеиновая кислота
НИИ ФХБ Научноисследовательский институт физикохимической биологии НПО научнопроизводственное объединение нт нуклеотид ОЕ оптические единицы
офВЭЖХ обращеннофазовая высокоэффективная жидкостная хроматография
ПААГ полиакриламидный гель
рРНК рибосомная рибонуклеиновая кислота
РСА рентгеноструктурный анализ
Грис трисгидроксиметиламинометан
тРНК транспортная рибонуклеиновая кислота
ТХУ зрихлоруксусная кислота
ТЭА триэтиламин
УФ ультрафиолетовый
ЦКБ 1 Центральная клиническая больница
ЯМР ядерный магнитный резонанс
А ангстрем
X длина волны
ВВЕДЕНИЕ
Оказалось, что большинство I абсолютно не похожи друг на друга, у них отсутствует какойлибо элемент структуры первичной, вторичной или третичной, общий для всех I. Не существует также единого механизма функционирования Iэлементов в процессе трансляции, аналогичного механизму кэпзависимой инициации трансляции. Тем не менее, на данный момент можно выделить общие принципы, лежащие в основе внутренней инициации трансляции, и описать несколько основных способов функционирования Iэлементов. Так, например, по механизму связывания с
субчастицсй Iэлемеиты вирусов подразделяют на зри основные группы группа I, подобных 1 вируса энцефаломиокордита, группа I, подобных I вируса гепатита С, и группа I, подобных I вируса паралича сверчка см. Однако молекулярные основы взаимодействий, обеспечивающих функционирование элемеитов в процессе инициации трансляции различных вирусных РНК остаются малоизученными. Большая часть накопленной к настоящему времени информации относится к Iэлементу РНК вируса гепатита С ВГС см. Вирус гепатита С относится к РНКсодержащим вирусам и принадлежит к роду ivi Гепацивирусов семейства vivii Флавивирусов. Его геном представлен линейной плюсцепыо РНК длиной около ит и имеет одну открытую рамку считывания, при трансляции которой образуется полипрогсин, состоящий примерно из ао. При расщеплении полипротеина образуются три структурных и четыре неструктурных белка. На бконцс геномной РНК расположена нетранслируемая область НТО, за которой следуют ген С, кодирующий белок нуклеокапсида, гены Е1 и , кодирующие гликопротеины внешней оболочки, и гены 2, 3, 4 и 5, кодирующие неструктурные белки . Очевидно, что трансляция является одной из важнейших стадий жизненного цикла ВГС. В настоящем обзоре суммированы структурные и биохимические данные о строении и функционировании I ВГС, а также о его взаимодействии с рибосомами, факторами инициации трансляции и с некоторыми другими клеточными белками. Особое внимание уделено структурнофункциональной организации I ВГС и его комплексам с рибосомами. Обзор охватывает в основном все данные, касающиеся этих вопросов, опубликованные с момента открытия внутренней инициации трансляции РНК ВГС. Iэлемент ВГС имеет длину 1 нт и занимает почти всю 5НТО геномной РНК I7. Граница I с 5стороны находится в районе ого нуклеотида , фрагмент 5НТО, включающий первые нт, представляет собой шпильку, формирующую домен I, который не входит в Iэлемент. Относительно Заграницы Iэлемента мнения немного расходятся, но наиболее общепринятым является предположение, что район, содержащий инициаторный кодон и несколько нуклеотидов кодирующей последовательности, входит в состав Iэлемента и является необходимым для эффективной инициации трансляции , . Геном вируса гепатита С обладает большой генетической вариабельностью. Так, в настоящее время выделяют шесть генотипов ВГС вариабельность , которые в свою очередь подразделяются на несколько субтипов вариабельность , обозначаемых строчными буквами , 1Ь и т. При этом у одного пациента РНК ВГС может варьировать в пределах по первичной структуре . Кроме того, у одного больного можно выделить сразу несколько вариантов вируса, так называемых псевдо или квазивидов 1 различий по нуклеотидной последовательности. По неоднородность нуклеотидной последовательности характерна в основном для кодирующей области РНК, в то время как ее нетранслирусмыс участки отличаются высокой консервативностью первичной структуры . Такая консервативность, повидимому, важна для поддержания сложной вторичной и третичной структур этих участков, обеспечивающих их функционирование в процессе жизнедеятельности ВГС. Предполагаемая вторичная структура I ВГС рис. Iэлементами родственных пестивирусов и вирусаВ , , химическом и ферментативном пробингс , и мутационном анализе , . I ВГС состоит из двух больших спиральных доменов II и III, соединенных с помощью псевдоузла с коротким стсблепетлсвым доменом IV, который содержит инициаторный кодон и часть кодирующей последовательност и рис. Домен II представляет собой протяженную неидеальную шпильку, иногда искусственно разделяемую на субдомены На и i. Домен III состоит из шести шпилек III.
| Род | Вирус | Клеточный рецептор |
| Aphthovirus | Foot-and-mouth disease virus | Integrin (strains A12), heparin sulfate (strain O1) |
| Cardiovirus | Encephalomyocarditis virus | VCAM-1 |
| Enterovirus | Coxsackievirus B1-6 Poliovirus 1-3 Major rhinovirus group Minor rhinovirus group | CAR, DAF (CD55) CD155 (Pvr) ICAM-1 VLDL-R |
| Hepatovirus | Hepatitis A virus | HAVcr-1 |
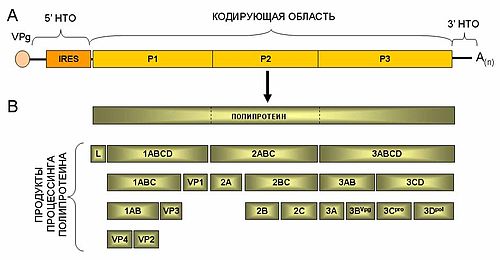
Геном пикорнавируса

Ø Регион P1 кодирует структурные полипептиды;
Ø Регионы Р2 и Р3 кодируют неструктурные белки, связанные с репликацией.
Ø L является дополнительным N-терминальным лидерным белком и в некоторых родах представляют собой как папаин-цистеин протеиназу (роды aphthovirus, erbovirus) или выполняют другие функции.
Общая схема строения геномной РНК (A) и процессинга полипротеина пикорнавирусов (B).
ü VPg-затравка для репликации;
ü 5’-НТО – трансляция с IRES, сайт посадки фактором для вирусной репликации;
ü L-лидерный белок (отсутствует у энтеровирусов, пареховирусов и гепатовирусов);
ü Неструктурные белки (NS) – процессинг полипротеина, выключение трансляции хозяйских белков, репликация РНК, перестройка клеточной мембраны;
ü 3’-НТО – сайт посадки факторов для вирусной репликации, стабильность РНК;
ü Поли-А – поддержание стабильности РНК, сайт связывания PABP, уридилирование VPg.
IRES пикорнавирусов
ü IRES (Internalribosomeentrysite) – внутреннийсайтпосадкирибосомы
ü Общие особенности: выраженная вторичная структура РНК, несколько AUG-кодонов, пиримидин-богатый участок;
ü IRES есть не только у пикорнавирусов, но и у флавивирусов, герпесвирусов, а также в клеточных мРНК (FGF, PDGF, VEGF, p53, bcl-2, eIFG, c-myc).

Общие сведения про IRES:
Согласно сканирующей модели инициации трансляции, рибосомальная субъединица может присоединяться исключительно к 5'-концу мРНК. Более 20 лет назад были проведены эксперименты, показывающие, на примере замкнутой в кольцо бетаглобиновой мРНК, что эукариотические рибосомы не способны связываться с 5'-дистальными (внутренними) участками мРНК. Однако в природе существует большое количество активно транслирующихся мРНК, структура 5'-НТО которых исключает возможность инициации трансляции по механизму сканирования. К ним относятся РНК пикорнавирусов – например EMCV или вируса полиомиелита (полиовируса). 5'-НТО РНК этих вирусов чрезвычайно структурированы, а также содержат большое количество AUG-кодонов и терминирующих триплетов в разных рамках считывания и нуклеотидных контекстах, что полностью исключает возможность инициации трансляции на последнем AUG такой 5'-НТО. В 1988 году двумя группами было показано, что инициация трансляции РНК пикорнавирусов происходит по альтернативному механизму внутренней инициации трансляции. В этих работах впервые было продемонстрировано, что эукариотическая рибосома способна осуществлять инициацию трансляции за счет присоединения к некоторому внутреннему участку мРНК – области внутренней посадки рибосом или IRES ( Internal Ribosome Entry Site).
IRES пикорнавирусов
Анализ первичной и вторичной структур 5'-НТО РНК пикорнавирусов позволил разделить их на две группы. К первой относятся энтеровирусы и риновирусы, ко второй – кардио- и афтовирусы. Типичным представителем первой группы можно считать вирус полиомиелита, второй – EMCV, FMDV и вирус энцефаломиелита грызунов Тейлера TMEV (Theiler’s murine encephalomyelitis virus). Хотя внутри этих групп гомология 5'-НТО (IRES элементов) не превышает 50%, но тем не менее последовательности обладают практически идентичной вторичной структурой. Причем мутации, разрушающие основные элементы этой структуры, приводят к инактивации IRES. Картирование IRES обеих групп показало, что все они содержат на 3'-конце AUG кодон, а в 25 нуклеотидах перед ним находится протяженный полипиримидиновый тракт (рис. 5А,Б). Этот AUG используется в качестве стартового в случае IRES EMCV, TMEV и FMDV (рис. 5Б). В первой группе инициация трансляции на 3'-концевом AUG IRES происходит с очень небольшой вероятностью. Основной стартовый кодон находится на некотором расстоянии после IRES – в случае полиовируса это 160 нуклеотидов (рис. 5А). Предположительно, инициаторный комплекс достигает этого AUG, сканируя РНК. Таким образом, можно полагать, что IRES пикорнавирусов первого типа используют своеобразную комбинацию внутренней посадки рибосомы и сканирования.

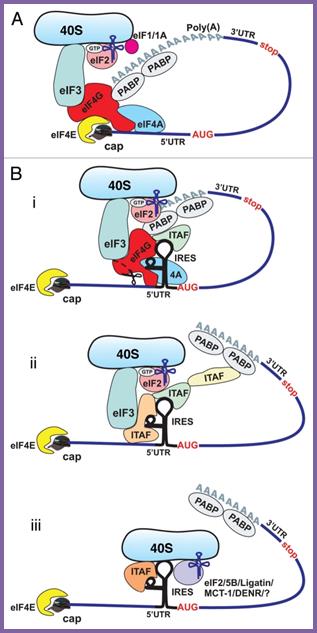

Оказалось, что для этой посадки достаточно участия eIF4А и центральной части белка eIF4G. При использовании мутантного варианта eIF4А, образующего прочный неактивный комплекс с eIF4G и блокирущего таким образом обмен связанного 4А и свободного 4А, инициации на IRES EMCV не происходит.
Дальнейшие исследования показали, что центральная часть eIF4G способна специфически связываться с определенным районом IRES EMCV и это связывание необходимо для инициации трансляции.
Рентгеноструктурный анализ центрального домена eIF4G показал, что области, с которыми связываются eIF4А и элементы вторичной структуры IRES EMCV расположены рядом и даже пересекаются, что объясняет кооперативность работы факторов 4G и 4A при сборке 48S инициаторного комплекса на IRES EMCV.
– пиримидин-тракт связывающий белок PTB (Pyrimidine-tract binding protein;
– unr, unrip; – поли-С-связывающий белок – 2 (PCBP-2).
Некоторые из этих белков действительно резко стимулировали трансляцию, направляемую IRES полиовируса in vitro. Однако их роль в механизме внутренней инициации трансляции до конца еще не выяснена. Возможно, что некоторые из этих белков, связываясь с IRES, стабилизируют его пространственную структуру.

IRES I: Enterovirus
IRES II: Aphthovirus, Cardiovirus, Erbovirus, Parechovirus, Kobuvirus
IRES III: Hepatovirus
(?)IRES IV: Avihepatovirus, Sapelovirus, Senecavirus, Tremovirus
HCV-like IRES: Teschovirus (смрис. 5В)
| Cell proteins | Virus RNA binding |
| La autoantigen | PV, HRV, CVB, EMCV, FMDV |
| PCBP2 | PV, HRV, CVB, FMDV, HAV |
| Unr | PV, HRV |
| PTB | PV, HRV, CVB, EMCV, FMDV |
| TAF-45 | FMDV |
| elF-4A | EMCV |
| elF-4B | EMCV, PV, FMDV |
| elF-4E | EMCV |
| elF-4G | EMCV, FMDV |
| elF-2 | EMCV, PV |
ü IRES пикорнавирусов различаются по взаимодействию с хозяйскими факторами;
ü Для HAV требуется наличие интактного elF-4F;
ü IRES II типа не требуют наличия La-фактора
Процессинг полипротеина
ü В расщеплении VP0 на VP4 и VP2 задействован неизвестный вирусный или хозяйский фактор. У Кобувирусов и Парэховирусов VP0 остается нерасщепленным.
ü L есть у АФТО-, Кардио-, Эрбо-, Кобу-, Сенека- и Тесчовирусов, но только у Афтовирусов и Эрбовирусов он обладает протеолитической активностью.
ü 2А Гепато-, Парэхо- и Тремовирусов не обладает протеолитической активностью.
ü Афто-, Авигепато-, Кардио-, Эрбо-, Сенека- и Тесчовирусы используют стратегию рибосомального пропуска (ribosomalskipping).
Рибосомальный пропуск

Репликация пикорнавирусов
Репликация происходит в цитоплазме.
- Прикрепление вируса к рецепторам клетки-хозяина служит посредником эндоцитоза вируса (у разных видов разный эндоцитоз; все 3 эндоцитоза характерны для Picornaviridea).
- Vpg отделяется от вирусной РНК, которая затем транслируется в процессинг полипротеина.
- У энтеро-, рино- и афтовирусов отключение клеточной кэп-зависимой трансляции осуществляется через расщепление факторов инициации трансляции вирусными протеазами.
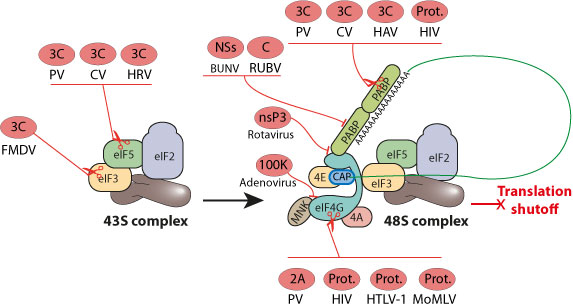
Этот глобальное ингибирование синтеза клеточных белков служит для обеспечения максимальной экспрессии вирусного генома и чтобы избежать иммунного ответа.
- Репликация происходит в вирусных фабриках, сделанных из мембранных везикул, вырезанных из ER (эндопл. ретикулум). Дц РНК синтезируется из геномной (+) ssРНК.
- Геномная дцРНК транскрибируется/реплицируется, тем самым обеспечивая вирусными mRNA/новые ssRNA (+).
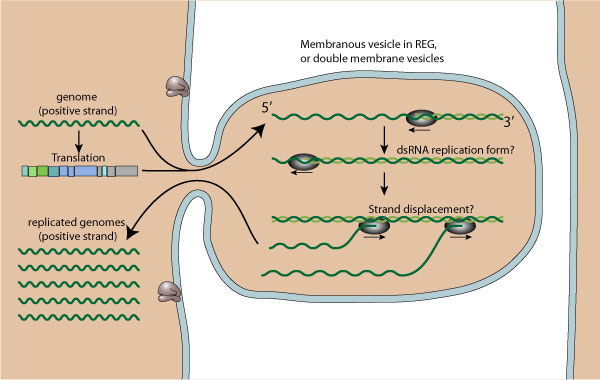
- Новая геномная РНК, как полагают, упаковывается в предварительно-собранные прокапсиды.

- Клеточный лизис и высвобождение вируса.

ü VPg используется как затравка для синтеза новой РНК-цепи на комплементарной матрице.
ü Соотношение (+)(-) цепей пикорнавирусных РНК в клетке – 50/1.
ü На поли-А садится PABP, и он, в свою очередь, связывается с комплексом PCBP2/3CD.
ü 3D и 2C обладают хеликазной активностью, способствуя расплетанию шпилек и элонгации цепи при репликации.
Дата добавления: 2018-06-01 ; просмотров: 358 ;
Внутренний сайт входа рибосомы , сокращенные IRES , является РНК - элемент , который позволяет трансляции инициации в кэп-независимым способом, как часть большего процесса синтеза белка . В эукариотических переводе , инициирование обычно происходит на 5' - конце молекул мРНК, так как 5' крышка распознавания требуется для сборки комплекса инициации. Место для элементов IRES часто бывает в 5' - UTR , но может также происходить в другом месте в мРНК.
содержание
история
IRES последовательность была впервые обнаружена в 1988 году в полиовируса (PV) и вирус энцефаломиокардита (EMCV) РНК - геном в лабораториях Нахум Соненберга и Eckard Виммера , соответственно. Они описаны как отдельные регионов молекул РНК, которые способны набирать эукариотической рибосомы с мРНК. Этот процесс также известен как кэп-независимый перевод. Было показано , что IRES элементы имеют различные вторичные или даже третичной структуры , но аналогичные структурные особенности на уровне либо первичной или вторичной структуры , которые являются общими для всех IRES сегменты не сообщалось до настоящего времени.
В последние годы стало общим для молекулярной биологии, чтобы вставить IRES последовательностей в их векторов, чтобы обеспечить экспрессию двух генов из одного вектора, например, трансгена и флуоресцентной молекулы-репортера. Первый ген инициируются при нормальном 5' колпачка, и второй ген инициируются на IRES.
Место нахождения

IRESs обычно находятся в 5' - UTR от РНК - вирусов и позволяют трансляцию РНК в кэп-независимым способом. Однако мРНК вирусов из Dicistroviridae семьи имеют две открытые рамки считывания (ORF , ), и перевод каждого направляется двумя разными IRESs. Он также предположил , что некоторые млекопитающих клеточные мРНК также IRESs. Эти клеточные элементы IRES , как полагают, находятся в эукариотических мРНК , кодирующих генов , участвующих в стресс выживания , а также другие процессы , важные для выживания. По состоянию на сентябрь 2009 года, есть 60 животных и 8 вирусов растений сообщается, содержат элементы IRES и 115 последовательностей мРНК , содержащих их.
активация
IRESs часто используются вирусами в качестве средства для того , чтобы вирусный перевод активен , если перевод хоста тормозится. Эти механизмы ингибирования трансляции хозяина разнообразны, и могут быть инициированы как вирусом и хозяином, в зависимости от типа вируса. Однако в случае большинство пикорнавирусов, такие как полиовирус , это достигается путем вирусного протеолитического расщепления eIF4G так , что она не может взаимодействовать с 5'cap связывающего белка eIF4E . Взаимодействие между этими двумя эукариотических факторов инициации (EIFS) от eIF4F комплекса необходимо для 40S рибосомальной субъединицей набора к' концу мРНК, который далее полагают, происходит с помощью мРНК 5' 5'cap к 3' поли (А) хвост петли образование. Вирус может даже использовать частично расщепленный eIF4G , чтобы помочь в инициации IRES-опосредованный перевод.
Клетки могут также использовать IRESs для увеличения перевода определенных белков в процессе митоза и запрограммированной гибели клеток . В митоза, клетка дефосфорилирует eIF4E так , что она имеет мало сродство к 5'cap . В результате, 40S рибосомальной субъединицей , а поступательная техника будет переадресован на IRES в пределах мРНК. Многие белки , участвующие в митозе кодируется мРНК IRES. В запрограммированной клеточной гибели, расщепление EIF-4G, такие , как выполняются вирусами, уменьшает перевод. Отсутствие необходимых белков способствует гибели клетки, как это делает перевод IRES мРНК , кодирующих последовательностей белков , участвующих в контроле клеточной гибели.
Механизм
На сегодняшний день механизм вирусной функции IRES лучше характеризуется , чем механизм клеточной функции IRES, которая до сих пор является предметом дискуссий. ВГС -как IRESs напрямую связываться с 40S рибосомальной субъединицей , чтобы расположить их инициатор кодоны расположены в рибосомной P-сайта без сканирования мРНК. Эти IRESs все еще используют эукариотические факторы инициации (EIFS) eIF2 , eIF3 , eIF5 и eIF5B , но не требуют факторов eIF1 , eIF1A и eIF4F сложные. В отличии от этого , пикорнавируса IRESs не связывает 40S субъединицы непосредственно, но набираются вместо через в eIF4G -связывающего сайта. Многие вирусные IRES (и клеточные IRES) требуют дополнительных белков опосредуют их функцию, известную как IRES транс -Актерских факторов (ITAFs). Роль ITAFs в функции IRES еще находится в стадии расследования.
тестирование
Тестирование определенной последовательности РНК на активность IRES опирается на бицистронной репортер конструкции. Когда сегмент IRES расположен между двумя репортерными открытой рамками считывания в эукариотической мРНК молекуле (бицистронный мРНК), он может управлять переводом вниз по течению белка кодирующей области независимо от структуры 5'-колпачка , присоединенной к концу 5' - мРНКа молекулы. В такой установке, оба белка образуются в клетке. Первый белок репортер расположен в первом цистрона синтезируется колпачковой-зависимой инициации, в то время инициации трансляции второго белка направлена на элемент IRES , расположенного в intercistronic спейсера между двумя кодирующих белок репортер регионов. Тем не менее, есть несколько предостережений , чтобы быть в курсе при интерпретации данных , полученных с помощью бицистронных репортер конструкции. Так , например, существует несколько известных случаев MIS-IRES сообщили элементы , которые впоследствии были признаны в качестве промотора отработанных регионов. Совсем недавно, сплайс - акцепторные сайты в пределах нескольких предполагаемых сегментов IRES были показаны, отвечаем за очевидную функцию IRES в бицистронных репортерных анализах.
- 978
- 0,4
- 4
- 0
Нох-гены — важный объект для изучения
— большое семейство генов, определяющих схему строения тела у многоклеточных. Они регулируют развитие организма — кодируют белки, которые обеспечивают правильное образование органов и тканей [1]. Сложно переоценить их распространение, потому что они есть чуть ли не у всех многоклеточных. Они контролируют развитие и у позвоночных, в том числе у человека [1]. Под их влиянием находится формирование как крыльев мух, так и ребер млекопитающих [2]. Даже цветки у растений появляются благодаря белкам, закодированным в этих генах [3]. Таким образом, работа определяет схему строения тела.
Однако, механизм регуляции экспрессии самих остается непонятным. Ясно только, что этот процесс очень сложен и многостадиен, в нем участвуют некодирующие РНК [4]. Также важна структура хроматина в месте расположения на ДНК [4]. Сами гены располагаются на хромосомах по порядку, поэтому строгая, последовательная их активация необходима для того, чтобы тело сформировалось правильно.
Недавно ученые обнаружили еще один этап регуляции — непосредственно перед началом синтеза закодированных в белков (во время инициации трансляции) [5].
Инициация трансляции бывает разная
Итак, генетический материал клетки закодирован в ДНК. С ДНК считывается определенный вид РНК, а с РНК — белок. Такой вид РНК называется матричной РНК, у эукариот он имеет определенное строение [6]. Это линейная молекула, соответственно, у нее есть 2 конца, которые называются 5′- и . На есть особая структура — кэп. Она необходима для начала синтеза белка на матрице РНК, так как привлекает фабрику белка — рибосому.
Так происходит у нас, но не у вирусов. Точнее, не у всех вирусов. У некоторых есть другие структуры в РНК, которые инициируют синтез белка — IRES. Так вот оказывается, что в РНК млекопитающих иногда обнаруживают структуры, похожие на IRES вирусов. При этом кэп тоже присутствует. Получается РНК с двумя сигналами привлечения рибосомы. Это интересное явление часто имеет важный биологический смысл. Например, при стрессе инициация трансляции подавлена [7, 8]. Но некоторые белки должны синтезироваться и при стрессе. Вот тогда клетка и использует IRES. А как работает такая смешанная система в нормальных, не шоковых условиях — большая загадка. Клеточные IRES не похожи друг на друга [9], их роль в развитии организма не ясна. Найти ответ на этот вопрос попытались ученые, изучающие регуляцию [10].
У мРНК Hox-генов есть IRES вирусов?
Интересно, что в мРНК некоторых предполагают наличие IRES. Причем именно IRES привлекает рибосому и запускает синтез белков. Уже приведены первые экспериментальные доказательства в пользу этой гипотезы [10]. Также ученые открыли еще один специальный регуляторный элемент — translation inhibitory element (TIE), который блокирует синтез белка [11]. Появление блокирующего элемента объясняет, почему при наличии и , и IRES работает только IRES.
Почему IRES лучше, чем кэп?
Важность того участка РНК, где находится предполагаемый IRES, в данном случае подтвердили экспериментально. Показали, что если подвергнуть мутации один из , удалив IRES, то мышь будет развиваться ненормально (см. рисунок 1).

Рисунок 1. Патологии в развитии скелета мышей с делециями в области в одном из — Ноха9. Ученые вывели линию мышей, у которых поврежден IRES в одном из . Такие мыши развиваются ненормально. У них нарушается строение скелета: например, не хватает ребер (на недостающие ребра указывают черные стрелочки). Также наблюдаются и другие патологии. Картинка из [11].
Предполагают, что для очень важных белков, которые закодированы в , IRES лучше, чем кэп. Это может быть связано с тем, что у всех мРНК одинаковая. А IRES разные. То есть к белкам, которые определяют строение тела, нужен индивидуальный подход. Даже начало синтеза является важным этапом регуляции и должно быть уникальным для каждого такого белка.
Читайте также:


