Исаков герпес вирусные инфекции
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Исаков В. А., Исаков Д. В.
Герпесвирусные инфекции широкораспространены среди людей. При рецидивирующем герпесе снижены клеточные реакции,продукция интерферонов и других цитокинов.Показана высокая эффективность индукторовинтерферонов, обладающих противовируснойи иммуномодулирующей активностью, в лечении и профилактике (иммунореабилитация) герпеса .
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Исаков В. А., Исаков Д. В.
PERSPECTIVES OF USING INTERFERON INDUCERS IN THERAPYOF HERPESVIRUS INFECTIONS
Herpesvirus infections are widelyspread in human. Immune cell reactions,production of interferons and other cytokines aredecreased during relapsing herpes infection. Therewas found high clinical and immunological efficacyof interferon inducer in therapy and prevention(immunorehabilitation) of herpes viral diseases.
Исаков В. А1, Исаков Д. В.2
ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ ИНДУКТОРОВ ИНТЕРФЕРОНА В ТЕРАПИИ ГЕРПЕСВИРУСНЫХ ИНФЕКЦИЙ
Isakov V. A.1, Isakov D. V.2
1 State Budget Educational Institution Higher Vocational Education the First Saint-Petersburg State Medical University. Acad. Pavlov Roszdrav
2 Federal State Budgetary Institution Research Institute of Experimental Medicine, Saint-Petersburg
PERSPECTIVES OF USING INTERFERON INDUCERS IN THERAPY OF HERPESVIRUS INFECTIONS
Резюме. Герпесвирусные инфекции широко распространены среди людей. При рецидивирующем герпесе снижены клеточные реакции, продукция интерферонов и других цитокинов. Показана высокая эффективность индукторов интерферонов, обладающих противовирусной и иммуномодулирующей активностью, в лечении и профилактике (иммунореабилитация) герпеса.
Ключевые слова: герпес, эффективность Меглюмина акридонацетата (Циклоферон), Инозина пранобекса (Гроприносин).
Summary. Herpesvirus infections are widely spread in human. Immune cell reactions, production of interferons and other cytokines are decreased during relapsing herpes infection. There was found high clinical and immunological efficacy of interferon inducer in therapy and prevention (immunorehabilitation) of herpes viral diseases.
Key words: herpes, efficacy of meglumine acridonacetate (Cycloferon), Inosine pranobex (Groprinosin).
Активность вирусного цикла находится под контролем клеток врожденного и приобретенного иммунитета. В частности, активирован-
Многочисленные результаты иммунологического обследования показали, что у больных часто рецидивирующим простым герпесом снижена продукция эндогенного интерферона (ИФН), активность НК-клеток и антителозави-симая клеточная цитотоксичность. Уменьшено абсолютное число и снижена активность
Т-лимфоцитов (С03+, С04+, С08+ Т клеток) и нейтрофилов [3, 5]. Эти иммунологические нарушения сохраняются в периоде рецидива и ремиссии заболевания [3].
В терапии ГВИ необходимо принимать во внимание состояние защитных механизмов макроорганизма и их взаимодействие с хими-опрепаратами (ХП). Важно учитывать форму и фазу инфекционного процесса: острый или хронический, прогредиентное или рецидивирующее течение, период разгара или реконва-лесценции болезни. В зависимости от клинической ситуации, анамнеза болезни используются различные схемы лечения: эпизодическое, длительная супрессивная терапия, местное или системное применение ХП, комплексная терапия препаратами с различным механизмом действия и пр. [3, 6, 7, 8].
Известна высокая эффективность противо-герпетических ХП в терапии острых симптомов рецидивирующего герпеса (РГ), но эти препараты не снижают частоту и тяжесть рецидивов, возможно развитие резистентности вирусов к ХП [7, 9, 10]. С другой стороны, терапевтический эффект может достигаться при использовании иммуномодуляторов (ИМД). Особый интерес представляют соединения, способные влиять на конкретные звенья неспецифических защитных механизмов (синтез протективных цито-кинов, усиление фагоцитоза, цитотоксической активности НК-клеток, миграции лейкоцитов) и, как следствие, повышать эффективность элиминации возбудителя, а именно, индукторы интер-феронов (ИИ) — препараты с бифункциональной активностью (противовирусной и иммуномоду-лирующей) [3, 4, 11]. Следует отметить, что ИМД чаще оказывают воздействие не на возбудителя, а на клетки организма, тем самым, избегая давления на эволюцию механизмов микробной резистентности. Многоуровневая неспецифическая активация клеток врожденного иммунитета предполагает усиление протекции от широкого спектра возбудителей, делая возможным применение ИМД на ранних стадиях инфекционных заболеваний, еще до идентификации причинного патогена [12].
вирусную активность, выступая в качестве интерфероногена (ИФН-а раннего типа). После введения ЦФ высокий уровень синтеза ИФНу в тканях и органах, содержащих лимфоидные элементы, отмечается на протяжении не менее 72 часов, тогда как в сыворотке крови нормального человека содержание высоких уровней ИФН сохраняется 48 часов [13].
Спектр биологической активности ЦФ: противовирусный, иммуномодулирующий, противовоспалительный, аналгезирующий, антипролиферативный, противоопухолевый, радиопротективный. Циклоферон применяется в комплексной терапии различных вирусно-бактериальных и соматических заболеваний, онкологической и хирургической патологии, ВИН различного генеза. Лекарственные формы ЦФ: 12,5 % раствор для внутривенного и внутримышечного введения (ампула 2 мл), таблетки по 150 мг (соль акридонуксусной кислоты и ^метил-глюкамина), покрытые кишечнорастворимой оболочкой и 5% линимент в тубах по 5 и 30 мл.
Экспериментально показано, что ЦФ прямо или косвенно повышает в 3-10 раз по сравнению с контролем процент дефект-интерфери-рующих частиц (ДИ-частиц), не вызывающих продуктивную инфекцию [3, 14, 15]. Опосредованно (через систему ИФН) оказывает противовирусное действие. Активирует собственную иммунную систему, нормализует ТЬ1/ТЬ2 тип иммунного ответа, повышает уровень и активность НК-клеток, способствует завершенному фагоцитозу.
В открытом рандомизированном сравнительном исследовании оценивалась эффективность ЦФ в терапии 100 больных рецидивирующим генитальным герпесом (РГГ) [5]. Все больные (80 женщин и 20 мужчин) были в возрасте до 42 лет, частота рецидивов ГГ составляла 5-8 раз в год, длительность заболевания 1-5 лет. Период наблюдения за больными 1 год. При лечении больных ГГ использовали ацикловир (50 больных, АЦ) и ЦФ (50 больных). Циклоферон назначали 1 раз в сутки внутримышечно по 2 мл 12,5 % раствора в 1, 2, 4, 6, 8-й дни лечения (основная группа). Пациенты контрольной группы получали АЦ по 200 мг 5 раз в сутки в течение 5 дней. Диагностика заболевания осуществлялась на основании анамнеза, клиники, кольпоскопии, методом прямой иммунофлюоресценции и ПЦР.
Анализ динамики основных клинических симптомов (местные субъективные прояв-
ления, интоксикация, продолжительность стадий везикулярной, эрозивной и эпители-зации, сроков рецидива) не выявил различий в обеих группах. Это указывает на высокую эффективность ЦФ при лечении рецидивов ГГ. Увеличение продолжительности ремиссии в 2,5 раза отмечено у 80 %, леченных ЦФ, и у 85 %, получавших АЦ. Однако, курс терапии ЦФ дешевле аналогичного лечения АЦ. В тоже время в группе больных, получавших ЦФ (основная группа), после лечения отмечено достоверное увеличение показателей С03+, С04+, СЭ8+ лимфоцитов, соотношение С04+/С08+, а также НК-клеток, по сравнению с пациентами, получавшими АЦ (прием АЦ мало влияет на показатели иммунитета). Достоверно увеличился синтез эндогенных ИФН-а/в и ИФН-у со снижением продукции ИЛ-4, что характеризует поляризацию иммунного ответа в сторону ТЬ1 ответа. Это важно, так как именно состояние Т-клеточных реакций во многом определяет выздоровление от вирусной инфекции [5].
Восстанавливалась функциональная активность лимфоцитов в тесте спонтанной и индуцированной РБТЛ (реакции бласттрансфор-мации лимфоцитов): повышались резервные возможности иммунокомпетентных клеток. После лечения ЦФ показатели активности естественных киллеров достигли нормы, повышалось содержание основных классов сывороточных иммуноглобулинов.
Иммуномодулирующий эффект Гроприносина проявляется активацией системы компле-
мента, синтеза эндогенного ИФН-а и усилением гуморального иммунного ответа (повышает синтез антител). При наличии вторичного клеточного иммунодефицита проявляется тимози-ноподобное действие препарата: усиление диф-ференцировки и пролиферации Т-лимфоцитов, регуляция соотношения субпопуляций хел-перных и супрессорных клеток, повышение функциональной активности Т-лимфоцитов и синтеза интерлейкина-2, активация естественных киллеров и фагоцитоза [1,18,19].
Гроприносин показан для терапии вирусных инфекций у пациентов с нормальной и ослабленной иммунной системой:
- заболевания, вызванные герпесвиру-сами — ВПГ-1,2 типов, ветряной оспы, опоясывающего герпеса, ВЭБ, ЦМВ; вирусами кори, паротита;
- вирусный бронхит, острые и хронические вирусные гепатиты В и С;
- заболевания, вызванные вирусами папилломы человека, подострый склеро-зирующий панэнцефалит.
- хронические инфекционные заболевания дыхательной и мочевыделительной систем; профилактика инфекций при стрессовых ситуациях; период реконва-лесценции у послеоперационных больных и лиц, перенесших тяжелые заболевания. Иммунодефицитные состояния (ВИН).
Схемы лечения и дозировки. Наилучший клинический эффект был достигнут при следующей схеме назначения препарата:
Эпизодическое лечение. Для купирования рецидива необходимо в самом начале обострения
с учетом тяжести назначать максимально высокую дозу препарата (6-8 таблеток по 500 мг в сутки взрослым), а не ограничиваться малыми дозами. Дозу ИП делят на 3-4 приема, препарат принимают до исчезновения высыпаний на коже, и далее еще 2 дня после исчезновения симптомов. Обычная длительность лечения рецидива герпеса составляет 7-9 дней, исчезновение высыпаний происходит между 5-7 днем.
Постоянное циклическое супрессивное лечение. Применяют высокие суточные дозы в 3-4 г ИП, равно поделенные на 3-4 приема, в течение 5-7 дней, затем лечение продолжают на сниженной поддерживающей дозе по 2 таблетки по 500 мг в день (принимать одновременно, до полудня) до появления первых признаков рецидива. Затем вернуться снова на высокую суточную дозировку и продолжать ее в течение 5 дней. При необходимости повторить лечение с проведением мониторинга для оценки состояния пациента и решения вопроса о продлении лечения.
После купирования рецидива Гроприносин назначается в виде поддерживающей дозы — 2 таблетки в сутки. При тяжелом течении инфекции поддерживающая иммуномодулиру-ющая доза препарата назначается длительно на период до 6-12 мес. При среднетяжелой форме инфекции поддерживающая терапия проводится в течение 3 мес, при легкой — в течение 1 мес. Если во время приема иммуномоду-лирующей дозы возник очередной рецидив ГИ, пациенту снова стоит назначить максимально высокую дозу препарата.
При лечении ВПГ-инфекции для достижения максимального эффекта от применения ИП следует придерживаться двух основных правил:
- раннее назначение ИП — желательно в продромальной фазе заболевания. Назначать при появлении первых признаков герпетических высыпаний (лучше всего в течение 24 часов);
- прием ИП должен быть регулярным, поделенным на 3-4 дозы, то есть препарат следует принимать 3-4 раза в день, что обеспечит поддержание оптимальной его концентрации в крови.
Русакевич П. С. с соавт. [20] обследовали (кольпоскопия, гистология, иммунограмма и др.) 232 женщины в возрасте 30,1 ± 8,8 года с различной патологией шейки матки (ШМ): ВПГ- и ВПЧ-инфекция. Подтвержденные гистологически вирусные изменения шейки матки выявлены у 121 (52,2 %) пациентки — основная
группа женщин (ОГ), которым дополнительно проводили иммуномодулирующую терапию Гроприносином. В контрольную группу (КГ) вошли 30 пациенток с идентичной патологией шейки матки, которым в комбинированном этапном лечении иммуномодулирующая терапия не проводилась. Дополнительную контрольную группу составили 20 здоровых женщин. Суммарная эффективность этапной терапии с использованием в качестве иммуно-модулятора препарата Гроприносин составила 97,2 ± 1,6 % при ВПГ-инфекции, 83,8 ± 3,4 % — при ВПЧ-инфекции и 78,2 ± 1,6 % — при соче-танных вирусных поражениях шейки матки (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
8. Ермоленко Д. К., Исаков В. А. Иммунопатогенетические особенности тяжелых форм гени-тального герпеса с монотонным типом рецидивирования. // Вестн. С. Петерб. ун-та. Сер. 11.— 2013.— № 4.— С. 69-75.
9. Ведение больных инфекциями, передаваемыми половым путем, и урогенитальными инфекциями. Клинические рекомендации. /под ред. А. А. Кубановой.— М.— 2012.— 112 с.
10. Европейские стандарты диагностики и лечения заболеваний, передаваемых половым путем. /гл. редактор К. Рэдклиф, проф. В. П. Адаскевич.— М.: Мед. Лит.— 2006.— 272 с.
11. Хаитов Р. М., Пинегин Б. В. Иммуномодуляторы: определение, классификация, механизмы действия и области клинического применения. // Иммунотерапия: руководство для врачей. (под ред. Р. М. Хаитова, Р. И. Атауллаханова).— М: ГЭОТАР-медиа.— 2011.— 672 с.
12. Hancock RE, Nijnik A, Philpott DJ. Modulating immunity as a therapy for bacterial infections. // Nat Rev Microbiol.— 2012, Mar 16.— Vol. N4.— P. 243-54.
13. Исаков В. А., Исаков Д. В. Иммуномодуляторы в терапии и профилактике герпесвирусных инфекций. // Клиническая медицина.— 2015/ — № 4, Т. 93.-С.16-24.
14. Ершов Ф. И., Романцов М. Г. Лекарственные средства, применяемые при вирусных заболеваниях: руководство для врачей.—М: ГЭОТАР-медиа.— 2007.— 368 с.
15. Романцов М. Г., Шульдякова О. Г., Коваленко А. Л. Иммуномодуляторы с противовирусной активностью: опыт применения метилглюкамина акридонацетата в педиатрической практике. // Фундаментальные исследования.— 2004. № 1.— С. 29-33.
16. Исаков В. А., Сельков С. А., Мошетова Л. К., Чернакова Г. М. Современная терапия герпесвирусных инфекций: руководство для врачей.— СПб, М.— 2004.— 168 с.
17. Campoli-Richards DM, Sorkin EM, Heel RC. Inosine pranobex. A preliminary review of its pharmacodynamics and pharmacokinetic properties, and therapeutic efficacy.// Drugs — 1986.— N32.—P. 383-424.
18. Masihi KN. Immunomodulatory agents for prophylaxis and therapy of infections. // Int J Antimicrob Agents — 2000.—Vol.14, N3.—P. 181-191.
19. Елисеева М. Ю., Мынбаев О. А. Роль вспомогательной терапии иммунотерапии в решении проблем ВПЧ-ассоциированных патологических поражений кожи и слизистых оболочек. // Акушерство и гинекология.— 2011.— № 4.— С. 104-111.
20. Русакевич П. С., Шмак К. И., Гришанович Р. В. Вирусные изменения шейки матки, ассоциированные с доброкачественными и предраковыми поражениями: новые возможности лечения и профилактики. // Медицинские новости.— 2010.— № 3.— С. 1-7.
21. Шульженко А. Е., Викулов Г. Х., Тутушкина Т. В. Герпетические инфекции — настоящее и будущее // Трудный пациент.— 2003.— № 4, Т. 1.— С. 6-15.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Герпесвирусы широко распространены в человеческой популяции. После первичного инфицирования вирусы герпесгруппы переходят в латентное состояние и пожизненно персистируют в организме. При неблагоприятных условиях и снижении местного или системного иммунитета может происходить реактивация инфекции, что обусловливает развитие воспаления чаще всего на местном уровне. Разнообразие клинических форм герпесвирусных инфекций постоянно поддерживает научный интерес как в области изучения их патофизиологии, так и в области поиска эффективной противовирусной терапии. Особенно актуально это для β- и γ-герпесвирусов, т. к. группа α-герпесвирусов изучена достаточно хорошо.
Цель исследования: определить эффективность валацикловира в отношении репликации вируса Эпштейна – Барр (ВЭБ), вируса герпеса человека 6 типа (ВГЧ-6), цитомегаловируса (ЦМВ) в ротоглотке у часто болеющих взрослых с хроническими воспалительными заболеваниями верхних дыхательных путей (ВДП).
Материал и методы: нами амбулаторно обследованы 80 пациентов с частыми рецидивами хронических воспалительных заболеваний ВДП. Всем пациентам проводились микробиологическое исследование мазков из ротоглотки и оценка вирусной нагрузки в смешанной слюне и цельной крови вне периода обострения. Пациенты получали терапию валацикловиром по схеме 500 мг 3 р./сут в течение 14 дней. Контроль вирусной нагрузки в биоматериале проводился после окончания лечения.
Результаты и обсуждение: микробный пейзаж ротоглотки часто болеющих взрослых вне периода обострения представлен преимущественно нормальной или условно-патогенной микрофлорой. В смешанной слюне обнаруживалась ДНК ВЭБ, ВГЧ-6, но не ЦМВ. При этом в образцах крови указанных пациентов ДНК вирусов герпесгруппы не выявлялась. Применение валацикловира в дозе 500 мг 3 р./сут достоверно снижает репликацию ВЭБ в ротоглотке у часто болеющих взрослых.
Выводы: целесообразно провести дальнейшие исследования по определению режима дозирования и оценке клинической эффективности ациклических нуклеозидов в лечении ВЭБ-инфекции.
Ключевые слова: герпесвирусы, вирус Эпштейна – Барр, вирус герпеса человека, цитомегаловирус, часто болеющие взрослые, вирусная нагрузка, валацикловир.
Для цитирования: Щубелко Р.В., Зуйкова И.Н., Шульженко А.Е. Герпесвирусные инфекции человека: клинические особенности и возможности терапии. РМЖ. 2018;8(I):39-45.
Human herpesviruses infections: clinical features and opportunities of therapy
R.V. Shubelko 1 , I.N. Zuykova 2 , A.E. Shulzhenko 2
1 JSC "K+31", Moscow
2 “National Research Center — Institute of Immunology” Federal Medical-Biological Agency of Russia, Moscow
Herpesviruses are widely spread among the human population. After the primary infection, the herpesviruses become latent and persistent in the human body for life. Adverse conditions and a low local or systemic immunity may reactivate the infection, which causes the inflammation, usually at the local level. The variety of clinical forms of herpesviruses infections constantly supports scientific interest both in the field of studying their pathophysiology and in the search for effective antiviral therapy. This is especially important for β- and γ-herpesviruses, since the α-herpesvirus group has been studied rather well.
Aim: to determine the efficacy of valacyclovir for replication of the Epstein-Barr virus (EBV), human herpesvirus type 6 (HHV-6), cytomegalovirus (CMV) in the oropharynx in frequently ill adults with chronic inflammatory diseases of the upper respiratory tract.
Patients and Methods: 80 patients with frequent recurrences of chronic inflammatory diseases of the upper respiratory tract were examined outpatiently. All patients underwent microbiological examination of swabs from the oropharynx and the viral load in mixed saliva and whole blood not in exacerbation period was assessed. Patients received valacyclovir therapy according to the scheme 500 mg x 3 times a day for 14 days. Control of viral load in the biomaterial was carried out after the end of treatment.
Results and Discussion: out of the period of exacerbation the oropharynx microflora in frequently ill adults is represented mainly by a normal or conditionally pathogenic microflora. EBV DNA, HHV-6, but not CMV DNA, were detected in the mixed saliva. The DNA of the herpesvirus was not detected in the blood samples of these patients. The use of valacyclovir in a dose
of 500 mg 3 times a day significantly reduces the replication of EBV in the oropharynx in frequently ill adults.
Conclusions: it is advisable to conduct further studies to determine the dosage regimen and evaluate the clinical efficacy of acyclic nucleosides in the treatment of EBV infection.
Key words: herpes viruses, Epstein-Barr virus, human herpes virus, cytomegalovirus, frequently ill adults, viral load, valacyclovir.
For citation: Shubelko R.V., Zuykova I.N., Shulzhenko A.E. Human herpesviruses infections: clinical features and opportunities of therapy // RMJ. 2018. № 8(I). P. 39–45.
В статье рассмотрены клинические особенности и возможности терапии герпесвирусных инфекции человека. Определена эффективность валацикловира в отношении репликации вируса Эпштейна – Барр, вируса герпеса человека 6 типа, цитомегаловируса.
Только для зарегистрированных пользователей
Методические указания для студентов к практическому занятию № 6.
Тема: Лабораторная диагностика герпесвирусных инфекций.
Цель: Изучение лабораторной диагностики герпесвирусных инфекций.
Модуль 3. Общая и специальная вирусология.
Содержательный модуль 16. Специальная вирусология.
Тема 6:Лабораторная диагностика герпесвирусных инфекций.
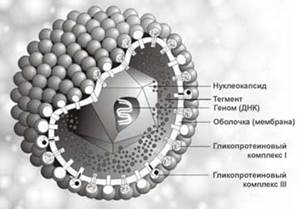
Актуальность темы:
Вирус простого герпеса – одна из самых распространенных вирусных инфекций человека, характеризующаяся лихорадочным состоянием и пузырьковыми высыпаниями, которые чаще всего локализуются на коже и слизистых оболочках. Важными особенностями герпетической инфекции являются пожизненное носительство вируса и частые рецидивы болезни.
Вирусная природа простого герпеса установлена в 1912 г. У. Грютером.
(Трёхмерное изображение вируса герпеса).
Герпесвирусы и вызываемые ими заболевания
| Типы вирусов герпеса | Вызываемые заболевания |
| ВПГ-1 (вирус простого герпеса типа 1) | Поражение: кожи, слизистой оболочки ротовой полости, конъюнктивы или роговицы глаза, энцефалиты |
| ВПГ-2 (вирус простого герпеса типа 2) | Поражение слизистых оболочек гениталий, у новорожденных - центральной нервной системы |
| ВЗВ (вирус ветрянки) | Ветряная оспа, опоясывающий лишай, постгерпетическая невралгия; язвенно-некротическая форма опоясывающего герпеса - СПИД-индикаторный признак заболевания |
| ЦМВ (цитомегаловирус) | Патологии новорожденных; осложнения после трансплантации органов и костного мозга: интерстициальная пневмония, гастроинтестинальные расстройства, гепатиты |
| ВЭБ (вирус Эпштейна-Барра) | Инфекционный мононуклеоз, лимфома Беркитта, рак носоглотки |
| ВГ-6 | Вирус, вызывающий фатальные интерстициальные пневмонии и инфекционные розеолы новорожденных |
| ВГ-7 | Вирус, выделенный от больных с синдромом хронической усталости |
| ВГ-8 | Вирус, выделенный из биоптата больного саркомой Капоши, ассоциированный с лимфопролиферативными заболеваниями |
| Примечание. ВГ - вирус герпеса. |
Таксономия, морфология, химический состав. Возбудитель простого герпеса - ДНК-содержащий вирус, относится к семейству Herpesviridae, роду Simplexvirus. По морфологии и химическому составу не отличается от вирусов ветряной оспы и опоясывающего герпеса.

Культивирование. Вирус простого герпеса (ВПГ) культивируют в куриных эмбрионах, культурах клеток и организме лабораторных животных. На хорионаллантоисной оболочке куриных эмбрионов вирус образует мелкие белые плотные узелки-бляшки; в зараженных культурах - вызывает цитопатический эффект: образование гигантских многоядерных клеток с внутриядерными включениями.
Антигенная структура. Вирус содержит ряд антигенов, связанных как с внутренними белками, так и с гликопротеидами наружной оболочки. Последние являются основными иммуногенами, индуцирующими выработку антител и клеточный иммунитет. Существует два серотипа вируса: ВПГ типа 1 и ВПГ типа 2.
Резистентность. Вирус может выживать на поверхности предметов при комнатной температуре в течение нескольких часов, чувствителен к УФ-лучам, обычным дезинфицирующим средствам, жирорастворителям, термолабилен.
Восприимчивость животных. Вирус простого герпеса патогенен для многих животных, у которых вызывает энцефалит при введении возбудителя в мозг или местный воспалительный процесс при заражении в глаз. В естественных условиях животные не болеют.
Эпидемиология. Простой герпес - одна из самых распространенных инфекций, которая поражает различные возрастные группы людей, чаще в осенне-зимний период. Отмечаются спорадические случаи заболевания, иногда небольшие вспышки в семьях, детских коллективах, больницах. Эпидемий не наблюдается.
Источником инфекции являются больные и носители. Основной механизм передачи - контактный, аэрогенный. Заражение происходит при попадании вирусов на поврежденные кожные покровы или слизистые оболочки.
Эпидемиология герпеса, вызванного вирусами типов 1 и 2, различна. ВПГ типа 1 передается через слюну, зараженные слюной руки и предметы быта, а ВПГ типа 2 - половым путем. Возможно заражение плода через плаценту.
Патогенез и клиническая картина. По клиническим проявлениям различают первичный и рецидивирующий герпес. Входными воротами возбудителя при первичной герпетической инфекции являются поврежденные участки кожи и слизистых оболочек рта, глаз, носа, мочеполового тракта, где вирусы репродуцируются. Затем по лимфатическим сосудам вирусы попадают в кровь и заносятся в различные органы и ткани.
Инкубационный период при первичном герпесе составляет в среднем 6-7 дней. Заболевание начинается с жжения, зуда, покраснения, отека на ограниченных участках кожи и слизистых оболочек, затем на этом месте появляются пузырьковые высыпания, наполненные жидкостью. Иногда заболевание сопровождается повышением температуры тела и нарушением общего состояния. При подсыхании пузырьков рубцов не образуется. Первичный герпес у новорожденных протекает тяжело и нередко заканчивается смертью. Однако у большинства людей первичная инфекция остается нераспознанной, так как протекает бессимптомно.
После первичной инфекции (явной и бессимптомной) 70-90 % людей остаются пожизненными носителями вируса, который сохраняется в латентном состоянии в нервных клетках чувствительных ганглиев. Нередко у носителей появляются рецидивы болезни в результате переохлаждения, перегревания, менструации, интоксикации, различных инфекционных заболеваний, стрессов, нервно-психических расстройств. Для рецидивирующего герпеса характерны повторные высыпания на коже и слизистых оболочках, нередко в тех же местах. Наиболее частой локализацией рецидивирующего герпеса, вызванного ВПГ типа 1, являются губы, крылья носа, полость рта, конъюнктива глаз. ВПГ типа 2 поражает мочеполовую систему и вызывает герпес новорожденных. Доказана роль ВПГ типа 2 в развитии рака шейки матки. Сравнительно редко встречаются генерализованные формы рецидивирующего герпеса, в частности поражения нервной системы и внутренних органов.
Иммунитет. В результате первичной герпетической инфекции в организме образуются сывороточные и секреторные антитела, которые обусловливают иммунитет к первичному герпесу, но не препятствуют сохранению вируса и возникновению рецидивов. Рецидивирующий герпес возникает при высоком уровне антител к вирусу герпеса. Основное значение в развитии рецидивирующего герпеса имеет состояние клеточного иммунитета.
Лабораторная диагностика. Материалом для исследования являются содержимое герпетических пузырьков, слюна, соскобы с роговой оболочки глаза, кровь, цереброспинальная жидкость, в летальных случаях . кусочки головного и спинного мозга.
Экспресс-диагностика заключается в обнаружении гигантских многоядерных клеток с внутриядерными включениями в мазках-отпечатках из высыпаний, окрашенных по Романовскому-Гимзе. Для дифференциации от других вирусов, принадлежащих к этому семейству, используют РИФ, ИФА, РИА, ПЦР. Выделение вируса проводят на куриных эмбрионах, культуре клеток и на лабораторных животных (мыши-сосунки), идентифицируют вирус с помощью РИФ или РН. В последние годы в диагностике простого герпеса начали применять моноклональные антитела, что дает возможность определить серотип вируса. Для серодиагностики заболевания используют РСК, РН, РИФ, ИФА.
Специфическая профилактика и лечение. Для профилактики тяжелых форм рецидивирующего герпеса в период ремиссии применяют многократное введение инактивированной, культуральной герпетической вакцины. Вакцинация, а также применение иммуномодуляторов, например реаферона, удлиняют межрецидивный период и облегчают течение последующих рецидивов. В остром периоде с лечебной целью используют химиотерапевтические препараты (виразол, ацикловир, оксолиновую, тебро-феновую, флореналовую мази, бонафтон), интерфероны и индукторы интерферона.
Вирус цитомегалии

Цитомегалия - инфекционное заболевание, возбудителем которого является цитомегаловирус (ЦМВ) Cytomegalovirus hominis (от греч. cytys - клетка, megas - большой). Вирус вызывает цитомегаловирусную инфекцию человека, характеризующуюся поражением почти всех органов (преимущественно слюнных желез) с образованием в них гигантских клеток с внутриядерными включениями, протекающую в различных формах - от бессимптомного носительства до тяжелой генерализованной формы, заканчивающейся летальным исходом.
Вирус впервые выделен К. Смитом в 1956 г.
Таксономия, морфология, антигенная структура. Возбудитель цитомегалии - ДНК-содержащий вирус, относится к семейству Herpesviridae, роду Cytomegalovirus.
Морфология, химический состав типичны для семейства герпесвирусов. Диаметр вирусной частицы (вириона) около 180 нм. В центре вириона находится двенадцатигранный нуклеокапсид, содержащий генетическую информацию - двухнитевую ДНК-вируса. Установлено 2 антигенных серотипа вируса.
Резистентность. Вирус термолабилен, чувствителен к дезинфицирующим средствам и жирорастворителям.
Эпидемиология. Цитомегаловирусная инфекция широко распространена на земном шаре. Источником вируса является больной человек или носитель. Вирус выделяется со слюной, мочой, секретами организма, реже фекалиями. Предполагается, что ведущий механизм передачи инфекции - контактно-бытовой, возможны аэрогенный и фекально-оральный механизмы передачи. Цитомегаловирус обладает высокой способностью проникать через плаценту (вертикальная передача), вызывая внутриутробную патологию плода.
Патогенез и клиническая картина. Патогенез не вполне выяснен. Инфекция связана с длительным носительством вируса, который в латентном состоянии сохраняется в слюнных железах, почках и других органах. Активация латентной инфекции происходит при иммунодефицитных состояниях, иммунодепрессивной терапии. Вирус поражает ЦНС, костный мозг, почки, печень, клетки крови. У беременных женщин цитомегалия может приводить к недоношенности, мертворождению, развитию аномалий у плода.
Иммунитет. У больных независимо от клинической формы инфекции, а также у носителей образуются антитела, которые, однако, не препятствуют сохранению вируса в организме и выделению его в окружающую среду. Интенсивность развития болезни находится под контролем клеточной иммунной системы хозяина.
Лабораторная диагностика. Обследованию на цитомегалию в первую очередь подлежат дети с поражением ЦНС и врожденными уродствами, а также женщины с неблагополучно протекающей беременностью. Исследуемый материал - слюна, моча, мокрота, цереброспинальная жидкость, кровь, пунктат печени.
Специфическая профилактика и лечение. Разработана живая аттенуированная вакцина. Для лечения применяют химиотерапевтические препараты (ганцикловир, фоскорнет натрия), иммуномодуляторы, интерферон.
Читайте также:


